Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Agronómica
versão impressa ISSN 0120-2812
Acta Agron. vol.62 no.2 Palmira abr./jun. 2013
Fitomejoramiento
1, 3 y 4Grupo de Biodiversidad y Biotecnología, Facultad de Ciencias Ambientales, Universidad Tecnológica de Pereira. 2Departamento de Fitotecnia, Facultad de Ciencias Agropecuarias, Universidad de Caldas. *Autor para correspondencia: ubioteve@utp.edu.co
En la vereda Betania, municipio de Guática, Risaralda (Colombia) a 2160 m.s.n.m., se evaluaron cinco materiales promisorios de mora (Rubus glaucus Benth.) por su resistencia a la antracnosis (Colletotrichum gloeosporioides) y por su alta productividad, los cuales fueron previamente seleccionados por el grupo de Investigación en Biodiversidad y Biotecnología de la Universidad Tecnológica de Pereira. Diez meses después del establecimiento las plantas fueron inoculadas con diferentes cepas del hongo a una concentración de 1.2 x 106 conidios/ml de agua. Las variables evaluadas fueron incidencia (presencia o ausencia de lesiones en tallo), severidad (según escala de 1 a 9) y rendimiento (kg/planta). Los genotipos se clasificaron en tres grupos según su resistencia al patógeno y por su rendimiento: el primero, lo conformaron UTP-8 y UTP-7, los cuales produjeron 21 y 17.6 t/ha, respectivamente; el segundo grupo estuvo formado por el genotipo UTP-1 el cual produjo 14.3 t/ha, y el tercero por UTP-2 y UTP-4 con 9.8 y 7.9 t/ha, respectivamente.
Palabras clave: Colletotrichum gloeosporioides, epidemiología, genotipos, hongo, resistencia a la enfermedad.
The research aimed to evaluate promising materials having both resistance to Anthracnose and high productivity. The experiment was established at the Betania village, municipality of Guática, department of Risaralda, located to 2,160 mamsl. Five blackberry genotypes previously selected by the research group on Biodiversity and Biotechnology of the Universidad Tecnológica de Pereira, Colombia. Ten months after establishment of the experiment, the plants were inoculated with two pathogenic isolates of Colletotrichum gloeosporioides at a concentration of 1.2 x 106 conidia ml-1 of water. The response variables were incidence (presence or absence of lesions on the stems), severity (using a scale of 1 to 9) and yield (kg per plant). The five genotypes tested were classified into three groups according to their resistance to the pathogen and its performance: the first, formed by UTP-7 and UTP-8, which produced 21 and 17.6 t ha-1, respectively; the second, by UTP-1 which produced 14.3 t ha-1, and the third, by UTP-2 and UTP-4 with 9.8 and 7.9 t ha-1, respectively.
Key words: Colletotrichum gloeosporioides, disease resistance, epidemiology, fungus, genotypes.
En Colombia el cultivo de mora (Rubus glaucus Benth.) constituye la principal fuente de ingresos económicos para 6000 pequeños y medianos agricultores, concentrados principalmente en la zona Andina (Agronet, 2010). Es considerado uno de los frutales con mayor potencial de desarrollo por su impacto en la generación de empleos directos e indirectos y constituye uno de los soportes más importantes en los programas de diversificación de cultivos, generación de empleo rural, oferta de alimento y agroindustria comercial como producto exótico (Franco y Giraldo, 2000).
De acuerdo con datos del Ministerio de Agricultura y Desarrollo Rural (MADR), la producción de mora pasó de 22,476 t/año en 1992 a 99,182 t/año en 2010; en este mismo periodo aumentó el área sembrada de 3167 ha para 12,203 ha. El rendimiento se ha mantenido alrededor de 8.1 t/ha durante estos 18 años, aunque en los departamentos con mayor producción (Santander y Casanare) se han alcanzado rendimientos hasta 15 t/ha (Agronet, 2010).
Las cifras muestran un aumento significativo en el área sembrada de mora en el Eje Cafetero, donde se pasó de 463 ha sembradas en el 2006 a 845 ha en 2010, sin embargo, los rendimientos no han aumentado y, por el contrario, han disminuido de 8 t/ha en 2006, a 7.8 t/ha en 2010, siendo el departamento del Quindío el más afectado con 3.5 t/ha, lo que significa un amplio margen de demanda no satisfecha en los procesos de precosecha de la fruta (Agronet, 2010).
El bajo rendimiento de mora en el país es ocasionado en gran parte por la presencia de antracnosis, enfermedad causada por Glomerella cingulata (Stoneman) Spauld y H. Schrenk (Forero de La-Rotta et al., 2002). En la mora de Castilla esta enfermedad generalmente se presenta como manchas oscuras en ramas y tallos, en cuyo interior se observa una coloración grisácea con bordes oscuros para luego aparecer las estructuras reproductivas del patógeno constituidas por acérvulos y masas de conidios de color salmón (Tamayo, 2003). Uno de los síntomas más frecuentes se observa en las ramas o tallos cortados durante las labores al cultivo, sitios por donde el microorganismo puede penetrar, ocasionando lesiones de color oscuro y bordes definidos que van colonizando en forma rápida todo el tejido causando, en el primer caso, muerte descendente de la rama y en el segundo, muerte desde la base del tallo hacia las ramas superiores (Forero de La-Rotta, 2001).
Cuando el cultivo se establece en zonas de alta humedad, la enfermedad ataca la base de los tallos y a diferencia de otras especies de frutales, el patógeno no es frecuente en estructuras florales y reproductivas (Tamayo, 2003). Los tejidos más lignificados son los más susceptibles para el desarrollo de la enfermedad, la que puede afectar entre el 50% y 70% de los tallos de las plantas (Forero de La-Rotta, 2001). Esta enfermedad es considerada como la más limitante en Colombia para el cultivo de mora, al presentar pérdidas superiores a 50% o en algunos casos la totalidad de la producción, cuando no se aplican medidas preventivas (Saldarriaga et al., 2008).
De acuerdo con lo anterior, es necesario buscar alternativas productivas mediante la recolección, caracterización y conservación de los recursos genéticos que garanticen el desarrollo de programas de entrega de genotipos de mora de alto potencial productivo, heterogeneidad, adaptación y resistencia a enfermedades, complementados con clonación de los genotipos seleccionados. Lo anterior con el fin de aumentar la competitividad del sector frutícola de Colombia, como estrategia para posicionar el producto en nuevos mercados internacionales.
Teniendo en cuenta lo anterior, los objetivos de la presente investigación fueron: (1) determinar el periodo de incubación del hongo; (2) medir la incidencia, severidad, tasa de desarrollo y área bajo la curva del progreso de la enfermedad; (3) determinar el efecto de los elementos climáticos sobre la incidencia y severidad de la enfermedad; y (4) cuantificar la producción y el porcentaje de pérdida por efectos del patógeno sobre cada uno de los genotipos evaluados.
El trabajo se desarrolló en la vereda Betania, corregimiento San Clemente, municipio de Guática, departamento de Risaralda (Colombia), en la vertiente oriental de la cordillera Occidental, a 5° 20' 26, 2" N y 75° 47' 28" O, y 2160 m.s.n.m. El sitio experimental medía 3000 m, de topografía ondulada, con una pendiente de 5%, previamente utilizado en explotación pecuaria con pasto kikuyo (Pennisetum clandestinum). Los datos de clima se registraron en una caseta climática, localizada en el campo a una altura de 1.5 m la cual contenía en su interior un termo-higrógrafo marca Thies clima (Intelpro S.A.). La precipitación diaria acumulada se midió con un pluviómetro Lhaura (Weather, Colombia) de escala numérica, fijado a 1.5 m sobre el suelo.
En el estudio se evaluaron cinco genotipos de mora, previamente seleccionados como promisorios en condiciones controladas de laboratorio por Morales et al. (2010), los cuales fueron identificados por sus características genéticas y morfológicas. En el Cuadro 1 aparecen las características y las respuestas de estos genotipos a las inoculaciones con C. gloeosporioides. Para asegurar su homogeneidad, los genotipos plantados en campo fueron obtenidos y caracterizados mediante protocolos de propagación in vitro de mora de Castilla, desarrollados por el Laboratorio de Biotecnología Vegetal de la Universidad Tecnológica de Pereira (Marulanda et al., 2000). Las plantas fueron cultivadas en invernadero durante 5 meses en condiciones adecuadas de riego y fertilización antes de ser llevadas a campo.
Se utilizó un diseño experimental de bloques completamente aleatorios con cuatro repeticiones, siendo la unidad experimental de 15 plantas que conformaron cada bloque. El tamaño útil de la parcela experimental fue de 77.5 m x 34 m para un total de 2635 m2 con 527 plantas. Las plantas fueron sembradas en agosto de 2009, a una distancia de 2.5 m entre ellas y 2 m entre surcos.
Debido a la baja tradición de cultivos agrícolas en la zona y los escasos cultivos comerciales de mora cercanos al lugar de estudio, existían muy pocas probabilidades de infestación natural con el patógeno. Se realizaron tres inoculaciones distanciadas cada 15 días entre junio y julio de 2010, 10 meses después de establecidos los genotipos en campo, tomando como base dos aislamientos de C. gloeosporioides (cepas 3s1 y 6) altamente patogénicos, previamente caracterizados por Morales et al. (2010). La inoculación se hizo por punción con uso de una aguja hipodérmica para hacer 12 heridas por tallo, ubicadas en el primer tercio inferior de la planta, sobre las cuales fue asperjada directamente la suspensión de esporas en una concentración de 1.2 x 106 conidios/ml tratando de dejar completamente cubierto cada uno de los tallos. En total se realizaron tres inoculaciones: la primera con el aislamiento 3s1, la segunda con el aislamiento 6 y la tercera con una mezcla de ambos, y el empleo de un pulverizador mecánico Easy-to (Fercon) a una dosis de 100 cc/planta. Las inoculaciones solamente fueron efectuadas sobre el genotipo UTP-4 altamente susceptible a antracnosis, el cual fue establecido en los bordes de cada uno de los bloques evaluados, con el fin de asegurar la presencia del patógeno en campo y la presión de inóculo sobre los genotipos.
El periodo de incubación del hongo se determinó como la diferencia en días entre la inoculación previa con el patógeno y la presencia de los primeros síntomas de la enfermedad en los tallos de las plantas, según la metodología de Castaño-Zapata (2002). Finalmente, cada semana y durante 30 semanas (septiembre de 2010 a marzo de 2011), se hicieron evaluaciones de la incidencia de la enfermedad. Para ello se marcaron al azar diez tallos en cada una de las 15 plantas efectivas de cada bloque, observando la presencia o no de lesiones características de la enfermedad. En cada planta se determinó el número de tallos sanos y afectados por el hongo. E l índice de incidencia se estableció mediante la metodología propuesta por Castaño-Zapata (2002).
De manera conjunta con las evaluaciones de incidencia, se determinaron los índices de severidad en dos tallos seleccionados al azar en cada una de las 15 plantas efectivas de cada bloque. La severidad de la enfermedad se determinó con un diagrama estándar según la metodología propuesta por Castaño- Zapata et al. (1997) (Foto 1). Las lecturas fueron suspendidas cuando el registro del genotipo susceptible (UTP-4) presentó 50% o más de severidad.
Los registros de producción de frutos frescos por planta en cada bloque se tomaron semanalmente. Este registro se hizo desde el momento de la primera inoculación, el 30 de junio de 2010, y finalizó el 30 de marzo de 2011, correspondiente al último día de evaluación de la enfermedad. Los porcentajes de pérdidas de rendimiento debido a la enfermedad se calcularon por diferencia de cada genotipo, en comparación con el rendimiento del mejor genotipo. Para estimar el efecto en la reducción del rendimiento debido al índice de severidad se calcularon las correlaciones entre ambos parámetros en cada uno de los genotipos evaluados.
El mantenimiento del cultivo consistió en el continuo emparrado y tutorado de ramas productivas de las plantas y en podas de formación, con el fin de estimular una mayor brotación. No se hicieron podas sanitarias o aplicaciones de fungicidas específicos para C. gloeosporioides con el fin de permitir el establecimiento de la enfermedad en campo. El manejo de enfermedades como el moho gris y el mildeo polvoso, causado por Botritys cinerea y Oidium spp., respectivamente, estuvo enfocado al control preventivo con aplicaciones de productos protectantes como azufres coloidales (Azuco® - Agro S.A.) y compuestos cúpricos (oxicloruro de cobre 58.8% W.P® - Proficol). El control de arvenses se hizo cada 15 días utilizando una guadañadora y machetes para los plateos. El plan de fertilización se efectuó de acuerdo con el análisis de suelos previo al establecimiento del cultivo.
Los datos obtenidos después de 30 semanas de evaluaciones de incidencia y severidad del hongo, al igual que la producción, se sometieron a un análisis de varianza simple (ANAVA), empleando el paquete estadístico Statistical Analysis System (SAS). Cuando se detectaron diferencias significativas (P < 0.05) se hizo una prueba de comparación de medias de Tukey.
La manifestación de síntomas característicos de antracnosis se observó a los 42 días después de la última inoculación del patógeno. Las lesiones iniciales se presentaron como manchas pequeñas de forma circular dispuestas principalmente sobre los aguijones (espinas) en la base de los tallos. Con el progreso de la enfermedad las lesiones se observaron en los aguijones más cercanos a la lesión inicial, con cambio a un color gris con bordes color violeta. Posteriormente, se observó desprendimiento de los aguijones severamente afectados, los cuales contenían acérvulos y masas de conidios color salmón (Foto 2).
El tiempo de inicio de la enfermedad (42 días) concuerda con los resultados obtenidos por Saldarriaga et al. (2008) quienes encontraron que los primeros síntomas de la enfermedad aparecen alrededor del día 39; entre los días 50 y 75 se manifiesta por clorosis en ramas; y entre los días 80 y 90 causa la muerte de las mismas. En los genotipos evaluados no se observaron síntomas de clorosis del follaje ni muerte de plantas. Las lesiones de la enfermedad solo fueron observadas sobre los genotipos UTP-2 y UTP-4, con una incidencia de 99% y 80% y una severidad de 50% y 46%, respectivamente (Cuadro 2).
Los registros de severidad permitieron construir la curva de desarrollo de la enfermedad donde se observa que en la última semana de evaluación el testigo susceptible (UTP-4) presentaba un 50% de severidad (Figura 1). Sólo los genotipos UTP-2 y UTP-4 mostraron síntomas de la enfermedad, con una incidencia de 99% y 80% y una severidad de 50% y 46%, equivalentes a una tasa de desarrollo de 0.17 y 0.13 y áreas bajo la curva del progreso de la enfermedad de 1039.78 y 861.78 unidades, respectivamente (P < 0.05).
En general, se observaron fisuras longitudinales severas en tallos, sumado a la pérdida de aguijones altamente esporulados, pero en ningún caso, incluyendo los genotipos severamente afectados, se observaron síntomas de muerte generalizada, la cual según Forero de La-Rotta (2001) ocurre por taponamiento vascular a causa del hongo, o anillamiento de los tallos en las zonas afectadas. Como respuesta de los genotipos de mora al ataque del patógeno se observó la proliferación de rebrotes y/o ensanchamiento de los tallos afectados, lo que generó un cuarteamiento de los tejidos. De acuerdo con Tamayo (2003) esta reacción ocurre para contrarrestar el daño en estos tallos y crear nuevos canales conductores de vital importancia; no obstante esta hipótesis hasta el momento no ha sido demostrada sobre plantas de mora en estados avanzados de la enfermedad.
Durante las 30 semanas experimentales, la temperatura en campo varió entre 14.9 y 24.1 °C, con un promedio de 19.5 °C. En las últimas 7 semanas la temperatura varió ±2 °C (Figura 2A). Esta condición coincidió con el mayor índice de severidad de la enfermedad. Así, cuando la temperatura permaneció constante, la severidad fue menor que 20% en ambos genotipos susceptibles; mientras que después de la semana 16, la temperatura varió de 18.5 para 20.5 °C, coincidiendo con una mayor severidad de la enfermedad en los genotipos UTP-4 y UTP-2. Forero de La-Rotta et al. (2002) en estudios epidemiológicos sobre antracnosis de la mora, encontraron que cuando la temperatura fue menor o igual a 13 °C la cantidad de tejido afectado disminuye considerablemente, pero cuando la temperatura se encuentra alrededor de 16 °C, la proporción de avance de la lesión es mayor. Leandro et al. (2003) hicieron una observación similar cuando evaluaron la relación de la temperatura y la duración de la humedad sobre la germinación de conidios, conidiación secundaria y formación de apresorio de C. acutatum en hojas asintomáticas de fresa. En este caso, observaron que bajo una humedad continua, la temperatura óptima para la germinación de los conidios fue de 23 °C, mientras que para la formación del apresorio varió de 17.5 a 23 °C y la conidiación secundaria varió de 21 a 25°C.
En el presente estudio, la humedad relativa promedio durante el tiempo de evaluaciones fue de 76.34%, presentando el valor más bajo (63.6%) en la semana 2 y el más alto (87%) en la semana 25 (Figura 2B). Forero de La-Rotta et al. (2002) y Leandro et al. (2003) encontraron una mayor germinación de conidios de C. gloeosporioides y C. acutatum dentro de este mismo tiempo y rango de humedad, lo que contrasta con los resultados aquí presentados en los que no se encontró interacción entre el desarrollo de la enfermedad y el porcentaje de humedad ambiental.
La distribución de las lluvias en el sitio de experimentación fue variable, presentando fluctuaciones durante las 30 semanas (Figura 2C). En total, se registró una precipitación acumulada de 1588.7 mm, con un promedio de 39.71 mm/semana. La semana con el más bajo registro de precipitación fue la 29 (23 de marzo de 2011) con 5 mm y la de mayor registro fue la 28 (16 de marzo de 2011) con 98.2 mm de lluvia acumulada. Al relacionar la precipitación con los promedios del índice de severidad de la enfermedad en los genotipos susceptibles, se encontró que éste no fue favorecido cuando la precipitación semanal fue igual o inferior a 20 mm, pero sí cuando fue superior a 25 mm, presentando un incremento exponencial. Estos resultados concuerdan con los de Álvarez (1996), Páez y Zuluaga (1998) y Forero de La-Rotta et al. (2002) quienes estimaron que precipitaciones inferiores a 19 mm por semana no favorecen el desarrollo de la lesión, pero cuando las precipitaciones son mayores que 35 mm el incremento de la lesión es notable.
La influencia de la precipitación sobre la dispersión del patógeno fue estudiada por Nair et al. (1983) y Yang et al. (1992) quienes identificaron claramente dos métodos de dispersión. El primero, aunque poco común, está relacionado con las ascosporas de Glomerella cingulata, dispuestas en peritecios inmersos en residuos de cosecha o en el suelo en estado de latencia a la espera de mejores condiciones para iniciar el proceso de infección; en este caso, la lluvia y el viento fueron los responsables de la diseminación de las ascosporas hacia tallos sanos. El segundo método es muy común y está relacionado con los conidios de C. gloeosporioides, los cuales están dispuestos en acérvulos sobre los aguijones o espinas de la planta de forma radial en tallos infectados, desde donde la lluvia por salpique los dispersa hacia los tallos sanos.
En la Figura 3 se observa el comportamiento del rendimiento de cada uno de los genotipos evaluados. Durante las primeras semanas de cosecha, que correspondieron a la época de inoculación del patógeno, los genotipos presentaron un rendimiento promedio de 334.5 g/planta, el cual disminuyó a 234.3 g/planta en la tercera semana y a 74 g/planta en la quinta semana. Esta producción, que inicialmente era homogénea, fue nula entre la octava y la onceava semana y notablemente diferente entre los genotipos a medida que comenzó el segundo ciclo de cosecha, después de la onceava semana. A partir del segundo ciclo de cosecha en la semana 21 (17 de noviembre de 2010), época en la cual ya se había confirmado la presencia de síntomas de la enfermedad, los rendimientos de los genotipos fueron variables (P < 0.05) (Cuadro 4).
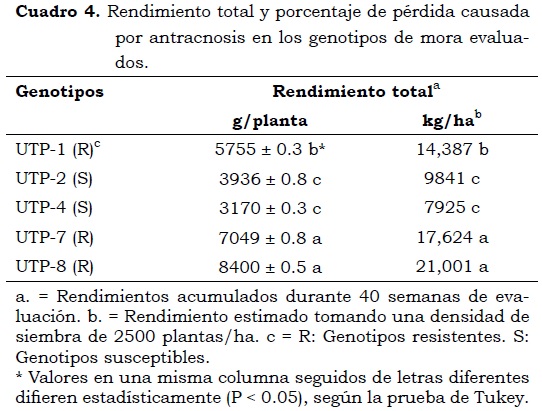
El genotipo con mayor rendimiento semanal (g/planta) fue UTP-8 (906.5), seguido de los genotipos UTP-7 (859), UTP-1 (732.5), UTP-2 (550.5) y UTP-4 (452). En el mismo orden, el genotipo con mayor rendimiento acumulado equivalente (kg/ha) fue UTP-8 (21,001), seguido por UTP-7 (17,624), UTP-1 (14,387), UTP-2 (9,841) y UTP-4 (7,925).
El genotipo UTP-8 es un material de alto valor genético debido a que su alto rendimiento supera ampliamente los rendimientos del cultivo a los niveles nacional y departamental, que según cifras de Agronet para 2010 fueron de 8100 kg/ha/año en el primer caso y de 9700 kg/ha/año en el departamento de Risaralda. Franco y Giraldo (2000) consideran que un cultivo tecnificado, en condiciones óptimas de clima y buenas características de resistencia a antracnosis, puede producir rendimientos entre 18,000 y 20,000 kg/ha/año.
Los promedios de rendimiento y los índices de severidad (5, 10, 15 y 20%) de los genotipos susceptibles (UTP-4 y UTP-2) presentaron una alta correlación con un coeficiente de determinación R2 = 0.88 ajustados al modelo: y= 0.237x2 - 15.619x + 231.9, donde y es igual a la pérdida de rendimiento de un genotipo susceptible y x es igual al valor de un índice de severidad evaluado (Figura 4).
Cuando se simularon los valores x del modelo de correlación logarítmica con los índices de severidad evaluados (5, 10, 15 y 20%), las pérdidas fueron de 26, 54, 77, y 93%, respectivamente, lo que concuerda con estudios realizados por Saldarriaga et al. (2008), quienes indican que el porcentaje de pérdidas a causa de antracnosis en mora puede ser superior a 50%. Denoyes y Baudry (1991) encontraron pérdidas superiores a 80% en cultivos del género Rubus susceptibles a la enfermedad en plantas sin tratamiento químico, lo que muestra el impacto negativo de C. gloeosporioides, catalogado como el segundo patógeno más importante en el cultivo de mora, después de Botrytis cinerea.
Los resultados muestran que el potencial de rendimiento de un genotipo susceptible es totalmente dependiente del grado de severidad de la enfermedad, siendo nulo el rendimiento cuando ésta es mayor que 20%. Vistos los resultados de este estudio, las prácticas de manejo de la enfermedad deberían estar orientadas según los niveles de severidad en el cultivo, es decir, se deben iniciar sistemas de manejo preventivos cuando las severidades sean inferiores a 5%, curativos con severidades menores o iguales al 10% y métodos de manejo erradicantes con severidades mayores o iguales al 20%.
- Los síntomas de antracnosis en mora se observaron 42 días después de la inoculación de la planta, cuando éstas alcanzaron 13 meses de edad. Los síntomas fueron variables, desde lesiones pequeñas hasta fisuras longitudinales en tallo y pérdida de espinas altamente esporuladas.
- Los genotipos UTP-2 y UTP-4 (testigo) fueron muy susceptibles a antracnosis, con incidencias de 79.8 y 99,4%, y severidades de 45.6 y 50%, respectivamente. El genotipo UTP-2 mostró una mayor tasa de desarrollo de la enfermedad (r = 0.17) con respecto al genotipo UTP-4 (r = 0.13). Los genotipos UTP-1, UTP-7 y UTP-8 no presentaron síntomas de la enfermedad.
- Se confirmó que factores climáticos como la temperatura y la precipitación son condicionantes para la expresión de la enfermedad en campo sobre genotipos susceptibles, ya que la variabilidad de la temperatura entre 18.5 y 20.5 °C y una precipitación acumulada igual o superior que 25 mm por semana constituyen una condición favorable para el desarrollo del patógeno.
- El genotipo de mora con mayor rendimiento de fruta fue UTP-8 con 21 t/ha/año, seguido de los genotipos UTP-7 y UTP-1 con 17.6 y 14.3 t/ha/año, respectivamente. Se encontró que la severidad de la enfermedad incide de forma directa sobre la producción de las plantas, así, severidades superiores al 20% pueden causar hasta 93% de reducción en la producción.
Al Ministerio de Agricultura y Desarrollo Rural (MADR) por su apoyo en la financiación de esta investigación y al Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias) por el apoyo económico brindado bajo el marco del programa Jóvenes Investigadores e Innovadores 2009-2010. Al personal académico del programa de Maestría en Fitopatología de la Universidad de Caldas, en especial al doctor Jairo Castaño Zapata. Al grupo de investigación en Biodiversidad y Biotecnología, Facultad de Ciencias Ambientales de la Universidad Tecnológica de Pereira, liderado por la doctora Marta Leonor Marulanda ángel, a Juliana Arias Villegas por la administración de la presente investigación. A la doctora Bertha Lucía Castro de CENICAFÉ. A José Aníbal Soto, representante de la Cooperativa Comercializadora de Productos Agropecuarios y Agroindustriales Campesinos del municipio de Guática (COPAC).
Agronet. 2010. Sistema de información del sector agropecuario y pesquero colombiano. Sistema de consultas de estadísticas agrícolas. Ministerio de Agricultura. Colombia. Disponible en: http://www.agronet.gov.co/agronetweb1/ [Fecha de revisión: Enero 31 de 2013] [ Links ].
Álvarez, J. M. 1996. Manejo integrado de la Antracnosis (Colletotrichum gloeosporioides Penz.) en el cultivo del tomate de árbol (Cyphomandra betacea) en el municipio de Manizales. Tesis: Facultad de Ciencias Agropecuarias. Universidad de Caldas, Manizales, Colombia. 67 p. [ Links ]
Castaño-Zapata, J. y Pérez-Madrid, L. 1997. Diagramas de severidad para cuantificar los daños provocados por Venturia inaequalis (Cke.) Wint. en manzano (Malus sp.). Boletín Fitotecnia N°01 Fitopatología, Universidad de Caldas. [ Links ]
Castaño-Zapata, J.2002. Principios básicos de fitoepidemiología. Centro Editorial Universidad de Caldas. 396 p. [ Links ]
Denoyes, B. y Baudry, A. 1991. Characterization of species of Colletotrichum isolated from strawberry in France: taxonomy and pathogenicity (abstract). En: Strawberry Diseases and Breeding for Varietal Resistance. International Workshop, Bordeaux. 1991. [ Links ]
Forero De La-Rotta, M. C. 2001. Enfermedades de la mora de Castilla. División de Sanidad Vegetal. Santafé de Bogotá, Colombia. Instituto Colombiano Agropecuario (ICA). Boletín 134 [ Links ]
Forero De La-Rotta, M. C.; Ávila, W.; y González, R. 2002. Estudio sobre Antracnosis en mora de Castilla. En: IV Seminario Frutales de Clima Frío Moderado. 2002. Medellín. Colombia. Memorias. Medellín: Corpoica, CDTF, UPB. p. 220 – 228. [ Links ]
Franco, G. y Giraldo, M. 2000. El cultivo de la mora. Corporación Colombiana de Investigación Agropecuaria (Corpoica) - Regional 9. Manizales, Colombia. 76 p. [ Links ]
Leandro, L. F. S.; Gleason, M. L.; Nutter, F. W.;Wegulo, S. N.; y Dixon, P. M. 2003. Influence of temperature and wetness duration on conidia and appressoria of Colletotrichum acutatum on symptomless strawberry leaves. Phytopath. 93:513 - 520. [ Links ]
Tamayo, P. J. 2003. Principales enfermedades del tomate de árbol, la mora y el lulo en Colombia. Corporación Colombiana de Investigación Agropecuaria, Corpoica, Regional no. 4 – Alcaldía de Medellín. Bol. Téc. No. 20. 20 p. [ Links ]
Marulanda, M, L.; Carvajalino, M.; y Vento, H. 2000. Establecimiento y multiplicación in vitro de plantas seleccionadas de Rubus glaucus Benth. para el departamento de Risaralda (Colombia). Actualidades Biológicas 22(73):121 - 129. [ Links ]
Marulanda, M, L.; Isaza, L.; y Ramírez, A. M. 2007. Identificación de la especie de Colletotrichum responsable de la Antracnosis de la mora de Castilla en la región cafetera. Universidad Tecnológica de Pereira. Scientia et Technica. 23(37):535 - 590. [ Links ]
Morales, Y. M.; Marulanda, M. L.; e Isaza, L. 2010. Caracterización morfológica y patogénica de aislamientos del género Colletotrichum spp. causantes de la antracnosis en mora de castilla (Rubus glaucus Benth.) provenientes de los departamentos de Caldas, Quindío y Risaralda (Colombia). Tesis: Facultad de Ciencias Básicas y Tecnologías. Universidad del Quindío, Armenia, Colombia. 53 p. [ Links ]
Nair, J.; Newhook, F. J.; y Corbin, J. B. 1983. Survival of Colletotrichum acutatum f. sp. pinea in soil and pine debris. Trans. British Mycol. Soc. 81:53 - 63. [ Links ]
Páez, A. y Zuluaga, M. V. 1998. Estudio epidemiológico de Antracnosis (Colletotrichum gloeosporioides Penz.) en tomate de árbol (Solanum betacea (Cav.) Sendt) y cuantificación de microflora en el filoplano, en el municipio de Silvania (Cundinamarca). Tesis: Facultad de Ciencias Agropecuarias. Universidad de Cundinamarca, Fusagasugá, Colombia. 74 p. [ Links ]
Saldarriaga-Cardona, A.; Castaño-Zapata, J.; y Arango-Isaza, R. 2008. Caracterización del agente causante de la antracnosis en tomate de árbol, manzano y mora. Rev. Academia Colombiana de Ciencias Exactas, Físicas y Naturales 32(123):145 - 156. [ Links ]
Yang, X. S.; Madden, L. V.; Reichard, D. L.; Wilson, L. L.; y Ellis, M. A. 1992. Splash dispersal of Colletotrichum acutatum and Phytophthora cactorum from strawberry fruit by single drop impactions. Phytopath. 82:332 - 340. [ Links ]













