Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.1 Palmira Jan./Mar. 2014
https://doi.org/10.15446/acag.v63n1.37895
http://dx.doi.org/10.15446/acag.v63n1.37895
Protección de cultivos
Centro de Biotecnología y Bioindustria (CBB), Corporación Colombiana de Investigación Agropecuaria (Corpoica). Autora para correspondencia: egrijalba@corpoica.org.co
Los agricultores colombianos utilizan productos químicos con categorías toxicológicas I, II y III para el control de insectos como la mosca blanca Bemisia tabaci (Gennadius, 1889) (Hemiptera: Aleyrodidae); pero su uso indiscriminado genera un riesgo para la salud y el medio ambiente. El control microbiológico con hongos entomopatógenos surge como alternativa de control ambientalmente sostenible. No obstante, su empleo exitoso dentro de una estrategia de manejo integrado de plagas (MIP) depende, en gran parte, del efecto de los productos químicos sobre el bioplaguicida. El objetivo del presente trabajo fue determinar la compatibilidad in vitro de un bioplaguicida con base en el hongo Isaria fumosorosea formulado como polvo mojable con cuatro fungicidas y cinco insecticidas comerciales. Para esto, se evaluó el efecto de tres concentraciones de los productos químicos: FR = dosis recomendada en campo, 0.5 x FR y 0.25 x FR sobre la germinación de los conidios y el número de unidades formadoras de colonia UFC/g de I. fumosorosea. Los cuatro fungicidas (Benlate, Carboxin Captan, Metalaxil-Mancozeb y Mancozeb) en las tres dosis evaluadas fueron incompatibles con el bioplaguicida, mientras que el insecticida Thiametoxam fue compatible cuando se utilizó la dosis de 0.25 x FR.
Palabras clave: Bioplaguicida, hongos entomopatógenos, Isaria fumosorosea, mosca blanca, sinergismo de los plaguicidas.
Colombian farmers use pesticides with toxicological category I, II and III to control the whitefly Bemisia tabaci (Gennadius, 1889) (Hemiptera: Aleyrodidae) in cotton and eggplant crops;although, its indiscriminate use offers a risk for the environment and the people. The use of biological control with entomopathogenic fungi can be an alternative to replace this is the use of biological control as the entomopathogenic fungi. However, the successful use of a biopesticide in an integrated pest management (IPM) would depend largely on the effect of pesticides on the entomopathogenic microorganism. The aim of this study was to determine the in vitro compatibility of a biopesticide based on the fungi Isaria fumosorosea formulated as a wettable powder (WP) to control the whitefly Bemisia tabaci with four fungicides and five insecticides currently used in cotton and eggplant crops. For this, the effect of the pesticides was evaluated at three concentrations (FR = Field recommendation; 0.5 x FR and 0.25 x FR). Effects of these products on conidia germination and the number of colony forming units (UFC)/g were compared. The four fungicides (Benlate, Carboxin Captan, Metalaxyl Mancozeb and Mancozeb) at the three doses evaluated were incompatible with the biopesticide, while one insecticide (Thiamethoxam) was compatible with the biopesticide when 0.25 x FR of its dose was tested.
Key words: Biopesticide, entomopathogenic fungi, Isaria fumosorosea, pesticides synergists,whitefly.
La mosca blanca Bemisia tabaci (Genandius) (Homoptera: Aleyrodidae) es una de las principales plagas a nivel mundial, ya que se encuentra ampliamente distribuida en diferentes cultivos en campo (Ahmed et al., 2009). En Colombia, su control depende principalmente del uso de insecticidas de origen químico pertenecientes al grupo de los organofosforados, carbamatos, piretroides y neonicotinoides con categoría toxicológica de los tipos I, II o III, que son nocivos para la salud humana y la de los animales.
Estudios realizados por Roditakis et al. (2005) y Yuan et al. (2012) muestran que la mosca blanca es resistente a neonicotinoides como imidacloprid, organofosforados como metil pirimifos, carbamatos como carbosulfan y piretroides como cipermetrina y bifentrina. Esta situación evidencia la importancia de buscar alternativas ambientalmente sostenibles, con un menor impacto en la salud y que no afecten económicamente a los agricultores, siendo los esquemas de Manejo Integrado de Plagas (MIP) una opción que combina estrategias químicas, culturales y biológicas -dentro de las que se encuentran los bioplaguicidas- para reducir la frecuencia de aplicación de los productos químicos y mantener las poblaciones consideradas como plaga dentro de un rango que no afecte económicamente la producción de los cultivos. Dentro de las perspectivas en la industria de bioplaguicidas, se plantean como retos incrementar la productividad y el rendimiento por unidad de área, disminuir los residuos de insecticidas en los alimentos y promover las nuevas alternativas de control ambientalmente sostenible; retos que solo pueden ser cumplidos si esta herramienta se establece dentro de programas del MIP (Marcus, 2009).
Una de las principales limitantes de los productos biológicos cuando son empleados en campo, consiste en la incompatibilidad que presentan con los insumos aplicados dentro de las prácticas tradicionales de cultivo; por tanto, si se busca la comercialización de los productos biológicos y su integración en programas MIP, se hace necesario determinar la compatibilidad de los aislamientos que constituyen el ingrediente activo de estos bioplaguicidas con agroquímicos. Estas evaluaciones deben ser realizadas para cada aislamiento en forma individual, ya que surgen diferencias aun entre varios aislamientos del mismo género, como resultado de su variación genética (Cantone y Vandenberg, 1998) y de los protocolos experimentales.
En investigaciones desarrolladas por Corpoica (Corporación Colombiana de Investigación Agropecuaria) (Espinel et al., 2006) se encontró que las formulaciones a base del hongo entomopatógeno Isaria fumosorosea (Hypocreales: Cordycipitaceae) utilizadas para el control de Bemisia tabaci resultaron en mayor rendimiento y rentabilidad del cultivo de tomate, en comparación con los obtenidos con el manejo tradicional por el agricultor. Este producto también fue evaluado en condiciones de campo en cultivos de algodón en Tolima y Córdoba y berenjena en Huila y Córdoba. El bioplaguicida en ambos casos y para ambos cultivos mostró una relación beneficio:costo > 1, lo que indica que es una opción económicamente posible para el manejo de la mosca blanca.
Teniendo en cuenta las perspectivas y el potencial del bioplaguicida a base de I. fumosorosea, en este trabajo se planteó como objetivo determinar su viabilidad in vitro, expresada como el porcentaje de germinación y el número de unidades formadoras de colonia (UFC), frente a dosis completa (100%), media (50%) y un cuarto (25%) de la recomendada para cinco insecticidas y cuatro fungicidas, comúnmente empleados en los cultivos de algodón y berenjena.
Agroquímicos evaluados
Los agroquímicos seleccionados son de uso frecuente por los agricultores de los departamentos de Tolima, Huila y Córdoba, para el manejo convencional de plagas y enfermedades en cultivos comerciales (Cuadro 1).
Producto biológico evaluado
El bioplaguicida empleado presentaba la característica de polvo mojable con base en conidios del hongo entomopatógeno I. fumosorosea (aislamiento Pc 013), con una concentración de 3.62 x 109 conidios/g, germinación de 80% después de 24 h de incubación a temperatura de 25 ± 2 °C, y 6.02 x 109 UFC/g después de 8 días de incubación bajo las mismas condiciones de temperatura. El tamaño de partícula de este polvo era igual o inferior a 100 micras y la humedad < 5%. Los ingredientes inertes de la formulación correspondieron a un protector solar (Uv01), un protector de secado (Ps01) y un diluente (Di03).
Viabilidad del principio activo del bioplaguicida en agroquímicos.
Para la determinación de la viabilidad en solución, el bioplaguicida fue suspendido en una solución de Tween 80® e inoculado sobre el medio de cultivo que contenía los agroquímicos. Como unidad experimental se utilizó una caja Petri con medio Agar Saboureaud y el agroquímico, el cual fue previamente reconstituido en agua a una concentración de 100,000 ppm y adicionado en el medio antes de que se solidificara. La concentración del agroquímico en el medio fue ajustada a 100%, 50% y 25% de la dosis recomendada por el fabricante (Cuadro 1). Como tratamiento control se incluyó la germinación del bioplaguicida en el medio Agar Saboureaud, sin presencia del agroquímico.
Para la preparación de las soluciones, el producto biológico fue suspendido en una solución de Tween 80® a 0.1% y partir de ella se realizaron las diluciones seriadas de 10-1,10-3 y 10-4 ml que se aplicaron sobre las cajas Petri. Cada caja con el tratamiento respectivo se incubó a una temperatura de 25 ± 2 °C por 24 h; después de este tiempo se extrajo una muestra de agar de 1 cm2 y se le adicionó una gota de azul de lactofenol para realizar la lectura de los conidios germinados y no-germinados en diez campos ópticos o hasta completar un total de 100 conidios por unidad experimental para el cálculo del porcentaje de germinación (Santos et al., 2012). El diseño experimental fue completamente al azar, con tres repeticiones por tratamiento y tres unidades experimentales.
Para determinar la viabilidad del bioplaguicida en agroquímicos mediante la formación de unidades formadoras de colonia (UFC), como unidad experimental se utilizó una caja Petri con medio agar-papasacarosa con el agroquímico seleccionado y al igual que en el ensayo anterior, se evaluaron tres concentraciones de cada producto (Cuadro 1). A partir de las diluciones seriadas, en cajas Petri se inoculó 0.1 ml de la dilución correspondiente a 10-8. Cada unidad experimental se incubó a 25 ± 2 °C durante ocho días, tiempo después del cual se realizó el conteo de UFC en cada caja. El diseño del experimento utilizado fue completamente al azar con tres repeticiones por tratamiento.
Análisis estadístico
Los datos de los resultados obtenidos para la viabilidad expresada como UFC fueron transformados con la función logarítmica base 10. Los resultados presentaron una distribución normal (Shapiro Wilk, a = 0.05) y varianzas homogéneas (Barlett, a = 0.05), por tanto se sometieron a una prueba de Anova y comparación de medias de Tukey (a = 0.05) utilizando el programa Statistix versión 7.0 -2000 (Analitycal Software, Florida, USA).
Para determinar el efecto de los agroquímicos sobre las dos variables evaluadas, germinación y crecimiento vegetativo expresado como UFC, se siguió la clasificación de Alves (1998) citado por Neves et al. (2001) que se basa en los valores promedios del porcentaje de germinación y el porcentaje de crecimiento vegetativo (UFC) para cada tratamiento con respecto al control, aplicando la fórmula siguiente:
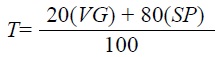
donde, T es el valor corregido del crecimiento reproductivo y vegetativo para la clasificación, VG es el porcentaje de crecimiento vegetativo (UFC) comparado con el control y SP es el porcentaje de esporulación comparado con el control.
Con los fungicidas Benlate y Carboxin- Captan el porcentaje de germinación del hongo varió de acuerdo con la dosis aplicada (Cuadro 2), no obstante con las tres dosis se obtuvieron valores significativamente inferiores con respecto al tratamiento control. Los resultados de germinación obtenidos en este estudio fueron superiores a los presentados por García et al. (2007), quienes evaluaron Benlate en las mismas dosis del presente sobre los conidios sin formular de Trichoderma koningii Oudem y después de 24 h encontraron que la germinación de los conidios fue < 10% en todas las dosis evaluadas. Por otra parte, los resultados obtenidos con el fungicida Carboxin-Captan difieren de los hallados por Bruck (2009), quien al evaluar el efecto de este fungicida sobre los conidios de Metarhizium anisopliae (Metchnikoff) Sorokin encontró 100% de inhibición de la germinación. Kubilay y Gökce (2004) evaluaron el efecto de Benlate y Captan en concentraciones de 500 y 2500 ppm, respectivamente, sobre dos aislamientos de Paecilomyces fumosoroseus (Wize) Brown y Smith, encontrando que Captan inhibió completamente la germinación de los conidios, mientras que Benlate redujo la germinación al 34%. Las diferencias obtenidas entre los resultados de germinación del presente estudio y los realizados por otros investigadores (Kubilay y Gökce, 2004; García et al., 2007; Bruck, 2009) con otros hongos entomopatógenos o aun con otros aislamientos de I. fumosorosea, evidencian que cada aislamiento se comporta de forma diferente y no se pueden generalizar los resultados, por tanto, es importante llevar a cabo pruebas de compatibilidad para cada cepa y formulación desarrollada.
Los resultados de la aplicación in vitro de los fungicidas Benlate y Carboxin-Captan sobre las UFC, evidenciaron que el desarrollo micelial de I. fumosorosea presentó mayor sensibilidad que la germinación de los conidios a la acción de estos productos. Estos resultados concuerdan con los obtenidos por Bruck (2009) quien al evaluar el efecto de algunos fungicidas sobre la germinación y el crecimiento radial de M. anisopliae, observó que el crecimiento micelial fue más sensible al efecto de los fungicidas que la germinación. El fungicida Benlate y su principal metabolito Carbendazim, interfieren en algunos de los procesos de la célula como la síntesis de ADN, la mitosis y el mecanismo de transmisión de mensajes genéticos del ADN al ARN (Liñan, 1997) y el fungicida Carboxin-Captan reacciona con las enzimas sulfihídricas para producir tiofosgeno, sustancia tóxica para las células fúngicas que interfiere con el proceso de respiración celular (Liñan, 1997). Otros fungicidas, como Mancozeb y Metalaxil-Mancozeb aplicados en dosis similares a las del presente trabajo inhibieron completamente la germinación y la formación de UFC. Se sabe que el ingrediente activo de Mancozeb altera la respiración celular, interrumpiendo el ciclo de Krebs en varias de sus etapas; mientras que Metalaxil inhibe la síntesis de proteínas e impide el desarrollo y crecimiento del micelio (Liñan, 1997).
Los insecticidas evaluados presentaron un menor efecto sobre el bioplaguicida, en comparación con los fungicidas (Cuadro 2), resultados que coinciden con los de Kubilay y Gökce (2004) quienes al evaluar el efecto de cinco fungicidas y seis insecticidas sobre dos aislamientos de P. fumosoroseus encontraron que estos fueron más sensibles a la aplicación de los fungicidas debido, posiblemente, a que los insecticidas pueden tener como sitio blanco los procesos propios de los insectos que no afectan directamente a los hongos, en contraste con los fungicidas que afectan directamente los procesos de su metabolismo.
En general, se observó que el efecto de los insecticidas fue mayor sobre la germinación que sobre las UFC. Griffin (1994) considera que muchos plaguicidas que no inhiben completamente los conidios o las hifas, a través del tiempo pueden reducir el efecto de estos, lo que puede explicar algunos de los hallazgos en el presente estudio. Este efecto se evidenció con el producto Imidacloprid, el cual interfiere en la transmisión de estímulos al excitar las células nerviosas de los insectos debido a su unión con los receptores de acetilcolina (Liñan, 1997); esto fue evidente cuando se evaluó la formación de UFC ya que no se presentaron diferencias con respecto al control (P > 0.05); contrario al efecto que se presentó sobre la germinación (P < 0.05).
El insecticida Buprofezin, que inhibe la síntesis de quitina en la cutícula de los insectos (Liñan, 1997) es posible que también interfiera de alguna manera en el proceso de germinación de los conidios, ya que cuando éste se inicia en el retículo endoplasmático se fabrica quitina y glucanos, necesarios para la formación de la pared celular. Sin embargo, en dosis de 100% y 50% la formación de UFC no presentó diferencias significativas con respecto al control, posiblemente debido a la reducción del efecto del insecticida a través del tiempo, como se mencionó anteriormente. De la misma manera, el producto a base de I. fumosorosea presentó mayor sensibilidad al insecticida Tiametoxam, especialmente durante la germinación; mientras que para las UFC solo se presentaron diferencias (P < 0.05) cuando se aplicó la dosis total (100%).
Con el insecticida Malathion, que inhibe la colinesterasa por fosforilación de la acetilcolinesterasa (Becker et al., 2003), no se observó formación de colonias con las tres dosis evaluadas (Foto 1); no obstante para la germinación sólo se presentaron diferencias (P < 0.05) con respecto al control cuando se evaluó la dosis comercial recomendada. Los resultados obtenidos en la formación de UFC son similares a los logrados por Kubilay y Gökce (2004) quienes, además de este último hallazgo, encontraron que con la dosis de 3170 ppm de este insecticida se inhibió completamente el crecimiento radial de dos aislamientos de P. fumosoroseus, actualmente clasificado como Isaria fumosorosea.
En el Cuadro 3 se presentan el valor T, o valor corregido del crecimiento vegetativo y reproductivo, y la clasificación de compatibilidad del bioplaguicida a base de I. fumosorosea con los agroquímicos evaluados, a partir de los resultados obtenidos con cada agroquímico para la germinación y el número de UFC/g. Se observó que con los fungicidas hubo un menor valor T en comparación con los valores calculados para los insecticidas, lo que indica que los fungicidas son más tóxicos para los conidios del bioplaguicida a base de I. fumosorosea, en comparación con los insecticidas evaluados. De esta manera, los menores valores para T se obtuvieron con Benlate, Carboxin-Captan, Mancozeb y Metalaxil-Mancozeb, por tanto son incompatibles con el bioplaguicida en las tres dosis evaluadas.
Con respecto a los insecticidas, se observó que el producto a base de I. fumosorosea presentó los menores valores para T con los insecticidas Malathion y Lufenuron, seguido de Buprofezin e Imidacloprid, a los cuales fue menos sensible. Los cinco insecticidas evaluados son incompatibles con el bioplaguicida a base de I. fumosorosea cuando se usó la dosis completa. Solo Tiametoxam presentó un efecto moderadamente tóxico cuando se empleó en la dosis 50% y fue compatible con la dosis 25%. Por otra parte, Imidacloprid y Buprofezin fueron moderadamente tóxicos con la dosis del 25%.
- En condiciones de laboratorio, el bioplaguicida a base de I. fumosorosea evaluado en este estudio fue incompatible con los fungicidas Benlate, Carboxin-Captan, Mancozeb y MetalaxilMancozeby y con los insecticidas Imidacloprid, Buprofezin, Malathion, Tiametoxam y Lufenuron a la dosis recomendada.
Los autores expresan su agradecimiento al Ministerio de Agricultura y Desarrollo Rural de Colombia (MADR) por la financiación del proyecto bajo el cual se desarrolló la investigación presentada en este artículo.
Ahmed, M. Z.; Jin, G. H.; Shen, Y.; Ren, S. X.; Du, Y. Z.; y Qiu, B. L. 2009. Population and host plant differentiation of the sweet potato whitefly, Bemisia tabaci (Homoptera: Aleyrodidae), in East, South and Southwest China. Acta Entomol. Sin. 52:1132 - 1138. [ Links ]
Becker, N.; Petric, D.; Zgomba, M.; Boase, C.; Dahl, C.; Lane, J.; y Kaiser, A. 2003. Mosquitoes and their control. Nueva York. Kluwer Academic Plenum Publ. 451 p. [ Links ]
Bruck, D.J. 2009. Impact of fungicides on Metarhizium anisopliae in the rhizosphere, bulk soil and in vitro. BioCont. 54: 597-606. [ Links ]
Cantone, F. A. y Vandenberg, J. D. 1998. Intraspecific diversity in Paecilomyces fumosoroseus. Mycol. Res. 102:209 - 215. [ Links ]
Espinel, C.; Villamizar, L.; Torres, L.; Grijalba, E.; Lozano,M .D.; Cotes, A. M.;López,A.; García, J.; Gonzáles, V. 2006. Desarrollo de un bioplaguicida para el control de la moca blanca Bemisia tabaci. Boletín técnico. 79p. [ Links ]
García, M.; Villamizar, L.; y Cotes, A. M. 2007. Compatibility of Trichoderma koningii with chemical fungicides. IOBC/wprs Bull. 30(6):441 - 445. [ Links ]
Griffin, D. H. 1994. Fungal physiology. Nueva York. Wiley Science Paperback Series. p. 400 - 420 [ Links ]
Kubilay, E. y Gökce, A. 2004. Effects of selected pesticides used against glasshouse tomato pests on colo-ny growth and conidial germination of Paecilomyces fumosoroseus. Biol Cont. 31:398 - 404. [ Links ]
Liñan, C. 1997. Farmacología vegetal. España. p. 108, 156, 158, 192, 703, 706, 708. [ Links ]
Marcus, M. S. 2009. Perspectives and challenges for biopesticide industry.2009. 4th Annual Biocontrol Industry Meeting (ABIM). Lucerne, Switzerland. October 19-20. En http://www.abim.ch/abim2009. Consulta: enero de 2013 [ Links ]
Neves, P.; Hirose, E.; Tchujo, P.; y Moino, A. 2001. Compatibility of entomopathogenic fungi with neonicotinoid insecticides. Biol Cont. 30 (2):263 - 268. [ Links ]
Roditakis, O.; Tsag, N.; y Karakou, A. 2005. Insecticide resistance in Bemisia tabaci (Homoptera: Aleyrodidae) populations from Crete. Pest Manag. Sci. 61:577 - 582. [ Links ]
Santos, A.; García, M.; Cotes, A. M.; y Villamizar, L. 2012. Efecto de la formulación sobre la vida útil de bioplaguicidas a base de dos aislamientos colombianos de Trichoderma koningiopsis Th003 y Trichoderma asperellum Th034. Rev. Iberoam. Micol. 29(3):150 - 156 [ Links ]
Yuan, L.; Wang, S.; Zhou, J.; Du, Y.; Zhang Y; y Wang, J. 2012. Status of insecticide resistance and associated mutations in Q-biotype of whitefly, Bemisisa tabaci, from eastern China. Crop Protection. 31:67 - 71 [ Links ]













