Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.1 Palmira Jan./Mar. 2014
https://doi.org/10.15446/acag.v63n1.43121
http://dx.doi.org/10.15446/acag.v63n1.43121
1 Centro Internacional de Agricultura Tropical (CIAT), Palmira, Colombia. 2 Corporación Colombiana de Investigación Agropecuaria (Corpoica), Centro de Investigación Tibaitatá, Mosquera Cundinamarca. Autor para correspondencia: gceballos@cgiar.org
El moko, enfermedad causada por Ralstonia solanacearum raza 2, afecta la producción de plátano (Musa AAB Simmonds) en Colombia, ocasionando pérdidas hasta de 100%. In vitro, se evaluó el efecto de filtrados crudos de cepas de Trichoderma sp. y dos productos comerciales como posibles reductores de poblaciones de R. solanacearum. Para cada cepa de Trichoderma spp., se empleó filtrado (40% en solución acuosa) y para R. solanacearum se utilizó una dilución de 10-4 por caja de petri, en un diseño completamente al azar con tres repeticiones para determinar el número de unidades formadoras de colonia de R. solanacearum. En invernadero, se aplicaron suspensiones de T. harzianum (Agroguard®), T. viride 14PDA3A y Ecoterra® en plantas de plátano Dominico Hartón y 30 días después se inoculó R. solanacearum en un diseño de bloques completos al azar con cuatro repeticiones. La severidad del ataque de R. solanacearum se evaluó utilizando una escala de síntomas foliares de 0 a 6. In vitro, los extractos crudos de dos cepas y dos productos comerciales de Trichoderma spp. inhibieron el 100% de R. solanacearum. Los tratamientos con T. viride y Ecoterra® mostraron bajos niveles de control de R. solanacearum en plantas (0.63 y 1.88, respectivamente).
Palabras clave: Antagonismo, moko, plátano Dominico Hartón, Trichoderma spp.
Moko, bacterial disease caused by Ralstonia solanacearum race 2, affects plantain production in Colombia, with losses up to 100 %. The in vitro effect of crude filtrates of strains of Trichoderma spp. and two commercial products were evaluated versus R. solanacearum. In vitro, filtrate was used (40 % in aqueous solution) for each strain of Trichoderma spp.; from R. solanacearum a dilution of 10-4 per petri dish was used, in a completely random design with three replications. For Ralstonia solanacearum, the number of colony forming units was determined. In greenhouse, the suspensions of Trichoderma harzianum (Agroguard ®), T. viride 14PDA3A, and Ecoterra® were applied to Dominico harton plantain plants, and 30 days later plants were inoculated with R. solanacearum, a randomized complete blocks design with four blocks was used. R. solanacearum severity was evaluated by leaf symptoms scale, of 0 to 6. In vitro, crude extracts of two strains and two commercial products of Trichoderma spp. inhibited 100% of R. solanacearum. T. viride and Ecoterra® treatments showed low levels of disease severity by R. solanacearum in plants (0.63 and 1.88 respectively).
Key words: Antagonism, Dominico Harton plantain, moko disease, Trichoderma spp.
En musáceas, la marchitez bacteriana o moko es el nombre de la enfermedad causada por Ralstonia solanacearum (Smith) raza 2 (Yabuuchi et al., 1995) Biovar 1 y 3, Filotipo 2, Sequevar 4 y 6 (Genin y Denny, 2012). Debido a la diversidad genética de este fitopatógeno, al grupo de microorganismos se le denomina como complejo de especies de R. solanacearum (RSSC, por sus siglas en inglés) (Fegan y Prior, 2006).
Este complejo induce un marchitamiento que se inicia con el amarillamiento y el colapso de las hojas más jóvenes, así como la necrosis de la hoja bandera, síntomas que progresan hacia las hojas maduras, e internamente los tejidos vasculares se tornan necróticos, especialmente los localizados cerca de la zona central del pseudotallo. Los frutos inmaduros de las plantas afectadas muestran color amarillo y pudrición seca de la pulpa formando una cavidad; cuando se presentan infecciones tempranas, o antes de floración, se produce un desarrollo anormal del racimo y en algunos casos la planta no alcanza a generarlos (De Oliveira e Silva et al., 2000).
El moko ha reducido seriamente la producción de plátano en las principales áreas sembradas en Colombia, generando pérdidas hasta de 100% en algunas plantaciones donde se presenta. El patógeno se ha difundido en los departamentos del Tolima, Valle del Cauca, Huila, Caquetá, Amazonas, Putumayo y de la Costa Atlántica (Belalcázar et al., 2003). Las áreas más afectadas por la enfermedad en Colombia se presentan en la región de Urabá, departamento de Antioquia, donde se han erradicado áreas extensas de cultivos de plátano infestados (Castañeda y Espinosa, 2005; Londoño, 2012). En Meta y Caquetá la enfermedad arrasó 20,000 ha entre 1970 y 1980 y en el Quindío entre 1999 y 2000, lo que generó pérdidas por US$73,000, aproximadamente (Obregón, 2007).
Debido a que el control químico de esta enfermedad no ha sido exitoso, actualmente se trabaja en el desarrollo de estrategias de manejo tendientes a evitar el ingreso del agente causal a las plantaciones o evitar su diseminación a nuevas áreas, tratando los focos para reducir la población bacteriana y su diseminación a nuevas áreas (Álvarez et al., 2013).
Los hongos del género Trichoderma son utilizados ampliamente en el control biológico como antagonistas de fitopatógenos que se presentan en suelos y semillas (Alexopoulos y Mims, 1979). Este biocontrolador produce antibióticos y otros metabolitos secundarios, con diferentes mecanismos de acción sobre los microorganismos fitopatógenos, algunos de ellos son: Pachibasin, que pertenece al grupo de los octacetidos; Trichodermin, del grupo de monoterpenos o trichothecanos; Trichorzianinas, metabolitos antifúngicos de alta solubilidad que una vez se localizan sobre las esporas pueden mantener su actividad fúngica por períodos prolongados (3 - 4 meses); y Gliotoxin, que presenta actividad antibiótica contra bacterias y hongos (Howell et al., 2000).
El efecto de Trichoderma spp., en la inhibición de fitopatógenos y en el mejoramiento de la nutrición de plantas ocurre en forma diferencial dependiendo de la especie empleada; por ejemplo, el efecto significativo del crecimiento de plantas de Tagetes erecta inoculadas con T. aureoviride y T. harzianum fue reportado por Calvet et al. (1993), en contraste con el efecto inhibitorio de cepas de T. pseudokoningii sobre el crecimiento de plantas de soya (Martínez et al., 2004).
Por otra parte, algunas bacterias de los géneros Pseudomonas y Bacillus son eficientes en el control de enfermedades foliares y radicales, debido a su rápida colonización (Fernández Larrea, 2001). Las cepas de Pseudomonas tienen propiedades contra fitopatógenos ya que mejoran la absorción de minerales por la planta, como es el caso del hierro, el cual una vez convertido en sideróforos (moléculas de bajo peso con afinidad al hierro (III) quelatado) se hace más disponible para la planta (Sharma y Johri, 2003) y poco disponible para los fitopatógenos; como se sabe los fitopatógenos no producen sideróforos y no pueden tomarlo de los antagonistas en su medio ambiente (Weller, 1988). Korsten et al. (1997) encontraron que B. subtilis en aplicaciones en pre- y poscosecha presentó un efecto similar al de fungicidas comerciales en el control de enfermedades fungosas en aguacate. El empleo de Trichoderma spp., bacterias antagonistas y bioproductos permite recuperar el equilibro biológico en el suelo, ya que reduce notoriamente las poblaciones de organismos patógenos como R. solanacearum o compiten con ellas. El objetivo de este trabajo fue evaluar en laboratorio e invernadero el efecto de extractos crudos de Trichoderma spp. y dos productos comerciales a base de este hongo sobre las poblaciones de R. solanacearum.
Localización
El ensayo se realizó en el laboratorio y en el invernadero del Programa de Fitopatología de Yuca del Centro Internacional de Agricultura Tropical (CIAT), localizado en Palmira, Valle del Cauca (Colombia), a 3° 50' N y 76° 35' O, a 980 m.s.n.m, con una precipitación anual de 1100 mm, humedad relativa de 78% y temperatura promedio de 24.5 °C.
Prueba en laboratorio
En condiciones in vitro se evaluaron extractos crudos procedentes de aislamientos de Trichoderma. Para evaluar el efecto se emplearon las cepas 41TSM1, 19TSM3A (T. virens), 47PDA3A (T. virens) y CIAT 14PDA4 (T. viride) y los productos comerciales Agroguard® (T. harzianum), y Trichoplant® (mezcla de cepas de T. harzianum, T. viride, T. koningii y T. lignorum). Las cepas de la colección fueron caracterizadas por Arango (2009), con la amplificación de la región ITS del ADN ribosomal (ADNr) mediante PCR con los cebadores universales ITS1-4 e ITS4-5.
Las muestras de las cepas y de cada producto comercial fueron cultivadas en medio líquido estéril -PD: Papa (200 g/L) y Dextrosa® (17 g/L) durante 15 días. Los extractos crudos fueron esterilizados por filtración mediante membrana de nitrocelulosa con tamaño de poro de 0.22 µm. La evaluación de los extractos se hizo a 40% de concentración; para lo cual se emplearon 48 mL de filtrado libre de estructuras que fueron mezclados con 72 mL de PDA (39 g/L) estéril para obtener un volumen final de 120 mL, que fue depositado en seis cajas petri (adaptado de Bedoya et al., 2000).
Sobre la superficie del medio de cultivo solidificado, que contenía los extractos crudos de Trichoderma spp., utilizando asa bacteriológica se distribuyó una muestra de 100 µL de la dilución 10-4 de R. solanacearum (cepa 78). Esta dilución se obtuvo a partir de una suspensión bacteriana de 0.2 de absorbancia (600 nm), correspondiente a una concentración de aproximadamente 1 x 108 UFC/mL (He et al., 1983). Los controles negativos y positivos fueron preparados con PDA estéril con y sin R. solanacearum, respectivamente. En el Cuadro 1 se incluye un resumen de los tratamientos.

El conteo de unidades formadoras de colonia (UFC) de R. solanacearum por caja se hizo diariamente, los valores obtenidos en los conteos se calcularon en UFC por microlitro (UFC/µL) y los resultados finales se expresaron en UFC/mL de la suspensión bacteriana. Se usó un diseño completamente al azar con tres repeticiones, donde la unidad experimental estuvo conformada por una caja Petri.
Prueba en invernadero
Para esta prueba se utilizaron plántulas de plátano Dominico Hartón de dos meses de edad, sembradas en bolsas con 5 kg de una mezcla esterilizada a vapor en proporción 2:1 de suelo Oxisol de la estación experimental CIAT-Quilichao y arena. Para estudiar el efecto de inhibición sobre R. solanacearum se eligieron los tratamientos con Agroguard® y 14PDA3A T. viride que mostraron resultados consistentes en la prueba de laboratorio; además se incluyó el producto Ecoterra® (mezcla de Azotobacter chroococcum, Pseudomonas aeureofaciens, Bacillus licheniformis, B. megaterium y B. subtilis) (Cuadro 2).

Inicialmente, se aplicaron los microorganismos antagonistas T. viride y los productos comerciales Agroguard® y Ecoterra®, con el fin de favorecer el establecimiento y colonización de los microorganismos en el suelo y el sistema radical de las plántulas de plátano. Por cada tratamiento se aplicaron 50 mL/planta utilizando concentraciones de Agroguard® y 14PDA3A T. viride de 1 x 108 conidias/mL y 0.5 g de Ecoterra®, equivalente a una concentración de 1 x 108 UFC.
Como inóculo se empleó R. solanacearum (cepa 78) aplicado un mes después de los tratamientos antes mencionados; para ello, se hizo una herida en la raíz de la planta y sobre ella se aplicaron 50 mL de una suspensión bacteriana de 0.1 de absorbancia (600 nm de longitud de onda), equivalente a 1 x 105 UFC/mL, siguiendo la metodología utilizada en tomate por Hernández et al. (2005) y Deberdt et al. (1999). Para medir el grado de la enfermedad se utilizó la escala 0 (ausencia) - 6 (muerte de la planta) de evolución de síntomas foliares, propuesta por Mesa y Triviño (2007) (Figura 1). Adicionalmente se midió la concentración foliar de nutrientes.
Se empleó un diseño de bloques completos al azar con cuatro bloques y ocho repeticiones con una unidad experimental de dos plantas. Los datos se analizaron por Anova y pruebas comparativas de medias, mediante el paquete estadístico SAS® Statistical Analysis System Versión 9.4.
Prueba en laboratorio
Se presentó un efecto altamente significativo (P< 0,001) de los extractos crudos de Trichoderma sp., en la inhibición in vitro de R. solanacearum (Cuadro 3). Los tratamientos que más inhibieron la bacteria fueron 41TSM1, 14PDA3A, Agroguard® y Trichoplant®, ya que no permitieron el crecimiento de colonias de R. solanacearum, en comparación con el control negativo (2.920 UFC/mL).
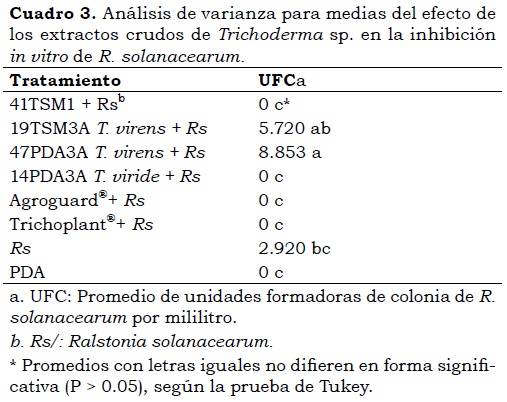
Las diferencias halladas en el efecto de las cepas de Trichoderma sp., corresponden a la gran especificidad de este hongo antagónico de fitopatógenos, ya que unas cepas permitieron inhibir completamente el crecimiento in vitro de R. solanacearum, como por ejemplo, 41TSM1, 14PDA3A, Agroguard® y Trichoplant®; mientras que otras como T. virens (cepas 19TSM3A y 47PDA3A) indujeron su crecimiento.
El anterior resultado coincide con los obtenidos por Asmaja (2005), quien reportó actividad antibacterial de filtrados libres de células de T. viride contra R. solanacearum causante de marchitez en jengibre.
Prueba en invernadero
En esta prueba se presentaron diferencias entre tratamientos sobre el desarrollo de síntomas foliares de moko en plátano. Las diferencias se presentaron el día 34 (P < 0.0385) y el 40 (P < 0.0134) después de la inoculación con R. solanacearum (Cuadro 4). Al finalizar la evaluación, las diferencias entre tratamientos fueron altamente significativas (P < 0.0084) siendo Agroguard® y T. viride (14PDA3A) los más contrastantes, ya que presentaron el máximo (3.63) y el mínimo (0.63) grado de enfermedad, en comparación con el control negativo R. solanacearum (2.87). El resultado obtenido con T. viride confirma su capacidad antagónica para contrarrestar el efecto de R. solanacearum, lo que se evidenció en la menor severidad de la enfermedad. Esto coincide con los resultados de Asmaja (2005).
Ecoterra® también fue antagónico para R. solanacearum ya que retardó la aparición de síntomas y severidad de la enfermedad (1.88). Con este producto se presentó menor evolución de los síntomas de la enfermedad y un mayor desarrollo de las raíces (Foto 1). Esto es debido a que las cepas de Pseudomonas que contiene, pertenecen a las llamadas bacterias promotoras del crecimiento vegetal (PGPB, por sus siglas en inglés) las cuales estimulan la producción de hormonas como auxinas, giberelinas y citoquininas, que inducen la iniciación radical e incrementan la formación de raíces y pelos absorbentes, característica que permite a la planta mayor área para absorción de nutrientes y tolerancia a la infección por R. solanacearum (Cuadro 5).
Aunque el Anova no mostró diferencias entre tratamiento para la concentración foliar de nutrientes, sí se observó que la concentración de potasio fue más alta en el tratamiento T. viride (60.1 g/Kg) vs. el testigo (47.6 g/Kg), lo cual coincide con una menor severidad de la enfermedad en las plantas tratadas con esta cepa, esto demuestra que este nutriente favorece la tolerancia de la planta al ataque de fitopatógenos (Álvarez et al., 2002).
No obstante, la capacidad de Bacillus spp., y Pseudomonas spp., presentes en Ecoterra® para solubilizar nutrientes como fósforo, mediante la producción de ácidos orgánicos o a través de fosfatasas (Kloepper et al., 1989), este efecto no se presentó en este suelo ya que de acuerdo con el resultado del análisis químico, la concentración de este elemento fue muy baja (13.72 mg/Kg). Por otra parte, el mayor contenido de hierro en los tratamientos con Ecoterra® coincide con los hallazgos de Sharma y Johri (2003) quienes encontraron que las bacterias antagonistas del género Pseudomonas mejoran la absorción de este elemento, lo que pudo influir en la reducción de la cantidad de inóculo y actividad patogénica de R. solanacearum.
Con excepción de zinc, todos los nutrientes presentaron mayor concentración en los tratamientos que recibieron Ecoterra®, esto debido principalmente a que los géneros Bacillus, Azotobacter y Pseudomonas presentes en este producto son los más importantes en agricultura por la transformación de compuestos orgánicos e inorgánicos que favorecen la nutrición de las plantas (Higuera, 2008).
La búsqueda de opciones que permitan el tratamiento de suelos contaminados con altas poblaciones de R. solanacearum, como consecuencia de la devastación de hospederos altamente susceptibles, exige la exploración de nuevas estrategias, entre ellas el uso combinado de T. viride y Ecoterra®, para evaluaciones en campo con poblaciones naturales de la bacteria.
- Trichoderma viride y Ecoterra® son alternativas diferentes a los agroquímicos usados convencionalmente para reducir las poblaciones de R. solanacearum en el suelo.
- Trichoderma viride fue el mejor tratamiento para inhibir R. solanacearum in vitro y contrarrestar la enfermedad de moko en plántulas de plátano en condiciones de invernadero, no obstante en condiciones de campo los resultados aún deben ser evaluados durante periodos más largos.
- Ecoterra® permite mejorar el desarrollo radical de plántulas de plátano, lo que se traduce en un mejor desarrollo de las plantas y en tolerancia a factores bióticos, entre ellos la enfermedad del moko.
- Reducción de poblaciones de Ralstonia solanacearum raza 2 (Smith) en plátano (Musa AAB Simmonds) con aplicación de extractos de Trichoderma sp. (Alexopoulus y Mims) y bacterias antagonistas
El presente trabajo fue posible gracias al apoyo del Ministerio de Agricultura y Desarrollo Rural MADR, el Fondo Regional de Tecnología Agropecuaria FONTAGRO, el Centro Internacional de Agricultura Tropical CIAT y la Federación de Plataneros de Colombia Fedeplátano. Un agradecimiento especial a los jurados de revisión por sus valiosos aportes al documento.
Alexopoulos, C. J. y Mims C. W. 1979. Introductory mycology. 3a ed. Nueva York, Willey. [ Links ]
Álvarez, E.; Bellotti, A.; Calvert, L.; Arias, B.; Cadavid, L. F.; Pineda, B.; Llano, G.; y Cuervo, M. 2002. Guía práctica para el manejo de las enfermedades, las plagas y las deficiencias nutricionales de la yuca. 120 p. [ Links ]
Álvarez, E.; Pantoja, A.; Gañan, L.; y Ceballos, G. 2013. Estado del arte y opciones de manejo del Moko y la Sigatoka negra en América Latina y el Caribe. Centro Internacional de Agricultura Tropical CIAT. Publicación no. 387. 40 p. [ Links ]
Arango, L. M. 2009. Alternativas de control de Botrytis cinerea y Colletotrichum spp. mediante el uso de antagonistas y extractos vegetales. Tesis pregrado. Universidad del Valle. Santiago de Cali, Valle, Colombia. 101p. [ Links ]
Asmaja, A. K. 2005. Investigations on antibacterial metabolite production by Trichoderma viride against Ralstonia solanacearum causing bacterial wilt of ginger (PR123). University of Calicut. Technical Bulletin No.8. Indian Institute of Spices Research. Abstracts of M.Sc. and Ph.D. Dissertations on spice crops, Calicut. Kerala. (Disponible en http://www.spices.res.in/downloads/abstract.pdf). [ Links ]
Bedoya, F. A.; Álvarez, E.; y Loke, J. B. 2000. Selección in vitro de aislamientos de Trichoderma spp. para el control biológico de la pudrición radical en yuca. Fitop. Col. 23(2):65 - 67. [ Links ]
Belalcázar, S.; Rosales, F. E.; y Pocasangre, L. E. 2003. El Moko del plátano y banano y el rol de las plantas hospederas en su epidemiología En: Galileo Rivas y Franklin Rosales (eds.). Manejo convencional y alternativo de la sigatoka negra, nematodos y otras plagas asociadas al cultivo de musáceas en los trópicos. Taller realizado en Guayaquil, Ecuador, 11 - 13 de agosto, 2003. p. 159 - 179 [ Links ]
Calvet, C.; Barea, J.; y Pera, J. 1993. Growth response of marigold (Tagetes erecta) to inoculation with Glomus mossae, Trichoderma aureoviride and Pythium ultimum in a peat-perlite mixture. Plant Soil. 148:1 - 6. [ Links ]
Castañeda, D. A. y Espinosa, J. 2005. Comportamiento e impacto de la enfermedad de moko en la zona de Urabá (Colombia) en las últimas tres décadas y media propuesta de un índice de riesgo de enfermedad. Rev. Fac. Nac. Agron. Medellín 58(1):2587 - 2599. [ Links ]
De Oliveira Silva S.; de Mello Veras S.; Gasparotto, L.; Pires de Matos A.; Maciel-Cordeiro, Z. J.; y Boher, B. 2000. Evaluación de Musa spp. para la resistencia a la enfermedad de Moko (Ralstonia solanacearum, raza 2). Infomusa 9(1):19 - 20. [ Links ]
Deberdt, P.; Quénéhervé, P.; Darrasse, A.; y Prior, P. 1999. Increased susceptibility to bacterial wilt in tomatoes by nematode galling and the role of the Mi gene in resistance to nematodes and bacterial wilt. Plant Pathol. 48:408 - 414. [ Links ]
Fernández-Larrea V. O. 2001. Microorganismos antagonistas para el control fitosanitario. Costa Rica. Manejo Integrado de Plagas 62(96 - 100). [ Links ]
Fegan, M; Prior, P. 2006. Diverse members of the Ralstonia solanacearum species complex cause bacterial wilts of banana. Australian Plant Pathology. 35:93-101. [ Links ]
Genin, S; Denny T. P. 2012. Pathogenomics of the Ralstonia solanacearum species complex. Ann. Rev. Phytopath. 50:67 - 89. [ Links ]
He, L. Y.; Sequeira, L.; y Kelman, A. 1983. Characteristics of strains of Pseudomonas solanacearum from China. Plant Disease 67(12):1357 - 1361. [ Links ]
Hernández, Y.; Mariño, N.; Trujillo, G.; y De Navarro, C.U. 2005. Invasión de Ralstonia solanacearum en tejidos de tallos de tomate (Lycopersicon esculentum Mill). Rev. Fac. Agron. 22(2):185 - 194. [ Links ]
Higuera, M. D. 2008. Los microorganismos del suelo en la nutrición vegetal. Investigación aplicada y Desarrollo. Orius Biotecnología. Villavicencio, Colombia. (Disponible en http://www.oriusbiotecnologia.com). [ Links ]
Howell, C. R.; Hanson, L. E.; Stipanovic, R. D.; y Puckhaber, L. S. 2000. Induction of terpenoid synthesis in cotton roots and control of Rhizoctonia solani by seed treatment with Trichoderma virens. Phytopath. 90(3):248 - 252. [ Links ]
Kloepper, J.; Lifshitz, R.; y Zablotowicz, R. 1989. Free-living bacteria inocula for enhancing crop productivity. Trends Biotechnol 7(2):39 - 44. [ Links ]
Korsten, L; De Villiers, E. E; Wehner, R. C.; y Kotzet, J. M. 1997. Field spray of Bacillus subtilis and fungicides for control of preharvest fruit diseases of avocado in South Africa. Plant Disease 81(5):455 - 459. [ Links ]
Londoño, R. H. 2012. Caracterización de síntomas de la enfermedad de Moko en invernadero y campo cuando se simulan labores que causen heridas en plantas de banano y plátano. Cenibanano. Asociación de Bananeros de Colombia (Augura). Bol. Téc. no. 4. 13 p. [ Links ]
Martínez, A.; Obertello, M.; Pardo, A.; Ocampo, J.; y Godeas, A. 2004. Interactions between Trichoderma pseudokoningiis trains and the arbuscular mycorrhizal fungi Glomus mosseae and Gigaspora rosea. Mycorrhiza 14(2):79 - 84. [ Links ]
Mesa, L. A. y Triviño, V. H. 2007. Evaluación microbiológica y físico-química de fuentes de lixiviados de compost de raquis de plátano y su efecto en el manejo de Moko. Tesis pregrado. Universidad del Quindío, Armenia, Quindío, Colombia. 125 p. [ Links ]
Obregón, M. 2007. Diagnóstico, hospederos y sobrevivencia de la bacteria Ralstonia solanacearum en banano y aplicaciones al control integrado de la enfermedad en la zona de Urabá. Tesis Maestría. Universidad Nacional de Colombia sede Medellín. Medellín, Antioquia, Colombia. [ Links ]
Sharma, A. y Johri, B. N. 2003. Growth promoting influence of siderophore-producing Pseudomonas strains GRP3A and PRS9 in maize (Zea mays L.) under iron limiting conditions. Microbiol. Res. 158(3):243 - 248. [ Links ]
Weller, M. W. 1988. Biological control of soil borne plant pathogens in the rhizosphere with bacteria. Ann. Rev. Phytopath. 26:379 - 407. [ Links ]
Yabuuchi, E.; Kosako, Y.; Yano, I.; Hotta, H.; y Nishiuchi, Y. 1995. Transfer of two Burkholderia and an alkali genes species to Ralstonia gen. nov.: Proposal of Ralstonia pickettii (Ralston, Palleroni and Doudoroff 1973) comb. nov., Ralstonia solanacerarum (Smith 1986) comb. nov. and Ralstonia eutropha (Davis 1969) comb. nov. Microbiol. Inmunol. 39(11):897 - 904. [ Links ]













