Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.3 Palmira July/Sept. 2014
https://doi.org/10.15446/acag.v63n3.41033
http://dx.doi.org/10.15446/acag.v63n3.41033
Agronomía
Evaluación del potencial biofertilizante de bacterias diazótrofas aisladas de suelos con cultivo de cacao (Theobroma cacao L.)
Evaluation of potential biofertilizer diazotrophas bacteria isolated from cocoa crop (Theobroma cacao L.)
Adriana Zulay Argüello-Navarro* y Laura Yolima Moreno-Rozo
Universidad Francisco de Paula Santander, Colombia. Departamento de Biología, Grupo de Investigación en Ciencias Biológicas- MAJUMBA. Autora para correspondencia: adrianaarguello@ufps.edu.co
Rec.: 02.12.2013 Acep.: 05.05.2014
Resumen
La adaptabilidad del cacao (Theobroma cacao L.) en condiciones adversas permite sugerir que la microbiota asociada con la rizosfera desempeña una función importante para la nutrición y el desarrollo de la planta. En el trabajo se evaluó el potencial biofertilizante de bacterias fijadoras de nitrógeno (diazótrofas) aisladas de suelos cacaoteros por la técnica de diluciones seriadas. Las bacterias se aislaron en medios semiselectivos (NFb, JMV, LGI, JNFb). Los aislados puros se caracterizaron morfológica y bioquímicamente y complementariamente se evaluó la capacidad de fijación biológica de nitrógeno (FBN) por el método de Micro-Kjeldahl. Los aislados con mejor capacidad de fijación de nitrógeno fueron seleccionados para evaluar su potencial promotor de crecimiento durante 120 días en plantas de cacao clon CCN 51 establecidas a partir de semillas. El análisis de datos mostró que las plantas de cacao respondieron efectivamente a los tratamientos con bacterias donde las variables de crecimiento y N (%) foliar incrementaron significativamente, en comparación con el testigo. Se destacó el aporte de los aislados DKA2J24, DKB3J73 presuntamente del género Burkholderia sp. y DKA1L3 semejante al género Gluconacetobacter sp., todos con un gran potencial como biofertilizantes en la prueba de bioensayo.
Palabras clave: Bacterias fijadoras de nitrógeno, Burkholderia, Gluconacetobacter, Herbaspirillum.
Abstract
The adaptability of cacao (Theobroma cacao L.) to adverse conditions, suggests that the microbiota associated with the rhizosphere of this plant could play an important nutrition and development function. In this paper was evaluated the potential of biofertilizer nitrogen fixing bacteria (diazotrophas) isolated by the technique of serial dilutions of cacao soils. Bacteria were isolated on semiselective media (NFb, JMV, LGI, JNFb). The pure isolates were characterized morphologically and biochemically and, additionally the capacity of biological nitrogen fixation (BNF) was evaluated by the Micro-Kjeldahl method. Isolates with better nitrogen fixation ability were selected to evaluate their potential for growth promoter in cocoa plants from seed CCN 51 for 120 days with a control without inoculum. As a result of statistical analysis, the cocoa plants effectively responded to bacterial treatments where growth variables and foliar % N, were significantly increased compared with the control whose response was lower. Highlighting the contribution of isolated DKA2J24 and DKB3J73 presumably genus Burkholderia sp., and DKA1L3 like genus Gluconacetobacter sp. all with great potential as biofertilizers in the bioassay test.
Key words: Nitrogen fixing bacteria, Burkholderia, Gluconacetobacter, Herbaspirillum.
Introducción
El cacao (Theobroma cacao L.) es considerado como uno de los cultivos perennes más importantes d el m undo y e s e xplotado c omercialmente para la producción de semillas principalmente destinadas a la fabricación de chocolate, además de su gran potencial en las industrias alimentaria, cosmética y farmacéutica. Su producción mundial ha decaído debido a cambios en las condiciones de clima de las principales zonas productoras como África Occidental y Sudamérica, problemas fitosanitarios, falta de inversión, envejecimiento de las plantaciones e inadecuada fertilización (Rojas y Sacristán 2009). Por consiguiente, una alternativa para recuperar el ecosistema cacaotero es el estudio y uso de la microbiota con potencial biofertilizante en los suelos, tecnología que se ha utilizado con éxito en la agricultura ecológica como una forma de mantener el equilibrio en la nutrición vegetal (Paulo et al., 2004). Por esta razón es importante identificar bacterias fijadoras de nitrógeno nativas de los suelos cacaoteros que aseguren mayor adaptabilidad, supervivencia y establecimiento del cultivo y promuevan la acción benéfica a nivel de la rizosfera con el fin de mejorar los resultados económicos y ambientales; además de incrementar el rendimiento de las cosechas y reducir el uso de fertilizantes nitrogenados de síntesis (Lara et al., 2007).
El presente estudio es una contribución importante al esquema agroecológico tendiente al mejoramiento de los cultivos de cacao en la región Norte-santandereana, Colombia, y tuvo como objetivo desarrollar cultivos puros de bacterias diazótrofas con posible potencial biofertilizante a partir de muestras de suelo rizosférico de plantaciones de cacao que fueron evaluadas y caracterizadas sobre semillas de cacao en vivero.
Materiales y métodos
Sitio y recolección de muestras
Las muestras de suelos rizosféricos fueron recolectadas de tres cultivos de cacao en las fincas Florilandia, El Porvenir y Villa Antigua, ubicadas en la vereda Astilleros, municipio El Zulia (07° 56' N 72°36' O) departamento de Norte de Santander (Colombia), con precipitación anual de 910 - 1610 mm y temperatura promedio de 26 °C. En cada lote de cultivo se realizaron tres muestreos, compuestos por 20 submuestras, para un total de nueve muestras de 1 kg de suelo representativo de cada cultivo.
Abundancia de microorganismos
A partir del proceso de diluciones seriadas de Baldani (2007) se midió la presencia de bacterias en diluciones 10-6 agar-glicerina, para actinomicetos en diluciones 10-5 en agaralmidón amoniacal y para hongos y levaduras en diluciones 10-4 en agar-rosa de bengala.
Aislamiento de bacterias, obtención y conservación de cultivos puros
El aislamiento de bacterias potencialmente fijadoras de N se hizo a partir de diluciones seriadas de suelo, en envases de vidrio de 10 ml con tapón de gasa estéril con 5 ml de medio. Se utilizaron medios de cultivo semisólidos NFb, JMV, LGI y JNFb semi-selectivos para el aislamiento de posibles géneros de Azospirillum, Burkholderia, Gluconacetobacter y Herbaspirillum, respectivamente, que permiten la movilización de estas bacterias hacia las zonas de tensión de oxígeno (Mantilla et al., 2009; Baldani et al., 1996). En la superficie de los medios se inocularon 1000 µl de las diluciones. Los envases fueron incubados a 32 °C por 7 días (Döbereiner et al., 1995). El aislamiento de medios sólidos se realizó a partir de los tubos que registraron crecimiento positivo con formación de película subsuperficial. Los aislados de NFb se reaislaron en agar de papa, mientras que los demás lo fueron en los mismos medios semiselectivos, pero modificados con la adición de extracto de levadura. Los cultivos puros fueron conservados dentro de tubos de vidrio con tapa de rosca en agar DYGS con una capa de aceite mineral estéril.
Caracterización de los aislados
La caracterización morfológica de las colonias y la tinción de Gram se hicieron una vez fueron purificados en el medio correspondiente. Teniendo en cuenta las pruebas bioquímicas sugeridas por Bergey's (2004) para todos los aislados oxidasa se evaluaron: catalasa, óxido fermentación de la glucosa (OF), licuefacción de la gelatina, manitol, maltosa, D-galactosa, D-fructosa, D-glucosa, sacarosa, urea, reducción de nitratos a nitritos. Adicionalmente para la identificación del género Gluconacetobacter sp. se realizaron las pruebas de producción de indol, producción de H2S y sorbitol. Para el género Burkholderia sp. se hizo crecimiento en agar MacConkey, rafinosa y manosa. Para el género Herbaspirillum sp. se midieron, además, las producciones de H2S, citrato y rafinosa.
Actividad nitrogenasa
Para evaluar la capacidad fijadora de nitrógeno de los aislados puros se utilizó el método de micro-Kjeldhal modificado de Kuss et al. (2007). Para ello, de una solución bacteriana previamente ajustada para 0.5 absorbancia en espectrofotómetro Jenway 6230D a 600 nm (aprox. 108 UFC/ml) se tomaron 1000 µl que fueron colocados en solución en 50 ml de caldo DYGS incubándose a 30 °C por 48 h a 120 rpm. Posteriormente, se centrifugaron durante 10 min a 6000 r.p.m. 10 ml del cultivo bacteriano, descartando el sobrenadante. Seguidamente, las células bacterianas se lavaron con 10 ml de amortiguador de fostato. De la suspensión resultante se inocularon 1000 µl en viales con 10 ml de medio semisólido, según el género bacteriano, incubando por 5 días. Para la liberación del contenido celular, se realizó un tratamiento térmico bajo presión, colocando los viales positivos en autoclave durante 5 min a 15 libras de presión.
De la suspensión resultante se adicionó 0.1 g en un matraz aforado y 4 ml de H2SO4 calentando en digestor a 440 °C durante 4 min, luego se adicionaron 10 ml de H2O2 gota a gota a una columna fragmentada hasta la caída de la última gota. La digestión transforma todo el nitrógeno orgánico a una forma mineral en NH3. Una vez que la temperatura disminuyó hasta 28 °C, se completó el volumen a 100 ml con agua destilada y se tomaron 5 ml que fueron colocados en una cubeta del espectrofotómetro para adicionarle tres gotas del estabilizador mineral (catalizador), tres gotas de alcohol polivinil y 1 ml del reactivo de Nessler. Para cuantificar el nitrógeno total (Nt) transformado a NH3, se realizaron lecturas de las muestras en espectrofotómetro HACH DR/2000 a 245 nm. Se hizo un análisis descriptivo en función de los valores promedio obtenidos en la FBN, seleccionando los aislados con los valores más altos para ser evaluados en bioensayo. Los ensayos se desarrollaron por triplicado.
Producción de inóculos bacterianos
De una solución bacteriana previamente ajustada para 0.5 absorbancia en espectrofotómetro Jenway 6230D a 600 nm (108 UFC/ml), los aislados se masificaron en 200 ml de caldo DYGS incubándose por 48 h a 32 °C y 100 r.p.m., hasta observar crecimiento bacteriano. Conservando las mismas condiciones de esterilidad, se extrajeron de cada recipiente 5 ml del inóculo para medir el crecimiento bacteriano y obtener una concentración final del inóculo de 108 UFC/ml mediante espectrofotometría. Dentro de cada frasco se colocaron las semillas de cacao sin musílago, previamente seleccionadas por homogeneidad de tamaño y desinfectadas con etanol al 70% durante 2 min e hipoclorito de sodio al 2% por 5 min, finalmente fueron lavadas con agua destilada estéril y secadas sobre papel absorbente estéril.Bioensayo
Las semillas preparadas se sumergieron durante 4 h en el inoculante según el tratamiento correspondiente y las del tratamiento testigo se colocaron por 4 h en agua destilada estéril. Posteriormente se ubicaron en germinador para calcular el porcentaje de prendimiento 30 días más tarde. El sustrato empleado, compuesto por suelo:arena:cisco en proporción 3:1:1 fue sometido previamente a solarización para la eliminación de patógenos. Luego de 30 días las plántulas fueron trasplantadas a macetas de 3 kg de capacidad, conservando el mismo sustrato y puestas en vivero bajo polisombra a 65% y riego diario hasta capacidad de campo. Cada 30 días y durante 3 meses después de la germinación de las semillas, se utilizaron cinco plantas por tratamiento como unidad experimental, se midieron las variables de crecimiento: número de hojas (NH), longitud del tallo (LT), diámetro del tallo (DT). A los 120 días se realizaron muestreos destructivos para evaluar, además, longitud de la raíz principal (LR), peso fresco total (PFT), peso seco (PS) en horno a 70 °C durante 72 h, largo y ancho de las hojas para el cálculo de área foliar (AF) de las plantas (Ochoa y Peña, 2012) y N foliar por Micro-kjeldahl (Laboratorio Bioambiental - Universidad Nacional Experimental del Táchira - UNET). Se empleó un diseño experimental completamente al azar, con siete tratamientos de 12 macetas por triplicado, empleando seis aislados bacterianos diazótrofos y un testigo sin inóculo, para un total de 252 macetas.
Análisis estadístico
Se realizó el análisis para la variable germinación ya que cumplió con el supuesto estadístico de homogeneidad de varianzas (Bartlett). Los resultados del bioensayo durante los días 30, 60 y 90 se interpretaron utilizando el método multivariable para medidas repetidas del programa estadístico SPSS versión 15.0. Para los resultados de las evaluaciones a 120 días, se realizó un análisis no paramétrico Kruskal Wallis del programa Infostat profesional versión 1.1 (Montgomery, 1993).
Resultados y discusión
Microbiología de muestras
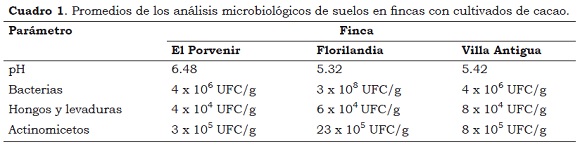
Las poblaciones de microorganismos en las muestras de suelo analizadas se encontraron dentro del rango de 106 bacterias/g, 105 actinomicetos/g, y 104 hongos/g reportados como las densidades normales en suelos agrícolas (Rojo y Urbano, 1992) (Cuadro 1). Las variaciones de pH no influyeron en el número de microorganismos rizosféricos presentes en las muestras, posiblemente debido a que la mayor parte de los microorganismos parecen crecer mejor en torno a un pH 7, aunque éste no es un valor óptimo para todos los microorganismos, sí se encuentra dentro del rango donde prolifera un número alto de ellos (Coyne, 2000).
Aislamiento, caracterización y selección de los aislados
Como resultado del proceso de aislamiento y purificación, se obtuvieron en medios selectivos aislados similares a los géneros Burkholderia sp., Herbaspirillum sp. y Gluconacetobacter sp. El probable género Burkholderia sp. fue el más abundante en los aislados debido a que es un colonizador de raíces, zona rizosférica y suelos adyacentes a la raíz de un gran número de cultivos agrícolas (Jha et al., 2009), coincidiendo con los resultados de Mora y Toro (2007) quienes reportaron que la bacteria predominante en la rizósfera de G. jussiaeana y C. venosum fue Burkholderia. Las bacterias del género Herbaspirillum sp. promueven el crecimiento vegetal, fijan nitrógeno y producen fitohormonas; éstas fueron aisladas en menor cantidad debido a su naturaleza endófita (Punschke y Mayans 2011). De igual manera, Garrido et al. (2010) en un estudio sobre la influencia de los factores edafo-climáticos y la especie de gramínea en la diversidad de bacterias diazotróficas encontraron reducciones de las poblaciones celulares de Herbaspirillum sp. y Gluconacetobacter sp. En la época de sequía, lo que pude ser debido al estrés que esta condición genera en los tejidos vegetales, lo cual reduce la producción de exudados aprovechables por las poblaciones de las bacterias diazotróficas presentes en la rizosfera. No se encontraron aislados similares al género Azospirillum sp., posiblemente por la competencia con otros microorganismos o contaminantes que se generan sobre el medio de cultivo.
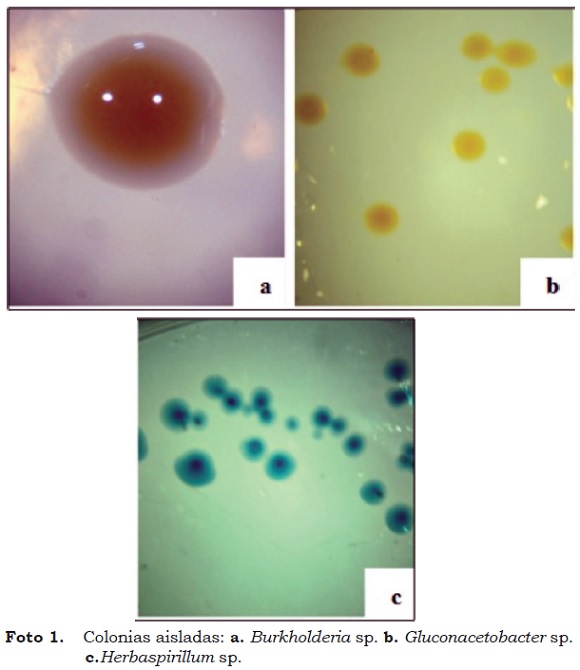
En medio JMV se desarrollaron colonias grandes de forma circular, cremosas, amarillas o de color blanco con centro amarillo (Baldani, 2007), borde liso, elevación en lente, superficie lisa, detalle óptico, traslúcidas y/o brillantes, microscópicamente de formas bacilares, Gram negativas, similares a Burkholderia sp. En medio JNFb las colonias presentaron tres veces la concentración normal de bromotinol azul, húmedas, con un centro de color verde o azul oscuro de forma circular, borde entero, elevación en lente, superficie lisa, detalle óptico traslúcido y/o brillante, microscópicamente de formas bacilares y Gram negativas, similares al género Herbaspirillum sp., concordando con Bergey's (2004) y Baldani (2007). Se encontraron aislados con crecimiento característico del género bacteriano Gluconacetobacter sp. sobre agar LGI como colonias pequeñas de forma circular, color amarillo/naranja, borde entero, elevación en lente, superficie lisa, detalle óptico opaco, microscópicamente de formas bacilares, Gram negativas coincidiendo con Baldani (2007). De un total de 33 aislados, 19 fueron similares al género Burkholderia, ocho al género Herbaspirillum y seis al género Gluconacetobacter (Foto 1).
Los aislados similares morfológicamente a Burkholderia sp. dieron resultados positivos frente a presencia de oxidasa, ureasa, catalasa, manosa, oxidación de la glucosa en medio OF y crecimiento en Agar MacConkey, presentando colonias rosadas; resultado negativo frente a la licuefacción de la gelatina y variabilidad en los resultados de uso de fuentes de carbono como el manitol, maltosa, D-galactosa, D-fructosa, D-glucosa, sacarosa, rafinosa, y reducción de nitratos a nitritos, coincidiendo con lo reportado en Bergey's (2004).
Los aislados obtenidos con características morfológicas similares al género Herbaspirillum sp. fueron positivos frente a pruebas de oxidasa, catalasa, reducción de nitratos a nitritos, presencia de ureasa y utilización del citrato; no presentaron licuefacción de la gelatina; la producción de H2S fue variable al igual que el uso de manitol, maltosa y D-fructosa; todos fueron positivos frente a la utilización de fuentes de carbono como D-galactosa, D-glucosa, sacarosa y rafinosa, lo anterior se ajusta a lo reportado en Bergey's (2004). El aislado DKA3Jn21 con características similares al género Herbaspirillum sp., resultó negativo para maltosa aproximándose bioquímicamente a H. seropediacae, H. frisingense y/o H. ribrisubalbicans, según lo reportado en Bergey's (2004).
Los aislados similares morfológicamente a Gluconacetobacter sp. Exhibieron pruebas negativas de oxidasa y licuefacción de la gelatina; catalasa, producción de indol y producción de H2S positivos; presentaron respuestas positivas frente al uso de fuentes de carbono como manitol, D-galactosa, D-fructosa y D-glucosa; fueron variables frente a la presencia de ureasa, reducción de nitratos a nitritos, sorbitol, maltosa y sacarosa; lo anterior coincide con lo reportado en Bergey's (2004). Para este género, se resalta que los aislados DKA1L3, DKB2L96 y DKB1L98 concordaron en todas las pruebas.
Fijación biológica de nitrógeno
Se seleccionaron dos aislados por género diazótrofo para el bioensayo, los cuales como se observa en el Cuadro 2 presentaron la mayor fijación de NH3. Los resultados de la cuantificación de ión NH3 obtenidos por Micro-Kjeldahl confirmaron la capacidad de las bacterias diazótrofas para convertir el nitrógeno no disponible a la forma NH3 y exudarlo al medio, ya que en el medio de cultivo del cual provienen no dispone de otra fuente de N para su crecimiento, sino del presente en el aire contenido dentro del recipiente, según lo reportado por Lara et al. (2007).
Bioensayo
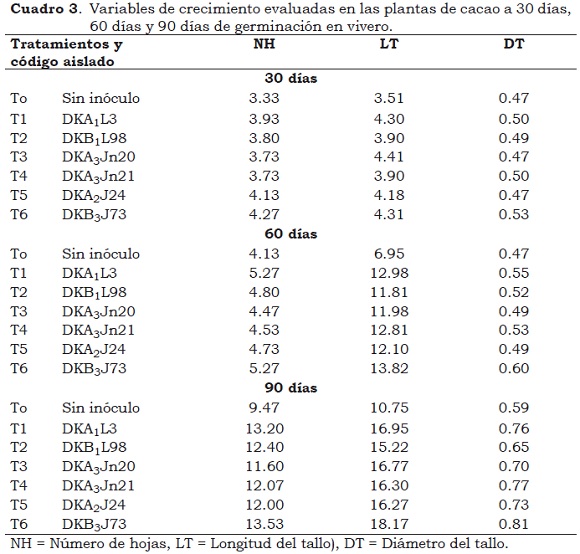
No se encontraron diferencias (P > 0.05) en la germinación de las semillas entre los tratamientos, lo que difiere de los resultados de Mora y Toro (2007) quienes encontraron diferencias en el porcentaje de germinación en semillas de maíz tratadas con B. cepacia logrando el 100% de germinación vs. El testigo sin inóculo bacteriano que fue de 71%. Durante los días 30, 60, 90 de evaluación se observaron diferencias (P < 0.01) entre los tratamientos bacterianos para todas las variables de crecimiento vs. El testigo sin inóculo (Cuadro 3). Se destacó el efecto de los tratamientos DKA2J24 y DKB3J73 que coinciden bioquímicamente con el género Burkholderia sp., el cual se considera como promotor de crecimiento vegetal debido a su habilidad para fijar nitrógeno (Perín et al., 2006).
En el día 120 de evaluación (Cuadro 4) se encontró que los tratamientos bacterianos en comparación con el tratamiento testigo sin inóculo, favorecieron el crecimiento morfológico de las plantas de cacao, destacando el efecto de los aislados similares a los géneros Burkholderia y Gluconacetobacter. Los resultados concuerdan con los hallazgos de Aguirre et al. (2007) en cacao y de Punschke y Mayans (2011) en arroz con el uso de biofertilizantes.
En el tratamiento testigo sin inóculo el desarrollo de las plantas fue normal, pero inferior a aquéllas que recibieron inóculo. El porcentaje de nitrógeno foliar fue más alto en las plantas inoculadas con los tratamientos bacterianos (P < 0.05). Los resultados obtenidos coinciden con los de Aguirre et al. (2007) quienes encontraron diferencias en contenidos de nitrógeno en hojas de cacao entre tratamientos biofertilizadas con G. intraradices, solo o aplicado con Azospirillum.
Conclusiones
- Se presentó una variación mínima en las densidades poblacionales de bacterias, actinomicetos, hongos y levaduras, en las muestras de suelos cacaoteros evaluadas, correspondiendo con densidades normales reportadas en suelos de uso agrícola; las variaciones de pH no influyeron en el número de microorganismos rizosféricos obtenidos en los recuentos.
- En la caracterización de los aislados bacterianos obtenidos a partir de muestras de suelos cacaoteros se encontraron similitudes morfológicas y bioquímicas con los géneros Burkholderia sp., Herbaspirillum sp. y Gluconacetobacter sp. En las características de las colonias en medios semiselectivos, tinción de Gram y pruebas de oxidasa, catalasa, ureasa, licuefacción de la gelatina, reducción de nitratos a nitritos, y uso de diversas fuentes de carbono coincidiendo con lo reportado por Bergey's en 2004.
- La evaluación de la capacidad fijadora de nitrógeno de las poblaciones aisladas por la técnica de Micro-kjeldahl, permitió seleccionar los aislados con mayor potencial biofertilizante, como inóculos bacterianos utilizados en el bioensayo, los cuales promovieron significativamente el crecimiento y desarrollo de las plantas de cacao, así como la mayor concentración de nitrógeno en sus tejidos, en comparación con el testigo.
- Los partes más desarrolladas de las plantas inoculadas fueron la longitud del tallo, la raíz y la lámina foliar; además de una mayor concentración de nitrógeno en el tejido vegetal.
Agradecimientos
A la Universidad Francisco de Paula Santander por la financiación de la investigación. Al personal de laboratorios-UFPS por su colaboración y apoyo. A Fedecacao - Norte de Santander y cultivadores de cacao de la vereda Astilleros, municipio el Zulia, Departamento Norte de Santander, Colombia.
Referencias
Aguirre, J.; Mendoza, A.; Cadena, J.; y Avendaño, C. 2007. Efecto de la biofertilización en vivero del cacao (Theobroma cacao L.) con Azospirillum brasilense tarrand, krieg et döbereiner y Glomus intraradices schenk et Smith. Agron. Trop. 32(8):541 - 547. [ Links ]
Baldani, V.; Baldani, J.; y Döbereiner, J. 1996. Meios de cultura específicos para o isolamento de bacterías endofíticas que fixam N2 atmosférico. CNPAB. Com. Téc. 12:4. [ Links ]
Baldani, V. 2007. Aislamiento, colonización e identificación de bacterias diazotróficas en plantas de arroz (Oryza sativa). En: Segundo curso internacional microorganismos promotores del crecimiento vegetal: rizobacterias y solubilizadores o movilizadores de fosfatos. Instituto de Biotecnología de la Universidad Nacional de Colombia-IBUN, CD-ROM. [ Links ]
Bergey's. Manual of systematic bacteriology. 2004. Second edition. Editorial Springer.1136 p. [ Links ]
Coyne, M. 2000. Microbiología del suelo. Un enfoque explorativo. Madrid, España Editorial Paraninfo. 416 p. ISBN: 84-283-2648-7 [ Links ]
Döbereiner, J.; Baldani, V.; y Baldani, J. 1995. Como isolar e identificar bactérias diazotróficas de plantas ñao leguminosas. Brazil, Empresa Brasileira de Pesquisa Agropecuaria (Embrapa). SPI. 60 p. [ Links ]
Garrido, M.; Cárdenas, D.; Bonilla, R.; y Baldani, V. 2010. Efecto de los factores edafoclimáticos y la especie de pasto en la diversidad de bacterias diazotróficas. Pastos y forrajes. 33(4):6 p. [ Links ]
Jha, B.; Thakur, M.; Gontia, I.; Albrecht, V.; Stoffels, M.; Schmid, M.; y Hartmann, A. 2009. Isolation, partial identification and application of diazotrophics rhizobacteria from tradicional india rice cultivars. Eur J soil biol. 45:62 - 72. [ Links ]
Kuss, A.; Kuss, V.; Lovato, T.; y Flores, M. 2007. Fixação de nitrogênio e produção de ácido indolacético in vitro por bactérias diazotróficas endofíticas. Pesq. Agrop. Bras. 42(10):1459 - 1465. [ Links ]
Lara, C.; Villalba, M.; y Oviedo, L. 2007. Bacterias fijadoras asimbióticas de nitrógeno de la zona agrícola de San Carlos. Córdoba, Colombia. Rev. Col. Biotecnol. 9(2):6 - 14. [ Links ]
Mantilla, A.; Cardona, G.; Peña, C.; Murcia, U.; Rodríguez, M.; y Zambrano, M. 2009. Distribución de bacterias potencialmente fijadoras de nitrógeno y su relación con parámetros fisicoquímicos en suelos con tres coberturas vegetales en el sur de la Amazonia colombiana. Rev. Biol. Trop. 57(4):915 - 927. [ Links ]
Montgomery, D. 1993. Diseño y análisis de experimentos. Grupo editorial Ibero-Americana. México. DF. 589 p. [ Links ]
Mora, E. y Toro, M. 2007. Estimulación del crecimiento por Burkholderia cepacia, una cepa nativa de suelos de sabanas venezolanas. Agron. Trop. 57(2):127 - 128. [ Links ]
Ochoa, P. y Peña, M. 2012. Efecto del riego en la microinjertación del cacao. Rev. Cienc. Téc. Agrop. 21:54 - 58. [ Links ]
Paulo, A.; Hernández, W.; y João, F. 2004. Avaliação de biofertilizantes, extratos vegetais e diferentes substâncias alternativas no manejo de tripes em cebola em sistema orgánico. Hortic. Bras. 22(3):659 - 662. [ Links ]
Perin, L.; Martínez, L.; Castro, R.; Estrada, P.; Cabellos, T.; Guedes, H.; Resi, V.; y Caballero, J. 2006. Diazotrophic Burkholderia species associated with field-grown maize and sugarcane. Appl. Environ. Microbiol. 72(5):3103 - 3110. [ Links ]
Punschke, K. y Mayans, M. 2011. Selección de cepas de Herbaspirillum spp. promotoras del crecimiento de arroz. Agrociencia 15(1):19 - 26. [ Links ]
Rojas, F. y Sacristán, E. 2009. Guía ambiental para el cultivo del cacao. Bucaramanga-Colombia, Federación Nacional de Cacaoteros-Fedecacao. 111 p. [ Links ]
Rojo, C. y Urbano, P. 1992. Condiciones del suelo y desarrollo de las plantas según Russel. Madrid- España. Ediciones Mundi-Prensa. p. 471 - 495. [ Links ]