Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.3 Palmira July/Sept. 2014
https://doi.org/10.15446/acag.v63n3.40980
http://dx.doi.org/10.15446/acag.v63n3.40980
Biotecnología
Multiplicación de Selenicereus megalanthus (pitahaya amarilla) e Hylocereus polyrhizus (pitahaya roja) vía organogénesis somática
Multiplication of Selenicereus megalanthus (yellow pitahaya) and Hylocereus polyrhizus (red dragon fruit) by somatic organogenesis view
Rocío Stella Suárez Román 1*, Creuci María Caetano 2 y Hernando Ramírez 2 Juan Gonzalo Morales Osorio3
1Universidad del Quindío, Colombia. 2Universidad Nacional de Colombia sede Palmira, Facultad de Ciencias Agropecuarias 3Universidad Nacional de Colombia sede Medellín, Departamento de Ciencias Agronómicas. *Autora para correspondencia: rociosuarezr@gmail.com
Rec.: 25.11.2013 Acep.: 28.01.2014
Resumen
Pitahaya amarilla (Selenicereus megalanthus) y roja (Hylocereus polyrhizus) se multiplicaron vía organogénesis somática, a partir de hojas cotiledonares y fragmentos de cladodio provenientes de plántulas con 20 días de desarrollo, en medio Murashige & Skoog (MS) suplementado con auxinas (ANA) y citocininas (Kinetina y BAP). En el medio de cultivo M3 (BAP + Kinetina 2 mg/l) se obtuvieron entre cuatro y nueve brotes enraizados de 4 cm de longitud, en un periodo de 30 días. En pitahaya roja se desarrolló mayor número de brotes. En todos los medios estudiados se observó formación de callo, siendo más alto el número en el medio con altas concentraciones de ANA. Las vitroplantas en fase de climatización alcanzaron 100% de sobrevivencia y presentaron respuestas diferenciales al sustrato empleado.
Palabras clave: Hojas cotiledonares, cladodios, pitahaya amarilla, pitahaya roja.
Abstract
Multiplication of both yellow and red pitahaya through somatic organogenesis were made from cotyledon leaves and fragments of cladodes from seedlings 20 days of development exposed to Murashige & Skoog (MS), supplemented with auxins (NAA) and cytokinins (Kinetina and BAP). In the M3 medium (BAP + Kinetin 2 mg/l) from four to 11 rooted shoots were obtained, with 4 cm, within a period of 30 days. Development of a higher number of buds was observed in red dragon fruit. Callus formation was observed in all media, with most in the media with high concentrations of ANA. Vitroplants under acclimation phase reached the 100% survival and showed differential responses to the substrate used.
Key words: Cotyledon leaves, cladodes, yellow pitahaya, red dragon fruit.
Introducción
La pitahaya amarilla (Selenicereus megalanthus ) es una especie de la familia Cactaceae, mundialmente reconocida por su uso alimenticio. Tradicionalmente, la parte comestible ha sido el fruto, aunque también se consumen las flores como legumbre, los brotes como hortaliza fresca (Cervantes y Gallegos, 2001; Cálix de Dios, 2004) y las semillas como probiótico (Wichienchot et al., 2010).
La creciente penetración de la pitahaya en el mercado internacional exige un mayor esfuerzo en la investigación que conduzca a mejorar la eficiencia del proceso de propagación, y a la obtención masiva y homogénea de material élite con tolerancia a agentes patógenos; así como al establecimiento de protocolos confiables, como base para programas de transformación de plantas por ingeniería genética a partir de genotipos seleccionados.
La investigación en cultivo in vitro ha sido descrita para diferentes cactáceas (Pérez-Molphe-Balch et al., 1998; Malda et al., 1999; Bhau 1999; Giusti et al., 2002; Mohamed-Yasseen, 2002; Pérez-Molphe-Balch y Dávila-Figueroa, 2002; Rubluo et al., 2002; Medeiros et al., 2006; Ferreira Gomes et al., 2006; Angulo-Bejarano y Paredes-López, 2011), incluyendo la pitahaya roja (Hylocereus polyrhizus). No obstante para S. megalanthus se registran solamente los trabajos de Infante (1992) y Pelah et al. (2002) orientados a la diferenciación de callos y más recientemente, los de Caetano Nunes et al. (2014). Estos autores desarrollaron un protocolo de regeneración in vitro, vía organogénesis indirecta en pitahaya amarilla, a partir de meristemos axilares (aréolas), donde el TDZ (Thidiazuron) a una concentración de 300 µM mostró mayor eficiencia en la inducción de callos compactos, y el más elevado número de brotes formados por punto de regeneración.
Por lo tanto, el objetivo de este trabajo fue evaluar el potencial organogénico de hojas cotiledonares y fragmentos de cladodio de pitahaya amarilla, en medios de cultivo MS suplementados con auxinas y citocininas, en comparación con Hylocereus polyrhizus.
Materiales y métodos
Establecimiento
Para el estudio se recolectaron semillas de frutos en grado de maduración 5 - 6 de cultivos certificados o en proceso de certificación en el norte del Valle del Cauca (Colombia), las cuales se colocaron en germinadores en cajas Petri de acrílico sobre papel absorbente Whatman grado 181 humedecido (Rao et al., 2007), previa aplicación de tratamiento de desinfección consistente en inmersión durante 10 min en sustancias tensoactivas y desinfectantes: Tween 20 (monolaurato de polioxietileno sorbitan), alcohol etílico al 70% e hipoclorito de sodio comercial al 6%, seguido de tres enjuagues con abundante agua destilada después de cada inmersión.
Como explantes, de plántulas con 20 días de desarrollo, se tomaron segmentos de hojas cotiledonares y de tallo o cladodio (Figura 1a-b) de 1 cm de longitud (Estrada-Luna et al., 2008). Previo a la siembra se realizó la desinfección de los explantes, la cual consistió en la inmersión en una solución con detergente concentrado (Tween 20), seguido de alcohol a 70% e hipoclorito de sodio al 3% durante 10 min, y enjuagues con abundante agua estéril.
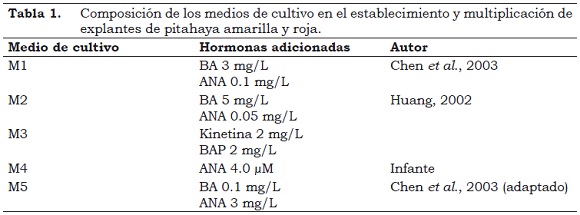
Los explantes se sembraron en cámara de flujo laminar, en recipientes con 10 ml de medio de cultivo MS al 100% (Murashige & Skoog, 1962; citados por Roca y Mroginski, 1993) suplementado con carbohidratos (sacarosa 30 g/lt y M-Inositol 800 mg/lt) y solidificado con agar (gelrite 2 g/lt), a pH de 5.8 y esterilizado en autoclave por 20 min a 121.5 °C y 15 libras de presión (Roca y Mroginski, 1993). Sobre este medio se adicionaron hormonas tipo auxinas (ácido Naftalenacético ANA) y citocininas (Benciladenina BA, Bencilaminopurina BAP y Kinetina) (Tabla 1). La incubación se realizó por 30 - 60 días en un área climatizada con una temperatura de 27 °C, 2000 lux y un fotoperiodo de 16 h luz y 8 h oscuridad (16/8).
Como variables de respuesta en el establecimiento in vitro se evaluaron el número y la longitud de brotes, la presencia/ausencia de callo, el color y la consistencia del callo (friable o no friable) y la presencia/ausencia de raíces. La evaluación se hizo por análisis de varianza para un diseño experimental completamente aleatorizado con 10 repeticiones por tratamiento, en un arreglo factorial con tres factores controlados: especie con dos niveles (amarilla y roja); tipo de explante con dos niveles (hoja cotiledonar y segmento de cladodio) y medios de cultivo con cinco niveles. Para la descripción de los brotes se consideró la posición del nuevo brote, es decir, en el ápice (apical), debajo del ápice (sub-apical), lateralmente (lateral) o desprendido de la base del fragmento de cladodio (basal).
Multiplicación
En esta fase se emplearon como explantes segmentos de cladodio apical, intermedio y basal (Figura 1c) provenientes de vitroplantas con 30 días de desarrollo, siguiendo el mismo procedimiento para la siembra e incubación descrito en la fase de establecimiento. Para evaluar los resultados se realizó un análisis de varianza para un diseño completamente aleatorizado con diez repeticiones por tratamiento, en un arreglo factorial con tres factores controlados: especie con dos niveles (amarilla y roja); tipo de explante (apical, intermedio y basal) y cinco medios de cultivo. Como variables de respuesta se consideraron aquellas evaluadas en la fase de establecimiento.
Climatización.
El porcentaje de sobrevivencia y otros aspectos asociados con el crecimiento fueron evaluados durante dos meses sobre vitroplantas de pitahaya de 60 días, enraizadas y con al menos un brote. Estas fueron sembradas sobre cuatro tipos de sustrato dispuestos en recipientes plásticos con capacidad de 355 cc. El ensayo se estableció en invernadero a 1.450 msnm, temperatura promedio, de 23 - 24°C e intensidad lumínica de 2.200 lux. Las vitroplantas en cada sustrato fueron expuestas a dos microambientes, uno con una atmósfera saturada de humedad en compartimentos de 44 cm de ancho x 46 cm de largo x 44 cm de profundidad cerrados con plástico calibre 4 mm, y el otro con la humedad relativa del invernadero y aplicación de un riego semanal.
Durante los primeros ocho días después del trasplante directo, todas las plántulas permanecieron cubiertas con un recipiente plástico de igual capacidad volumétrica y perforado, para permitir el intercambio de gases. A partir del día nueve, las plántulas se expusieron al ambiente durante una hora diaria hasta llegar al día 16, cuando se retiró definitivamente el recipiente que las cubría (Villalobos et al., 1993).
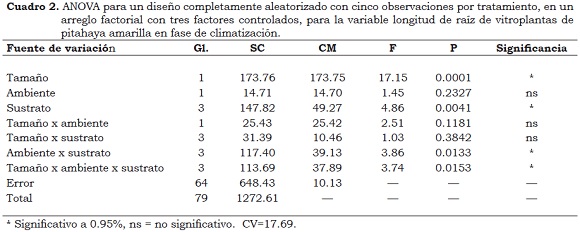
Para explicar los resultados se realizó un análisis de varianza para un diseño completamente aleatorizado con cinco repeticiones por tratamiento, en un arreglo factorial con tres factores controlados: tamaño de planta (> 4 cm, < 4 cm), microambiente (71% y 100% de humedad relativa), sustrato (suelo, arena, vermiculita, suelo:arena:turba, 1:1:1).
Como variables de respuesta fueron evaluados el porcentaje de aumento en peso de la plántula, el número de brotes por cada explante (con transformación), el porcentaje de aumento en la longitud del brote más largo y longitud de la raíz.
Resultados y discusión
Establecimiento
En esta etapa se presentaron diferencias (α = 5%) asociadas con el medio de cultivo y el tipo de explante (hoja cotiledonar y segmento de cladodio). En el medio de cultivo M3 suplementado con citocininas (BAP y Kinetina 2mg/lt) y en los medios M1 y M5, los cuales contenían bajas cantidades de auxina (ANA) y citocinina (BA), se alcanzaron los más altos valores promedio en el número de brotes (5 - 9). En las vitroplantas provenientes de hojas cotiledonares se produjeron un máximo de cuatro brotes/hoja (Figura 1d), mientras que a partir de segmentos de cladodio este número varió entre tres y nueve brotes. En ambos tipos de explantes se observó enraizamiento en los medios M1, M2, M3 y M5; en el medio M4, suplementado con ANA, las raíces fueron escasas y anormalmente engrosadas. La fase de establecimiento se completó 30 días después de la siembra.
Multiplicación y climatización
La proliferación de brotes de pitahaya en cultivo in vitro es estimulada por la interacción de auxinas como el ácido Naftalenacético (ANA) y el Ácido Indol Butírico (IBA) y citocininas como Bencilaminopurina (BAP), Benciladenina (BA), 6-Dimetilalylaminopurina (2ip), Thidiazuron (TDZ) o Kinetina, tanto en pitahaya roja (Chen et al., 2003; Huang, 2002; Mohamed-Yasseen, 2002) como en pitahaya amarilla (Pelah et al., 2002). En este ensayo se corrobora la acción de las citocininas en la brotación y enraizamiento.
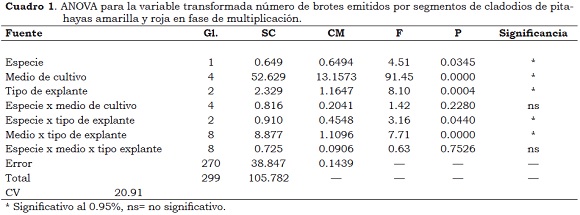
El análisis de varianza para número de brotes permitió establecer que se presentaron diferencias (α = 5%) (Cuadro 1) debidas a la especie, al medio de cultivo, al tipo de explante y las interacciones entre la especie y el tipo de explante y entre el medio de cultivo y el tipo de explante. Por la prueba de comparación de medias LSD se presentaron, en promedio, 3.2 brotes en pitahaya roja y 3.0 brotes en pitahaya amarilla. El mayor número de brotes (6.6) se presentó en el medio de cultivo M3, mientras que el menor ocurrió en el M2 (1.4). En los medios M1, M4 y M5 se observaron entre 2.3 y 2.7 brotes/explante.
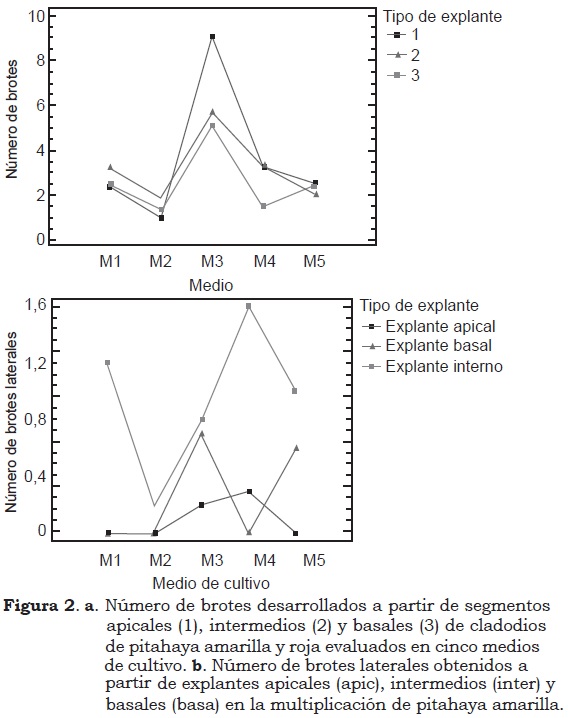
A partir de los explantes apical e intermedio se formaron 3.6 y 3.2 brotes en relación con el explante basal, donde sólo se formaron, en promedio, 2.5 brotes. Así mismo, la interacción de este factor (tipo de explante) con la especie indica que en pitahaya amarilla los explantes apicales producen 3.8 brotes, en promedio, y en pitahaya roja, con explantes apicales e intermedios se forman 3.6 y 3.5 nuevos brotes, respectivamente (Figura 2a).
En relación con la interacción medio de cultivo x tipo de explante, en el Medio M3 se produjeron 5.1, 5.6 y 9.1 brotes a partir de los explantes basal, intermedio y apícal, respectivamente. En el medio M2 se produjo el menor número de brotes con explantes apicales (1.1) y basales (1.3) (Figura 2a).
Para la multiplicación in vitro de cactus se han utilizado diferentes explantes (Drew, 2002; Ordóñez, 2003) y medios de cultivo, siendo el medio basal de Murashige & Skoog (1962) citado por Roca y Mroginski, 1993) recomendado como el más adecuado, al suplementarlo con reguladores de crecimiento, especialmente con bajos niveles de auxina en combinación con niveles moderados a elevados de citocinina para la proliferación axilar (Ordóñez, 2003). Esto coincide con los resultados de este trabajo, ya que los medios M1, M3 y M5 se caracterizan por presentar concentraciones moderadas de auxina (ANA) y citocininas (BA, Kinetina).
Con respecto a la ubicación de los nuevos brotes, proliferaron los laterales y sub-laterales, formados a partir de explantes intermedios, con especial predominio en los medios M1, M4 y M5 (Figura 2b). En el medio M3 se obtuvo el mayor número de brotes laterales a partir de explantes basales (Figura 3a). Para Mohamed-Yasseen (2002) la mayor proliferación de brotes en pitahaya roja se alcanza con explantes no-apicales de la parte distal. En el presente trabajo, a partir de explantes apicales e intermedios se formaron brotes tanto apicales, subapicales, como basales y laterales (Figura 3b-d). Según Litz y Jarret (1993), el potencial órgano-genético de un explante es inversamente proporcional a su edad fisiológica. A partir de secciones de tallo cercanas a los ápices caulinares se puede producir mayor cantidad de meristemoides que desde la porción baja del tallo.
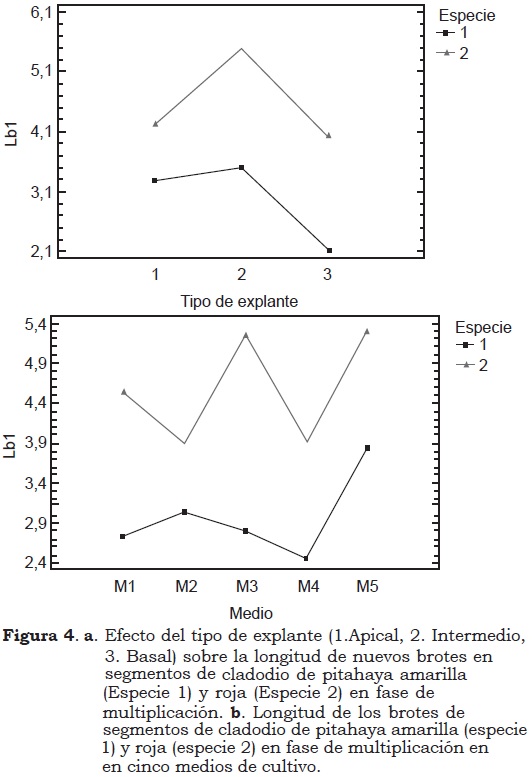
Para la variable longitud del brote se encontraron diferencias significativas debido a la especie, al medio de cultivo, al tipo de explante y a las interacciones especie x tipo de explante y especie x medio de cultivo x tipo de explante. En cuanto al tipo de explante, la prueba LSD indica que los segmentos intermedios produjeron brotes más largos (4.5 cm), seguido de los apicales (3.75 cm) (Figura 4a); en los basales se alcanzó una longitud de 3.08 cm.
En pitahaya roja los nuevos brotes alcanzaron mayor longitud promedio (4.58 cm) mientras que en pitahaya amarilla fue de aproximadamente 3 cm. En los medios de cultivo M5 y M3 se presentaron longitudes promedio, de 4.6 y 4.0 cm respectivamente; los medios M1 y M2 conformaron un grupo homogéneo según la prueba LSD con valores entre 3.4 y 3.6; en el medio M4 los brotes alcanzaron una longitud de 3.1 cm (Figura 4b).
La interacción especie x tipo de explante indica que en la pitahaya roja los brotes intermedios tuvieron una longitud de 5.5 cm, los apicales 4.2 cm y los basales 4.0 cm. En la pitahaya amarilla los brotes originados de segmentos intermedios presentaron una longitud promedio de 3.5 cm.
En la interacción medio de cultivo x tipo de explante, la prueba de comparación de medias LSD mostró cinco grupos homogéneos. En el primero, formado por el medio M5, los brotes de explantes apicales alcanzaron longitudes de 5.6 cm. En el segundo, conformado por los medios M5, M4 y M3, la longitud fue 4.7 cm para brotes provenientes de explantes intermedios. En el tercero, se ubicaron los medios M2, M1 y M3 con valores entre 3.8 y 4.2 cm para brotes de explantes intermedios y basales, respectivamente. Los medios M3, M1, M2 y M5 conformaron el cuarto grupo, con longitudes, promedio, de 3.3 a 3.5 cm en explantes apicales y basales. En el quinto grupo se encontraron los medios M2 y M4 con longitudes de 2.1 a 2.7 para brotes provenientes de explantes basales y apicales.
De este análisis se puede establecer que los medios de cultivo empleados en el ensayo, tanto en la fase de establecimiento como en la de multiplicación, exceptuando el medio M4 (MS suplementado solo con ANA), ofrecieron al explante una combinación apropiada de hormonas que permitieron tanto la estimulación de la organogénesis, mediante la cual se formaron nuevos cladodios con una morfología normal (Figura 5), como la proliferación de raíces que contribuyó a la climatización del 100% de las vitroplantas de pitahaya amarilla y pitahaya roja en el medio arena:suelo:turba (Cuadro 2). Se debe resaltar que en los trabajos de Huang (2002), Drew et al. (2002), Pelah et al. (2002) y Zhao et al. (2005) el enraizamiento se logró en una fase adicional, empleando como agente enraizador el Ácido Indolbutírico IBA (auxina), lo cual incrementa costos y tiempo en la obtención de las vitroplantas.
Formación de callos
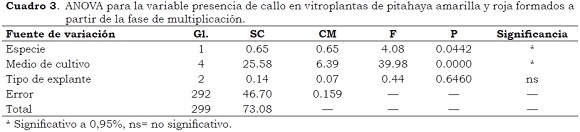
En el 10% de las plántulas obtenidas a partir de la germinación de semilla sexual en condiciones in vitro (Figura 5c) así como en los cladodios del medio de cultivo M4, se presentó proliferación de callos lo que coincide con los resultados de Infante (1992) y Pelah et al. (2002). En las plántulas provenientes de semilla sexual el callo se formó principalmente en el área radicular, mientras que en las vitroplantas su desarrollo ocurrió tanto a nivel basal del explante como en la mayoría de los puntos vegetativos de los cladodios (aréolas) (Figura 5d); su tamaño varió entre 0.2 cm y 5.5 cm (Cuadro 3). Según Margara (1988) la formación de callo dificulta el crecimiento de vástagos y raíces, hecho que se observó en este ensayo, especialmente en el medio M4, donde las raíces fueron escasas y engrosadas. La formación de callo también puede generar menor estabilidad genética (Krikorian, 1997).
El análisis de varianza para la variable presencia de callos indicó diferencias estadísticamente significativas debidas a la especie y al medio de cultivo, con mayor presencia de callo en la pitahaya amarilla y en los medios M4, M1 y M5. Por su consistencia, los callos de pitahaya se categorizaron como friables y compactos; los primeros con dos características, blancos y oxidados, mientras los compactos aparecen con o sin pigmentación clorofílica (Figura 5e). Según Marulanda et al. (2010) los callos que presentan zonas con desarrollo de clorofila forman embriones a partir de las estructuras verdes en varias especies de Bamboo, por lo cual se considera que pueden constituir un potencial importante para evaluar embriogénesis somática en pitahaya. Por su parte, los callos oxidados ofrecen un punto de partida importante para la investigación en el empleo de Intermediarios de Oxígeno Reactivo (ROS), causantes de la oxidación y fenolización en el cultivo in vitro, como indicadores del estrés celular y como moléculas señalizadoras de diferentes vías y procesos metabólicos como: germinación, mitosis, elongación celular, senescencia, muerte celular, lignificación de tejidos, formación de elementos cribosos del floema y xilema, regulación de la expresión génica asociada a estrés biótico y abiótico y sistema de defensa contra patógenos. Estas sustancias se han registrado asociadas con el incremento en la producción de embriones somáticos en explantes de coníferas de Vitis sp. y Paulownia sp. (Azofeifa, 2009).
Se debe señalar que el subcultivo de callos de pitahaya obtenidos en el medio M4 en otro medio enriquecido con 2,4-D y Kinetina no generó diferenciación (datos no presentados). Según Puri y Verma (1996) las altas concentraciones de auxina pueden inhibir la diferenciación de los callos. No obstante, se observó embriogénesis somática a partir de un callo obtenido de una semilla germinada en condiciones in vitro, cuando se cultivó en el medio M3 (Figura 5f), y aunque no era el objetivo del trabajo, se espera ensayarlo en el futuro, dada su viabilidad en la especie.
La embriogénesis somática ofrece varias oportunidades en cultivares de importancia económica como la producción de semilla artificial, fuente de variación somaclonal y un sistema unicelular para inducción de mutaciones y selección (Perea, 2003). Su formación está asociada con la presencia de auxinas exógenas, la fuente de nitrógeno y otras sustancias como la sacarosa (Villalobos y Thorpe, 1993). Los resultados de este trabajo pueden ser utilizados como base para estos fines.
Conclusiones
- La fase de establecimiento de pitahayas amarilla y roja en condiciones in vitro se alcanzó empleando como explantes hojas cotiledonares y fragmentos de cladodio provenientes de plántulas obtenidas a partir de la germinación de semilla sexual con una edad promedio de 20 días, los cuales se cultivaron en un medio MS suplementado con BAP 2 mg/lt y Kinetina 2 mg/lt. El desarrollo de nuevas plántulas enraizadas ocurrió por la vía organogénesis somática, en un término de 30 días.
- La multiplicación a partir de segmentos apicales e intermedios produjo en un término de 30 días, en promedio, 5 a 9 brotes, en los medios de cultivo M3, M1 y M5.
- En los medios de cultivo M3 (MS al 100% adicionado con BA 2 mg/l y Kinetina 2 mg/l) y M5 (BA 0.1 mg/l + ANA 3 mg/l) a partir del explante apical, los brotes desarrollaron una longitud promedio de 4.6 cm en pitahaya roja y 3.0 cm en pitahaya amarilla.
- En el medio M4 suplementado con ANA (4.0 µM) se presentó el mayor porcentaje de callos (98%), los cuales se describen por sus características externas, especialmente la consistencia y el color como friables, compactos, blancos y clorofílicos. Los callos se desarrollaron en la base del explante y en la mayoría de los puntos vegetativos de los cladodios (areólas) a partir de explantes basales de filocladodio. En los demás medios, especialmente en los medios M1 y M5, también se formaron callos, pero en menor proporción (20%).
- A diferencia de los hallazgos en otras investigaciones, en este ensayo se logró el establecimiento, la multiplicación y el enraizamiento con el mismo medio de cultivo, lo cual disminuye tiempo, costos y riesgo por pérdida de material.
- En la etapa de climatización de vitroplantas con una edad promedio de 60 días, se observaron diferencias en el peso de las plántulas, el número y la longitud de los brotes emitidos y en la longitud de las raíces, según el sustrato evaluado. Los ambientes con una humedad relativa de 100% favorecieron el incremento en peso y la brotación. En los sustratos arena, suelo y mezcla (arena:suelo:turba -v/v) las plántulas alcanzaron mayor brotación; las raíces más largas se desarrollaron en arena y en vermiculita. En todos los sustratos la sobrevivencia fue de 100%.
Agradecimientos
A: Asopitahaya por el suministro de material vegetal, Laboratorio de Cultivo de Tejidos Vegetales de la Universidad Nacional de Colombia sede Palmira donde se desarrolló la investigación; María Elena Guevara, técnica del Laboratorio de Cultivo de Tejidos Vegetales de la Universidad Nacional de Colombia sede Palmira; Lina María Arbeláez, técnica del Laboratorio de Cultivo de Tejidos Vegetales de la Universidad del Quindío por su decidida y valiosa colaboración; Bióloga María Eunice Quintero por sus aportes.
Referencias
Angulo-Bejarano, P. I.; and Paredes-López, O. 2011. Development of a regeneration protocol through indirect organogenesis in prickly pear cactus (Opuntia ficus-indica (L.) Mill). Sci. Hortic. 128:283 - 288. [ Links ]
Azofeifa, A. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agron. Mesoam. 20 (1):153 - 175. [ Links ]
Bhau, B.S. 1999. Regeneration of Coryphantha elephantidens (Lem.) Lem. (Cactaceae) from root explants. Sci. Hortic. 81:337 - 344. [ Links ]
Caetano Nunes, D. G.; Escobar, R.; Caetano, C. M.; y Vaca Vaca, J. C. 2014. Estandarización de un protocolo de regeneración en pitahaya amarilla (Selenicereus megalanthus (K. Schum. Ex Vaupel) Moran). Acta Agronomica .63(1),31-41. [ Links ]
Cálix de Dios, H. 2004. Geographical distribution of pitahayas (Hylocereus) in México. Cactáceas y Suculentas Mexicanas 49 (1):4 - 23. [ Links ]
Cervantes, H. J. y Gallegos, V. C. 2001. Use of pitaya (Stenocereus queretaroensis (Weber) Buxbaum) in the Cañõn de Juchipila, Zacatecas. Serie Ingeniería Agropecuaria. Rev. Chapingo 4 (2):29 - 33. [ Links ]
Chen, G.; Xie, X. y Lin, Y. 2003. Tissue culture techniques for Hylocereus undatus Fruit Crop. South China Fruits 32 (3):31. [ Links ]
Drew, R. y Azimi, M. 2002. Micropropagation of red pitaya (Hylocereus undatus). Acta Hortic. 1(575):93 - 98. [ Links ]
Estrada-Luna, A.; Martínez-Hernández, J.; Torres-Torres, M.; y Chablé-Moreno, F. 2008. in vitro micropropagation of the ornamental prickly pear cactus Opuntia lanigera Salm-Dyck and effects of sprayed GA3 after transplantation to ex vitro conditions. Sci. Hortic. 117 (4):378 - 385. [ Links ]
Ferreira Gomes, F. L.; Heredia, F. F.; Silva, P. B.; Faco, O; y Campos, F. A. 2006. Somatic embryogenesis and plant regeneration in Opuntia ficus-indica (L.) Mill. (Cactaceae). Sci. Hortic. 108:15 - 21. [ Links ]
Giusti, P.; Vitti, D.; Fiocchetti, F.; Colla, G.; Saccardo, F.; y Tucci, M. 2002. in vitro propagation of three endangered cactus species. Sci. Hortic. 95:319 - 332. [ Links ]
Huang, Q. 2002. In vitro culture of prism of Hylocereus undatus. Fujian J. Agric. Sci. 17(3):186 - 189. [ Links ]
Infante, R. 1992. In vitro axillary shoot proliferation and somatic embryogenesis of yellow pitaya Mediocactus coccineus (Salm-Dyck). Plant Cell, Tissue and Organ Culture 31(2):155 - 159. [ Links ]
Krikorian, A. 1993. Propagación clonal in vitro. En: Roca, W. y Mroginski, L. (eds.). Cultivo de Tejidos en la Agricultura. Cali, Colombia. Centro Internacional de Agricultura Tropical, CIAT, Unidad de Investigación en Biotecnología y Unidad de Publicación. p. 95 - 125. [ Links ]
Litz, R. y Jarret, R. 1993. Regeneración de plantas en el cultivo de tejidos: embriogénesis somática y organogénesis. En: Roca, W. y Mroginski, L. (eds.). Cultivo de Tejidos en la Agricultura. Cali, Colombia. Centro Internacional de Agricultura Tropical, CIAT, Unidad de Investigación en Biotecnología y Unidad de Publicación. p. 143 - 172. [ Links ]
Malda, G.; Suzán, H.; y Backhaus, R. 1999. in vitro culture as a potential method for the conservation of endangered plants possessing crassulacean acid metabolism. Sci. Hortic. 81:71 - 87. [ Links ]
Margara, J. 1998. Multiplicación vegetativa y cultivo in vitro. Madrid: Mundi-Prensa. 230 p. [ Links ]
Marulanda, M.; López, A.; Uribe, M. y Gutiérrez, L. 2010. Biodiversidad y biotecnología de la Guadua angustifolia Kunth. Risaralda (Colombia). Universidad Tecnológica de Pereira. 106 p. [ Links ]
Medeiros, L. A.; Ribeiro, R. C.; Gallo, L. A.; Oliveira, E. T.; y Dematte, M. E. 2006. In vitro propagation of Notocactus magnificus. Plant Cell, Tissue and Organ Culture 84:165 - 169. [ Links ]
Mohamed-Yasseen, Y. 2002. Micropropagation of pitaya (Hylocereus undatus Britton et Rose). In vitro Cell. Develop. Biol. Plant 38(5):427 - 429. [ Links ]
Ordóñez , M. A. 2003. Propagación in vitro de Mammillaria voburnensis Scheer. (Cactaceae). Trabajo de grado Biólogo. Guatemala. Universidad de San Carlos de Guatemala. Facultad de Ciencias Químicas y Farmacia. Escuela de Biología. [ Links ]
Pelah, D.; Kaushik, R.; Mizrahi, Y.; y Sitrit, Y. 2002. Organogenesis in the vine cactus Selenicereus megalanthus using Thidiazuron. Plant Cell, Tissue and Organ Culture 71(1):81 - 84. [ Links ]
Perea Dallos, M. 2003. Biotecnología. Bananos y plátanos. Bogotá: Editora Guadalupe. 209 p. [ Links ]
Pérez-Molphe-Balch, E.; y Dávila-Figueroa, C. A. 2002. In vitro propagation of Pelecyphora aselliformis Ehrenberg and P. strobiliformis Werdermann (Cactaceae). In vitro Cell. Develop. Biol. Plant 38:73 - 78. [ Links ]
Pérez-Molphe-Balch, E.; Reyes, M. E.; Rangel Amador, E. V.; Ruiz, L. R.; y Viramontes, H. J. 1998. Micropropagation of 21 species of mexican cacti by axillary proliferation. In vitro Cell. Develop. Biol. Plant 34:131 - 135. [ Links ]
Puri, S. y Verma, R. 1996. Vegetative propagation of Dalbergia Sissoo Roxb. using softwood and hardwood stem cuttings. J. Arid Environ. 34:235 - 245. [ Links ]
Rao, K.; Hanson, J.; Dulloo, E.; Ghosh, K.; Nowell, D. y Larinde, M. 2007. Manual para el Manejo de Semillas en Bancos de Germoplasma. Roma: Bioversity International. 164 p. [ Links ]
Roca, W. y Mroginski, L. 1993. Establecimiento de un laboratorio para el cultivo de tejidos vegetales. En: Roca, W. y Mroginski, L. (eds.). Cultivo de tejidos en la agricultura. Cali, Colombia: Centro Internacional de Agricultura Tropical, CIAT, Unidad de Investigación en Biotecnología y Unidad de Publicación. p. 1 - 17. [ Links ]
Rubluo, A.; Marín-Hernández, T.; Duvala, K.; y Márquez-Guzmán, A. J. 2002. Auxin induced morphogenetic responses in long-term in vitro subcultured Mammillaria san-angelensis Sánchez-Mejorada (Cactaceae). Sci. Hortic. 95:341 - 349. [ Links ]
Villalobos, V. Y Thorpe, T. 1993. Micropropagación: conceptos, metodología y resultados. En: Roca, W. y Mroginski, L. (eds.). Cultivo de tejidos en la agricultura. Cali, Colombia: Centro Internacional de Agricultura Tropical, CIAT, Unidad de Investigación en Biotecnología y Unidad de Publicación. p. 127 - 141. [ Links ]
Villalobos, V.; Mejía, J. y Escobar, H. Micropropagación de opuntias y agaves. 1993. En: Roca, William y Mroginski, Luis (eds.). Cultivo de tejidos en la agricultura. Cali, Colombia. Centro Internacional de Agricultura Tropical CIAT, Unidad de Investigación en Biotecnología y Unidad de Publicación. p. 644 - 650. [ Links ]
Wichienchot, S.; Jatupornpipat, M.; y Rastall, R. A. 2010. Oligosaccharides of pitaya (dragon fruit) flesh and their prebiotic properties. Food Chem. 120(3):850 - 857. [ Links ]
Zhao, C.; Zhang, G.; Huang, Z.; y Liu, M. 2005. Effects of media and IBA on stem cutting rooting of Hylocereus undatus cv. Vietnam. Southwest China J. Agric. Sci. 18(3):370 - 372. [ Links ]