Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.4 Palmira Oct./Dec. 2014
https://doi.org/10.15446/acag.v63n4.43598
Doi: http://dx.doi.org/10.15446/acag.v63n4.43598
Agronomía
Respuesta fotosintética de Eucalyptus grandis W. Hill a la disponibilidad de agua en el suelo y a la intensidad de luz
Photosynthetic response of Eucalyptus grandis W. Hill to soil water availability and to the light intensity
María Sara Mejía de Tafur*, Ronal Arturo Burbano Díaz, Mario Augusto García Díaz y Diosdado Baena García
Universidad Nacional de Colombia sede Palmira, Facultad de Ciencias Agropecuarias. *Autora para correspondencia: msmejiat@unal.edu.co
Rec.: 21.05.2014 Acep.:16.06.2014
Resumen
En condiciones de campo en la Universidad Nacional de Colombia sede Palmira (950 m.s.n.m., 24°C y 75% de humedad relativa) se evaluó la respuesta fotosintética de cuatro clones de Eucalyptus grandis (28-3, 18-3, 24A-5, 19-1) al estrés hídrico: capacidad de campo (1 cc), 0.5 cc, 0.25 cc y a la saturación de agua e intensidades lumínicas variables de 1500, 1000, 500, 250, y 0 µmol/m2/s en el primer ensayo y de 1500, 1000, 435, 87, 70, 52, 35, 26, y 0 µmol/m2/s en el segundo. En ambos estudios, se utilizó un diseño experimental de parcelas divididas con cuatro repeticiones, donde la parcela principal correspondió al nivel de humedad en el suelo y la subparcela a los clones. El análisis estadístico mostró que E. grandis reduce la tasa de fotosíntesis de manera significativa cuando se presenta estrés hídrico en el suelo y que el grado de la respuesta depende del clon, lo que sugiere la presencia de mecanismos fisiológicos dependientes del genotipo para responder al estrés hídrico. Se presentaron curvas de luz típicas con puntos de compensación bajos (0.9 - 7.0 µmol/m2/s), tasas de fotosíntesis altas (68 - 39 µmol CO2 /m2/s) y alta eficiencia fotosintética (0.0003 - 0.0086 mol CO2 /mol luz).
Palabras clave: Eucalyptus grandis, fotosíntesis, curvas de luz, estrés hídrico
Abstract
At the Universidad Nacional de Colombia Sede Palmira (950 m, 24 °C and 75% RH) two experiments were established to assess the photosynthetic response of four clones of Eucalyptus grandis to water stress and its response to light intensity. In both cases the experimental design was a split plot with 16 treatments (4 levels of water and 4 clons) and four replications. The main plot corresponded to the water level and the clones were located in the sub - plots. Statistical analysis of the data indicates that the E. grandis reduces its photosynthesis rate in response to soil water stress, which depends also on the clone. This suggests the presence of physiological mechanisms depending on each genotype. Typical light curves with low compensation points were presented (0.9 - 7.0 µmol/m2/s), high photosynthetic rates (68 - 39 µmol CO2 /m2/s) and high photosynthetic efficiency (0.0003 to 0.0086 mol CO2 / mol of light).
Key words: Eucalyptus grandis, photosynthesis, light curves, water stress.
Introducción
La disponibilidad de agua en el suelo es determinante para la distribución de las plantas en los ecosistemas y la productividad de los cultivos, por tanto, el estudio de la relación agua: planta es importante para conocer la capacidad de adaptación de los diferentes genotipos y cultivares al estrés hídrico y para la selección de sitios de siembra y el establecimiento de variables de respuesta estables como criterio de selección temprana (El-Sharkawy et al., 2012). Esto es fundamental debido al efecto esperado del calentamiento global, que según algunas predicciones, modificará el régimen hídrico en las regiones intertropicales, con períodos de sequía prolongados, alternados con épocas lluviosas igualmente dilatadas y ocurrencia de eventos de lluvias intensas con las consecuentes inundaciones (El-Sharkawy y Mejía, 2011).
La fotosíntesis es un proceso de oxidación-reducción que utiliza energía de la luz solar para sintetizar carbohidratos a partir del CO2 del aire y liberar oxígeno al medio ambiente a partir de H2O y es afectada por condiciones climáticas como disponibilidad de agua, intensidad de luz y temperatura, entre otros. El impacto de las condiciones ambientales, entre ellas la intensidad de luz, sobre la fotosíntesis se relaciona directamente con la producción y la adaptabilidad de las plantas (Taiz y Zeiger, 2010). La luz es un factor limitante en la respuesta fotosintética de las plantas. Kok (1949) encontró una relación directa y definida que explica la relación entre la fotosíntesis y la respiración. Lobo et al. (2013); Rosati y Dejong (2003); Habermann et al. (2003); Melgarejo (2013) y Solarte y Pérez (2013) desarrollaron modelos matemáticos para el ajuste de la curva que relaciona la intensidad de luz vs. la tasa de fotosíntesis en las plantas.
La cuantificación de la tasa de fijación de CO2 en hojas enteras mediante flujo fotónico creciente, permite la construcción de curvas de respuesta a la luz que proporcionan información de las propiedades fotosintéticas de las plantas. En la oscuridad no ocurre asimilación fotosintética de carbono y la planta libera CO2 como consecuencia de la respiración, por tanto, los valores de fotosíntesis son negativos. En la medida que la intensidad de luz aumenta, la tasa de fotosíntesis neta se incrementa hasta igualarse con el CO2 liberado por la respiración mitocondrial. El momento en el cual la tasa de incorporación de CO2 es igual al de su liberación se denomina Punto de Compensación a la Luz (PCL). En general, las plantas de sol presentan un PCL entre 10 y 20 µmol/m2/s y las de sombra entre 1 y 5 µmol/m2/s. En la medida que el flujo fotónico aumenta se da un incremento lineal de la tasa de fotosíntesis hasta el punto de saturación, cuando la fotosíntesis no responde al incremento de la intensidad de luz. La pendiente de la porción lineal de la curva indica el rendimiento cuántico máximo de la fotosíntesis. En el rango entre el PCL y el punto de saturación, la fotosíntesis es limitada por la tasa de transporte de electrones que, a su vez, es limitada por la cantidad de luz disponible. Las plantas responden al estrés hídrico disminuyendo la tasa de fotosíntesis y modificando el punto de saturación de luz (Taiz y Zeiger, 2010; Buchanan y Jones, R. 2000).
El eucalipto, Eucalyptus grandis W. Hill ex Maiden, es una Myrtaceae conocido con los sinónimos Eucalyptus saligna var. pallidivalvis Baker et A.C. Sm. y comúnmente como eucalipto rosado. Es originario de Australia y comprende cerca de 700 especies. Se encuentran de manera natural en un amplio rango de ambientes entre 32° y 17° de latitud sur en la región costera de Queensland y en Nueva Gales del Sur (Australia), desde el nivel del mar hasta 900 m.s.n.m., con precipitación promedio anual entre 1.000 y 1.780 mm, y una estación seca de aproximadamente 3 meses. Es la especie arbórea más cultivada para la producción de pulpa de fibra corta, madera, aceites esenciales y medicinales (FAO, 2012; Whitehead et al., 2004; Pérez Arbeláez, 1952; Faostat, 2012). En Colombia se cultiva aproximadamente en 15.984 ha en los departamentos del Cauca, Valle, Caldas, Risaralda y Antioquia, entre 1.000 y 2.000 m.s.n.m., generalmente en zonas de laderas degradadas utilizadas con ganadería extensiva y en zonas con períodos estacionales de sequía (Almeida et al., 2007). Presenta mecanismos fisiológicos para la defensa al estrés hídrico, como son el arreglo casi vertical de las hojas, alta sensibilidad estomática, sistema radical profundo y capacidad de ajuste osmótico para mantener la turgencia de las hojas. (FAO, 2012; Whitehead et al., 2004).
Según Kalarackal y Somen (1997); Whitehead et al. (2004); Costa Silva et al. (2004); Pita et al. (2005); Almeida et al. (2007); Rolando y Little (2008); Hubbard et al. (2010); y Cabral et al. (2010), el eucalipto responde al estrés por agua al mantener el potencial hídrico de las hojas a niveles relativamente altos y cerrar los estomas para evitar la pérdida de agua y la consecuente diminución de la tasa de fotosíntesis.
Por otro lado, existen pocas referencias sobre la tolerancia del eucalipto al exceso de agua en el suelo, no obstante hay especies tolerantes como E. robusta, de raíces adventicias, que crece en zonas inundables, en contraste con E. grandis que presenta reducción en el crecimiento en condiciones de saturación de agua en el suelo (Pardos, 2004).
Debido a la importancia económica e industrial del eucalipto, los trabajos presentados en este artículo tuvieron como objetivo determinar el efecto de la disponibilidad de agua en el suelo sobre la tasa de fotosíntesis del E. grandis y su respuesta a cambios en la intensidad de luz.
Materiales y métodos
Los ensayos fueron establecidos en la Universidad Nacional de Colombia sede Palmira (950 m.s.n.m., 24°C, y humedad relativa de 75%). En ambos ensayos se utilizó un diseño de parce-las divididas con cuatro repeticiones, en el cual las parcelas principales estaban constituidas por las disponibilidades de agua en el suelo: capacidad de campo (cc) equivalente a 1 cc, 0.5 cc, 0.25 cc y saturación del suelo, como subparcelas los clones de eucalipto 28-3, 18-3, 24A-5, y 19-1.
Las plantas fueron sembradas en macetas de 60 cm de altura por 30 cm de diámetro, utilizando suelo fertil del lugar Para determinar la curva de agua y el volumen de agua requerido para mantener el suelo a capacidad de campo, se utilizó el método gravimétrico y con esta base se calculó el volumen para los tratamientos con déficit de agua. El tratamiento de saturación del suelo se alcanzó con una lámina de agua > 1 cm. Para evitar la alteración de la humedad en los tratamientos, las macetas fueron cubiertas con tapas plásticas.
Cada día durante el tiempo experimental se aplicaron riegos para asegurar los niveles de humedad en el suelo que fueron controlados con tensiómetros.
La tasa de fotosíntesis se determinó con un equipo portátil ADC modelo LCPro+ de sistema abierto, regulando la intensidad de luz con lámparas complementarias. En cada ensayo se hicieron seis evaluaciones y los datos generales de fotosíntesis fueron obtenidos con una intensidad lumínica de 1.200 µmol/m2/s. Las curvas de luz se obtuvieron con intensidades variables: 1.500, 1.000, 500, 250, y 0 µmol/m2/s en el primer ensayo y 1500, 1000, 435, 87, 70, 52, 35, 26, y 0 µmol/m2/s en el segundo, con el fin de obtener tasas de fotosíntesis a bajas intensidades de luz. Para las evaluaciones, realizadas 70 días después de iniciados los tratamientos, se tomaron hojas desarrolladas del tercio superior de los árboles en cada ensayo. Con estos datos se determinó el efecto del estrés hídrico sobre el intercambio de gases. El análisis estadístico se realizó utilizando el programa SAS 9.3 2013. Las curvas de luz se construyeron con las tasas de fotosíntesis a diferentes intensidades de luz con el modelo de Mitscherlich (Ecuación 1), mediante el cual se determinaron la fotosíntesis máxima, la eficiencia fotosintética y el punto de compensación de luz (Solarte, Perez y Melgarejo, 2013).
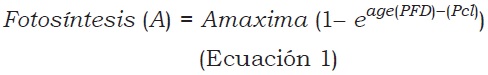
Donde:
A = Fotosíntesis neta.
Amax = Asíntota de la fotosíntesis a alta luz (fotosíntesis máxima).
age = Pendiente inicial de la curva (eficiencia de la fotosíntesis (φ).
Pcl = Punto de compensación por luz (intercepto en X cuando la fotosíntesis es igual a cero)
Resultados y discusión
Con una intensidad de luz 1.200 µmol/m2/s la respuesta de E. grandis a los diferentes niveles de disponibilidad de agua en el suelo fue altamente significativa (P < 0.01), igualmente lo fue entre los clones estudiados en todas las variables de respuesta evaluadas: fotosíntesis, CO2 interno en la cavidad subestomática, conductancia estomática y tasa de transpiración (Cuadro 1 y Cuadro 2). Las tasas de fotosíntesis fueron altas, si se comparan con las de otras especies C3 que presentan valores entre 10 y 24 µmol CO2/m2/s (Taiz y Zeiger, 2010. Buchanan, Gruissem y Jones, 2000) y con los hallados por Forrester et al. (2012) en plantas de E. nitens, y por Whintehead y Beadle (2004) en varias especies de Eucalyptus. Pita et al. (2005) en el sureste de España encontraron en este mismo género tasas de fotosíntesis de 30 µmol CO2 /m2/s de CO2 en mediciones entre junio y julio, lo que coincide con los resultados en los trabajos de Riaño y colaboradores en Colombia (Riaño, 2013. Comunicación personal).
La mayor tasa de fotosíntesis se encontró en suelos a capacidad de campo (cc) y a 0.5 cc, a 0.25 cc la tasa fue menor que a cc pero igual a 0.5 cc. El tratamiento de saturación presentó tasas de fotosíntesis significativamente menores, lo cual indica que E. grandis tiene mecanismos fisiológicos como cierre de estomas que le permiten responder al estrés por exceso de agua. Esto se puede confirmar con la reducción de CO2 interno en la cavidad sub-estomática en los tratamientos con mayor tasa de fotosíntesis y los menores valores de conductancia estomática y tasa de transpiración en el tratamiento saturado; estos resultados coinciden con los de Marchant et al. (2007). y permiten inferir que E. grandis tolera mejor la sequía que el exceso de agua en el suelo, condición que ocasiona estrés por déficit de oxígeno y como consecuencia primaria la inhibición de intercambio de gases debido al cierre de los estomas (Cuadro 1).
Se observaron diferencias altamente significativas entre clones (Cuadro 2) para fotosíntesis, conductancia estomática y transpiración, lo que indica que el mecanismo de cierre y apertura de estomas está ligado al genotipo. El clon 28-3 presentó las mayores tasas de fotosíntesis, conductancia estomática y transpiración y el menor CO2 interno, lo que indica la relación entre estas variables de respuesta y el grado de apertura de los estomas, además esta relación varía entre los clones, lo que confirma el efecto del genotipo en el intercambio de gases por la planta y el medio ambiente.
Si se toman como referencias los promedios de las conductancias estomáticas entre los tratamientos (2.14 mol/m2/s) y entre los clones (2.11 mol/m2 y la tasa de transpiración entre los tratamientos y los clones (6.6 mmol/m2/s, en ambos casos) se observa que en los clones 28-3 y 18-3 la conductancia estomática y la tasa de transpiración fueron mayores que el promedio general; mientras que en los clones 19-1 y 24A-5 fueron menores, esto reafirma el efecto del genotipo y sugiere que E. grandis tiene mecanismos fisiológicos y bioquímicos que le permiten responder al estrés de agua.
Como se observa en la Figura 1, la respuesta fotosintética de la planta al estrés hídrico y a la intensidad de luz en todos los clones evaluados fue significativa (P < 0.01). En condiciones de oscuridad los valores fueron negativos, lo que indica respiración de la planta. En todos los casos hubo respuesta positiva a la intensidad de luz; a baja irradiación las curvas presentaron una respuesta lineal, seguida de una desaceleración hasta la saturación, pero los datos no mostraron foto-inhibición.
En el Cuadro 3 se incluyen los resultados del modelo ajustado para todos los tratamientos y clones, se pueden observar la tasa de fotosíntesis máxima, el punto de saturación, el punto de compensación a la luz y la eficiencia fotosintética. Los resultados indican que todos los clones tienen un potencial fotosintético mayor que el promedio (ver Cuadro 2), lo que sugiere que en el ambiente donde crecieron las plantas, otros factores, diferentes a la disponibilidad de agua, fueron limitantes.
En todos los casos el punto de compensación a la luz fue bajo, si se tiene en cuenta que el eucalipto es una planta C3 (Taiz y Zeiger, 2010; Buchanan, Gruissem y Jones, 2000). Para la eficiencia fotosintética no se observaron diferencias entre tratamientos y clones, debido a que esta característica depende en gran medida de la ruta fotosintética (Taiz y Zeiger, 2010; Buchanan, Gruissem y Jones, 2000). Con el fin de confirmar las tasas de fotosíntesis a intensidades de luz menores que 500 µmol CO2 /m2/s, en el segundo ensayo se confirmo la respuesta fotosintetica a bajas intensidades de luz (Cuadro 4) reafirmando los bajos puntos de compensación en E. grandis.
Agradecimientos
Los autores agradecen a la Universidad Nacional de Colombia sede Palmira, Cartón de Colombia S.A y al Programa de Suelos de la UN-Palmira, por su colaboración para la realización de los trabajos; y a Marzory Andrade Bernal por el análisis estadístico de los datos.
Referencias
Almeida, A. C; Soares, J. V.; Landsberg, J. J; y Rezende, G. D. 2007. Growth and water balance of Eucalyptus grandis hybrid plantations in Brazil during a rotation for pulp producction. Forest ecol. Manag. 251:10 - 21. [ Links ]
Buchanan, B.; Gruissem, W.; y Jones, R. 2000. Biochemeistry and molecular biology of plants. Am. Soc. Plant Physiol. EE.UU. 1367 p. [ Links ]
Cabral, O M.; Rocha, H; Gash, J. H.; Ligo, M. A.; Freitas, H. C; y Tatsch, J. D. 2010. The energy and water balance of a Eucalypthus plantation in southeast Brazil. J. Hydr. 388:208 - 216. [ Links ]
Costa e Silva, F. Shvaleva, A; Maroco, J. P; Almeida,M. H; Chaves, M. M. y Pereira, J.S. 2004. Responses to water stress in two Eucalyptus globulus clones differing in drought tolerance. Tree Physiol. 24:1165 - 1172 [ Links ]
EL-Sharkawy M. A.; Mejia de Tafur M. S.; y López, Y. 2012. Research on cassava productivity, photosynthesis, eco-physiology and responses to environmental stresses in the tropics -a model of a multidisciplinary approach for crop improvement and sustainable production. En: B. Ospina y H. Ceballos (comp.). Cassava in the third millennium modern production, processing, use and marketing systems. Cali, Colombia. Centro Internacional de Agricultura Tropical (CIAT); Latin American and Caribbean Consortium to support Cassava Research and Development (Clayuca), Technical Centre for Agricultural and Rural Cooperation (CTA). 574 p. [ Links ]
EL-Sharkawy M. A. y Mejia de Tafur M. S. 2011. Cambio climático: Causas y posibles impactos en los ecosistemas agrícolas. En: C. V. Durán- Castro y R. Campos-Gaona (eds.). Segundo Simposio Internacional. Genómica y Modelación en los Nuevos Escenarios de la Ganadería Bovina Tropical. Universidad Nacional de Colombia, sede Palmira. p. 21 - 48. [ Links ]
FAOSTAT, 2012. FAO, 2012. El Eucalipto en la repoblación forestal. http://www.fao.org/docrep/004/AC459S/AC459S10.htm [ Links ]
Forrester, D. I.; Collopy J. J; Beadle, C. L.; Warren, C. R.; y Baker, T. G. 2012. Effect of thinning, pruning and nitrogen fertilizer application on transpiration, photosynthesis and water - use efficiency in young Eucalyptus nitens plantation. Forest Ecol. Manag. 266:286 - 300. [ Links ]
Habermann, G.; Caruso Machado, E.; Domingos Rodrigues, J.; y Lázaro Medina, C. 2003. CO2 assimilation, photosynthetic light response curves and water relations of 'Pêra' sweet orange plants infected with Xylella fastidiosa. Braz. J. Plant Physiol. 15(2):79 - 87. [ Links ]
Hubbard, R. M.; Stape, J.; Ryan, M. G; Almeida, A. C.; y Rojas, J. 2010. Effects of irrigation on water use efficiency in two fast growing Eucalyptus plantations. Forest Ecol. Manag. 259:1714 - 1721. [ Links ]
Kalarackal, J. y Somen, C. K. 1997. An ecologycal evaluation of the suitability of Eucalyptus grandis for planting in the tropics. Forest Ecol. Manag. 95:53 - 61. [ Links ]
Kok, B. 1949. On the interrelations of respiration and photosynthesis in green plants. Biochem. Bioph. Acta. 3:625 - 631. [ Links ]
Lobo, F. de A.; de Barros, M. P.; Dalmagro, H. J; Dalmolin, Â. C.; Pereira, W. E.; de Souza É. C.; Vourlitis, G. L.; y Rodríguez Ortíz, C.E. 2013. Fitting net photosynthetic light-response curves with Microsoft Excel a critical look at the models. Photosynth. 51(3):445 - 456. [ Links ]
Marchant, A; Callister, A; Arndt, S; tausz, M; y Adams, M. 2007. Contrasting physiological responses of six Eucalyptus species to water defict. Ann. Bot. 100:1507 - 1515. [ Links ]
Pardos, J. A. 2004. Respuestas de las plantas al anegamiento del suelo. Invest. Agrar: Sist. Recur. For. p. 101 - 107 [ Links ]
Pérez-Arbeláez, E. 1956. Planta útiles de Colombia. Tercera ed. Sucesores de Rivadeneyra (S. A.) Onésimo Redondo, 26 - Madrid. Librería Colombiana. Camacho Roldan (Cia Ltda) - Bogotá. 831 p. [ Links ]
Pita, P; Cañas, I; Soria, F; Ruiz, F.; y Toval, G. 2005. Use of physiological traits in tree breeding for improved yield in drought-prone environments. The case of Eucalyptus globulus. Invest. Agrar. Sist. Recur. 14(3):383 - 393. [ Links ]
Raigosa, M. J. y Pedrol, N. 2004. Ecofisiología vegetal. En: Raigosa, M.; Pedrol, N.; y Sánchez, A. (eds.). La ecofisiología vegetal, una ciencia de síntesis. Thomson editores, España. 1175 p. [ Links ]
Solarte, M. E; Pérez, L. V.; y Melgarejo L. M. 2013. Ecofisiología Vegetal. www.bdijital.unal.edu.co/8545/21/10-cap08pdf [ Links ]
Rolando C. A. y Little, K. M. 2008. Measuring water stress in Eucalyptus grandis Hill ex Maiden seedlings planted into pots. South Afr. J. Bot. 74:133 - 138. [ Links ]
Rosati, A. y Dejong, T. M. 2003. Estimating photosynthetic radiation use efficiency using incident light and photosynthesis of individal leaves. Ann. Bot. 91:869 - 877. [ Links ]
Taiz, L. y Zeiger, E. 2010. Plant physiology 5th Ed. Sinauer Associates Inc. Publishers. Sunderland, Massachusetts. EE.UU. [ Links ]
Whintehead, D. y Beadle, C. L. 2004. Physiological regulation of productivity and water use in eucalyptus: A review. Forest Ecol. Manag. 193:113 - 140. [ Links ]













