Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.64 no.1 Palmira Jan./June 2015
https://doi.org/10.15446/acag.v64n1.38814
Agroindustria doi: http://dx.doi.org/10.15446/acag.v64n1.38814 e-ISSN 2323-0118
Caracterización de harina y almidón de frutos de banano Gros Michel (Musa acuminata AAA)
Characterization of starch and flour of Gros Michel banana fruit (Musa acuminata AAA)
Jairo Montoya-López, Víctor Dumar Quintero-Castaño y Juan Carlos Lucas-Aguirre
Ingeniería de Alimentos, Facultad de Ciencias Agroindustriales, Universidad del Quindío, Colombia. Autor para correspondencia: jclucas@uniquindio.edu.co
Rec.:09.10.2013 Acep.:19.05.2014
Resumen
En el estudio se determinaron las características fisicoquímicas, térmicas y reológicas de la harina y el almidón de frutos de banano Gros Michel (Musa acuminata) cosechado en fincas del departamento del Quindío, Colombia. En el análisis proximal, la harina presentó un contenido de fibra de 18.82% y el almidón presentó contenidos de proteína de 1.92%, grasa de 5.3% y fibra de 2.76%. La harina presentó la temperatura más alta de absorción de calor (68.88 °C) y su entalpía de gelatinización fue de 2.17 J/g; mientras que para el almidón estos valores fueron de 48.36 °C y 44.62 J/g, respectivamente. El análisis termogravimétrico (TGA) de la harina o temperaturas en las cuales se registra la descomposición de carbohidratos (componentes de bajo peso molecular) y polisacáridos (componentes de alto peso molecular) fueron, respectivamente, de 284.51 °C y 470.42 °C; y para el almidón fueron de 307.51 °C y 500.46 °C. Los gránulos de almidón de banano tienen forma elipsoidal con un tamaño longitudinal promedio de 39.39 µm y tamaño transversal promedio de 29.47 µm. Los difractogramas de rayos X mostraron patrones de difracción tipo B. Los viscoamilogramas mostraron que para la harina la temperatura de inicio de gelatinización (Tg) es de 76.3 °C, la viscosidad máxima de 1120 cP, y para el almidón la Tg fue de 70.75 °C y la viscosidad máxima de 2087 cP.
Palabras clave: Musaceae, Musa acuminata, harina, almidón, características de la cocción, DSC, TGA, Rayos X, RVA.
Abstract
The flour and starch were extracted from an unconventional source starchy Gros Michel bananas (Musa acuminata) yield in Quindio, Colombia, evaluating their physicochemical, thermal and rheological characteristics. Protruding in the proximal flour analysis for fiber content 18.82 %; while for starch 1.92 % protein, 5.3 % fat and 2.76 % fiber. The highest temperature of heat absorption was for flour was 68.88°C and the enthalpy of gelatinization was 2.17 J/g of starch were 48.36 °C and 44.62 J/g respectively. While the flour TGA temperatures in which the breakdown of carbohydrates (low molecular weight components) and polysaccharides (high molecular weight components) were recorded at 284.51 °C and 470.42 °C respectively and for starch were of 307.51 °C and 500.46 °C. Starch granules banana ellipsoidal in shape with an average longitudinal size of 39.39 microns and 29.47 microns average transverse size. The viscoamylograms realize that for flour the gelatinization onset temperature (Tg) was 76.3 °C, the peak viscosity for starch 1120 cP and the Tg was 70.75 °C, maximum viscosity 2087 cP.
Key words: Musaceae, Musa acuminata, baking characteristics, DSC, TGA, X-ray diffraction (XRD), RVA.
Introducción
Las harinas y los almidones, son fuentes alimenticias importantes en África y Centro y Suramérica, donde la producción de banano Gros Michel (Musa acuminata AAA) se cultiva en áreas extensas (Xu et al., 2014; Glenn et al., 2014; Avérous y Halley, 2014; Laycock y Halley, 2014). Estos compuestos son utilizados como aditivos para mejorar las propiedades tecnológicas que caracterizan a muchos de los alimentos procesados, debido a que tienen la capacidad de retener agua, y por tanto provocan cambios en la reología del producto final, dependiendo de las características físicas y químicas de los gránulos de almidón (De la Torre et al., 2008). Las fuentes convencionales importantes para la obtención de harina y almidón son cereales como maíz, trigo, arroz y sorgo y tubérculos como papa y yuca; también se utilizan hojas y semillas de leguminosas. Actualmente se exploran otras fuentes no convencionales que presentan características fisicoquímicas, estructurales y funcionales de uso en la industria (Shrestha y Halley, 2014), como materiales para empaques biodegradables (Pelissari et al., 2013), producción de almidones resistentes (Zhang y Hamaker, 2012), elaboración de productos alimentarios y como sustitutos de almidones de trigo y maíz en panadería (De la Torre et al., 2008).
El banano es una fruta cultivada en regiones tropicales y subtropicales, con una producción anual a nivel mundial, aproximada, de 104 millones de toneladas para 2010 (Bello et al., 2011). Los principales países productores son Brasil, China, Ecuador, Filipinas e India y los mayores exportadores son Ecuador, Colombia, Costa Rica y Filipinas. Las plantas musáceas comestibles son clasificadas dentro de los grupos genómicos AA, AB, BB, AAA, AAB, ABB, AAAA, AAAB, y ABBB, (Aurore et al., 2009; Mohapatra et al., 2009, 2010a,b).
Los frutos de banano inmaduros contienen en su pulpa grandes concentraciones de almidón, celulosa y hemicelulosa. Estos compuestos, por su alto potencial nutritivo y nutracéutico, son una importante fuente para la producción de harinas destinadas a la elaboración de productos alimenticios (Langkilde et al., 2002). El objetivo de este trabajo fue determinar las características reológicas, térmicas y físico-químicas de la harina y el almidón de banano Gros Michel (Musa acuminata AAA) como alternativas para el mejoramiento de las características de productos agroindustriales.
Materiales y métodos
Procesamiento de muestras. Los frutos de banano fueron cosechados verdes en la ciudad de Armenia, Colombia, y procesados en la planta piloto de alimentos de la Universidad del Quindío. Inicialmente fueron pesados y después se les retiró la cascara para pesarlos nuevamente. Los bananos pelados fueron cortados en rodajas y colocados en estufa de secado (marca Memmert UL40, Alemania) a 40 °C durante 48 h, antes de pasarlos por un molino IKA 2870900 MF 10.1, USA. Finalmente se pasaron por filtro con membrana de tamaño de poro de 100 µm, con el fin de obtener la harina (Lucas et al., 2013).
Para la extracción del almidón se utilizó el método tradicional, consistente en adicionar agua a las rodajas de banana en relación 1:1, antes de licuar 6000 r.p.m. durante 1 min y pasó a través de una malla de 100 µm, con adición de abundante agua destilada. La mezcla fue centrifugada a 10,000 r.p.m. durante 1 min a 25 °C. El precipitado se filtró a través de una membrana con tamaño de poro de 100 µm y el filtrado que contenia el almidón se secó en estufa de recirculación (marca Memmert UL40, Alemania) a 40 °C por 48 h (Dufour et al., 2008).
Composición química. La proteína cruda se determinó por micro-Kjeldahl (AOAC, 2000), la humedad por el método 925.10 (AOAC, 2000), la grasa por el método 30-25 (AACC, 2000) y las cenizas por el método 08-01 (AACC, 2000). Todas las determinaciones fueron realizadas por triplicado.
Análisis termogravimétrico (TGA). Este análisis se realizó en un equipo TA Instruments TGA Q500-USA, en presencia de una atmósfera de nitrógeno con un rango de temperatura desde ambiente hasta 800 °C, con una velocidad de calentamiento de 5 °C/min en muestras de 6 ± 0.50 mg (Pineda et al., 2011).
Calorimetría diferencial de barrido (DSC). Para la determinación de la temperatura (Tp) y la entalpía de gelatinización (ΔHp) se utilizó un equipo TA Instruments DSC-Q100-USA, en muestras de 10 ± 0.50 mg con contenido de humedad de 80%, preparadas en cápsulas herméticas de aluminio donde se mezclaron directamente la masa de almidón y la harina, a una velocidad de calentamiento de 5 °C/min, desde temperatura ambiente hasta 100 °C en atmósfera de nitrógeno (Pineda et al., 2011).
Microscopía electrónica de barrido (SEM). Se realizó con un microscopio electrónico de barrido de alto vacío marca JEOL, modelo JSM-6060LV, Japón. Las condiciones de análisis fueron 20 kV de tensión de aceleración de electrones y 12 - 20 Pa de presión en la cámara de la muestra, con lo que se obtuvieron imágenes en las superficies de fractura con la señal de electrones secundarios. Las muestras fueron fijadas sobre un porta-muestras de cobre con tapa de carbono y recubiertas con una capa de oro para mejorar la conductividad del material (Londoño et al., 2014). Los diámetros y las características morfológicas de los gránulos fueron obtenidos con el software Image Tool V 2.0.
Difracción de rayos X. Las muestras fueron reducidas a polvo fino y pasadas a través de una malla de 150 µm de tamaño de poro. Posteriormente, fueron empacadas densamente dentro de una montura de aluminio. Los patrones de difracción de rayos X se obtuvieron usando un equipo Siemens D5000-Alemania, con una línea de radiación Cu Ka (l = 1.5418 Å) y una diferencia de potencial de 30 kV a una densidad de corriente de 20 mA. Las muestras se registraron entre 5 y 40 grados (2q) con un paso angular de 0.050 y un tiempo de conteo por paso de 15 segundos. El material se colocó en un porta-muestra de aluminio de área de 30 mm x 30 mm a temperatura ambiente y baja humedad (Rojas et al., 2007).
Viscoamilografía rápida. Para esta medición se utilizó un analizador rápido RVA-4 (RVA Rapid Visco Analyser, Newport Scientific Narabeen, NSW - Australia). Con perfil definido de temperatura desde 50 hasta 90 °C, a 6 °C/min, manteniendo la temperatura durante 5 min y reduciendo hasta 50 °C a razón de 6 °C/min. Para las harinas se utilizó una suspensión al 8% (b.s.) en presencia de inhibidor de α-amilasa (AgNO3, 0.002 mol/l) y para los almidones se empleó agua y una concentración de 7%. Se determinaron la temperatura de inicio de empastamiento, la viscosidad máxima (Vmax), la facilidad de cocción (FC), la inestabilidad del gel o 'breakdown', y la reorganización o 'setback' (Dufour et al., 2009). Los resultados fueron tabulados, graficados y procesados con el software Origin 9.0.
Resultados y discusión
Análisis proximal
Harina. En el Cuadro 1 se observan los resultados de este análisis para harina de banano Gros Michel y se comparan con los resultados de Soto (2010) en harina de M. paradisiaca y Cardona et al. (2001) en harina de yuca, destacándose los mayores contenidos de humedad y fibra en harina de banano, así como en menor contenido de proteína (0.41%). Da Mota et al. (2000) evaluaron la composición proximal de harinas de diferentes grupos genéticos de musáceas, entre ellas, Ouro colatina (AA), Nanica (AAA), Nanicão (AAA), Prata anã (AAB), Prata comum (AAB), Mysore (AAB), Maçã (AAB) y Ouro da mata (AAAB) y observaron que solo el contenido de proteína (2.5% ± 0.02 - 3.3% ± 0.1) fue superior a los valores obtenidos en el presente estudio, en los demás componentes (grasa y humedad) se obtuvieron valores inferiores, mientras que los contenidos de cenizas fueron similares.
En este estudio, el contenida de fibra del banano Gros Michel (AAA) fue alto (> 12%), valor que duplica a los obtenidos con otras variedades ampliamente consumidas (7%) como Nanica y Nanicão (AAA). Dufour et al. (2009) y Gibert et al. (2009) determinaron la composición proximal de la harina de banano Gros Michel, perteneciente al grupo de bananos llamados de postre, y la compararon con la composición de harina de bananos del mismo grupo: Bocadillo, Primitivo, Cavendish, Rollizo, Tafetán Morado, y de otros grupos de musáceas, entre ellos, plátanos de cocción no-Plantain (guineo, guayabo, huamoa, cachaco y pelipita); híbridos de postre (Fhia 17, Fhia 1, Fhia 18, Fhia 25); híbridos de cocción (Fhia 20, Fhia 21); plátanos del grupo Plantain (Africa, Dominico, Dominico Hartón, Hartón, Cubano blanco, Hartón Maqueño) y observaron que el contenido de ceniza en general, en todos los grupos, varíó entre 2.3 y 4.3%, valores que coinciden con los hallados en el presente estudio. En este último grupo, los contenidos de fibra cruda variaron entre 1.8 y 5%, valores inferiores a los obtenidos en el presente trabajo (12.82% ± 1.15); por el contrario, para los primeros el contenido de proteína cruda varió entre 2.1 y 4.9%, un valor muy alto, si se compara con el encontrado en el presente estudio (0.41% ± 0.01) con la variedad Gr os Michel.
Almidón. En almidón, los contenidos de grasa (5.3%±0,04), ceniza (1.72% ± 0.01), fibra (2.76% ± 0.06), proteína (1.92% ± 0,02) y humedad (16.44% ± 0.08) fueron más altos que los encontrados por Waliszewskia et al. (2003), diferencias que fueron debidas, posiblemente, al grado de maduración de los frutos y a las técnicas de extracción y purificación del almidón utilizadas (Bello et al., 1999, 2000; Carmona et al., 2009).
El alto contenido de cenizas en el almidón es debido a la presencia de minerales como calcio, potasio y magnesio, especialmente en bananos de postre (AAA) como Bocadillo, Primitivo, Cavendish, Rollizo, Tafetán morado, Valery y Gros Michel (Dufour et al., 2009). La humedad se encontró dentro del rango aceptable para la comercialización y almacenamiento de almidones (Waliszewskia et al., 2003; Dufour et al., 2009; Gibert et al., 2009).
Calorimetría diferencial de barrido (DSC)
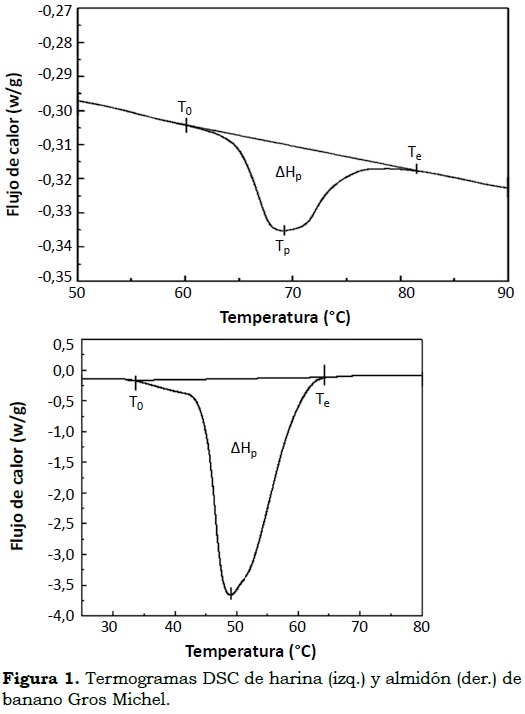
Harina. En la Figura 1a se presenta la transición térmica de la harina de banano Gros Michel. Inicialmente se observa como un leve pico endotérmico sobre la línea base del termograma que comienza a 60.16 °C (temperatura inicial-To). El valor de la temperatura de pico (Tp) fue de 68.88 °C en la cual se registran los valores más altos de absorción de calor; a medida que el proceso finaliza, el sistema regresa a un estado en el cual no hay cambios en la fase ni en la composición de la muestra, tal como se refleja en el termograma cuando el pico endotérmico se retrae hasta llegar a la línea base alcanzando una temperatura final (Te) de 81.51°C. La energía necesaria para completar el proceso se conoce como entalpía de gelatinización (ΔHp) para harina de banano y su valor es de 2.17 J/g. A su vez, la línea base del termograma desciende, por lo cual el sistema requiere de mayor flujo de calor o energía, con el fin de garantizar el proceso de gelatinización.
Los trabajos de Tribess et al. (2008) con harina de banano variedad Nanicao (Musa cavedenshii) muestran que la temperatura en pico (Tp) para este fruto varía desde 67.95 °C ± 0.31 hasta 68.63 °C ± 0.28 y para banano (M. acuminata) alcanza una Tp de 68.88 °C, lo que no muestra mayor diferencia para esta clase de frutos; por otra parte, sus entalpías de gelatinización varían desde 9.04 ± 1.71 J/g para 11.63 ± 1.74 J/g. Estos resultados son comparables con los obtenidos por Sandoval et al. (2005) en harina de yuca (Manihot esculenta) quienes encontraron valores de Tp de 77.6 °C ± 1 y de entalpia (ΔHp) de 13.8 J/g, y en harina de trigo con valores To: 57 °C, Tp: 62.3 °C y ΔHp: 5.3 J/g encontrados por Zaidul et al. (2008). Lii y Chang (1991) y Da Mota et al. (2000) observaron un ligero cambio en el rango de la temperatura de gelatinización debido al grado de maduración del fruto, a las variedades y la interferencia de otros compuestos presentes en la harina. Dufour et al. (2008, 2009) encontraron que la temperatura de gelatinización para diferentes grupos de musáceas varió en forma significativa entre 59.7 y 67.8 °C, entre bananos de postre, híbridos FHIA, sub-grupo Plantain y plátanos de cocción diferentes al grupo Plantain. En el estudio no se observaron diferencias entre el grupo de los híbridos FHIA (postre y cocción) con los demás plátanos de cocción. Para banano Gros Michel la temperatura de gelatinización fue de 63.2 ± 0.3 °C, valor más alto que el encontrado en este estudio (60.16 °C). Estas diferencias en gelatinización reflejan los comportamientos frente a la cocción y contribuyen a explicar las diferencias entre variedades y grupos genéticos (Da Mota et al., 2000; Zhang et al., 2005) donde las variedades del grupo Plantains demandan más energía para gelatinizar y tardan más tiempo para cocinarse y ablandarse que el grupo de los bananos.
Almidón. En la Figura 1b se observa el termograma del almidón de banano Gros Michel, donde aparece un pico endotérmico pronunciado sobre la línea base empezando la transición de fase a una temperatura inicial (To) de 33.59°C, seguido de la temperatura de pico (Tp) con los valores más altos de absorción de calor (48.36 °C). En este punto la muestra comienza a pasar a un estado gomoso debido al inicio de la ruptura de los gránulos de almidón. Cuando el proceso finaliza el sistema regresa a un estado en el cual no hay cambios en la fase ni en la composición de la muestra. La temperatura final (Te) fue de 64.37 °C y la entalpía de gelatinización (ΔHp) de 44.62 J/g. Estos resultados contrastan con los hallados por Zaidul et al. (2008) para el almidón de papa, con marcadas diferencias en los valores de To (63.4 °C), Tp (67.7 °C) y ΔHp (20.8 J/g) en este caso; y con los encontrados por Hyun- Jung et al. (2008) (To: 66.9 °C, Tp: 74.5 °C y ΔHp: 89.0 J/g).
Nwokocha y Williams (2009), Núñez et al. (2004) y Zhang et al. (2005) observaron mayores temperaturas de gelatinización (To) para almidones del grupo Plantains (Musa paradisiaca normalis) con valores entre 68 y 71.88 °C y entalpías entre 8.59 y 15.02 J/g. Las diferencias en temperaturas de gelatinización de los almidones han sido atribuidas a la interacción de la composición, la estructura molecular de la amilopectina y la arquitectura de gránulo. El rango de gelatinización depende de la diferencia en el grado de heterogeneidad de los cristales dentro de los gránulos (Gunaratne y Hoover, 2002).
Análisis termogravimétrico (TGA)
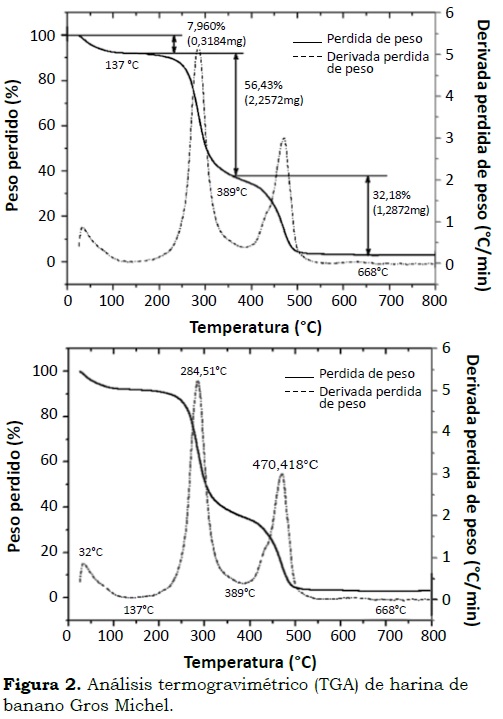
Harina. En las Figura 2a y Figura 2b se observan los termogramas y las derivadas de pérdida de peso (línea punteada), el porcentaje y la pérdida de peso que presentó la harina de banano y la temperatura aproximada a la que fue registrada.
La primera zona registró la pérdida de humedad en la muestra, que fue de 7.96% (0.32 mg en peso) y ocurre entre 100 y 150 °C, con su mayor pico a 137 °C. En la segunda zona se presentó la mayor pérdida de peso entre 200 - 389 °C y una velocidad máxima de descomposición a 284.51 °C, la pérdida de peso ocurrió a 56.43%, punto en el cual se descompusieron los carbohidratos de bajo peso molecular correspondiente al almidón presente en la muestra. En la tercera zona o final se presentó la descomposición de polisacáridos con peso molecular alto, como proteínas y lípidos, con rangos de temperatura entre 389 °C y 668 °C y una velocidad máxima de descomposición a 470.42 °C, y porcentaje de pérdida de peso de 32.18%. Los residuos presentados en el termograma fueron de 3.43%, equivalentes al contenido de cenizas en el material. Estos resultados son similares a los reportados por Lucas et al. (2013) con harina de guineo (Musa sapientum) y permiten determinar la composición del material y predecir su estabilidad térmica y establecer el porcentaje de almidón en harinas (Pineda et al., 2011). En el presente estudio la cantidad de componentes de bajo peso molecular y las temperaturas para la descomposición de los componentes de alto peso molecular fueron similares a los observados por Montoya et al. (2012) en harina de trigo.
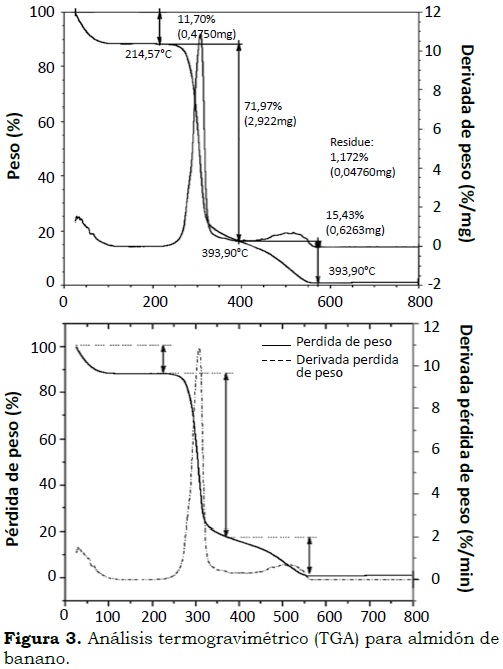
Almidón. En la Figura 3 se observan tres zonas importantes donde se representan las pérdidas de peso más pronunciadas en el análisis termogravimétrico para el almidón de banano Gros Michel. En la zona 1 (Figura 1a) se presentó una pérdida de peso de 11.70% entre los 96 y 220 °C con su mayor alcance a 214.57 °C. En la zona 2 la mayor pérdida de peso ocurrió entre 230 y 393.9 °C equivalente a 71.97% donde se descomponen carbohidratos y componentes de bajo peso molecular, entre ellos el almidón. En la zona 3 se presenta la descomposición de polisacáridos con peso molecular alto en un porcentaje de 15.43% y un rango de temperatura entre 393.9 y 571.80 °C, con un residuo de 1.17%, equivalente al contenido de cenizas del almidón. La celeridad de pérdida de la harina fue de 5.4% y del almidón de 11%/min, respectivamente. El menor valor de pérdida de la harina es debido a su mayor cantidad de componentes de alto peso molecular (32.18%) en comparación con el almidón (15.43%), como se observa por la diferencia en el segundo pico presentado en las curvas de las derivadas en las Figura 2b y Figura 3b.
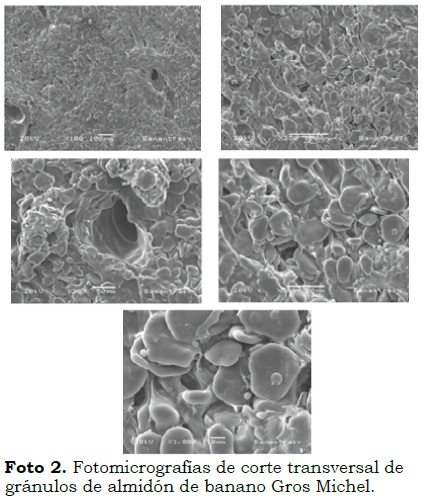
Microscopía electrónica de barrido en almidón
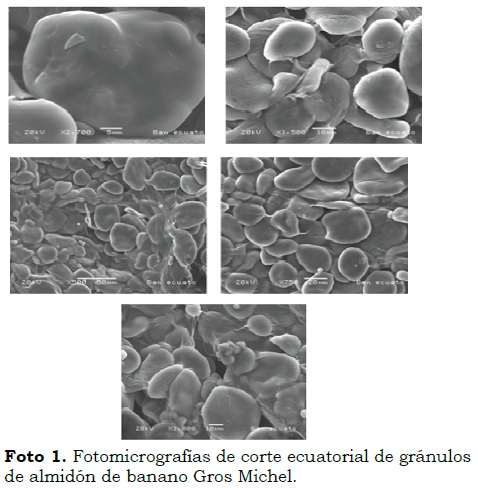
Los gránulos de almidón de banano presentaron tamaños variables, con longitudes ecuatoriales entre 29.3 µm y 48.53 µm y transversales desde 16.6 µm hasta 40.55µm. La forma y estructura de los gránulos fue principalmente elipsoidal (Foto 1 y Foto 2). En el análisis fotomicrográfíco aparecen algunos gránulos cubiertos por sacos de fibra y otros más pequeños (proteínas) adheridos al almidón, lo que concuerda con el alto contenido de fibra hallado en el análisis proximal (12.82%). Además, se observan gránulos en su gran mayoría lisos, sin protuberancias, sin rupturas ni fracturas, lo cual demuestra que los procedimientos de obtención y aislamiento del almidón fueron los adecuados. Estos resultados concuerdan con los obtenidos por Waliszewskia et al. (2003), Espinosa et al. (2009), Nwokocha y Williams (2009) y Núñez et al. (2004) quienes encontraron diámetros longitudinales de 39.39 µm y transversales de 29.47 µm, con morfologías elipsoidal, alargada y lenticular.
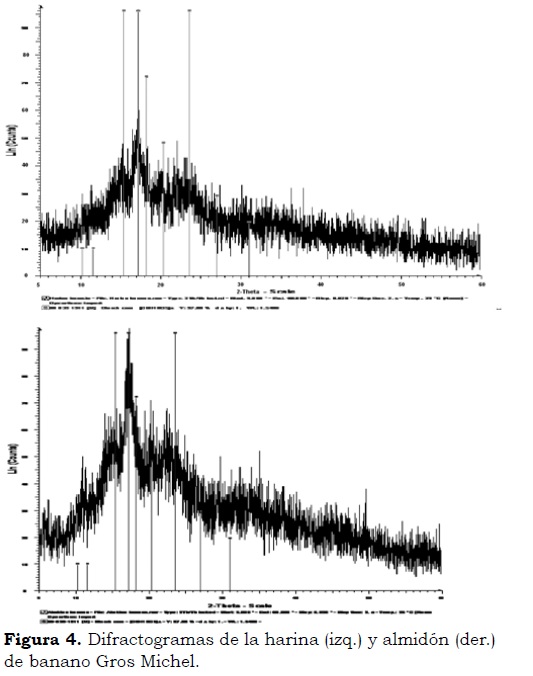
Difracción de rayos X (XRD)
En los difractogramas de la harina y el almidón de banano Gros Michel (Figura 4a y Figura 4b) se observa la presencia de picos que definen la cristalinidad de la harina los cuales, en su gran mayoría, coinciden con los estándares para almidón debido a su alto contenido en harina. El pico más representativo se encuentra en el ángulo 2θ = 17° y con aparición de picos desde el ángulo 2θ = 11°, seguido por los ángulos 2θ = 15.5, 18.3, 22, 23 y 30°, lo que permite concluir que la harina y el almidón de esta variedad de banano muestran picos correspondientes a los patrones de difracción tipo B y C, siendo estos últimos una combinación de los tipo A y B. Según Millan et al. (2005), Waliszewskia et al. (2003) y Lucas et al. (2013) el almidón de musáceas es una mezcla de patrones B y C.
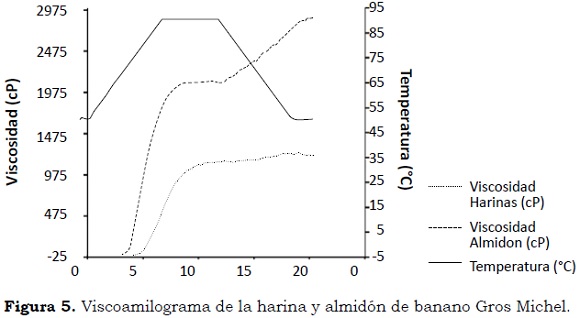
Análisis de viscosidad rápida
Las curvas de empastamiento de la harina y el almidón de banano mostraron que las temperaturas de inicio de gelatinización (Tg), donde los gránulos de almidón comienzan a hincharse, pierden cristalinidad y aumentan la viscosidad, fueron de 76.3 °C y 70.75 °C, respectivamente (Figura 5) lo que indica que los almidones necesitan menos energía y menor tiempo para comenzar el proceso de gelatinización. La viscosidad máxima (Vmax) para la harina fue de 1120 cP y para almidón de 2087 cP, destacando la alta viscosidad del almidón con respecto a la harina, debido, principalmente, a los diversos componentes que ésta posee, lo que permite determinar un posible uso potencial en la elaboración de sopas o en productos que demandan altas viscosidades.
La inestabilidad del gel (cP o 'breakdown') es un indicativo de estabilidad y resistencia de los geles frente al corte en procesos agroindustriales; cuando este valor es alto menor es la estabilidad de la pasta. Los valores encontrados en este estudio -8 cP para la harina y 2 cP para el almidón- indican que son muy estables para estos procesos.
La reorganización ('setback') evalúa la reasociación de los polímeros de almidón solubles y los fragmentos granulares insolubles durante el enfriamiento. En este estudio este valor fue de 107 cP en harinas y de 669 cP en almidón. La facilidad de cocción o tiempo que transcurre antes del hinchamiento de los gránulos fue 6.8 min para la harina y de 5.73 min para el almidón.
Al comparar estos resultados con los encontrados por Dufour et al. (2008, 2009) (Cuadro 2) para diferentes variedades de musáceas, se observan existentes especialmente en las temperatura de inicio de gelatinización y la viscosidad máxima alcanzada, lo que muestra la diferencia de comportamientos en cocción y contribuye a explicar las diferencias entre variedades y grupos genéticos e indica que los grupos genéticos con mayores valores en temperatura de inicio de gelatinización (Tg) necesitan más energía para gelatinizar los almidones y tardan más en ablandarse durante procesos de cocción (Da Mota et al. 2000; Zhang et al., 2005; Lucas et al., 2013).
Conclusiones
- La harina y el almidón obtenidos de banano Gros Michel presentan altos contenidos de fibra, grasa y proteína, por tanto tienen un buen potencial para la elaboración o mejoramiento de productos agroindustriales de uso masivo.
- La microscopía electrónica de barrido (SEM) y la difracción de rayos X permitió establecer que, de acuerdo con el tamaño de los gránulos y el tipo de almidón obtenido, es posible utilizar esta variedad de banano en procesos que requieran aumentar la viscosidad, como es el caso de salsas y compotas.
- Las características térmicas de la harina y el almidón obtenidos del banano Gros Michel permiten reducir los costos energéticos en diferentes procesos agroindustriales, ya que gelatinizan a una temperatura relativamente baja y el pico máximo se alcanza rápidamente, por tanto son de fácil cocción y requieren menos energía que otros tipos de almidón.
- La forma y el tamaño de los gránulos de almidón de banano Gros Michel favorecen la formación de gel, con mayor capacidad de absorción de agua, mayor velocidad de hidratación y rápida desintegración.
Referencias
Aurore, G.; Parfait, B.; y Fahrasmane, L. 2009. Bananas, raw materials for making processed food products. Trends Food Sci. Techn. 20:78 - 91. [ Links ]
Avérous, L. y Halley, P. 2014. Starch polymers: From the field to industrial products. En: Halley, P. y Avérous, L. (eds.). Starch polymers, starch polymers. Elsevier, Amsterdam. p. 13 - 10. [ Links ]
Bello, P. L.; Agama, A.; Osorio-Díaz, P.; Utrilla-Coello, R.; y García-Suárez, F. 2011. Banana and Mango Flours. En: Preedy, V.; Watson R.; y Vinood B. (eds.). Flour and breads and their fortification in health and disease prevention. Academic Press. 22:235 - 245. [ Links ]
Bello, P. L.; Agama, A. E.; Sánchez-Hernández, L.; Paredes-López, O. 1999. Isolation and partial characterization of banana starches. J. Agric. Food Chem. 47:854 - 857. [ Links ]
Bello P. L.; Romero-Manilal, R.; y Paredes-López, O. 2000. Preparation and properties of physically modified banana starch prepared by alcoholic-alcaline treatment. Starch. 52:154 - 159. [ Links ]
Cardona, M. G.; Sorza, J. D.; Posada, S. L.; Carmona, J. C.; Ayala, S. A.; y Álvarez, O. L. 2001. Establecimiento de una base de datos para la elaboración de tablas de contenido nutricional de alimentos para animales. Facultad de Ciencias Agrarias, Universidad de Antioquia. 3 p. [ Links ]
Carmona, G. R.; Sánchez-Rivera, M. M.; Guadalupe Méndez-Montealvo, G.; Garza-Montoya, B.; y Bello-Pérez, L. A. 2009. Effect of the crosslinked reagent type on some morphological, physicochemical and functional characteristics of banana starch (Musa paradisiaca). Carboh. Pol. 76:117 - 122. [ Links ]
Da Mota, R. V.; Lajolo, F. M.; Ciacco, C.; y Cordenunsi, B. R. 2000. Composition and functional properties of banana flour from different varieties. Stärke. [Starch] 52(2-3):63 - 68. [ Links ]
De la Torre, G. L.; Chel-Guerrero, L.; Betancur-Ancona, D. 2008. Functional properties of square banana (Musa balbisiana) starch. Food Chem. 106 (3):1138 - 1144. [ Links ]
Dufour, D.; Gibert, O.; Giraldo, A.; Sánchez, T.; Reynes, M.; Pain, J. P.; González, A.; Fernández, A.; y Díaz, A. 2009. Differentiation between cooking bananas and dessert bananas. 2. Thermal and functional characterization of cultivated colombian Musaceae (Musa sp.). J. Agric. Food Chem. 57(17):7870 - 7876. [ Links ]
Dufour, D.; Giraldo, A.; Gibert, O.; Sánchez, T.; Reynes, M.; González, A.; Fernández, A.; y Díaz, A. 2008. Propiedades físico-químicas y funcionales de los bananos de postre, plátanos de cocción y FHIA híbridos: preferencia varietal de los consumidores en Colombia. En: Borja, J. S.; Nogales, C.; Orrantia, C.; Paladines, R.; Quimi, V.; Tazan, L. (eds.). CD-Proceedings, Acorbat 2008, XVIII International Meeting, November 11-14/2008, Guayaquil, Ecuador. p. 33. [ Links ]
Espinosa, S. V.; Jane, J.; y Bello P. L. 2009. Physicochemical characteristics of starches from unripe fruits of mango and banana. Starch/Stärke 61:291 - 299. [ Links ]
Gibert, O.; Dufour, D; Giraldo, A.; Sánchez, T.; Reynes, M.; Pain, J. P.; González, A.; Fernández, A. y Díaz, A. 2009. Differentiation between cooking bananas and dessert bananas. 1. Morphological and compositional characterization of cultivated colombian Musaceae (Musa sp.) in relation to consumer preferences. J. Agric. Food Chem. 57(17):7857 - 7869. [ Links ]
Glenn, G.; Orts, W.; Imam, S.; Chiou, B. y Wood, D. 2014. Chapter 15 - Starch plastic packaging and agriculture applications. En: Starch Polymers. Halley, P. y Avérous, L. Elsevier, Amsterdam: 421 - 452, [ Links ]
Gunaratne, A. y Hoover, R. 2002. Effect of heat-moisture treatment on the structure and physicochemical properties of tuber and root starches. Carbohydrate Polymers 47:425 - 437. [ Links ]
Hyun-Jung, C.; Qiang, L.; Pauls, P. K.;Ming, F. Z.; y Rickey, Y. 2008. In vitro starch digestibility, expected glycemic index and some physicochemical properties of starch and flour from common bean (Phaseolus vulgaris L.) varieties grown in Canada. Food Res. Intern. 41(9):869 - 875. [ Links ]
Langkilde, A. M.; Champ, M.; y Andersson, H. 2002. Effects of high-resistant-starch banana flour (RS2) on in vitro fermentation and the small-bowel excretion of energy, nutrients, and sterols: An ileostomy study. Am. J. Clinical Nutr. 75:104 - 111. [ Links ]
Laycock, B. y Halley, P. 2014. Starch applications: State of market and new trends. En: Starch polymers, starch polymers. Halley, P. and Avérous, L. Elsevier, Amsterdam. Chapter 14. 381 - 419. [ Links ]
Lii, C. Y. y Chang, Y. H. 1991. Study on starch in Taiwan. Food Rev. Intern. 7:185 - 203. [ Links ]
Londoño, R. S.; Rincón-Londoño, N.; Contreras-Padilla, M.; Acosta-Osorio, A. A. 2014. Physicochemical, morphological, and rheological characterization of Xanthosoma robustum Lego-like starch. Intern. J. Biol. Macrom. 65:222 - 228. [ Links ]
Lucas, a. J.; Quintero Castaño, V. D.; y Cárdenas Valencia C. A. 2013. Caracterización de harina y almidón obtenidos a partir de plátano guineo AAAea (Musa sapientum L.). Acta Agronómica 62(2):83 - 96. [ Links ]
Millan, T. C.; Mendez-Montealvo, M. G.; Ottenhof, M. A.; Farhat, I. A.; y Bello, P. L. 2005. Determination of the molecular and structural characteristics of okenia, mango, and banana starches. J. Agric. Food chem. 53:495 - 501. [ Links ]
Mohapatra, D.; Mishra, S.; y Meda, V. 2009. Plantains and their postharvest uses: An overview. Stewart Postharvest Review 5(5):1 - 11. [ Links ]
Mohapatra, D.; Mishra, S.; y Sutar, N. 2010a. Banana and its byproduct utilisation: An overview. J. Scien. Ind. Res. 69:323 - 329. [ Links ]
Mohapatra, D.; Mishra, S.; y Sutar, N. 2010b. Banana post-harvest practices: Current status and future prospects. Agric. Rev. 31(1):56 - 62. [ Links ]
Mohapatra, D.; Mishra, S.; Singh, C. B.; y Jayas, D. S. 2011. Post-harvest processing of banana: opportunities and challenges. Food Bioproc. Techn. 4(3):327 - 339. [ Links ]
Montoya, L. J.; Giraldo, G. A.; y Lucas, A. J. 2012. Caracterización física de harina de trigo, masa y pan mediante determinación de calorimetría diferencia de barrido y análisis termogravimetrico. Vitae, Rev. Facultad Química Farmac. 19(1): s417 - s419. [ Links ]
Núñez, S. M.; Bello P. L.; y Tecante, A. 2004. Swelling-solubility characteristics, granule size distribution and rheological behavior of banana (Musa paradisiaca) starch. Carboh. Pol. 56:65 - 75. [ Links ]
Nwokocha, L. M. y Williams, P. A. 2009. Some properties of white and yellow plantain (Musa paradisiaca Normalis) starches. Carboh. Pol. 76:133 - 138. [ Links ]
Olaoye, O. y Ade-Omowaye, B. 2001. Composite flours and breads: potential of local crops in developing countries. En: Preedy, V.; Watson, R. y Patel, V. (eds.). Flour and breads and their fortification in health and disease prevention. Academic Press, San Diego. Chap. 17:183 - 192. [ Links ]
Pelissari, F.; Andrade-Mahecha, M.; Amaral Sobral, P. y Menegalli, F. 2013. Comparative study on the properties of flour and starch films of plantain bananas (Musa paradisiaca). Food Hydrocolloids 30 (2):681 - 690. [ Links ]
Pineda, G. P.; Coral, D.F.; Ramos-Rivera, D.; Rosales- Rivera, A.; y Rodríguez-García, M. E. 2011. Thermo-alkaline treatment. A process that changes the thermal properties of corn starch. Procedia Food Sci. 1:370 - 378. [ Links ]
Rojas, M. I.; Gutiérrez-Cortz, E.; Palacios-Fonseca, A.; Baños, L. et al. 2007. Study of structural and thermal changes in endosperm of quality protein maize during traditional nixtamalization process. Cereal Chem. 84(4):304 - 312. [ Links ]
Sandoval, A. A; Rodríguez S. E.; y Fernández Q. A. 2005. Aplicación del análisis por calorimetría diferencial de barrido (DSC) para la caracterización de las modificaciones del almidón. Universidad Nacional de Colombia sede Medellín. DYNA 72(146):45 - 53. [ Links ]
Shrestha, A. y Halley, P. 2014. Starch Modification to develop novel starch-biopolymer blends: state of art and perspectives. En: Halley, P. y Avérous, L. (eds.). Starch polymers. Elsevier, Amsterdam Chap. 5105 - 5143, [ Links ]
Soto, A. V. 2010. Cuantificación de almidón total y de almidón resistente en harina de plátano verde (Musa paradisíaca) y banana verde (Musa cavendish). Universidad Mayor de San Simón, Facultad de Bioquímica y Farmacia, Cochabamba, Bolivia. 2 p. [ Links ]
Tribess, T. B.; Hernández - Uribe, J. P.; Méndez-Montealvo, M. G.; Menezes, E. W.; Bello-Pérez, L. A.; y Tadini, C. C. 2009. Thermal properties and resistant starch content of green banana flour (Musa cavendishii) produced at different drying conditions. LWT - Food Sci. Techn. 42(5):1022 - 1025. [ Links ]
Waliszewskia, K. N.; Aparicio, M. A.; Bello, L. A.; y Monroy, J. A. 2003. Changes of banana starch by chemical and physical modification. Carboh. Pol. 52:237 - 242. [ Links ]
Xu, X.; Visser, G. F.; y Trindade, L. 2014. Starch modification by biotechnology. En: Halley, P. y Avérous, L. (eds.). State of art and perspectives, in starch polymers. Elsevier, Amsterdam. p. 479 [ Links ]
Zaidul, I. S.; Yamauchi, H.; Matsuura-Endo, C.; Takigawa, S.; y Noda, T. 2008. Thermal analysis of mixtures of wheat flour and potato starches. Food Hydroc. 22(4):499 - 504. [ Links ]
Zhang, P. y Hamaker, Z. 2012. Banana starch structure and digestibility. Carboh Pol. 87(2):1552 - 1558. [ Links ]
Zhang, P. Y.; Whistler, R. L.; BeMiller, J. N.; y Hamaker, B. R. 2004. Banana starch: production, physicochemical properties, and digestibility -a review. Carboh. Pol. 59:443 - 458. [ Links ]