Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.64 no.1 Palmira Jan./June 2015
https://doi.org/10.15446/acag.v64n1.35773
Protección de cultivos doi:http://dx.doi.org/10.15446/acag.v64n1.35773 e-ISSN 2323-0118
Efecto fungistático de extractos y aceites esenciales de Lippia origanoides HBK y Thymus vulgaris L. como alternativas de manejo de Botrytis cinerea en fresa
Fungistatic effect of extracts and essential oils of Lippia origanoides HBK and Thymus vulgaris L. as alternative management of Botrytis cinerea in strawberry
Luis Alejandro Taborda Andrade1*, Manuel Salvador Sánchez Orozco2, Carmen Rosa Bonilla Correa3 y Carlos Huertas Davey4
1Universidad De La Salle, Colombia, Facultad de Ciencias Agropecuarias; 2,4Universidad Nacional de Colombia sede Palmira, Colombia, facultad de Ciencias Agropecuarias; 3Universidad Nacional de Colombia sede Bogotá, Colombia. *Autor para correspondencia: lataborda@unisalle.edu.co
Rec.: 02.12.2012 Acep.: 04.02.2014
Resumen
El moho gris de la fresa causado por Botrytis cinerea es una enfermedad que produce importantes pérdidas poscosecha. En el estudio se evaluó el efecto fungistático de extractos y aceites esenciales de Lippia origanoides HBK y Thymus vulgaris L. en concentraciones de 128, 256 y 500 mg/lt sobre B. cinerea in vitro e in vivo. In vitro se determinó el porcentaje de inhibición del crecimiento micelial del hongo. En estas condiciones se observó que el aceite esencial (AE) de L. origanoides presentó el porcentaje de control más alto (66.2%) sobre B. cinerea. In vivo, se observó que en bananos inoculados con B. cinerea después de 120 los AE controlaron eficientemente la incidencia de daño causado por el patógeno estudiado y no se encontraron diferencias significativas con el control químico utilizando el fungicida Benomil.
Palabras clave: Botrytis cinerea, Lippia origanoides HBK, Thymus vulgaris L, evaluaciones in vitro e in vivo, aceites esenciales, extractos, inhibición de crecimiento micelial.
Abstract
The strawberry gray mold caused by Botrytis cinerea is a disease that causes significant postharvest losses. In this t study the fungistatic effect of extracts and essential oils of Lippia origanoides HBK and Thymus vulgaris L (at concentrations of 128, 256 and 500 mg / l) on the pathogenic fungus Botrytis cinerea under in vitro and in vivo conditions was evaluated. In the in vitro test, the percentage of inhibition of mycelial growth was determined. It was observed that the essential oil (EO) from Lippia origanoides showed the highest percentage of control (66.2%) of Botrytis cinerea. The evaluation in vivo showed that, the control percentage of the damage incidence from the pathogenic fungus (by an incidence value scale from 0 to 7 according to specific characteristics of deterioration of fruits) on bananas inoculated with Botrytis cinerea was measured. After 120 hours of monitoring, it was observed that the EO efficiently controlled the incidence of damage caused by the pathogen studied and no significant differences were observed when chemical control (fungicide Benomyl) was applied.
Key words: Botrytis cinerea, Lippia origanoides HBK, Thymus vulgaris L, in vitro and in vivo evaluations, essential oils, extracts, inhibition of mycelial growth.
Introducción
La fresa (Fragaria sp.) es un cultivo con un potencial importante en la economía regional y nacional (Cano, 2012). Sin embargo, su fruto es altamente perecedero y susceptible a daños mecánicos, pérdidas de agua y deterioro fisiológico y microbiológico causados por hongos como Botrytis cinerea (moho gris) que ocasionan la pudrición del fruto y consecuente pérdida de su valor económico (Cruz et al., 2008).
El moho gris en la fresa constituye una enfermedad que produce pérdidas importantes en poscosecha (aproximadamente de 20%), lo que afecta la economía de los productores, comercializadores y consumidores (López et al., 2006). Los fungicidas químicos han sido tradicionalmente los medios primarios para el control de este patógeno, pero su aplicación continua ha generado el interés público por los problemas ocasionados como toxicidad, altos costos, reducción de exportaciones por presencia de residuos en producto de consumo y daños al medio ambiente, a la salud de los operarios y del consumidor final (Arturo, 2008; Montoro et al., 2009). Por otra parte, los microorganismos fitopatógenos han generado resistencia a los ingredientes activos de algunos fungicidas sintéticos, como una respuesta a la presión de selección a las altas dosis y aplicaciones continuas sin previo estudio y cronograma de control, lo que ocasiona grandes pérdidas económicas (Leroch et al., 2010; Wilson et al., 1997).
Recientemente las investigaciones se han enfocado en la evaluación de varias alternativas de control para reducir la dependencia de fungicidas sintéticos, entre ellas microorganismos antagonistas, tratamientos físicos, sustancias naturales como aceites esenciales (AE) y extractos de diferente tipo. Los AE y extractos etanólicos (EE) de las especies de los géneros Lippia y Thymus presentan propiedades biocontroladoras (Combrinck et al., 2011; Lizcano, 2007; López et al., 2006; Bolívar et al., 2009; Bouchra et al., 2003; Alzate et al., 2009). El objetivo del trabajo fue evaluar el potencial fungistático in vitro e in vivo de los aceites esenciales y los extractos etanólicos de L. origanoides HBK y T. vulgaris como alternativas de manejo de B. cinerea.
Materiales y métodos
Material vegetal
Las muestras de material vegetal de L. origanoides y T. vulgaris fueron obtenidas de parcelas establecidas de la colección de trabajo de plantas medicinales y aromáticas del Centro Experimental de la Universidad Nacional de Colombia sede Palmira (CEUNP), donde predominan Vertisoles, un promedio de precipitación anual de 1000 mm, 25 °C y humedad relativa de 83%.
El follaje recolectado de ambas especies se colocó en bandejas metálicas para exponerlo al ambiente durante tres días en condiciones de sombra, en el Laboratorio de Fitoquímica de la Universidad Nacional de Colombia sede Palmira.
Obtención de extractos etanólicos
Para obtener los EE se molieron 50 g de follaje, previamente expuesto a deshidratación en el ambiente de laboratorio (42% de humedad), de cada especie y se dispusieron en dos reservorios porta-muestras cada uno de 10 cm de diámetro, al cual se le adicionaron 180 ml de etanol con 98% de pureza. Los reservorios fueron sellados para evitar la volatilización de los fitocompuestos y se almacenaron durante 3 días a una temperatura, promedio, de 25 °C. Después de este tiempo se extrajeron los percolados o concentrados etanólicos los cuales fueron roto-evaporados con un equipo Buchi modelo R-114. En este proceso se recuperaron 176 ml de etanol de cada uno de los reservorios que contenían las muestras de L. origanoides y T. vulgaris y se obtuvieron 10 g de materia seca de extracto final en cada muestra.
Obtención de aceites esenciales
Los AE se obtuvieron por hidro-destilación en un equipo Clevenger de muestras de 100 g de hojas (42% de humedad) de 1 - 3 cm de tamaño; colocadas en reservorio de vidrio piloto para hidro-destilación.
En todas las corridas o etapas de destilación se emplearon 200 ml de agua destilada contenida en un matraz redondo que fue calentado en estufa a temperatura constante de 80 °C. Una vez condensado el vapor del proceso, para la separación de fases (hidrolato-aceite esencial) se empleó una trampa Clevenger. A continuación se retiró el aceite y por cada milímetro de éste se agregaron 5 g de sulfato de sodio anhidro (Na2SO4) con el fin de secar los residuos de humedad, evitar la oxidación y finalmente conservarlo a 10 °C.
Inoculación con Botrytis cinerea
El hongo patógeno estudiado se aisló de muestras de fresas (Fragaria sp.) infectadas con B. cinerea. Las muestras fueron recolectadas en un cultivo de una finca comercial de la vereda El Castillo, municipio de Palmira, Valle, y conservadas en cámaras húmedas (98% HR) con el objeto de estimular el crecimiento del patógeno.
El reconocimiento de las colonias fungosas se realizó mediante el método de impronta (López et al., 2006) antes de montar placas con azul de algodón y observar al microscopio con ampliación 40X. Para la identificación de estructuras fungosas se utilizaron las claves de Barnett (1972) y Pardo (1995) y la siembra de los cultivos puros se hizo en PDA inclinado refrigerado a 8 °C.
Evaluación in vitro
La concentración mínima inhibitoria se determinó mediante el método de dilución en caldo de los extractos a los cuales se les atribuyó actividad fungistática, según lo establecido en el documento Eucast, ED 7.1 (Rodríguez-Tudela et al., 2008), las concentraciones evaluadas fueron 128, 256 y 500 mg/ml. La inhibición del crecimiento de micelios se determinó mediante la Ecuación 1 propuesta por Sztejnberg et al. (1987) (Alzate et al., 2009):

Evaluación in vivo
Para esta evaluación fueron seleccionados frutos en escala 4 de madurez, según lo establecen las normas NTC 4130 1997 para fresa variedad Chandler (Icontec, 1997). Los frutos fueron lavados con agua esterilizada y una solución de hipoclorito al 1%.
Siguiendo la metodología propuesta por Alvarado et al. (2011) para cada tratamiento se tomaron cinco frutos de fresa que fueron perforados con una aguja estéril en orificios de 2 mm de ancho x 2mm de profundidad, en la parte superior, cerca al pedúnculo. Posteriormente, estos frutos fueron colocados en vasos de precipitado que contenían las soluciones de los tratamientos evaluados (256 y 500 mg/lt) y cubiertos totalmente durante 5 segundos para posteriormente colocarlos en una superficie lisa dentro de la campana de flujo laminar, donde se secaron durante 5 min a 25 °C hasta 69% de HR. Finalmente se asperjaron con la solución de 1.0 x 105 esporas/ml.
Un procedimiento similar se realizó para los tratamientos testigo -un tratamiento con etanol a 98% de pureza en vaso de precipitado, y una solución del fungicida Benomil de síntesis química a una concentración de 100 µg/ml-. Finalmente, los frutos se dispusieron en contenedores plásticos estibados, recubiertos por anjeo, donde se realizó seguimiento por 120 h antes de calificar los índices de severidad y porcentajes de control
Indice de severidad y porcentajes de control
De acuerdo con el modelo propuesto por Alvarado et al. (2011) se elaboró un diagrama pictográfico del índice de severidad de daño causado por el patógeno en el fruto. El modelo se basa en el seguimiento y observación del diámetro de las lesiones de los frutos cada 12 h durante 5 días, registrando el avance parcial de la infección con respecto a la infección total del fruto en el tiempo.
Esta escala se utilizó para seguir el progreso de la infección a 48, 96 y 120 horas en los frutos inoculados. Adicionalmente se determinó el porcentaje de control de cada tratamiento sobre el hongo patógeno evaluado, en función del porcentaje de infección presentada por el testigo negativo, como se calcula con la Ecuación 2.

Diseño experimental y análisis de datos
Los tratamientos en el experimento in vitro se dispusieron en un factorial aumentad 22 x 3 + testigos, donde los factores evaluados fueron: especies vegetales (2) (L. origanoides y T. vulgaris), tipos de extractos (2) (AE y EE) y concentraciones (3) (128, 256 y 500 mg/lt) y como testigo la aplicación de 100 µg/ml del fungicida comercial Benomil. En el ensayo in vivo se evaluaron dos concentraciones (256 y 500 mg/lt). Los datos fueron analizados con el software estadístico SAS (Statistical Analysis System Versión 9.3.1, 2012).
Resultados y discusión
Evaluación in vitro
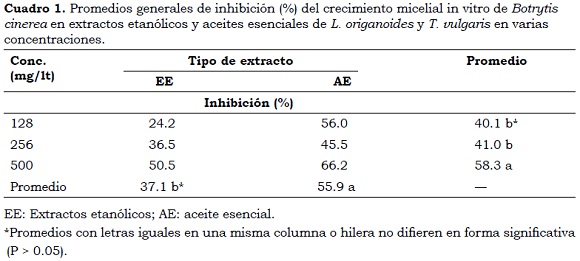
Los extractos de L. origanoides presentaron mayor porcentaje promedio de inhibición de crecimiento micelial (44%) que los de T. vulgaris (37%). Esta diferencia se debe a la concentración de metabolitos complementarios con actividad biológica inhibitoria. Según Ruiz et al. (2007) el timol en L. origanoides HBK se encuentra en una concentración de 68% y según Maqtari et al. (2011) en T. vulgaris la concentración es de 54%.
Se observan diferencias (P < 0.05) entre los extractos evaluados. Los AE presentaron un porcentaje promedio de inhibición de crecimiento de B. cinerea de 55.9%, siendo mayor que el obtenido con los extractos etanólicos (37.1%) (Cuadro 1). Hammami et al., (2011) encontraron resultados similares a los del presente estudio cuando evaluaron el potencial biocontrolador de AE y EE de Viola odorata sobre B. cinerea cultivado in vitro, no obstante los primeros presentaron mayor actividad inhibitoria que los EE.
Igualmente se encontraron diferencias (P < 0.05) entre las concentraciones evaluadas. La concentración más alta (500 mg/lt) presentó el mayor porcentaje de inhibición (58.3%). Las concentraciones 256 y 128 mg/lt inhibieron 41 y 40.1% el crecimiento micelial de B. cinerea, respectivamente, (P > 0.05). Los AE en las concentraciones más altas (500 mg/lt) presentaron los mayores porcentajes promedio de inhibición (66.2%), (Foto 1 y Cuadro 1). Estos resultados son similares a obtenidos por Lizcano (2007) con extractos etanólicos de T. vulgaris en tres diluciones, donde el tratamiento de 500 mg/lt también presentó mayor inhibición del crecimiento micelial de B. cinerea in vitro.
Evaluación in vivo
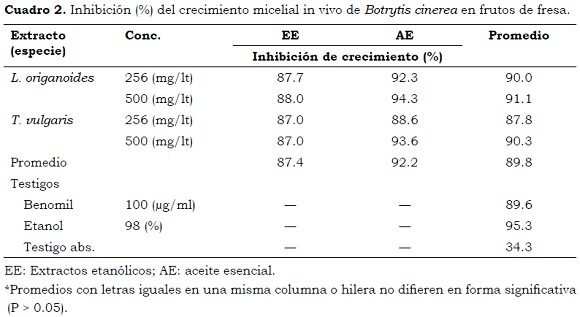
En este medio de cultivo, los extractos de L. origanoides mostraron promedios altos de inhibición de crecimiento micelial (90.5%) y estadísticamente similares a los obtenidos con T. vulgaris (89%). El promedio de inhibición de crecimiento micelial del hongo fue mayor (P < 0.05) en los AE (92.2%) en comparación con los resultados obtenidos con los EE (87.4%) (Cuadro 2), lo que coincide con los resultados obtenidos en las evaluaciones in vitro en este ensayo y con los resultados obtenidos por Fang et al. (2011) quienes evaluaron el potencial biocontrolador de AE y EE de V. odorata en el control de B. cinerea in vitro e in vivo encontrando, en ambos casos, que los AE tienen mayor actividad antifúngica que los etanólicos.
Estos resultados son explicables, debido a que los metabolitos secundarios (complementarios) volátiles con actividad promisoria biocontroladora se encuentran de forma concentrada en los AE y se obtienen por el mecanismo de volatilización-condensación, mientras que la extracción con etanol significa necesariamente el arrastre de otros compuestos de la planta en elevadas concentraciones que pueden afectar el potencial biocontrolador (Hammami et al., 2011).
Aunque en promedio los AE de L. origanoides en concentraciones altas (500 mg/ lt) presentaron porcentajes de control ligeramente superiores en comparación con las concentraciones más bajas, no se detectaron diferencias (P > 0.05) entre las concentraciones evaluadas. Este resultado es contrario al obtenido en los experimentos in vitro con las mismas especies y con los resultados obtenidos por Soylu et al. (2010) quienes al evaluar tres concentraciones (35, 75 y 100 mg/lt) de AE de Origanum syriacum en el control in vivo de B. cinerea encontraron alta correlación entre la concentración de AE y el porcentaje de control del patógeno.
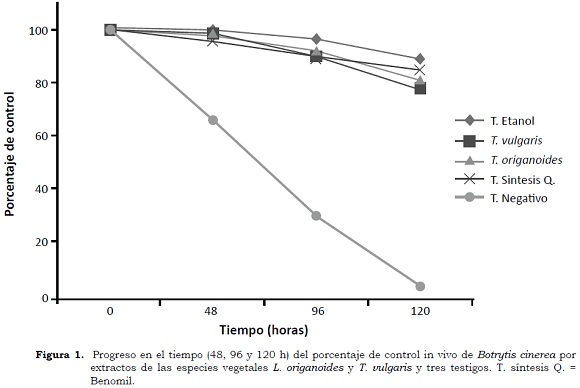
Por otra parte, las evaluaciones a 48, 96 y 120 h después de la inoculación demostraron que el porcentaje de control se mantiene en niveles superiores a 80%, comparable a los índices de inhibición del crecimiento micelial obtenidos con el control químico (Benomil) (Figura 1), lo que confirma el potencial de estas especies vegetales como alternativas eficientes para el control de este patógeno, lo que mitiga los impactos ambientales y los daños a la salud de operadores en cosecha y poscosecha y por tanto al consumidor final (Jacometti et al., 2010) (Wilson et al., 1997).
Conclusiones
- Los aceites esenciales y extractos etanólicos de Lippia origanoides presentaron mayor inhibición del crecimiento micelial del hongo patógeno Botrytis cinerea en fresa, cuando se compara con los resultados obtenidos con estos mismos derivados a partir de Thymus vulgaris.
- Los aceites esenciales de L. origanoides y T. vulgaris presentaron las mayores inhibiciones promedio del crecimiento micelial in vitro e in vivo del hongo patógeno B. Cinerea, común en frutos de fresa.
- Los aceites esenciales y extractos etanólicos de L. origanoides y T. vulgaris son alternativas promisorias y eficientes en el control del hongo patógeno B. cinerea.
- Los resultados in vitro demostraron una proporcionalidad directa entre las concentraciones evaluadas y el porcentaje de control de B. cinerea en fresa, siendo la concentración de 500 mg/lt la que presentó mayores porcentajes de inhibición.
Agradecimientos
Los autores agradecen a la Dirección de Investigación de la Universidad Nacional de Colombia sede Palmira, a Colciencias y a la Facultad de Ciencias Agropecuarias de la Universidad de La Salle por el apoyo financiero a la realización de la investigación.
Referencias
Al-Maqtari, M. A.; Alghalibi,S. M.; y Alhamzy, E. H. 2011. Chemical composition y antimicrobial activity of essential oil of Thymus vulgaris from Yemen. Turkish J. Biochem. 36:342 - 349. [ Links ]
Alvarado, H. A. M.; Barrera, N. L.,; Hernández, A. N.; y Velázquez del Valle, M. G. 2011. Antifungal activity of chitosan y essential oils on Rhizopus stolonifer (Ehrenb.: Fr.) Vuill causal agent of soft rot of tomato. Rev. Col. Biot. 13:127 - 134. [ Links ]
Alzate, D.; Gonzalo, I.; Afanador, M.; y Durango, R. 2009. Evaluación de la fitotoxicidad y la actividad antifúngica contra Colletotrichum acutatum de los aceites esenciales de tomillo (Thymus vulgaris), limoncillo (Cymbopogon citratus) y sus componentes mayoritarios. Vitae 16:116 - 125. [ Links ]
Arturo, C. 2008. Síntomas ocasionados por plaguicidas en trabajadores agrícolas. Rev. Med. Inst. Mex Seguro Soc. 46:145 - 152. [ Links ]
Barnett, H. 1972. Illustrated genera of imperfect fungi. USA. p. 70. [ Links ]
Bolívar, K.; Sanabria, M. E.; Rodríguez, D.; de Camacaro, M. P.; Ulacio, D.; Cumana, L.; y Crescente, O. 2009. Potencial efecto fungicida de extractos vegetales en el desarrollo in vitro del hongo Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. y de la antracnosis en frutos de mango. Rev. UDO Agrícola 9(1):175 - 181. [ Links ]
Bouchra, C.; Achouri, M.; Idrissi Hassani, L. M.; y Hmamouchi, M. 2003. Chemical composition and antifungal activity of essential oils of seven Moroccan Labiatae against Botrytis cinerea Pers: J. Ethnopharm. 89(1):165 - 169. [ Links ]
Cano S. C. 1993. Corporación Colombiana Internacional. Alimentos Hoy. 4(4) p. 20 - 22. [ Links ]
Combrinck, S. T; Regnier, S.; y Kamatou, G. P. 2011. In vitro, activity of eighteen essential oils and some major components against common postharvest fungal pathogens of fruit. Ind. Crops Prod. 33:344 - 349. [ Links ]
Cruz, L.; Jacksens, L.; Siro, I.; Devlieghere, F.; y Debevere, J. 2008. Envasado de fresas en alta concentración de oxígeno con atmósfera modificada en equilibrio. Cien. Tecn. Alim. 18. (3), p. 24-29 [ Links ]
Fang, X. L.; Wang, Y. H.; y Zhang, X. 2011. In vitro and in vivo antimicrobial activity of Xenorhabdus bovienii YL002 against Phytophthora capsici y Botrytis cinerea. J. Applied Microb. 111:145 - 154. [ Links ]
Hammami, I.; Kamoun, N.; y Rebai, A. 2011. Biocontrol of Botrytis cinerea with essential oil y methanol extract of Viola odorata L. flowers. Arch. Appl. Sci. Res. 3:44 - 51. [ Links ]
ICONTEC (Instituto Colombiano de Normas Técnicas). 1997 Norma Técnica NTC Colombiana 4130 1997-05-28. [ Links ]
Jacometti, M. A; Wratten, S. D.; y Walter, M. 2010. Review: alternatives to synthetic fungicides for Botrytis cinerea management in vineyards. Aust. J. Grape Wine Res. 16:154 - 172. [ Links ]
Leroch, M.; Kretschmer, M.; y Hahn, M. 2010. Fungicide resistance phenotypes of Botrytis cinerea isolates from commercial vineyards in South West Germany. J. Phytop. 159:63 - 65. [ Links ]
Lizcano, M. 2007. Evaluación de la actividad antifúngica del extracto de tomillo (Thymus vulgaris) contra Botrytis cinerea, Fusarium oxysporum y Sclerotinia sclerotiorum, tesis publicada en www.javeriana.edu.co [ Links ]
López, A.; Vélez, M.; Sánchez, M. S.; Bonilla, C. R.; y Gallo, P. I. 2006. Evaluación de extractos vegetales para manejo de hongos patógenos en banano y fresa almacenados. Acta Agronómica 55:39 - 44. [ Links ]
Montoro, Y.; Moreno, R.; y Gomero, L. 2009. Características de uso de plaguicidas químicos, y riesgos para la salud en agricultores de la sierra central del Perú. Rev. Perú. Med. Exp. Salud Publica 26:466 - 472. [ Links ]
Pardo, V. 1995. Hongos fitopatógenos de Colombia. Medellín. Universidad Nacional de Colombia. p. 51-54. [ Links ]
Rodriguez-Tudela, J. L; Arendrup, M. C.; Barchiesi, F.; Bille, J.; Chryssanthou, E,; Cuenca-Estrella, M.; Dannaoui, M., E.; Denning, D. W; Donnelly, J. P.; y Dromer, F. 2008. EUCAST definitive document EDef 7.1: method for the determination of broth dilution MICs of antifungal agents for fermentative yeasts. Clin. Microbiol. Infect 14:398 - 405. [ Links ]
Ruiz, C.; Tunarosa, F.; Martínez, J.; y Stashenko, E. 2007. Estudio comparativo por GC-MS de metabolitos secundarios volátiles de dos quimiotipos de Lippia origanoides HBK, obtenidos por diferentes técnicas de extracción. Sci. Techn. 1(33). [ Links ]
Soylu, E. M. ; Kurt, S.; y Soylu, S. 2010. In vitro e in vivo antifungal activities of the essential oils of various plants against tomato grey mould disease agent Botrytis cinerea. Int. J. Food Microb. 143:183 - 189. [ Links ]
Sztejnberg, A.; Freeman, S.; Chet, I.; y Katan, J. 1987. Control of Rosellinia necatrix in soil and in apple orchard by solarization and Trichoderma harzianum. Plant Disease 71:365 - 369. [ Links ]
Wilson, C. L; Solar, J. M; Ghaouth, A. E.; y Wisniewski, M. E 1997. Rapid evaluation of plant extracts y essential oils for antifungal activity against Botrytis cinerea. Plant disease 81:204 - 210. [ Links ]