Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.64 no.2 Palmira Apr./June 2015
https://doi.org/10.15446/acag.v64n2.44265e
Ciencia del Suelo
doi: http://dx.doi.org/10.15446/acag.v64n2.44265 e-ISSN 2323-0118
Evaluación de la recuperación de suelos contaminados por el vertido de Aznalcóllar
Assessment of contaminated soil recovery by Aznalcollar spill
1Margarita María Sarria Carabalí, 2Luis Enrique Cortés Páez y 3Francisco José Martín Peinado
1Universidad Nacional de Colombia sede Palmira, Facultad de Ciencias Agropecuarias, Palmira, Colombia. 2Universidad de Granada, España. 3Universidad Nacional de Colombia sede Palmira, Facultad de Ingeniería y Administración, Palmira, Colombia. Autora para correspondencia: mmsarriac@unal.edu.co
Rec.: 02.07.2014 Acep.: 18.09.2014
Resumen
Los suelos afectados por el accidente de la mina de Aznalcóllar, Sevilla (España) en 1998 fueron remediados para disminuir la contaminación generada principalmente por As, Cu, Pb y Zn. Para evaluar la recuperación de los suelos, especialmente los que se sometieron a medidas de remediación, se hizo un muestreo en tres perfiles: suelo contaminado (SC), suelo remediado (SR) y suelo no contaminado (SNC) en el sector 'Puente de las Doblas', 10 años después de ocurrido el accidente. Se determinaron las propiedades físico-químicas y se realizaron bioensayos con la bacteria Vibrio fischeri y Lactuca sativa (lechuga), para valorar la toxicidad generada por dichos metales. El SR presentó propiedades similares a las del SNC, pero con una mayor concentración de metales totales que no superan el nivel crítico para parques naturales y zonas forestales. Las concentraciones de Cu y Zn en fase soluble eran superiores a los valores máximos deseables en la solución del suelo; además, ambos metales generaron toxicidad en Vibrio fischeri, entre 40 y 50 cm de profundidad, asociada con pH ácido. Se sugiere continuar los seguimientos periódicos con el fin de evaluar la evolución y la dispersión potencial de la toxicidad detectada en los suelos recuperados, y efectuar las actuaciones necesarias para la recuperación ambiental.
Palabras clave:metales, movilidad, remediación, toxicidad, suelo, vertido de mina Aznalcóllar
Abstract
The affected soils by Aznalcollar´s mine accident, Sevilla, España, in 1998, were remediate to reduce the contamination generated mainly by As, Cu, Pb and Zn. To evaluate the recovery of soils, especially those undergoing to remediation, three soils were sampled: contaminated (SC), remediate (SR), uncontaminated soil (SNC), in the sector called "Puente de las Doblas" 10 years after the accident. We were analysed the physic-chemical properties, and perfomed bioassays with Vibrio fischeri and Lactuca sativa, to evaluate the toxicity produced by the pollutants. The SR has similar properties as the SNC, but with a higher concentration of total metals that do not exceed the critical level for natural parks and forest areas, and the concentrations of Cu and Zn in a soluble phase are higher than the maximum desirable soil solution. Moreover, these two metals generated toxic in Vibrio fischeri, to 40 â 50 cm depth at the acidic pH associated. We recommended continuing making periodic monitoring in order to assess the evolution and potential dispersion toxicity detected in the remediated soils, and taking the actions necessary for environmental recovery.
Key words:Metals, mobility, remediation, toxicity, soil, Aznalcollar mine spill.
Introducción
El 25 de abril de 1998 se produjo la rotura de la presa de contención de la mina de pirita (FeS2), en Aznalcóllar (Sevilla, España) que vertió más de cinco millones de m3 de lodos y aguas ácidas con alto contenido de metales pesados en los ríos Agrio y Guadiamar, afectando una área de 55 km2 (Gil et al.; 2006, Simón et al.; 1998). Los principales contaminantes encontrados en los suelos fueron As, Cu, Zn, Cd y Pb, de los cuales los tres últimos eran los de mayor solubilidad (Aguilar et al.; 2004) afectando los ecosistemas, la comunidad biológica, y la población humana (Gil et al.; 2006). Una semana después del accidente y hasta el verano del 2000, los suelos se sometieron a medidas de remediación mediante retirada del lodo y adición de enmiendas orgánicas como carbono orgánico (CO) y espuma azucarera (CaCO3), e inorgánicas como arcilla y óxidos de Fe y Mn; no obstante en algunos sectores esta contaminación continuó superando los niveles críticos. (Aguilar et al.; 2003). En el presente trabajo, 10 años después del accidente por vertido de la mina de Aznalcóllar, se evaluó la recuperación de suelos contaminados con As, Cu, Pb y Zn en el sector Puente de las Doblas.
Materiales y métodos
El muestreo de suelos (Fluvisoles) se realizó en la margen derecha del río Guadiamar (37° 30' N, 6° 20' O) en tres perfiles, con el fin de evaluar el comportamiento de los contaminantes y la eficacia de las medidas de remediación. Para el efecto se seleccionaron: (1) un suelo contaminado en el cual no se realizó tratamiento de limpieza y aún permanecían restos de lodo (SC) (UTM: 29S 0745430-4141952), (2) un suelo sometido a medidas de remediación (SR) (UTM: 29S 0745436-4141620), y (3) un suelo que no fue contaminado (SNC) (UTM: 29S 0745303 - 4141578) próximo a la zona de influencia del vertido.
La toma de muestras se realizó por profundidades en el perfil de cada caso de suelo, teniendo en cuenta la descripción macro-morfológica de campo y la aparición de las diferentes capas de contaminación u horizontes edáficos. Dentro de cada calicata de muestreo, el muestreo se hizo por triplicado en secciones paralelas, según la distribución de profundidades. En todos los casos se tomaron entre 50 g y 100 g de muestra, con el fin de realizar por diferentes métodos (en paréntesis) los análisis siguientes: textura (pipeta de Robinson), pH del suelo (1:2.5), capacidad de intercambio catiónico (acetato de amonio 1N, pH 7), mineralogía de arcillas (Martín, 2004), CaCO3 (Barahona, 1984), carbono orgánico (CO) (Walkley and Black), formas de Fe (Schwertmann, 1964) y de Mn (Holmgren, 1967). Las concentraciones de As, Cu, Pb y Zn totales (digestión ácida con HNO3 + HF), solubles (relación suelo: agua = 1:10 con agitación) y biodisponibles (extracción con EDTA) y cuantificación en un ICP-MS. Las formas solubles y biodisponibles permiten evaluar el movimiento de los contaminantes tanto en el suelo como en el ecosistema y su posible absorción por los organismos animales y vegetales (Aguilar et al., 2004).
Se realizaron bioensayos con la bacteria Vibrio fischeri (Vf) según la modificación del protocolo descrito para Microtox ® Basic Test for Aqueous Extracts (Martín et al.; 2010) y basado en la medida de la inhibición de la bioluminiscencia de V. fischeri NRRL B-11177, en el equipo Microtox 500, según normas UNE-EN ISO 11348-1, 2, 3; ASTM D5660; y bioensayos con lechuga (Lactuca sativa var. Larga rubia-galaica) según el protocolo de la OECD (2003) y las recomendaciones de la U.S. EPA (1996). Estos ensayos se realizaron en extractos de los suelos (relación suelo: agua 1:10) a los cuales se les midió pH en soluto -pHW (1:10) y CE.
Los datos fueron analizados por métodos descriptivos (media, mediana, desviación típica, máximo, mínimo, entre otros). La prueba de Kolmogorov-Smirnov indicó que todos los datos (físico-químicos y biológicos) eran normales. Se realizó un análisis de varianza de un factor (Anova) y prueba de Post-hoc de Tukey para todos los factores (suelos, profundidades y la interacción suelo x profundidad).
Resultados y discusión
Hasta 5 cm de profundidad en el suelo el SR y el SNC presentaron textura franco arenosa, mientras que el SC fue franco arcillo limoso (Cuadro 1 ) con variaciones a partir de 10 cm de profundidad, debido a la presencia de material aluvial (llanura de inundación), caracterizado por la alternancia de capas de diferente granulometría.
Los contenidos de Fe y Mn, tanto libre como amorfo, presentaron diferencias (P < 0.05) entre los suelos, entre profundidades y su interacción suelo x profundidad (Cuadro 2). Las diferencias a través del perfil entre SC y SR fueron debidas a que en este último el hierro fue aplicado como enmienda y se distribuyó uniformemente, mientras que en el SC su presencia y concentración no uniforme se debe principalmente al vertido (Aguilar et al.; 2000).
El pHS (pH en suelo) en el SC varió en todas las profundidades, con un mayor valor entre 0 y 5 cm, una ligera reducción entre 10 y 15 cm e incrementos a partir de los 40 cm de profundidad, lo cual posiblemente es debido a la textura y/o a la contaminación generada por los sulfatos solubles eluviados (Kraus y Wiegand, 2006). El pHS del SR disminuyó con la profundidad en el suelo, con alta acidez entre 40 y 50 cm, lo cual se puede atribuir a la presencia de sulfatos provenientes del vertido. El pHW en el SC es extremadamente ácido, mientras que en el SR es moderadamente ácido, excepto entre 40 y 50 cm donde también es fuertemente ácido (USDA, 1998) posiblemente debido, tal vez, a la infiltración de los sulfuros y su oxidación a sulfatos, lo que provoca acidificación en el suelo; además, el efecto restaurador de las enmiendas no alcanza esta profundidad. La CE es alta en el SC, siendo mayor entre 4 y 5 cm, en comparación con los valores observados en los demás suelos. La alta CE hasta 1 cm de profundidad en el SR posiblemente se debe a la presencia de sales de sulfatos como contaminantes secundarios. (Clemente et al.; 2003).
Contenidos totales de As, Cu, Pb y Zn
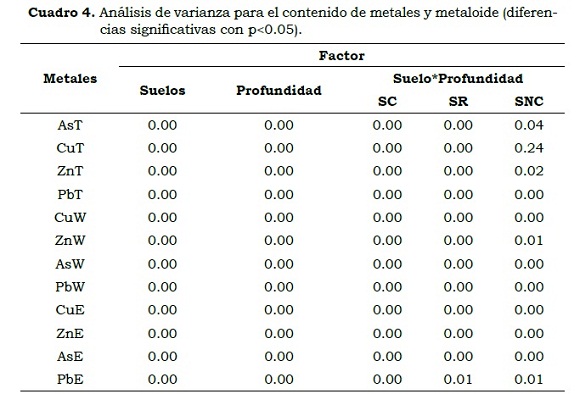
En el SR, sólo el AsT (>50 mg/kg) fue más alto que el nivel crítico permitido en suelos agrícolas hasta 15 cm de profundidad, pero los metales no superaron el nivel de intervención de parques naturales (mg/kg) (AsT > 100, CuT > 500, ZnT > 1000 y PbT > 1000) en las profundidades del estudio (CMAJA, 1999) (Cuadro 3).
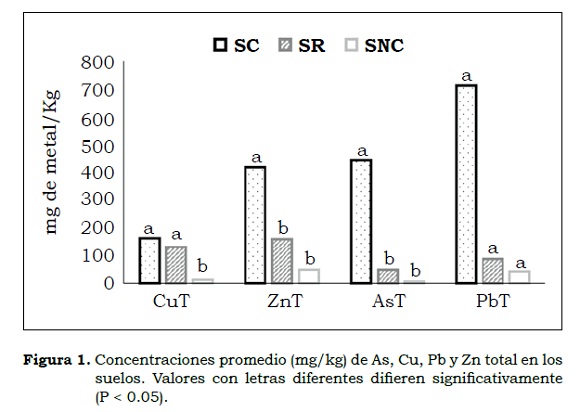
En suelos contaminados (SC) la concentración de AsT hasta 50 cm de profundidad fue ampliamente superior que los niveles de intervención para suelos agrícolas y parques naturales, en consecuencia es importante mantener el uso del suelo para estos sistemas y prohibir las actividades de caza y pastoreo. El ZnT y el PbT en todas las profundidades estudiadas superaron los niveles de intervención permitidos para suelos agrícolas (> 600 y > 350 mg/g, respectivamente), pero no superaron los niveles para parques naturales. El CuT presentó concentraciones muy inferiores a las establecidas en los niveles de intervención para suelos agrícolas (> 300 mg/ kg) y de parques naturales y zonas forestales.
El mayor contenido de los metales en el suelo remediado (SR) respecto a suelo no contaminado (SNC) puede ser debido a la posible contaminación residual generada por la oxidación de los lodos, que pudieron alterar algunas de las características de los suelos (Martín et al.; 2008) por contaminación potencial.
Los contenidos de AsT, CuT, PbT y ZnT difirieron significativamente entre suelos (Cuadro 4). El post-hoc de Tukey (P < 0.05) entre suelos y para cada metal, indicó que las medidas de remediación han sido efectivas para AsT, ZnT y PbT. Para CuT no se presentaron diferencias (P > 0.05) entre el SR y SC (Figura 1) lo que es debido a su correlación negativa con CaCO3 (-0.927**) y pHW (-0.800**) por lo que puede ser co-precipitado por ellos y adsorbido por los óxidos de hierro y de manganeso (Juárez et al.; 2006). El comportamiento de este metal se rige por la regresión siguiente , la cual se justifica por la asociación de Cu con los sulfuros provenientes de lodos (Aguilar et al.; 2003).
Contenidos de As, Cu, Pb y Zn solubles
En suelo remediado (SR) el AsW superó el nivel crítico de 0.04 mg/kg (Bohn, 1993) en los primeros 5 cm de profundidad y su movilidad está relacionada con el CO añadido (AsW = 0.140CO + 0.047CT - 0.005CIC - 0.045, R2=0.995, P < 0.05), lo que posiblemente genera la desorción de este metal de los óxidos de hierro (Wang y Mulligan, 2009).
En este suelo, las concentraciones de CuW y ZnW fueron inferiores que las observadas en SC como resultado de la adición de enmiendas, principalmente Fe y CaCO3, pero más altas que los niveles críticos de toxicidad (0.7 y 0.5 mg/kg, respectivamente) (Bohn, 1993) en todas las profundidades. La movilidad de estos elementos posiblemente fue afectada por la continua oxidación de los lodos provenientes de la contaminación residual, según las ecuaciones siguientes:
La concentración de PbW no superó el nivel crítico (1 mg/kg) (Bohn, 1993), lo que puede atribuirse a una posible asociación con los óxidos, oxihidróxidos e hidróxidos de Mn y con CaCO3, que permite su precipitación como hidróxidos, fosfatos o carbonatos para formar complejos orgánicos muy estables; no obstante, el mayor contenido en este suelo (SR) respecto al SC puede deberse a su liberación durante la transformación de la plumbojarosita a hierro amorfo (Feo) (Paz, 2012), según la relación:
El contenido de los elementos solubles en estudio presentó diferencias (P < 0.05) entre suelos y se encontró que las prácticas de remediación fueron efectivas en todos ellos, como lo indica la falta de diferencias (P > 0.05) entre el SR y el SNC (Figura 2). El CaCO3 en las dosis aplicadas no disminuyó las concentraciones de CuW y ZnW por niveles inferiores a aquellos considerados críticos, a pesar de que la espuma azucarera (CaCO3) evita completamente la disolución de Cu y Zn en suelos ácidos (Jiménez et al.; 2006), por tanto es posible que se encuentre regulado por óxidos de manganeso y por la formación de complejos con la fracción orgánica (Ordóñez et al.; 2007).
Contenidos de As, Cu, Pb y Zn biodisponibles
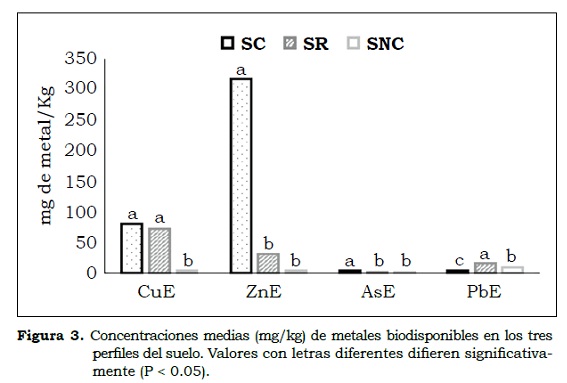
En el estudio, las concentraciones de estos elementos no superaron los niveles críticos (mg/kg) (AsE = 2, ZnE = 150, CuE = 200, PbE = 20) por lo que no representan riesgo para contaminación ambiental. El Anova indicó que la concentración biodisponible de todos los elementos difiere entre suelos (P < 0.05). Las prácticas de remediación sólo fueron eficientes para AsE y ZnE y no presentaron diferencias entre SR y SNC. (Figura 3).
Toxicidad
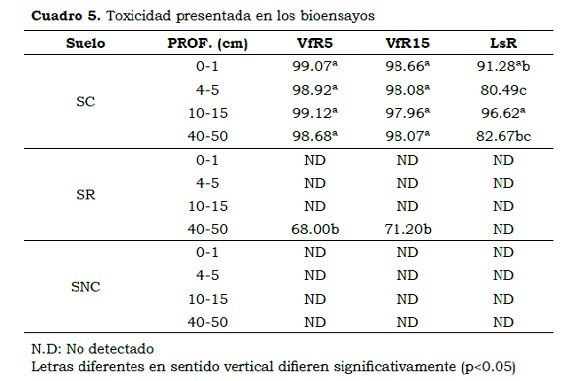
Se encontraron diferencias (P < 0.05) entre suelos y entre profundidades para VfR5, VfR15 y LsR. La interacción suelo x profundidad mostró que en el SC no existen diferencias para VfR5 y VfR15, pero sí en el SR. En este suelo sólo se presentó toxicidad para V. fischeri entre 40 y 50 cm de profundidad (Cuadro 5), lo que se relaciona principalmente con la solubilización de Cu y Zn (R2 = 0.980** y 0.990**, respectivamente), en condiciones de pH ácido (R2 = 0.988**). En el suelo contaminado (SC) la toxicidad en la bacteria y la lechuga es muy alta en todo el perfil. El cobre posiblemente alteró algunas funciones de las proteínas y la actividad enzimática de la bacteria, causando daños en sus tejidos (Gaete et al.; 2010) y generando estrés oxidativo (Kabata-Pendias, 2011); mientras que el Zn pudo afectar la membrana celular por formación de especies de oxígeno reactivo (ROS) extracelular y/o contacto directo con su pared celular, causando cambios en el microambiente. (Heinlaan et al.; 2008)
Conclusiones
- No obstante, la falta de homogeneidad de las prácticas de remediación debido a la extensión de la zona del estudio, en general éstas fueron eficientes en la reducción de AsT, ZnT, PbT, metales solubles, AsE y ZnE, ya que no presentaron diferencias con el contenido de estos elementos en el suelo no contaminado.
- Con la aplicación de enmiendas orgánicas (CO) se redujeron las concentraciones de CuT, ZnT, AsT, PbW, ZnE y PbE, y con las inorgánicas (CaCO3, Fe y Mn) se redujeron las de CuT, ZnT, AsT, metales solubles, CuE, ZnE y AsE; no obstante la espuma azucarera (CaCO3) no disminuyó las concentraciones de CuW y ZnW hasta los valores críticos de toxicidad.
- En el suelo remediado sólo se encontró toxicidad sobre la bacteria entre 40 cm y 50 cm de profundidad debido, principalmente, al pH de la solución del suelo y a los contenidos de CuW y ZnW.
Agradecimientos
Al departamento de Edafología y Química Agrícola de la Universidad de Granada (España), a la Asociación Universitaria Iberoamericana de Posgrado (AUIP) y al Grupo de Investigación en uso y manejo de suelos y aguas, con énfasis en degradación de suelos, de la Universidad Nacional de Colombia, sede Palmira.
Referencias
Aguilar, J.; Dorronsoro, C.; Fernández, E.; Fernández, J.; García, I.; Martín, F.; Ortiz, I.; y Simón, M. 2000. El desastre ecológico de Aznalcóllar. Disponible en: http://edafologia.ugr.es/donana/aznal.htm [ Links ]
Aguilar, J.; Bouza, P.; Dorronsoro, C.; Fernández, E.; Fernández, J. et al. 2003. Contaminación de los suelos afectados por el vertido de Aznalcóllar y su evolución en el tiempo (1998â2001). Edafología 10(1):65-73. [ Links ]
Aguilar, J.; Dorronsoro, C.; Fernández, E.; Fernández, J.; García, I.; Martín, F.; y Simón, M. 2004. Soil pollution by a pyrite mine spill in Spain: evolution in time. Environ. Poll. 132:395-401. [ Links ]
ASTM (American Society for Testing and Materials). 2004. Standard test method for assessing the microbial detoxification of chemically contaminated water and soil using a toxicity test with a luminescent marine bacterium. ASTM D5660â96. USA. [ Links ]
Barahona, E. 1984. Determinaciones analíticas en suelos. Normalización de métodos. Determinación de carbonatos totales y caliza activa. Grupo de Trabajo de Normalización de Métodos Analíticos. Primer Congreso de la Ciencia del Suelo, Madrid, España, 1:53-67. [ Links ]
Bohn, H. 1993. Química del suelo. Editorial Limusa, S.A.; de C.V. Primera edición. México. [ Links ]
Clemente, R.; Walker, D. J.; Roig, A.; y Bernal, M. P. 2003. Heavy metal bioavailability in a soil affected by mineral sulphides contamination following the mine spillage at Aznalcóllar (Spain). Biodegradation 14:199-205. [ Links ]
CMAJA (Consejería de Medio Ambiente de la Junta de Andalucía). 1999. Los criterios y estándares para declarar un suelo contaminado en Andalucía y la metodología y técnicas de toma de muestra y análisis para su investigación. Andalucía, España. 257 p. [ Links ]
EPA (Environmental Protection Agency). 1996. Test methods for evaluating soil waste physical/ chemical methods: Acid digestion of sediments, sludges, and soils. Method 3050B. Revisión 2. [ Links ]
Gaete, H.; Hidalgo, M. E.; Neaman, A.; y ávila, G. 2010. Evaluación de la toxicidad de cobre en suelos a través de biomarcadores de estrés oxidativo en Eiseniafoetida. Química Nova 33(3):566-570. [ Links ]
Gil, F.; Capitán-Vallvey, L. F.; De Santiago, E.; Ballesta, J.; Pla, A.; et al. 2006. Heavy metal concentrations in the general population of Andalusia, South of Spain. A comparison with the population within the area of influence of Aznalcóllar mine spill (SW Spain). Sci. Total Environ. 372:49-57. [ Links ]
Heinlaan, M.; Ivask, A.; Blinova, I.; Dubourguier, H-C.; y Kahru, A. 2008. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus. Chemosphere 71:1308 - 1316. [ Links ]
Holmgren, G. G. 1967. A rapid citrate-dithionite extractable iron procedure. Soil Sci. Soc. Amer. J. 31:210-211. [ Links ]
Jiménez M. C.; Iglesias, N.; y Palencia, I. 2006. Application of sugar foam to a pyrite contaminated soil. Min. Eng. 19:399-406. [ Links ]
Juárez, S. M.; Sánchez, A. J.; y Sánchez, S. A. 2006. Química del suelo y medioambiente. Universidad de Alicante. p 692. [ Links ]
Kabata-Pendias, A. 2011. Trace elements in soils and plants. 4a ed. CRC Press, Boca Raton, FL. Estados Unidos. [ Links ]
Kraus, U. y Wiegand, J. 2006. Long-term effects of the Aznalcóllar mine spill -heavy metal content and mobility in soils and sediments of the Guadiamar river valley (SW Spain). Sci. Total Environ. 367:855-871. [ Links ]
Ordóñez, R.; Vicente, J.; Vanderlinden, K.; Carbonell, R.; y González, P. 2007. Temporal and spatial monitoring of the ph and heavy metals in a soil polluted by mine spill. Post cleaning effects. Water Air Soil Poll. 178:229 - 243. [ Links ]
Martín, F.; García, I.; Díez, M.; Sierra, M.; Simón, M.; y Doronsoro, C. 2008. Soil alteration by continued oxidation of pyrite tailings. Applied Geoch. 23:1152-1165. [ Links ]
Martín, F.; Escoto, M.; Fernández, J.; Fernández, E.; Arco, E.; Sierra, M.; y Doronsoro, C. 2010. Toxicity assessment of sediments with natural anomalous concentrations in heavy metals by the use of bioassay. Intern. J. Chem. Eng. doi:10.1155/2010/101390. [ Links ]
OECD (Organization for Economic Cooperation and Development). 2003. Terrestrial Plant Test N° 208: Seedling emergence and seedling growth test. Paris, Francia.
Paz, G. M. 2012. Efectos sobre la precipitación de jarosita por adición de potasio en drenajes ácidos de mina. Tesis de Master en Geología y Gestión Ambiental de los Recursos Minerales. Universidad Internacional de Andalucía. España. [ Links ]
Schwertmann, U. 1964. Differenzierung der Eisenoxide des Bodensdurch Extraktion mit Ammonium oxalat- Lösung. Z. Pflanzenernähr. Düng. Bodenk 105:194-202.
Simón, M.; Ortiz, I.; García, I.; Fernández, E.; Fernández, J.; Dorronsoro, C.; y Aguilar, J. 1998. El desastre ecológico de Doñana. Edafología 5:153-161. [ Links ]
Simón, M.; Díez, M.; García, I.; y Martín, F. 2009. Distribution of As and Zn in Soils Affected by the Spill of a pyrite mine and effectiveness of the remediation measures. Water Air Soil Poll. 198:77-85. [ Links ]
USDA. United States Department of Agriculture. 1998. Soil Quality Information Sheet. Soil Quality Indicators: pH. USDA Natural Resources Conservation Service. Disponible en: http://soils.usda.gov/sqi/publications/files/indicate.pdf [ Links ]
Wang, S. y Mulligan, C. 2009. Effect of natural organic matter on arsenic mobilization from mine tailings. J. Hazardous Materials 168:721-726. [ Links ]