Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.64 no.2 Palmira Apr./June 2015
https://doi.org/10.15446/acag.v64n2.43936
Protección de Cultivos
doi: http://dx.doi.org/10.15446/acag.v64n2.43936 e-ISSN 2323-0118
Parámetros poblacionales y comportamiento de Steneotarsonemus spinki Smiley (Acari: Tarsonemidae) en el cultivo de arroz
Population parameters and behavior of Steneotarsonemus spinki Smiley (Acari: Tarsonemidae) in rice culture
Shirley Toro Sánchez y Nora Cristina Mesa Cobo
Universidad Nacional de Colombia sede Palmira. Facultad de Ciencias Agropecuarias, Palmira, Colombia. Autora para correspondencia: storos@unal.edu.co
Resumen
El ácaro Tarsonemidae Steneotarsonemus spinki Smiley desde su introducción en Colombia ha causado impacto económico y reducción en la productividad del cultivo de arroz, aumento de las aplicaciones de agroquímicos para su control e incrementos en los costos de producción. Con el fin de estudiar su biología, en condiciones de laboratorio (27 ± 3 °C y 85 ± 5% H.R) se estableció un ensayo en plantas de la variedad Fedearroz 473 con el objeto de hacer observaciones y registros diarios de todos los cambios durante el desarrollo de huevo a adulto. Se encontró que la duración, en días, de los estados inmaduros fue: para huevo, 1.4; para larva, 0.7 y para ninfa-pupa, 0.6. La duración total de huevo a adulto fue de 3.5 días. La hembra presentó un periodo de oviposición de 8 días y una longevidad 8.9 días. Se registró una fecundidad de 43 huevos por hembra y una tasa de oviposición diaria de 4.43. La relación hembra: macho fue de 11.5:1. Los parámetros de la tabla de vida obtenidos fueron: tasa reproductiva neta (Ro) = 52.72, tasa intrínseca de crecimiento natural (rm) = 1.36, tasa finita de multiplicación (l ) = 3.88, tiempo de duplicación (Td) = 0.51 días y tiempo generacional (T) = 4.59 días. Estos resultados permiten entender el impacto de S. spinki en el cultivo de arroz en Colombia.
Palabras clave:Oryza sativa, Tarsonemidae, biología, reproducción, ácaro de la panícula.
Abstract
The mite Tarsonemidae Steneotarsonemus spinki Smiley since its introduction to the country, has caused economic impact and reduced productivity of rice cultivation, increased agrochemical applications for control and increases in production costs. In order to study his biology, in laboratory conditions( 27 ± 3 oC y 85 ± 5% R.H) a trial was established in plants of the variety Fedearroz 473, daily observations and record all changes made during its development from egg to adult. We found that the duration in days of the immature stages was: egg: 1.4; larva: 0.7 and nymph-pupae: 0.6. The total time from egg to adult was 3.5 days. The female presented an oviposition period of 8.0 days and 8.9 days longevity. Fecundity of 43 eggs per female daily oviposition rate of 4.43 was recorded. The ratio female: male was 11.5: 1. The parameters of the life table were obtained: net reproductive rate (Ro) = 52.72, intrinsic rate of natural increase (rm) = 1.36, finite multiplication rate (l ) = 3.88, doubling time (Td) = 0.51days and generation time(T) = 4.59. These results allow us to understand the impact ofS. spinki in rice cultivation in Colombia.
Key words:Oryza sativa, Tarsonemidae, biology, reproduction, survival, mite panicle.
Introducción
Steneotarsonemus spinki Smiley es considerado como la plaga más importante del arroz en el mundo (Tseng, 1984). Se distribuye geográficamente en Asia, región Caribe, Norte, Centro y parte del Sur de América (Navia et al., 2010). Entre sus hospederos se encuentran más de 70 especies de plantas incluyendo malezas que crecen con el cultivo de arroz, entre ellas, el arroz silvestre Oryza latifolia Desv., el pasto Argentina Cynodon dactylon (L.) Pers (Poaceae), el coquito Cyperus iria L. (Cyperaceae), palla (Oxycaryum sp. -Cyperaceae), el junco (Cyperus articulatus (L.) (Sanabria y Aguilar, 2005; Rao y Prakash, 1996, 2002; (CRRI, 2006).
Los estiletes quelicerales de S. spinki perforan la epidermis de las células de las plantas de arroz y este mecanismo de alimentación del ácaro causa lesiones necróticas en la superficie de la vaina y entre el grano y la vaina (Chow et al., 1980). Las plantas de arroz atacadas por lo general se atrofian y presentan problemas en su desarrollo como deformación de panículas y de inflorescencias, tejidos necróticos y deshidratados, puntos de color café sobre la pared de los granos, esterilidad, y reducción en la calidad del grano y en el número de panículas (Cho et al., 1999; Kim et al., 2001; Almaguel et al., 2003).
La diseminación de S. spinki en la región Caribe incrementó la incidencia de la infección por el hongo Sarocladium oryzae (Sawada) (Moniliaceae) (Chow et al., 1980; González y Cárdenas, 2003; Ramos y Rodríguez, 2001). Este hongo fitopatogénico puede causar pudrición de la vaina y, en combinación con altas infestaciones de S. spinki, ocasiona reducción significativa en la producción del cultivo. De acuerdo con Almaguel et al., (2003), en Cuba la presencia de S. spinki en asociación con S. oryzae produjo síntomas de esterilidad en la panícula y pudrición de la vaina. En Panamá, Nandakumar et al., (2007) describieron la asociación de las bacterias Burkholderia glumae (Kurita y Tabei) y B. gladioli (Severini) lo que produce los síntomas del tizón de la panícula ('panicle blight') y Hummel et al., (2009) en Louisiana encontraron sintomatología de tizón bacterial de la panícula ('bacterial panicle blight'), un daño que incluye vaneamiento del grano y panículas erectas en plantas de arroz atacadas por el ácaro.
El ácaro puede llevar esporas de hongos (Lo y Hor, 1977; Chow et al., 1980). Según Ochoa et al., (1991) se conoce que algunas especies de Tarsonemidae pueden llevar adheridas en su cuerpo y en estructuras especializadas esporas que contribuyen a la diseminación de enfermedades fungosas. Cabrera et al., (2005) aislaron del cuerpo de S. spinki esporas de los hongos Hirsutella nodulosa, Sarocladium oryzae, Cephalosporium sp. y Penicillium sp. Almaguel et al., (2003) reportan también la asociación de S. pinki con los hongos fitopatogénicos S. oryzae y los géneros Pyricularia, Rhynchosporium y Rhizoctonia, que causan manchado de granos y vainas.
Steneotarsonemus spinki ha sido reportado causando pérdidas económicas en el cultivo de arroz en diferentes países como Taiwán (Cheng y Chiu, 1999), China (Jiang et al., 1994), India (Ou et al., 1977). Para la agricultura de Cuba, es considerado como una de las principales plagas en cultivos de arroz, los registros del periodo 1997-98, cuando se confirmó su llegada a la Isla, indican que la producción se redujo en 70% y en los años siguientes las pérdidas estuvieron en el rango entre 30 y 60% (Ramos y Rodríguez, 2000). En Costa Rica, durante el 2004 ocurrieron las primeras infestaciones de S. spinki y se produjeron pérdidas de 96,000 t de arroz en la Provincia de Guanacaste, lo cual representó cerca del 45% de la producción del país y un estimado de pérdidas económicas de US$ 11millones (Navia et al., 2010). Situaciones similares fueron encontradas en 1998 en República Dominicana, con pérdidas económicas y de producción aproximadas de 40% (Díaz et al., 1999; Ramos et al., 2001); en Haití estas pérdidas fueron de 60% (Almaguel y Botta, 2005) y entre 40 y 60% en Panamá (García, 2005). En Colombia el ácaro fue registrado por el ICA en el 2005 y mediante la resolución 1195 del mismo año fue declarada la emergencia fitosanitaria en todo el territorio nacional por la presencia de los ácaros S. spinki (Smiley) y S. furcatus (De León) en arroz. Mediante acciones de vigilancia fitosanitaria y diagnóstico vegetal y por información de productores de semilla se detectó la presencia de S. spinki en arroz producido en Casanare, Tolima, Huila y Norte de Santander, y S. furcatus en el Tolima. Toro (2014) reportó la presencia de S. spinki y S. furcatus en cultivos de arroz en los departamentos de Córdoba, Sucre, Bolívar, Magdalena, Cesar, Norte de Santander, Valle del Cauca, Tolima, Huila y Meta.
Steneotarsonemus spinki se reproduce tanto sexualmente como por partenogénesis arrenotoca, es decir, que hembras vírgenes dan origen a machos. Esta estrategia reproductiva contribuye a incrementar rápidamente las poblaciones (Navia et al., 2010). Santos et al. (1998) determinaron las generaciones de S. spinki para las diferentes zonas productoras de arroz en Cuba e indicaron una duración del ciclo de vida (huevo-adulto) de 12.2 días a 20 °C, de 5.11 días a 29 °C y de 4.9 días a 34 °C; en el día 15 sólo ocurrió el desarrollo del embrión. El umbral mínimo de desarrollo fue 16.1°C para el período embrionario, 15.9 °C para el desarrollo larval y de 16.1 °C para el ciclo total. En estudios realizados por Ramos y Rodríguez, (2000) y Almaguel et al.,(2004) se demostró también el efecto de la temperatura en la duración del desarrollo de huevo a adulto. A 20, 24, y 30 °C, la duración fue de 11, 7, y 3 días respectivamente. Resultados similares obtuvieron Lo y Hor (1979) y Xu et al., (2001) en trabajos realizados con poblaciones de S. spinki en Asia donde encontraron que a 20°C la duración huevo-adulto fue de 13-17 días y de 3-8 días a 30°C.
El presente trabajo tuvo como objetivo obtener información clave sobre esta especie de ácaro que ha tenido un impacto negativo en la producción del cultivo del arroz en diversos países. Aunque en Colombia no se conocen reportes sobre la evolución de las poblaciones de S. spinki en las diferentes zonas arroceras del país, se consideró importante conocer sus principales aspectos biológicos y de comportamiento, así como algunos de los parámetros de la tabla de vida del ácaro en desarrollo en vainas de la planta de arroz. Se espera que los resultados obtenidos en esta investigación sean una herramienta que aporte información a la hora de planear estrategias de manejo integrado para esta plaga.
Materiales y métodos
Para obtener los ácaros que se utilizaron en el estudio de ciclo de vida, se estableció una colonia en casa de malla en la zona de estudio, mediante la siembra semanal en materas de 20 plantas de la variedad de arroz Fedearroz 473. Estas siembras se hicieron en jaulas de 2 x 1 x 1 m. que fueron forradas con muselina para prevenir la entrada de insectos y/o ácaros del arroz que no eran objeto de estudio. Las materas permanecieron con lámina de agua, que fue cambiada semanalmente con el fin de evitar la contaminación por hormigas.
Los estudios se realizaron en condiciones de laboratorio a 27 ± 3 oC y 85 ± 5% H.R, utilizando plantas de arroz de aproximadamente 75 días después de la emergencia; para el estudio, en cada planta se usó la hoja principal o bandera. En cada hoja se hizo una herida en el haz sobre la nervadura central de aproximadamente 0.5 cm de largo por 0.2 cm de ancho, se dejaron al descubierto las recámaras internas donde se colocó una hembra adulta con el fin de obtener huevos. Después de 6 h ésta fue retirada y los huevos se individualizaron en recámaras similares, como se describió anteriormente. Dos veces diarias se hicieron observaciones de una cohorte inicial de 100 individuos, registrando los cambios y la sobrevivencia de cada uno de los estados de desarrollo hasta adulto y el momento cuando se observó el estado de pupa-larva (estado de desarrollo inmóvil que ocurre entre la larva y el adulto).
Una cohorte de 30 hembras ya copuladas fue individualizada en cámaras de las hojas bandera, en la forma como se describió antes para los estudios de desarrollo. Diariamente se contabilizó el número de huevos puestos por cada hembra y se registró la sobrevivencia hasta cuando todas las hembras murieron. Los ácaros adultos obtenidos se montaron en medio Hoyer Krantz (1978), para ser revisados en microscopio de contraste de fases, con el objeto de confirmar su sexo y establecer la relación macho:hembra. La proporción de machos se calculó dividiendo el número de hembras sobre el total de la población obtenida. Los parámetros calculados de la tabla de vida fueron: la tasa de reproducción neta (R0), la tasa intrínseca de crecimiento (rm), el tiempo medio generacional (T), el tiempo de duplicación (Td) y la tasa finita de crecimiento (l ). Se utilizó la técnica de Jackknife implementada por Maia et al. (2000) con el sofware estadístico SAS (SAS, 2000) y las ecuaciones respectivas (Andrewartha y Birch, 1954; Rabinovich, 1980).
Resultados y discusión
Durante el desarrollo del ácaro S. spinki se identificaron los estados de huevo, larva, pupa-larva y adulto. Los huevos son semirredondos, totalmente traslucidos recién puestos; la hembra normalmente los ubica en masas aunque ocasionalmente también se observan separados. En la medida que avanza la etapa de desarrollo se tornan de un color blanquecino turbio, lo que indica que se encuentran próximos a su eclosión. Cuando la larva emerge tiene forma ovalada alargada; recién nacida es de color traslucido, hexápoda y muy móvil, y en la medida en que se desarrolla se torna de color blanquecino con una mancha blanca en la parte ventral. Las larvas se transforman en 'pupas larvales', estado de desarrollo inmóvil, aunque fisiológicamente activo; son de forma ovalada con los extremos bien agudos, de color blanco hialino y una mancha blanca de forma rectangular. Durante este estado no se alimentan y son cargadas y transportadas por el macho sobre el dorso. Los machos caminan rápidamente y se mantienen muy activos, buscando una pupa-larva, la que levantan con ayuda del último par de patas, la fijan por la papila genital masculina al extremo posterior de su cuerpo y las cargan a medida que caminan, hasta la emergencia del adulto hembra. La cópula se realiza por lo general casi inmediatamente emerge el adulto hembra. Una vez copulan se separan. Los adultos hembras presentan idiosoma alargado, de mayor tamaño que los machos. Las características morfológicas observadas en los adultos son similares a las descritas por Hummel et al., (2009) y Ramos y Rodríguez (2001).
Bajo las condiciones del estudio la duración del desarrollo de huevo hasta adulto fue de 3.5 días, siendo el periodo de incubación de los huevos el más prolongado del ciclo con una duración de 1.4 días (Cuadro 1). Este tiempo coincide con la duración reportada a 30°C en condiciones de laboratorio por Ramos y Rodríguez, (2001) y Almaguel et al. (2003).
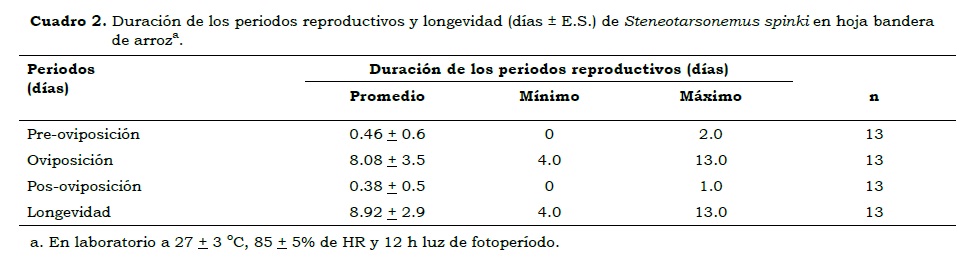
La relación de sexos (hembra: macho) fue de 11.5:1, que contrasta con los encontrados por Zhang (1984) de 22:1, 32:1 a 32°C, y 8:1 a 28oC, en condiciones de campo. La sobrevivencia de la especie (lx) (Figura 1) reveló una tendencia curva en la cual las larvas presentaron alta sobrevivencia debido, posiblemente, a que se desplazan muy poco del área de alimentación; mientras que en el estado de pupa-larva la mortalidad aumentó debido, probablemente, a que en este estado los individuos son cargados y transportados sobre el dorso del macho, quien camina rápidamente y permanece en constante movimiento. Una vez las hembras copularon presentaron un periodo de pre-oviposición de 0.46 días, la duración promedio del periodo de oviposición fue de 8.08 días y la mayor producción de huevos ocurrió entre 4 y 8 días de vida de la hembra (Cuadro 2). La fecundidad total (Mx) de S. spinki fue de 43 huevos/hembra, lo que es equivalente a 4.43 huevos/hembra por día (Figura 2). Estos valores fueron menores que los obtenidos en laboratorio por Xu et al. (2001) de 55.5 huevos/hembra entre 24.5 y 35.4oC.
Los parámetros de la tabla de vida de S. spinki obtenidos en este estudio confirman la celeridad de crecimiento de las poblaciones de este ácaro y explican las causas por las cuales se convirtió en una plaga de importancia en el cultivo de arroz. Estos parámetros muestran una tasa reproductiva neta (Ro) de 52.72, una tasa intrínseca de crecimiento natural (rm) de 1.36%, una tasa finita de multiplicación (l ) de 3.88, un tiempo generacional (T) de 4.59 días y un tiempo de duplicación (Td) de 0.51 días (Cuadro 3). Los valores obtenidos para rm o tasa de crecimiento de la población demuestran la capacidad biológica que presenta S. spinki y permiten entender el impacto de su actividad en campo cuando encuentra condiciones favorables para su multiplicación y desarrollo.
Conclusiones
- Los parámetros poblacionales de S. spinki obtenidos en las condiciones de este trabajo indican que esta especie puede ocasionar daños severos y reducir la producción en el cultivo del arroz en Colombia, así como los registrados para otros países de Centroamérica y el Caribe.
- Por el hábito de alimentación y reproducción de este ácaro en el interior de la vaina de la hoja de las espigas en formación, fue necesario desarrollar una metodología para hacer las observaciones sobre la biología y comportamiento reproductivo, lo que confirma la dificultad que tienen los productores para lograr un control efectivo sobre el ácaro y sugiere la necesidad de realizar estudios con enemigos naturales y otras estrategias de manejo que puedan llegar a estas estructuras de la planta.
Agradecimientos
Los autores agradecen a la Federación Nacional de Arroceros (Fedearroz) por la financiación del Proyecto Dinámica Poblacional y Estudio de la Incidencia del ácaro Steneotarsonemus spinki Smiley (Acari: Tarsonemidae) sobre el Desarrollo Fenológico del Arroz en Colombia. Al Grupo de Investigación de Acarología de la Universidad Nacional de Colombia sede Palmira. A Norbey Marín, por su aporte en los análisis estadísticos de la presente investigación.
Referencias
Almaguel, L.; Rojas, A.; De la Torre, P; Botta, E.; Hernández, J.; Cáceres, I; y Ginarte, A. 2003. Dinámica de población e indicadores ecológicos del ácaro Steneotarsonemus spinki Smiley 1967 (Acari: Tarsonemidae) en arroz de riego en Cuba. Fitosanidad 7(1):23 - 24. [ Links ]
Almaguel L; Torres, P.E.; y Cáceres, I. 2004. Suma de temperaturas efectivas y potencial de multiplicación del ácaro del vaneado del arroz (Steneotarsonemus spinki Smiley) en Cuba. Fitosanidad 8:37 - 40. [ Links ]
Almaguel, L. y Botta, E. 2005. Manejo integrado de Steneotarsonemus spinki, Smiley. Resultados de Cuba y transferencia para la región de Latinoamérica y el Caribe. Curso de Posgrado de Acarología, Introducción a la Acarología Agrícola. La Habana, Cuba. 44 p. [ Links ]
Andrewartha, H. G. y Birch, L. C. 1954. The Distribution and abundante of animals. The University of Chicago Press, Chicago. 782 p. [ Links ]
Cabrera, I. M.; Ramos, M.; y Fernándes, B. M. 2003. Factores que influyen en la abundancia de Steneotarsonemus spinki en arroz en Cuba. Costa Rica. Manejo Integrado de Plagas (MIP). Agroecol. 69:34-37. [ Links ]
Cabrera, R. I.; Garcia, A.; Otero-Colina, G.; Almaguel, L.; y Ginarte, A., 2005. Hirsutella nodulosa and other fungus species associated to the rice tarsonemid mite Steneotarsonemus spinki (Acari: Tarsonemidae) en Cuba. Folia Entomol. Mex. 44(2):115 - 121. [ Links ]
CRRI (Central Rice Research Institute). 2006. A new alternate host of rice panicle mite. CRRI Newsl. 27(3):10. [ Links ]
Cheng, CH. y Chui YI. 1999. Review of changes involving rice pests and their control measures in Taiwan since 1945. Taipei. Plant Prot. Bull. 41(1):9-34. [ Links ]
Cho, M. R.; Kim, D. S.; e Im, D. S.; 1999. A new record of tarsonemid mite Steneotarsonemus spinki (Acari: Tarsonemidae) and its damage on rice in Korea. [ Links ] Korean J. Appl. Entomol. 38:157-164.
Chow, Y. S; Tzean, S. S; Chang, C, S; y Wang, C. H. 1980. A morphological study of the tarsonemid mite Steneotarsonemus spinki Smiley (Tarsonemidae). Plant Prot. Bull. 22:17-21. [ Links ]
Díaz, F.; Abud, A.; y González, M. 1999. El ácaro de la panícula del arroz. Fersan Informa 24:11-12. [ Links ]
García, M. P. 2005. Vaneamento y manchado de grano en cultivos de arroz en Panamá. Rev Arroz 53(455). [ Links ]
González, M.; y Cárdenas, R. M. 2003. Influencia de factores bióticos en el comportamiento del vaneo del grano en variedades y líneas de arroz (Oryza sativa L.). Cultivos Tropicales 24:41-44. [ Links ]
Hummel, N. A.; Castro, B. A.; McDonald, E. M; Pellerano, M. A; y Ochoa, R. 2009. The panicle rice mite, Steneotarsonemus spinki Smiley, a re-discovered pest of rice in the United States. Crop Prot. 28.547-560. [ Links ]
ICA (Instituto Colombiano Agropecuario). 2005. Resolución No. 001195 de 2005. Diario Oficial, edición 45.892. Miércoles 27 abril de 2005. Bogotá, Colombia, p. 17. [ Links ]
Jiang, P. Z.; Xie, X. J.; Chen, W. X.; Cao, S. Y.; y Liang, Z.H. 1994. Regularity of incidence of Steneotarsonemus spinki. Guandong. Agric. Sci. 5:37-40. [ Links ]
Kim D. S.; Lee M. H., e Im D. J. 2001. Effect of dust mite incidence on grain filling and quality in rice. Korean J. Crop Sci. 46:180-183. [ Links ]
Krantz, G. W. 1970. A manual of Acarology. First edition. OregonState University Book Stores, Inc. Corvallis, 335 p. [ Links ]
Lo, K. C.; y Ho, C. C. 1979. Ecological observations on rice tarsonemid mite, Steneotarsonemus spinki (Acarina: Tarsonemidae). China. J. Agric. Res. 28(3):181-192. [ Links ]
Lo, K. C.; y Hor, C. C. 1977. Preliminary studies on rice tarsonemid mite Steneotarsonemus spinki (Acarina: Tarsonemidae). Nat. Sci. Counc. Mon. 5 (4):274-284. [ Links ]
Maia, A. de H. N.; Luiz, A. J.; y Campanhola, C. 2000. Statistical inference on associated fertility life parameters using Jackknife technique: computational aspects. J. Econ. Entomol. 93(2):511- 518. [ Links ]
Nandakumar, R.; Rush, M.C.; y Correa, F. 2007. Association of Burkholderia glumae and B. gladioli with Panicle Blight Symptoms on Rice in Panama. Plant Dis. 91:767. [ Links ]
Navia, D.; Mendonça, R. S.; y de Melo, L. A. 2005. Steneotarsonemus spinki -an invasive tarsonemid mite threatening rice crops in South America. En: Plant Protection and Plant Health in Europe, Introduction and Spread of Invasive Species. Humboldt University, Berlin, Alemania. 9 - 11 June 2005. [ Links ]
Navia, D.; Mendonça, R. S.; y Ochoa, R. 2010. The rice mite Steneotarsonemus spinki, an invasive species in the Americas. Springer Science+Business Media B. V. 2010. [ Links ]
Ochoa, R.; Smiley, R. L.; y Saunders, J. L. 1991. The family Tarsonemidae in Costa Rica (ACARI: Heterostigmata). Int. J. ácarol. 17:41-86. [ Links ] [ Links ]
Rabinovich, J. E. 1980. Introducción a la ecología de poblaciones animales. Consejo Nacional para la Enseñanza de la Biología, A. C. 1a. ed. Compañía editorial continental, México. 287 p. [ Links ]
Ramos, M.; y Rodríguez, H. 1998. Steneotarsonemus spinki Smiley (Acari: Tarsonemidae): Nuevo informe para Cuba. Rev. Protec. Veg. 13:25-28. [ Links ]
Ramos, M. y Rodríguez, H. 2000. Ciclo de desarrollo de Steneotarsonemus spinki Smiley (Acari: Tarsonemidae) en laboratorio. Rev. Prot. Veg. 15(2):51-52. [ Links ]
Ramos, M.; Gómez, C.; y Cabrera, R. I. 2001. Presencia de Steneotarsonemus spinki (Acari: Tarsonemidae) en cuatro variedades de arroz en la Republica Dominicana. Rev. Protec. Veg. 16:6-9. [ Links ]
Ramos, M.; y Rodríguez, H. 2001. Aspectos biológicos y ecológicos de Steneotarsonemus spinki en arroz, en Cuba. ManejoIntegrado de Plagas (MIP) 61:48-52. [ Links ]
Rao, J.; Prakash, A.; Dhanasekharan, S.; y Ghosh, S. K. 1993. Observations on rice tarsonemid mite Steneotarsonemus spinki, white-tip nematode and sheath-rot fungus interactions deteriorating grain quality in paddy fields. J. Appl. Zool. Res. 4:89-90. [ Links ]
Rao, J.; y Prakash, A. 1996. Cynodon dactylon (Linn.) Pers. (Graminae): an alternate host of rice tarsonemid mite, Steneotarsonemus spinki Smiley. J. Appl. Zool. Res. 7:50-51. [ Links ]
Rao, J. y Prakash, A. 2002. Paddy field weed, Schoenoplectus articulatus (Linn.) Palla (Cyperaceae): a new host of tarsonemid mite, Steneotarsonemus spinki Smiley and panicle thrips, Haplothrips ganglbaureri Schmutz. J. Appl. Zool. Res. 13:174- 175. [ Links ]
Reissig, W. H.; Heinrichs, E. A.; Litsinger, J. A.; Moody, K.; Fiedler, L.; Mew, T.W.; y Barrion, A.T. 1986. Illustrated guide to integrated pest management in rice in tropical Asia. Manila (Filipinas). International Rice Research Institute. p. 228 - 232. [ Links ]
SAS Institute Inc. 2000. SAS User's guide version 8.1. SAS Institute, Cary, North Carolina, E.U. [ Links ] Sanabria, C.; y Aguilar, H. 2005. El ácaro del vaneo del arroz (Steneotarsonemus spinki L: Tarsonemidae). Boletín Fitosanitario, Ministerio de Agricultura y Ganadería, San José, Costa Rica, 16 p. [ Links ]
Santos, A.; Almaguel, L.; de la Torre, P.; Cortiñas, J.; y Cáceres, I. 1998. Duración del ciclo de vida en condiciones controladas del ácaro Steneotarsonemus spinki (Acari:Tarsonemidae) en arroz (Oryza sativa L.) en Cuba. Primer Encuentro Internacional de Arroz, Palacio de Convenciones. La Habana. 1998. p. 187. [ Links ]
Sawada, K. 1922. Descriptive Catalogue of the Formosan Fungi II. Rept. Dept. Agr. Gov. Res. Inst. Formosa. 2. p. 1 - 173. [ Links ]
Tseng, Y. H. 1984. Mites associated with weeds, paddy rice, and upland rice fields in Taiwan. En: Griffiths, Bowman (eds.). ácarology VI, vol. 2. Ellis Horwood, Chichester, Reino Unido. p. 770-780. [ Links ]
Toro, S. S. 2014. Dinámica poblacional y estudio de la incidencia del ácaro Steneotarsonemus spinki Smiley (Acari:Tarsonemidae) sobre el desarrollo fenológico del arroz en Colombia. Tesis de doctorado. Universidad Nacional de Colombia sede Palmira. Repositorio Institucional UN. [ Links ]
Xu, G. L.; Wu, H. J.; Huan, Z. L.; y Wan, M. 2001. Study on reproductive characteristic of rice mite, Steneotarsonemus spinki (Acari: Tarsonemidae). Systematic Appl. ácarol. 6:45-49. [ Links ]
Xu, G. L.; Wu, H. J.; Tong, X. L. 2002. Studies on stress resistance of Steneotarsonemus spinki Smiley. Plant Prot. 28(5):18-21. [ Links ]
Zhang, B. D. 1984. Preliminary observations on the biological characteristics of Steneotarsonemus spinki Smiley. Insect Knowledg. 18:55-56. [ Links ]