Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Agronómica
versão impressa ISSN 0120-2812
Acta Agron. vol.65 no.1 Palmira jan./mar. 2016
https://doi.org/10.15446/acag.v65n1.45180
http://dx.doi.org/10.15446/acag.v65n1.45180
Fitonematodos asociados a Cyphomandra betacea (Cav.) Sendtn., Solanum quitoense Lam. y Daucus carota L. en el Departamento de Boyacá, Colombia
Plant parasitic nematodes associated with Cyphomandra betacea (Cav.) Sendtn., Solanum quitoense Lam. and Daucus carota L. in Boyacá, Colombia
Ana Teresa Mosquera–Espinosa
Programa de Ingeniería Agronómica, Grupo de Investigación CIDE, Universidad Pedagógica y Tecnológica de Colombia–sede Tunja. Tunja, Boyacá, Colombia. Autora para correspondencia: ana.mosquera@uptc.edu.co
Rec.: 25.08.2014 Acep.: 22.12.2014
Resumen
Los frutales y hortalizas en zonas de clima frio moderado suplen parte de la demanda alimentaria del país. Sin embargo, la mayor limitante para su producción son los problemas por patógenos y parásitos. Los fitonematodos ocasionan pérdidas hasta de 100% por los complejos patológicos que inducen. Los estudios publicados para Colombia no incluyen reportes de las zonas agrícolas del Departamento de Boyacá. En el estudio se contextualiza la información sobre los fitonematodos asociados con tomate de árbol (Cyphomandra betacea (Cav.) Sendtn, lulo (Solanum quitoense Lam.) y zanahoria (Daucus carota L.), como también los síntomas que inducen. Se visitaron fincas en los municipios de Buenavista y Ventaquemada, zonas de mayor producción para el departamento y en ellas se recolectaron muestras de suelo rizosferico y raíces que se procesaron por el método Coob y Bird, respectivamente. Se analizaron datos poblacionales, ecológicos y parasíticos, encontrando la mayoría de los géneros de fitonematodos mencionados en literatura para Colombia: en zanahoria se encontró Meloidogyne y Helicotylenchus, en los frutales además, Pratylenchus. En general, las poblaciones de dichos géneros fueron altas, sin embargo, no existe un valor de umbral de daño económico para interpretar si son limitantes en la producción de la región. Los síntomas observados en la parte aérea y en raíces de los tres hospederos, indicaron afección por fitonematodos. Por niveles poblacionales el género de mayor importancia fue Meloidogyne, causando agallas y síntomas correspondientes a complejos patológicos.
Palabras clave: Cultivos de clima frio, fitopatología, fitonematodos, manejo integrado de enfermedades.
Abstract
Fruits and vegetable from moderately cold climates supply part of the national demand food for country. However, their successful production is limited by pathogens and parasites. Nematodes cause yield losses up to 100%, principally by facilitating pathogen complexes. Published studies from Colombia do not include reports for agricultural regions of Boyacá. The present study tries contextualizing information about nematodes associated to tree tomato, lulo and carrot, as well as the symptoms they cause. The farms were sampled in the municipality of Buenavista and Ventaquemada, where production is perform in a highest level. Soil and roots samples of rhizosphere were collected and processed by the methods of Coob and Bird, respectively. Populations, ecology and parasitism were evaluated and genera of plant–associated nematodes were found for tree tomato and lulo Meloidogyne and Helicotylenchus, also Pratylenchus corresponding to carrot; previously reported for these hosts in other parts of Colombia. Average populations in soil and roots were higher, however, since threshold levels for economic damage were not establish and recorded, it is not clear if these levels must be considered low or high. Symptoms observed in roots and shoots indicated that the nematode damage was mostly due to Meloidogyne in galls. Symptoms corresponding to pathogen complexes were also performed. The results of this study will form the basis of a management plan, taking into account the agroecological conditions of the area of study.
Keywords: Cold climate crops, integrated pest management, plant pathology, plant nematodes.
Introducción
Las zonas de clima frio moderado, como lo es la mayor parte del Departamento de Boyacá, Colombia, son una importante despensa de alimentos (Fontagro, 2006). Los frutales y hortalizas, como tomate de árbol, lulo y zanahoria, cada vez se proyectan más en la región con nueva áreas de siembra, ya que tienen alta aceptación en el mercado nacional tanto para consumo en fresco como para transformación agroindustrial (PFN, 2006). No obstante al mismo tiempo se incrementan los problemas fitosanitarios debido, principalmente, al deficiente desarrollo tecnológico que se refleja en la baja producción y calidad de los productos. Lo anterior, sumado a las inadecuadas prácticas de manejo conlleva al desequilibrio en los agroecosistemas con pérdidas en sostenibilidad (Fontagro, 2006).
Cuando los patógenos que afectan los cultivos se encuentran en la parte aérea de las plantas es posible realizar evaluaciones visuales para cuantificar la enfermedad y calcular pérdidas en producción; pero cuando se presentan en el sistema radicular, como ocurre con el ataque de fitonematodos, pasan desapercibidos y generalmente son confundidos con problemas de nutrición, subestimando su afección y por ende, realizando un incorrecto manejo de la situación fitosanitaria (Tamayo, 2001).
Los fitonematodos (Phylum Nematoda) que habitan en el suelo afectan raíces y órganos subterráneos, alteran el normal desarrollo de las plantas y sobre todo, su productividad. En órganos aéreos inducen principalmente amarillamiento, reducción en el desarrollo, atrofia y marchitez. Además, las lesiones que estos ocasionan al penetrar al tejido son el medio de entrada para otros patógenos como hongos y bacterias, que igualmente causan detrimento a la planta. Meloidogyne es uno de los géneros de fitonematodos que más limita la producción agrícola, causando agallas en el sistema de raíces e impidiendo la absorción de agua y nutrientes (Agrios 2002, Múnera y Navarro 2002, Vargas et al., 2002, Huertas et al., 1999).
En tomate de árbol (C. betacea (Cav.) Sendtn.) los fitonematodos del género Meloidogyne son los de mayor frecuencia y distribución. Estos causan daño mecánico permitiendo la llegada de otros patógenos que generan complejos sanitarios, los cuales en la parte aérea de la planta se observan como marchitez generalizada (Lozada et al., 2002; Múnera y Navarro, 2002). Cuando el deterioro de la planta es progresivo, se observan hojas cloróticas, defoliación y marchitez, reducción del tamaño de frutos y del periodo de producción, finalmente las plántulas mueren (Forero 2001). En este frutal se reconocen M. incognita y Nacobbus aberrans como fitonematodos limitantes, ya que generan interacciones negativas con patógenos del suelo como Fusarium solani y Phytophthora infestans aumentando el daño que sufre el hospedero (Moreta, 2010; Ron y Revelo, 2010). En el Departamento de Nariño predominan las especies M. incognita, M. arenaria, M. exigua y M. hapla, siendo más frecuente M. incognita (García et al., 2004). En el caso del Valle del Cauca y Risaralda se citan los géneros Helicotylenchus, Pratylenchus y Meloidogyne, este último con las especies M. incognita y M. arenaria (Lozada et al., 2002).
En lulo (S. quitoense Lam.) el problema patológico más limitante es ocasionado por el nematodo del nudo radical Meloidogyne spp., que no sólo genera daño en sistema de raíces sino que facilita la entrada a otros patógenos como Fusarium, Phytophthora, Rhizoctonia y Pythium (Huertas et al., 1999; Gómez 1997). En raíces de la planta se observan agallas producto de la hipertrofia e hiperplasia inducida por las enzimas que inyecta el nematodo para su alimentación (Agrios, 2002). La planta presenta reducción en altura, retraso en el desarrollo, amarillamiento y marchitez generalizada en hojas (Corrales et al., 1999; ICA, 2011; Huertas et al., 1999; Forero, 1999). En Antioquia se cita la presencia de las especies M. incognita y M. javanica (Múnera y Navarro, 2002); en Nariño existe mayor incidencia de M. incognita seguida de M. arenaria (García et al., 2004); en Tolima, Huila, suroccidente de Cundinamarca y Valle del Cauca se indica mayor prevalencia de la especie M. incognita (Corrales et al. 1999; García et al. 2007; Huertas et al. 1999; Forero 1999; Gómez 1997).
La zanahoria (D. carota L.) es uno de los hospederos más afectados por fitonematodos. Los registros mundiales mencionan alrededor de 90 especies ubicados en los géneros Pratylenchus, Nacobbus, Ditylenchus y Meloidogyne, estos dos últimos causan importantes pérdidas a nivel económico (Gaviola, 2013). Según el estudio de López y Azofeifa (1981) en Costa Rica los fitonematodos con mayor frecuencia de aparición son los géneros Helicotylenchus, Meloidogyne, Criconemoides, Paratrichodorus, Tylenchus, Globodera y Heterodera; mientras que las más bajas densidades poblacionales corresponden a Pratylenchus, Ditylenchus, Criconema y Tylenchulus. En Argentina, los géneros limitantes son Nacobbus, Meloidogyne y Ditylenchus, cuyas especies identificadas, respectivamente, son N. aberrans; M. hapla, M. incognita, M. arenaria y M. javanica; D. dipsaci y D. destructor. Meloidogyne spp. por ser el nematodo más cosmopolita es el de mayor predominancia en esta hortaliza. Causa agallas en pelos radiculares y disminución de los mismos; las raíces afectadas son más cortas y cuando el ataque ocurre en estado de plántula, la raíz se bifurca adquiriendo forma ‘patuda’. En hojas los síntomas se confunden con deficiencia de agua y nutrientes, ya que se manifiesta como reducción del crecimiento, amarillamiento y marchitez (Gaviola, 2013).
En Colombia cada día aumentan las zonas productoras de frutales y hortalizas, lo que conlleva al incremento de problemas fitosanitarios, especialmente aquellos que se relacionan con fitonematodos. Lo anterior, obliga a realizar y/o actualizar registros de enfermedades y sus agentes causales, como también proponer estrategias de manejo para cada cultivo bajo las condiciones agroecológicas particulares a cada región de estudio.
Por lo anterior, en el presente estudio se plantearon como hipótesis que: (1) algunos de los géneros de fitonematodos asociados a tomate de árbol, lulo y zanahoria corresponden a los mencionados en literatura, como también la sintomatología observada a nivel aéreo y en raíces; (2) los datos poblacionales, ecológicos y parasíticos de los géneros de fitonematodos asociados a dichos cultivos, serán específicos a los sistemas de producción de las zonas seleccionada para el estudio. Por tanto, los objetivos fueron: (1) identificar los géneros de fitonematodos asociados a tomate de árbol, lulo y zanahoria en municipios de mayor producción en el departamento de Boyacá y describir los síntomas inducidos por estos parásitos. (2) determinar niveles poblacionales, ecológicos y parasíticos de los diferentes géneros de fitonematodos asociados a estos cultivos.
Métodos y materiales
Durante el primer semestre de 2014 en el Departamento de Boyacá, Colombia, se seleccionó el municipio de Buenavista como zona productora representativa de tomate de árbol y lulo, y el municipio de Ventaquemada para zanahoria. En campo se realizaron muestreos de reconocimiento para determinar tanto géneros como datos poblacionales de fitonematodos asociados a dichos cultivos. Se recolectaron 26 muestras en total, 16 correspondieron a tomate de árbol, ocho a lulo y dos a lotes con otros hospederos (granadilla y pastos) que fueron analizados con los datos de lulo, ya que los lotes fueron destinados para establecer dicho frutal. Para zanahoria se recolectaron 10 muestras en total (Tabla 1).
Las áreas de los lotes correspondieron a 1 o 2 fanegadas (6400 m2) donde se tomaron muestras en recorridos en ‘zig–zag’ y de ellas 10 submuestras al azar que conformaron una muestra compuesta de 500 g de suelo rizosferico y, aproximadamente, 20 g de tejido de raíces. Las muestras se conservaron en bolsas plástica transparentes, se rotularon y fueron llevadas al Laboratorio de Diagnóstico Vegetal (La Casona) de la Universidad Pedagógica y Tecnológica de Colombia (UPTC–Tunja), donde se almacenaron a 10 °C hasta su procesamiento. Igualmente, se diligenciaron formularios para obtener información complementaria de los sistemas de producción (localidad, ubicación del lote, edad del cultivo, prácticas y productos aplicados al cultivo durante su desarrollo), que permitieran interpretar los resultados obtenidos en laboratorio.
En el estudio se siguieron las metodologías estandarizadas por Varón de Agudelo y Castillo (2001). Para la extracción de fitonematodos del suelo se siguió el método de flotación–decantación. La identificación a nivel de género se hizo con base en observaciones en microscopio, con ayuda de claves taxonómicas (Volcy, 1998; Cepeda, 1996; Nickle, 1991; Luc et al., 1990). Para la cuantificación de nematodos se realizaron cinco lecturas en alícuotas de 1 ml, la población se expresó con base en el número total de individuos presentes en muestras de 100 cc de suelo. La extracción de nematodos de raíces se hizo por el método de maceración–filtración y el reconocimiento y cuantificación se hicieron de manera similar a como se hizo para las muestras de suelo; la población se expresó con base en el número total de individuos presentes en 1 g de raíces secas.
Los datos poblacionales se interpretaron siguiendo la metodología de Volcy (1998) y los resultados de las muestras de raíces se analizaron con base en el número de poblaciones máximas y promedias de cada género. Para el suelo rizosferico, además, se analizaron parámetros ecológicos y parasíticos como: frecuencia absoluta (F.Ab.) y relativa (F.R.); densidad absoluta (D.Ab.) y relativa (D.R.); valor de prominencia (V.P.).
Para el reconocimiento y descripción de síntomas se siguió la metodología de FAO (1985) con toma de fotografías y comparaciones con claves taxonómicas, guías prácticas y artículos que describen los problemas causados por fitonematodos de forma general y específica para cada cultivo (Múnera 2010; Lozada et al., 2002; Varón de Agudelo y Castillo, 2001; Huertas et al., 1999; Corrales et al., 1999; Volcy, 1998; Cepeda, 1996; Nickle, 1991; Luc et al., 1990; FAO, 1985).
Resultados y discusión
Géneros de fitonematodos en suelo y raíces de frutales solanáceas
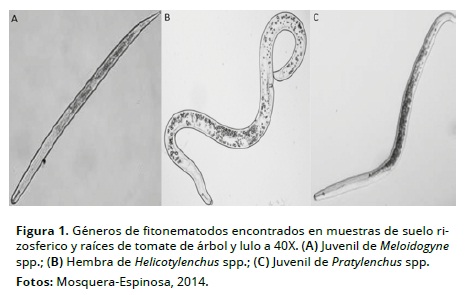
Tanto en suelo como en raíces fueron encontrados los géneros Meloidogyne, Helicotylenchus y Pratylenchus (Tabla 2, Figura 1), lo que coincide con los estudios publicados para Colombia en los departamentos con mayor producción comercial de tomate de árbol (García et al., 2004; Lozada et al., 2002; Múnera y Navarro, 2002) y lulo (García et al., 2007; García et al., 2004; Múnera y Navarro, 2002; Corrales et al., 1999; Huertas et al., 1999; Forero, 1999; Gómez, 1997). En agroecosistemas de Nueva Zelanda las pérdidas en tomate de árbol como frutal exótico se deben a Meloidogyne incognita, sin desconocer la posible participación patológica del género Pratylenchus con la especie P. crenatus (Knight, 2001). En Colombia la información que existe de identificación hasta especie corresponde al género Meloidogyne, con M. incognita, M. arenaria, M. exigua y M. hapla (García et al., 2004; Lozada et al., 2002; Corrales et al., 1999). En el presente estudio no se realizaron cortes perineales para la identificación de especies de Meliodogyne, porque la cantidad de hembras encontradas no fue suficiente para cumplir con el número de observaciones requeridas y obtener información confiable. En consecuencia el reporte se hizo sólo hasta género e igual condición ocurrió para zanahoria.
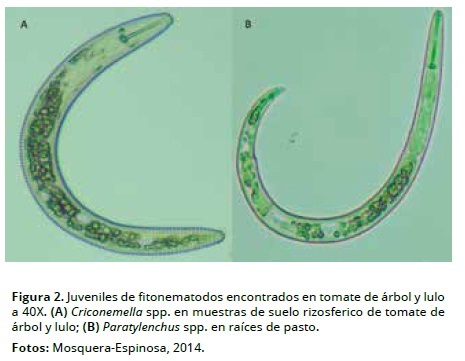
En suelo rizosferico en cultivos de tomate de árbol, lulo y pastos se encontró Criconemella (Sinonimia: Mesocriconema), y sólo en raíces de pasto se presentó Paratylenchus, ambos géneros con bajos niveles poblacionales y frecuencia de aparición (Tabla 2, Figura 2). El rango de hospederos de Paratylenchus es amplio, entre los que se mencionan ornamentales, pastos y frutales, y estudios detallados de parasitismo e infección en piña (Linford et al., 1949). Sin embargo, de estos dos géneros no existe información previa para Colombia de la actividad fitoparasítica en tejido radical de solanáceas en condiciones de invernadero o campo.
Géneros de fitonematodos en suelo y raíces de zanahoria
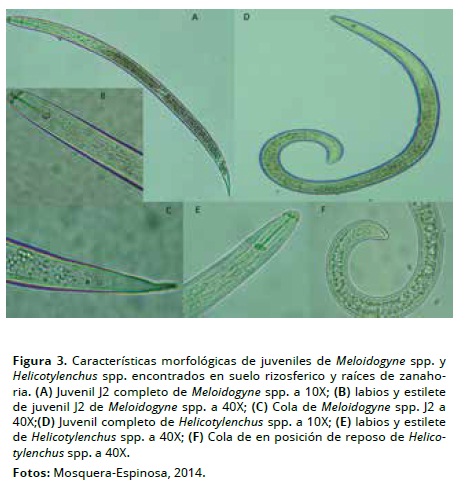
En las muestras recolectadas de suelo rizosferico y raíces de zanahoria, sólo se encontraron los géneros Meloidogyne y Helicotylenchus (Tabla 3, Figura 3). Esta información coincide con los reportes mundiales que mencionan a Meloidogyne como el fitonematodo que causa mayor limitación económica en este cultivo (Gaviola 2013; López & Azofeifa 1981). Aún cuando en el municipio de Ventaquemada, la zanahoria se cultiva en rotación con papa y cebolla, no se encontró en suelo y/o tejidos el género Ditylenchus como tampoco sintomatología inducida por éste, lo que contrasta con los resultados obtenidos por Gaviola (2013) y Senasica (2013).
Parámetros ecológicos y parasíticos de los fitonematodos en frutales solanáceas
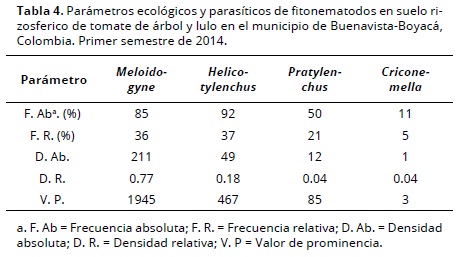
Los valores más altos de poblaciones máximas y promedias en 100 cc de suelo la presentó Meloidogyne con 1724 y 333 individuos en tomate de árbol, seguido de Helicotylenchus con población máxima de 288 y 216 individuos en lulo y tomate de árbol, respectivamente. Por último se encontró Pratylenchus al presentar población máxima de 120 individuos, nuevamente en tomate de árbol (Tabla 2). Este patrón se conservó al analizar el grado de infestación de los diferentes géneros en suelo de Buenavista (D.Ab.), así como entre géneros (D.R.). Sin embargo, el mayor rango de dispersión de géneros y entre géneros (F.Ab. y F.R.) lo mostró Helicotylenchus (Tabla 4). En el caso de raíces secas, los valores más altos de población máxima y promedia los presentó Meloidogyne con 4880 y 833 individuos/g en lulo, y en tomate de árbol con 2800 y 508 individuos/g. En tomate de árbol, Helicotylenchus y Pratylenchus presentaron igual valor de población máxima (400 individuos/g), pero fue mayor la población promedia de Helicotylenchus (94 individuos/g) (Tabla 2).
Los datos obtenidos para Boyacá en tomate de árbol coinciden con los de Lozada et al. (2002) para el Valle del Cauca, ya que registran los mismos géneros de fitonematodos en suelo y raíces. No así los valores de población máxima y promedia, ya que en el presente estudio las poblaciones para cada género fueron más altas. Aún cuando la literatura para Colombia menciona los géneros de fitonematodos asociados con este cultivo, no existen estudios que comparen poblaciones para saber si éstas son altas o bajas, o si corresponden a un umbral económico (Múnera & Navarro 2002; Lozada et al. 2002). Mientras que en Ecuador, Moreta (2010) encontró poblaciones máximas de Meloidogyne en suelo de 12,800 individuos/100cc y en raíces secas 16,850 individuos/g. En dicho estudio, las poblaciones en suelo son siete veces más altas y en raíces tres veces más alta, comparado con lo registrado en Boyacá en el primer semestre de 2014. Teniendo en cuenta que el mismo autor menciona como umbral de daño económico 400 individuos/100 cc en suelo, lo anterior indica que en el municipio de Buenavista no se alcanzaron poblaciones promedias para considerar dicho umbral, ya que el valor máximo encontrado fue de 333 individuos/100 cc en suelo (Tabla 2). Para el caso de lulo, los datos presentados por Gómez (1997) en Tolima y Huila muestran a Helicotylenchus como el segundo género de importancia después de Meloidogyne, coincidiendo con lo aquí encontrado (Tabla 2). Igualmente, éste género presentó el mayor rango de dispersión (F.R = 37%, Tabla 4), lo cual lo ubica como un posible facilitador para la entrada de otros patógenos del suelo, ya que los síntomas observados corresponden a complejos patológicos tal como ocurre con Meloidogyne (Huertas et al. 1999; Gómez 1997).
Al analizar la población máxima y promedia de Meloidogyne en raíces de solanáceas (Tabla 2), el valor de prominencia (V.P = 1945, Tabla 4) y la presencia de agallas en raíces en diferentes estados de desarrollo, indican la alta susceptibilidad de los hospederos al fitonematodo, en especial lulo. En condiciones de invernadero este frutal ha sido considerado efectivo para el desarrollo de especies de Meloidogyne, pues en evaluaciones con M. arenaria indujo agallas, presencia de sus estados juveniles y aumento de población en suelo y raíces (Rodríguez–Kabana & King 1987). A partir de datos obtenidos bajo condiciones controladas, es posible inferir que igual respuesta puede ocurrir en campo (Múnera y Navarro 2002).
Parámetros ecológicos y parasíticos de los fitonematodos en zanahoria
En suelo rizosferico, el género Meloidogyne presentó los mayores valores de población máxima y promedia siendo, respectivamente, de 2304 y 560 individuos/100 cc (Tabla 3); así como el mayor grado de infestación (D.Ab. = 448 y D.R.= 7.5, Tabla 5). En el caso de Helicotylenchus la población máxima y promedia, respectivamente, fue de 640 y 153 individuos/100 cc y el mayor rango de dispersión (F.Ab. = 100% y F.R. = 56%, Tabla 5). Algunos países productores de zanahoria tienen establecido valores poblacionales de Meloidogyne en suelo y consideran umbrales de tolerancia para el establecimiento del cultivo: Holanda, por ejemplo, admite 30 individuos J2/100 cc de suelo; Canadá, nueve individuos J2/100 cc de suelo; y Argentina, 100 individuos J2/100 cc (Gaviola, 2013). Cuando se relaciona el valor más alto de umbral de tolerancia mencionado en la literatura con la población promedia de Meloidogyne en suelos del presente estudio, se encontró en Ventaquemada una población seis veces más alta. Los datos obtenidos indicaron la presencia y actividad de Meloidogyne en cultivos de zanahoria de este municipio, sin embargo, en Colombia tampoco existen estudios sobre nivel poblacional de fitonematodos para determinar umbral de daño económico (Múnera y Navarro, 2002; Lozada et al., 2002).
En raíces secas nuevamente Meloidogyne registró la mayor población máxima y promedia, con 3188 y 1523 individuos/g, respectivamente (Tabla 3), asimismo el mayor registro de prominencia, lo que indica la susceptibilidad del hospedero (V.P = 4007, Tabla 5); además de presentar agallas en pelos radicales. Lo anterior confirma el problema potencial en zanahoria a causa de este género para los sistemas de producción en Boyacá, ya que la población admitida en tejido seco de raíces, según lo registrado en Argentina, son 17 individuos/g (Gaviola, 2013). Los datos del presente estudio indican que la población fue 89 veces más alta, y al igual que para suelo, no se ha establecido umbral de dañó económico para este cultivo en Colombia.
Sintomatología por daños de fitonematodos en frutales solanáceas
Síntomas en tomate de árbol (C. betacea (Cav.) Sendtn.). Los síntomas observados en los sistemas de producción de tomate de árbol en Buenavista– Boyacá, fueron principalmente: hojas cloróticas (Figura 4A) (Forero, 2001), defoliación paulatina y marchitez generalizada de la planta (Figura 4B). Lo anterior se relaciona con la reducción en la absorción de nutrientes por el deterioro del sistema radical inducido por las agallas que provoca Meloidogyne spp. (Lozada et al., 2002; Múnera y Navarro, 2002) (Figura 4C y 4D).
Síntomas en lulo (S. quitoense Lam.). Los síntomas en lulo correspondieron a plantas con amarillamiento de hojas y marchitez generalizada (Figura 5a) (ICA, 2011; Huertas et al., 1999; Forero, 1999). En un estado avanzado del ataque se presentó pérdida total de hojas y muerte de la planta (Figura 5B), posiblemente por la entrada adicional de patógenos del suelo como lo mencionan para este cultivo Huertas et al. (1990) y Gómez (1997). También se observó formación de agallas y pérdida total del sistema radical a causa del ataque por Meloidogyne spp. (Figuras 5C y 5D).
Sintomatología por daños de fitonematodos en zanahoria
Los síntomas observados fueron a nivel de pelos radicales con presencia de agallas (Figura 6A), perdida de los mismos y en ocasiones, desarrollo anormal de la parte terminal de la raíz induciendo bifurcación (Figura 6B). Lo anterior coincide con lo mencionado por Gaviola (2013) al describir la sintomatología provocada por Meloidogyne spp. en el sistema radical de zanahoria. No obstante, se debe investigar más sobre las características físicas y la composición química del suelo, ya que estas propiedades pueden estar contribuyendo a la alteración morfológica y fisiológica de la raíz.
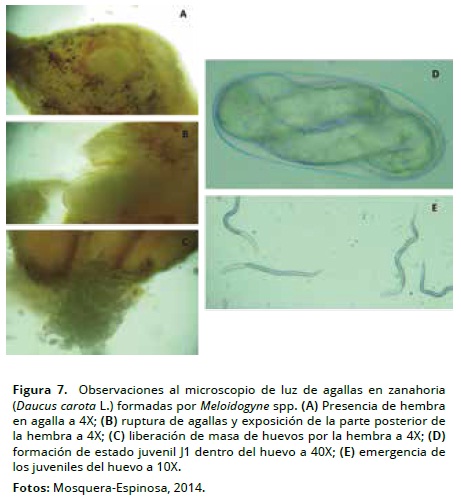
En la parte área de la planta no se presentaron síntomas que se pudieran relacionar con fitonematodos (Figura 6C), ya que en general las plantas presentaron normal desarrollo. Sin embargo, los síntomas del ataque por Meloidogyne para zanahoria en la parte aérea se describen como reducción del crecimiento, amarillamiento en hojas y marchitez generalizada de la planta (Gaviola, 2013; Anwar y McKenry, 2010). Sólo fue posible determinar la presencia del fitonematodo una vez extraía la raíz del suelo y observar las agallas inducidas por el proceso de alimentación. En laboratorio bajo el microscopio de luz a 4X se evidenció en agallas la presencia de hembras, masas de huevos, juveniles J1 en formación y juveniles J2 recién emergidos de huevos (Figura 7).
Con base a los parámetros poblacionales, ecológicos y parasíticos, el género Meloidogyne fue el fitonematodo de mayor importancia para los tres cultivos estudiados, lo cual implica que se generen complejos patológicos impidiendo que se observen las lesiones y síntomas inducidos por los otros géneros de fitonematodos que también se presentaron (Lozada et al., 2002; Vargas et al., 2002; Huertas et al., 1999; Gómez, 1997).
Manejo integrado para fitonematodos en tomate de árbol, lulo y zanahoria.
Antes de implementar cualquier estrategia de manejo se debe generar información complementaria que permita orientar exitosamente las prácticas de control, para lo cual es determinante: 1) conocer la patogénesis (descripción de síntomas y envío de muestra a laboratorio para análisis); 2) monitoreo del agente causante de la enfermedad (uso de escalas de incidencia y severidad); 3) determinar umbral de daño económico (revisión de literatura, establecer dicho umbral y evaluar para el cultivo de interés).
- Evitar sembrar en terrenos donde previamente existieron cultivos de tomate de árbol, lulo y zanahoria, pues pueden permanecer géneros y poblaciones de fitonematodos limitantes para el nuevo cultivo.
- De tener que utilizar el terreno, dejarlo en barbecho de 3 a 6 meses. Posteriormente realizar labranza para exponer el suelo a radiación solar, hacer minino 2 volteos a intervalos de 4 semanas y cuantificar la población de fitonematodos presente antes de la siembra.
- No realizar asociación con plantas de las mismas familias del cultivo (Apiaceae y Solanaceae) o con cultivos que sean hospederos de los géneros de fitonematodos mencionados en este estudio.
- Adquirir plántulas o semillas certificadas ante el ICA, para evitar presencia de patógenos y fitonematodos que limiten la producción.
- De establecer su propio vivero de frutales, hacer solarización del suelo, aplicar productos microbiológicos (Beauveria spp., Paecilomyces spp., Lecanicillium spp.). También incluir hongos micorrízicos en esta etapa y en los sitios definitivos al momento de la siembra.
- De utilizar nematicidas no combinarlo con los productos microbiológicos, pues inhibe su acción. Para el manejo y aplicación de nematicidas seguir recomendaciones técnicas.
- Realizar aplicaciones periódicas en “drench” y en la zona de plateo, hongos como Beauveria spp., Lecanicillium spp., Paecilomyces spp., entre otros.
- En el plan nutricional del cultivo, incluir materia orgánica bien compostada para evitar llevar hongos patógenos y fitonematodos.
- Realizar control de arvenses, por ser hospederos alternos de fitonematodos.
- Intercalar en el cultivo plantas como ruda, caléndula, crotalaria y tagetes que controlan poblaciones de fitonematodos.
- Realizar monitoreo permanente en el sistema de raíces, para identificar presencia de agallas o cambio de coloración que orienten a considerar la presencia de fitonematodos.
- Eliminar y quemar las plantas con presencia de agallas o deterioro de raíces en el mismo sitio donde fueron encontradas, sean frutales o arvenses.
Modelo para estimar umbral de daño económico de fitonematodos en tomate de árbol, lulo y zanahoria.
El modelo para determinar el umbral de daño económico por fitonematodos, se basa en realizar inoculaciones controladas utilizando un hospedero susceptible y diferentes densidades de población en un bioensayo compuesto por varios tratamientos (densidades de población) comparados con un testigo absoluto (sin nematodos).
- Establecer bajo condiciones controladas un semillero del material comercial de los hospederos estudiados (tomate de árbol, lulo y zanahoria), siguiendo las indicaciones descritas anteriormente para el manejo del suelo. Se deben sembrar varias semillas por sitio para conservar finalmente las plantas más vigorosas y sanas.
- Conservar las condiciones controladas para trasplantar en bolsas de polietileno de capacidad de 4 kg de suelo una planta, que se utilizará como unidad experimental. En el caso de los frutales solanáceos, una vez presenten entre 15 a 20cm de altura se realiza la inoculación de los fitonematodos. Se debe disponer de la cantidad necesaria de unidades experimentales que permita establecer un diseño completamente al azar, con 4 repeticiones como mínimo. Además las bolsas se deben colocar sobre mesas o tarimas para evitar el contacto directo con el suelo, ya que se pueden contaminar con otros nematodos o microorganismos fitopatógenos.
- Las densidades de población de fitonematodos a utilizar (número de tratamientos) dependen de los registros promedios, mínimos y máximos encontrados en el reconocimiento hecho previamente en campo. En Meloidogyne se evalúa concentraciones de 0, 2000, 5000 y hasta de 10.000 huevos/planta suspendidos en 5 ml de agua (Volcy 1998).
- La consecución de inóculo se hace a partir de cultivos en campo o de hospederos alternos cultivados en invernadero. El inóculo que se emplea del género Meloidogyne son huevos, para los otros géneros serían sus estados infectivos. La descripción metodológica en detalle se presentan en: Lozada et al. (2002); Varón de Agudelo y Castillo (2001); Corrales et al. (1999); Volcy (1998).
- Desarrollar manejo agronómico según los requerimientos del cultivo en esta etapa de desarrollo (vivero), que se enmarca en: riego, fertilización, control fitosanitario de otros fitopatógenos y las prácticas que requiera el cultivo para su normal desarrollo.
- Las variables a evaluar se relacionan con el desarrollo de la infección de los fitonematodos sobre el hospedero, que serían incidencia y severidad (FAO 1985); para Meloidogyne se utiliza el índice de nudosidad propuesto por Taylor y Sasser (1983). Para medir el efecto del nematodo sobre la planta se realiza un muestreo destructivo 60 días después de la inoculación y se registran variables de crecimiento del hospedero como: altura, número de hojas, peso fresco y seco de raíces y hojas (Lozada et al. 2002; Varón de Agudelo y Castillo 2001; Corrales et al. 1999; Volcy 1998).
- Los datos obtenidos para cada género se analizan estadísticamente, para determinar el efecto de las diferentes concentraciones de inóculo sobre el desarrollo de los hospederos y sus alteraciones fisiológicas.
- Finalmente se debe cumplir con los postulados de Koch, para lo cual, se cuantifica la población final del fitonematodo tanto en suelo como en raíces mediante la extracción de los nematodos por los métodos recomendados para cada caso (Varón de Agudelo & Castillo 2001).
Conclusiones
- En los cultivos de tomate de árbol y lulo en Buenavista–Boyacá, Colombia, se identificaron cinco géneros de fitonematodos: Meloidogyne, Helicotylenchus, Pratylenchus, Criconemella y Paratylenchus. Los dos últimos no habían sido reportados en Colombia para estas solanáceas.
- Los valores de poblaciones máximas y promedias fueron altas comparadas con los encontrados en otros estudios. Sin embargo, no existe un umbral de daño económico para Colombia en estos cultivos que permita interpretar si dichas poblaciones son limitantes.
- Con base en parámetros poblacionales, ecológicos y parasíticos, Meloidogyne fue el fitonematodo de mayor importancia para tomate de árbol y lulo.
- Los datos poblacionales más altos de Meloidogyne se presentaron en suelo y raíces de tomate de árbol, así como en raíces de lulo; siendo éste último el hospedero más susceptible.
- La afección por fitonematodos en tomate de árbol y lulo se evidenció tanto en la parte aérea como en raíces; en éstas últimas, por la presencia de agallas inducidas por Meloidogyne.
- En sistemas de producción de zanahoria en Ventaquemada–Boyacá se identificaron sólo los géneros Meloidogyne y Helicotylenchus.
- Los valores más altos de población máxima y promedia, los presentó Meloidogyne. Sin embargo, no se ha establecido para Colombia un umbral de daño económico en zanahoria para considerar las poblaciones encontradas como limitantes en la producción.
- Los síntomas causados por fitonematodos en zanahoria sólo se observaron en raíces, con la presencia de agallas inducidas por Meloidogyne.
- Fue posible demostrar que en Boyacá existen algunos de los géneros de fitonematodos mencionados en la literatura para los cultivos en estudio, al igual que algunos de los síntomas inducidos por estos fitoparásitos. El comportamiento poblacional, ecológico y parásito de los fitonematodos encontrados están relacionados con las prácticas agronómicas y de manejo que se implementan en los sistemas de producción visitados en el departamento de Boyacá.
Agradecimientos
A la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia (UPTC) por la financiación para realizar este estudio. Al Laboratorio de Diagnóstico Vegetal de la UPTC por facilitar sus instalaciones para el procesamiento de muestras. A los agricultores de tomate de árbol y lulo del municipio de Buenavista, así como los productores de zanahoria en Ventaquemada, Boyacá, por permitir tomar muestras en sus cultivos. A los Ingenieros Agrónomos Cosme Rodríguez y Adriana González, al Médico Veterinario Néstor Andrés Fonseca por realizar los acercamientos con los agricultores y la colaboración incondicional durante el desarrollo del trabajo. Al estudiante de Ingeniería Agronómica de la UPTC Yonatan Matallana por la disposición a colaborar y aprender en el trabajo de campo. A la Dra. Francia Varón de Agudelo y al Dr. Paul Bayman por sus correcciones y valiosos aportes.
Referencias
Agrios, G. N. 2002. Fitopatología, 2a edición. Editorial Limusa, S.A., Traducción de Plant Pathology, México. 830 p. [ Links ]
Anwar, S. A. y McKenry, M. V. 2010. Incidence and reproduction of Meloidogyne incognita on vegetable crop genotypes. Pakistan J. Zool. 42(2):135 – 141. [ Links ]
Cepeda, M. 1996. Nematología Agrícola. México, Trillas. UAAAN. 305 p. [ Links ]
Corrales, S. P.; Varón de Agudelo, F.; y Barrera, N. 1999. Reconocimiento de nematodos y efecto parasítico de Meloidogyne spp. en el cultivo del lulo Solanum quitoense Lam. Acta Agronómica. 49(3–4):43 – 47. [ Links ]
FAO. 1985. Manual para patólogos vegetales. CAB. 2da edición, FAO para América Latina y El Caribe, Chile. 438 p. [ Links ]
Fontagro. 2006. Productores de lulo y mora competitivos mediante selección participativa de clones élite, manejo integrado del cultivo y fortalecimiento de cadenas de valor. Informe avance de investigación. 77 p. [ Links ]
Forero, T. 2001. Manejo integrado del cultivo de tomate de árbol. Centro de investigación Nataima. Corporación Colombiana de Investigación Agropecuaria (Corpoica). 120 p. [ Links ]
Forero, T. 1999. Manejo integrado del cultivo del lulo. Centro de investigación Nataima. Corporación Colombiana de Investigación Agropecuaria (Corpoica). 96 p. [ Links ]
García, J.; Floriano, J.; Vera, L.; Segura, J. 2007. Enfermedades y plagas del cultivo de lulo (Solanum quitoense) en el departamento del Huila. Centro de investigación Nataima, Corpoica. 18 p. Disponible En: http://conectarural.org/sitio/sites/default/files/documentos/Enfermedades%20y%20plagas%20del%20cultivo%20de%20lulo.pdf [ Links ]
García, F.; Obando, J.; y Betancourt, C. 2004. Reconocimiento de especies de Meloidogyne en tomate de árbol (Solanum betacea) y lulo (Solanum quitoense) en la zona norte del departamento de Nariño. Rev. Cien. Agric. 11: 1–12. [ Links ]
Gaviola, J.C{< . 2013. Manual de producción de zanahoria. Capitulo 6. Plagas de la zanahoria y su manejo. INTA, Argentina. 152p. Disponible En: http://inta.gob.ar/documentos/manual–de–produccion–de–zanahoria/at_multi_download/file/INTA%20–%20Cap%206.%20Plagas%20de%20la%20zanahoria%20y%20su%20manejo.pdf [ Links ]
Gómez, L.E. 1997. Enfermedades del cultivo de lulo en Tolima y Huila: Guía de reconocimiento y control. Centro de investigación Nataima. Corpoica. 35 p. Disponible En:http://corpomail.corpoica.org.co/BACFILES/BACDIGITAL/24657/24657.pdf [ Links ]
Huertas, C.; Salazar, F.; Varón de Agudelo, F. 1999. Manejo integrado del cultivo del lulo (Solanum quitoense Lam) en el Valle del Cauca. Boletín Técnico, ICA–Palmira. 22 p. [ Links ]
ICA. 2011. Manejo fitosanitario del cultivo de lulo (Solanum quitoense Lam). Medidas para la temporada invernal. 20 p. Disponible En: http://www.ica.gov.co/getattachment/de9f2f66–898a–45b8–848d–0c49a23ca70c/manejo–fitosanitario–del–cultivo–de–lulo–(solanum.aspx [ Links ]
Knight, K. W. L. 2001. Plant parasitic nematodes associated with six subtropical crops in New Zealand, N. Z. J. Crop Hortic. Sci. 29 (4):267 – 275. [ Links ]
Linford, M.; Oliveira, J.; y Ishii, M. 1949. Paratylenchus minutes, n. sp., a Nematode Parasitic on Roots. Pacific Sci. 3:111 – 119. [ Links ]
López, R. y Azofeifa, J. 1981. Reconocimiento de nematodos fitoparásitos asociados con hortalizas en Costa Rica. Agron. Costarric. 5:29 – 35. [ Links ]
Lozada, S.; Varón de Agudelo, F.; Gómez, E. 2002. Nematodos asociados al tomate de árbol (Solanum betacea) en el Valle del Cauca. Fitop. Col. 26(2):93 – 98. [ Links ]
Luc, M.; Sikora, R. A.; y Bridge, J. 1990. Plant parasitic nematodes in subtropical and tropical agricultura. CAB International Institute of Parasitology, Reino Unido. 877 p. [ Links ]
Moreta, G. 2010. Determinación de la presencia de nematodos fitoparásitos en plantaciones de tomate de árbol (Cyphomandra betacea) en las provincias de Imbabura y Pichincha. Tesis Doctoral. Universidad Técnica de Babohoyo, Ecuador. Facultad de Ciencia Agropecuarias. Escuela de Ingeniería Agronómica. 72 p. disponible En: http://www.docstoc.com/docs/132238986/Trabajo de tesis final de tomate de arbol [ Links ]
Múnera, G. 2010. Nematodos fitoparásitos asociados con mora (Rubus glaucus Benth.) en cinco departamentos de Colombia. VII seminario internacional de frutas tropicales, agroindustria e innovación. Memorias. p. 83. Medellín, Colombia, 22 y 23 de julio. Disponible En: http://www.aoxlab.com/wp–content/uploads/2009–2010/Memorias–Seminario–Frutas–Tropicales–Actividad–Antioxidante–Y–Efecto–Cardioprotector–De–Las–Bebidas.pdf [ Links ]
Múnera, G. y Navarro, R. 2002. Nematodos asociados a frutales de clima frio. IV Seminario Nacional de Frutales de Clima Frio Moderado. Memorias. p. 5. Medellín, Colombia, 20 al 22 de noviembre. [ Links ]
Nickle, W. R. 1991. Manual of Agricultural Nematology. United States Department of Agriculture. Maryland. 1035 p. [ Links ]
PFN (Plan Frutícola Nacional). 2006. Desarrollo de la Fruticultura en Boyacá. 68 p. [ Links ]
Rodríguez–Kábana, R. y King, P. S. 1987. Passion fruit naranjilla as hots for soybean nematodes. Nematropica 17:171 – 177. [ Links ]
Ron, L.; Revelo, J. 2010. Manejo de Meloidogyne incognita en naranjilla (Solanum quitoense) y tomate de árbol (Solanum betaceum) con el uso de porta injertos resistentes. Nematrópica 40 (2): 151. [ Links ]
Senasica. 2013. Nematodo de la pudrición de la papa (Ditylenchus destructor, Thorne, 1945). Dirección General de Sanidad Vegetal – Sistema Nacional de Vigilancia Epidemiológica Fitosanitaria (Sinavef). Centro Nacional de Referencia Fitosanitaria. México, DF. Ficha Técnica No17. 23 p. Disponible En: http://www.cesaveson.com/files/ea9e402b567cfc1a2fbb3bd5980a44b2.pdf [ Links ]
Tamayo, P. 2001. Meloidogyne incognita en granadilla. ASCOLFI INFORMA 27: 18–19. [ Links ]
Taylor A.; Sasser, J. 1983. Biología e identificación y control de nematodos del nudo de la raíz. Ed. Universidad Carolina del Norte. EE.UU. p. 111. [ Links ]
Vargas, Z.; Varón de Agudelo, F.; y Gómez, E. 2002. Nematodos asociados a la granadilla (Passiflora ligularis Juss) en el Valle del Cauca. Fitop. Col. 26(2): 87 – 92. [ Links ]
Varón de Agudelo, F.; y Castillo, G. 2001. Seminario – Taller sobre identificación de nematodos de importancia agrícola. ICA–Palmira. Asociación Colombiana de Fitopatología (Ascolfi). 25 p. [ Links ]
Volcy, Ch. 1998. Nematodos. Diversidad y parasitismo en plantas. Tomo 2. Universidad Nacional de Colombia, sede Medellín. 182 p. [ Links ]