Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.65 no.2 Palmira Apr./June 2016
https://doi.org/10.15446/acag.v65n2.43397
http://dx.doi.org/10.15446/acag.v65n2.43397
Alterações físicas, fisiológicas e bioquímicas durante o desenvolvimento de sementes de sorgo de diferentes concentrações de tanino
Physical, physiological and biochemical changes during the development of sorghum seeds with different concentrations of tannin
Tanismare Tatiana de Almeida1*, João Almir Oliveira 1, Sttela Dellyzete Veiga Franco da Rosa 2, Adriano Alves da Silva 1, Andrea dos Santos Oliveira1 e Diego de Sousa Pereira1
1 Universidade Federal de Lavras, Departamento de Agricultura, Lavras, Brasil; 2 EMBRAPA, Empresa Brasileira de Pesquisa Agropecuária, Lavras, MG, Brasil. *Autor correspondente: tanismaresilva@gmail.com
Rec.: 10.05.2014 Acep.: 15.09.2014
Resumo
Com o interesse de verificar a relação entre a concentração de tanino e a dormência das sementes, objetivou-se nessa pesquisa, avaliar as alterações bioquímicas, físicas e fisiológicas ocorridas durante o desenvolvimento de sementes de sorgo com diferentes concentrações de tanino. Foram utilizadas sementes dos cultivares BR 305 e BR 310, colhidas em sete estádios de desenvolvimento (100, 103, 107, 113, 119, 121, 127 dias após a semeadura), conforme o teor de água. As sementes colhidas em cada estádio foram divididas em dois lotes, um submetido à secagem a 35 °C, até umidade de 12% e o outro lote sem secagem. A qualidade das sementes foi avaliada pelos testes de germinação e perfis enzimáticos. Foi determinada, ainda, a concentração de tanino nas sementes em cada estádio de desenvolvimento. Observa-se efeito benéfico da secagem na germinação, em sementes com maior teor de água. Nas sementes avaliadas sem secagem, a porcentagem de dormência é maior quando comparada à das sementes submetidas à secagem artificial. Para o cultivar BR 305, foi observado maiores concentrações de tanino nas sementes secas. O mesmo ocorreu para o cultivar BR 310, em sementes colhidas aos 100, 103 e 119 dias após semeadura. Para os perfis enzimáticos, foram observadas maiores atividades das enzimas álcool desidrogenase, malato desidrogenase, catalase, α-amilase e esterase, em sementes da cultivar com baixo teor de tanino BR 310 e após a secagem.
Palavras-chave: Sorghum bicolor, germinação, colheita, maturação.
Abstract
With the interest of verifying the relationship among tannin concentration and seed dormancy, it was intended, in this research, to evaluate the biochemical, physical and physiological alterations occurred during the development of sorghum seeds with different concentrations of tannin. Seeds of cultivars BR 305 and BR 310, collected in seven development stages (100, 103, 107, 113, 119, 121, 127 days after sowing) according to water content. The seeds collected in each stage were divided into two lots, one submitted to drying at 35C to the moisture of 12% and the other lot without drying. The quality of seeds was evaluated by germination and enzyme profile tests. In addition, the tannin concentration in the seed in each development stage was measured. Beneficial effects of drying on germination of higher water seeds are found. In the seeds evaluated without drying, the percentage of dormancy is greater when compared to that of seeds submitted to artificial drying. For cultivar BR 305, drying favored tannin concentration in seeds collected in different development stages. The same occurred for cultivar BR 310 in seeds collected at 100, 103 and 119 days after sowing. For the enzyme profiles, increased activities of the enzyme alcohol dehydrogenase, malato dehydrogenase, catalase, α-amilase and catalase and esterase were observed in the seeds of the low tannin cultivar BR 310 and after drying.
Key words: Sorghum bicolor, germination, harvest, maturation.
Introdução
O desenvolvimento das sementes pode ser acompanhado por meio de detecção de alterações, tais como tamanho, teor de água, conteúdo de massa seca, germinação e vigor. Em estudos realizados durante a maturação de sementes de diversas espécies, a massa de matéria seca tem sido considerada como o melhor e mais seguro indicativo de que as sementes atingiram a maturidade fisiológica (Dias, 2001); Vanderlip e Reeves (1972), relataram que após 70 dias a partir da floração, no estádio sete, o grão de sorgo é considerado leitoso, com metade da matéria seca. No estádio oito, três quartos da massa seca da semente já foram acumuladas, e no estádio nove, caracterizado pelo máximo acúmulo de massa seca, com teor de água entre 25% a 35% é considerado o ponto de maturidade fisiológica desta espécie.
Tillmann, Peters, Mello e Silva, (1985), observaram estreita relação entre a perda de água e o acréscimo de massa seca nas sementes, para as três porções da panícula em sorgo BRS 501, durante o processo de maturação. Verificaram, ainda, que o máximo de germinação e matéria seca ocorreu aos 47 dias após a antese, na porção apical e em torno de 54 dias após a antese, para a porção média e basal, em decorrência da desuniformidade da maturidade fisiológica das sementes na panícula. Durante o processo de secagem, na fase final da maturação, ocorre a síntese de proteínas resistentes ao calor (Bewley e Black, 1994), cuja detecção e acúmulo têm sido correlacionados com a aquisição de tolerância à dessecação em várias espécies (Kermode, 1997). No entanto, a secagem pode causar danos nos sistemas de membranas, e o comprometimento da estrutura celular facilita o contato da enzima polifenoloxidase, exclusiva de plastídeos, com os compostos fenólicos, armazenados preferencialmente nos vacúolos, tornando inevitável a oxidação de fenóis, os quais convertidos à quinonas podem reagir com proteínas, inclusive a própria polifenoloxidase.
Além das alterações enzimáticas, com a redução do teor de água, as sementes de sorgo podem ser induzidas à dormência secundária com o avanço da secagem sob temperatura de 46 °C - 48 °C. Segundo Marcos Filho (2005), a inibição da germinação pode ser provocada por substâncias presentes na cobertura ou na parte interna das sementes, as quais podem bloquear o metabolismo preparatório para a geminação ou impedir o livre acesso do oxigênio ao embrião ou a liberação de gás carbônico. São conhecidos vários tipos de inibidores da germinação, como taninos, ácidos fenólicos, aldeídos e alcalóides.
O tanino em grãos de sorgo depende do genótipo, e pode estar presente ou ausente no grão, sendo altamente correlacionado com a germinação das sementes, no entanto, a dormência secundária não perdura por mais de três meses. E, como as sementes de sorgo tendem a superar a dormência com o armazenamento, não se sabe realmente se isso é devido a uma estratificação a baixas temperaturas ou à redução de compostos fenólicos no tegumento das sementes, a exemplo do tanino.
Na ausência de informações precisas, as alternativas disponíveis para determinar a época ou o estádio mais favorável para a colheita consistem na avaliação do grau de umidade e utilização de características morfológicas de partes da planta. Assim, objetivou-se, com a realização desta pesquisa, avaliar possíveis alterações das sementes de sorgo em duas variedades com diferentes concentrações de tanino.
Material e métodos
As análises foram conduzidas no Laboratório Central de Análise de Sementes e Laboratório de Ciência dos Alimentos, da Universidade Federal de Lavras e a semeadura foi realizada na área experimental do Departamento de Agricultura. O solo do tipo Latossolo Vermelho Escuro, cultivado anteriormente com milho, foi preparado de maneira convencional, de acordo com recomendações para a cultura, 5ª aproximação (Ribeiro, Guimarães e Alvares, 1999). Cada tratamento foi constituído de quatro parcelas, compostas de seis linhas de 5 m, com espaçamento de 0,5 m entre linhas e 12 plantas por metro linear, totalizando 30 m2. A área útil de cada parcela foi constituída pelas quatro linhas centrais. Para a adubação de plantio, foram utilizados 400 kg/ha da formulação 8-20-10 (N-P-K) e, para adubação de cobertura, o sulfato de amônio, na dosagem de 350 kg/ha, em duas aplicações, aos 30 e 45 dias após o plantio.
O início da colheita foi caracterizado pelo grão leitoso, conforme descrito por Varderlip e Reeves (1972), e quando as sementes atingiram aproximadamente 48%, 43%, 40%, 35%, 30%, 25% e 20% de grau de umidade, o que correspondeu a 100, 103, 107, 113, 119, 121 e 127 dias após a semeadura, respectivamente. As panículas foram colhidas e debulhadas manualmente. Parte das sementes foi secada artificialmente em estufa de circulação de ar, a 35 °C, até que estas atingissem 12% de grau de umidade e a outra parte não foi submetida à secagem. O delineamento experimental foi em blocos inteiramente casualizados, no esquema fatorial de 7×2, sendo sete estádios de desenvolvimento, com e sem secagem, as variáveis foram analisadas por meio de regressão. Foram utilizadas quatro repetições de 50 sementes em cada tratamento e avaliada a qualidade por meio dos testes descritos a seguir.
Grau de umidade: realizado pelo método da estufa, a 105°C, durante 24 horas, conforme as Regras para Análise de Sementes (Brasil, 2009), em quatro repetições com 50 sementes.
Teste de germinação: o substrato para semeadura foi o papel, umedecido com água destilada, em quantidade de 2,5 vezes o peso seco do papel. As sementes foram colocadas em germinador à temperatura de 25°C e a avaliação realizada aos quatro e aos 10 dias após a semeadura. Ao final do teste de germinação, as sementes (Brasil, 2009), não germinadas foram submetidas ao teste de tetrazólio para identificar as sementes dormentes.
Quantificação de tanino: 5g de sementes trituradas foram colocados em tubos de ensaio e acrescidos de 30 ml de metanol 80%. A mistura foi fervida por 20 minutos, em refluxo, sobre chapa elétrica para tubo 150 °C. A quantificação, seis repetições por amostra, foi realizada pelo método químico-colorimétrico de Folin-Dennis e a determinação da curva padrão utilizou-se a solução padrão de ácido tânico, água destilada, Folin Denis e solução de carbonato de sódio e as leituras realizadas em espectrofotômetro, a 760nm.
Análise enzimática: em cada estádio de desenvolvimento, duas amostras de 100 sementes foram retiradas e armazenadas em temperatura de -86°C, até o momento de realização das análises. Para a extração da enzima α-amilase, as sementes foram embebidas em papel, a 25°C, por um período de 96 horas, foram descartados os eixos embrionários e o restante das sementes foi triturado na presença de PVP e nitrogênio líquido. Para a extração das demais enzimas, as sementes foram maceradas sem embebição em solução tampão (Tris HCl 0,2 M pH 8,0 + 0,1% de β mercaptoetanol, na proporção de 250 µL por 100 mg de amostra e homogeneizado em vórtex, mantido overnight, em geladeira, seguido de centrifugação a 16.000xg, por 30 minutos, a 4°C. A corrida eletroforética foi realizada em sistema de géis de poliacrilamida a 7,5% (gel separador) e 4,5% (gel concentrador) e, para α-amilase, foi acrescentado 0,5% de amido. O sistema gel/eletrodo utilizado foi o Tris-glicina pH 8,9. Foram aplicados 50 µL do sobrenadante da amostra e a corrida efetuada a 120 V, por 6 horas. A revelação foi realizada conforme Alfenas, Peters, Brune e Passador (1991), para as enzimas catalase (CAT), esterase (EST), malato desidrogenase (MDH), álcool desidrogenase (ADH) e α-amilase. Para análise eletroforética de proteínas resistentes ao calor e a determinação da atividade da polifenoloxidase, as sementes foram embebidas nas mesmas condições citadas, mas por período de 5 horas. Para a extração das proteínas resistentes ao calor, as sementes foram maceradas em solução tampão (50 mM tris-HCl 7,5; 500 mM NaCl; 5 mM MgCl2; 1 mM PMSF), na proporção de 1:10 (peso material: volume tampão de extração) e transferidas para microtubos. O material foi homogeneizado em vórtex e centrifugado, a 16.000xg, por 30 minutos, a 4°C. O sobrenadante foi colocado em banho-maria, a 85°C, por 15 minutos e novamente centrifugado. Posteriormente, 70µL do sobrenadante foram misturados a 40 µL de solução tampão (2,5 ml de glicerol, 0,46 g de SDS e 20 mg de azul de Bromofenol) e colocados em banho-maria, com água em ebulição, por cinco minutos. Foram aplicados 50 µL no gel de poliacrilamida SDS-PAGE a 12,5% (gel separador) e 6% (gel concentrador). A corrida eletroforética foi realizada a 120 V, por 6 horas e o gel corado em Coomassie Blue a 0,05% (Alfenas et al., 1991), durante 12 horas e descorado em solução de ácido acético 10%.
As sementes de sorgo foram moídas em moinho refrigerado a 4°C, adicionando-se nitrogênio líquido. A cada 5g de amostra, foram adicionados 40 mL da solução tampão de fosfato de potássio 0,1 M pH 6,0; homogeneizado em vórtex por 5 minutos e filtradas em papel de filtro Whatman nº 1, a vácuo. Foi utilizado extrato da amostra sem o DOPA (L-3,4-dihydroxyphenyalanina) como branco e realizada a curva padrão em espectrofotômetro Schumaz e os resultados expressos em U/min/g.
Resultados e discussão
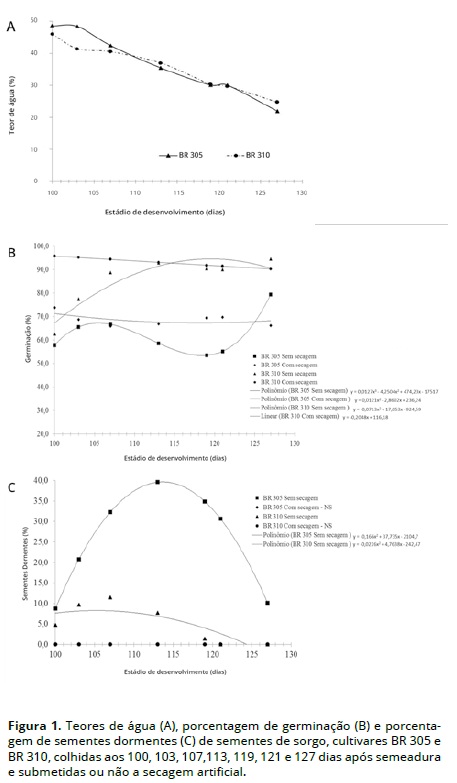
Os teores de água das sementes, no momento da colheita nos diferente estádios de desenvolvimento, estão apresentados na Figura 1 e variaram de 48,5% a 21,9%, para lote com alto tanino (BR 305) e de 46,0% a 24,7% para lote com baixo tanino.
Foram observadas interações significativas entre a secagem e estádio de desenvolvimento para ambos os lotes, para todos os testes realizados. Pela análise da germinação (Figura 1B), em sementes não submetidas à secagem, no lote BR 305, observou-se redução nos valores de germinação a partir dos 107 (67%) e até 119 (54%) dias, com aumento aos 121 (56%) dias.
Os maiores valores de germinação da cultivar BR 305 foram observados quando as sementes foram colhidas com 22% de grau de umidade e não submetidas à secagem. Outros autores observaram melhor germinação quando as sementes apresentavam 30% (Andrade e Oliveira, 1988) ou 42% de teor de água (Borba, Andrade, Azevedo, e Oliveira, 1993)
Para as sementes do lote com baixo teor de tanino (BR 310) e não submetidas à secagem houve comportamento semelhante ao do lote BR 305, em relação à germinação, tendo ocor rido aumento até 113 dias nesse valor, com a máxima germinação coincidindo com a redução no teor de água. A germinação das sementes da cultivar BR 310, independentemente da secagem, foi superior à da cultivar BR 305, em todos os estádios de desenvolvimento, os compostos fenólicos, tais como o tanino, inibem as enzimas glicose-6-fosfato de-hidrogenase, glicose fosfato isomerase e aldolase, os quais estão relacionadas com a síntese de açúcares, levando à menor germinação das sementes (Muscolo, Panuccio, Sidari, e Nardi, 2001)
As sementes não germinadas foram submetidas ao teste de tetrazólio para confirmar a condição de dormência. A maior porcentagem de sementes úmidas dormentes, do cultivar BR 305 ocorreu quando essas estavam com 35% de umidade, aos 113 dias (Figura 1C). No entanto, para as sementes deste mesmo lote, submetidas à secagem artificial, observou-se redução na porcentagem de germinação até os 107 dias, sendo mantida até o último estádio de desenvolvimento. Portanto, com secagem, a porcentagem de sementes dormentes foi nula.
Os resultados de dormência (Figura 1C), nas sementes submetidas à secagem artificial são semelhantes aos observados em sementes do lote BR 305 e BR 310. Nas sementes sem secagem do lote BR 310, houve um incremento na porcentagem de sementes dormentes até um valor máximo de 12%, aos 107 dias, quando estas apresentavam grau de umidade de 40%. A partir desse estádio, ocorreu queda nesses valores, sendo nula aos 121 e aos 127 dias, quando colhidas com 25% e 20% de teor de água, respectivamente. Para o lote BR 305, o valor máximo de sementes dormentes ocorreu aos 113 dias, quando estas apresentavam 35% do grau de umidade, com posterior queda nesses valores, coincidindo com a redução no teor de água.
Analisando-se os resultados da concentração de tanino (Figura 2), verifica-se que, após a secagem, as sementes apresentaram redução na concentração de tanino até um mínimo de 327,8 mg/100g, aos 119 dias após semeadura, para sementes do lote BR 310 com posterior aumento.
Nas sementes da cultivar BR 305 submetidas à secagem artificial, houve redução da concentração de tanino com o avanço da maturação e maiores valores de tanino quando comparados aos das sementes não secadas. A concentração de tanino não variou muito com o estádio de desenvolvimento nesta cultivar, sendo registrada a menor concentração de tanino para essas sementes aos 119 dias após semeadura. Pode-se verificar, ainda, que, para o lote BR 305, a secagem favoreceu a concentração desse composto em sementes em diferentes estádios de desenvolvimento. No entanto, para o lote BR 310, a secagem não favoreceu a concentração, observando-se maior diferença para a primeira época.
A atividade da enzima polifenoloxidase (Figura 2B), foi maior em sementes submetidas à secagem do lote com baixa concentração de tanino, aos 100 e aos 103 dias após a semeadura. Logo após o terceiro estádio de maturação, no entanto, observou-se inversão nessa tendência, com maior atividade da enzima nas sementes que não foram submetidas à secagem.
No entanto, para o lote com mais alta concentração de tanino, menor atividade foi observada em sementes submetidas à secagem artificial, independentemente do estádio de desenvolvimento. Para as sementes sem secagem, houve aumento na atividade da enzima ao longo do desenvolvimento, sendo mais acentuado a partir dos 107 dias, com o máximo valor de atividade, 44,573 U/min/g aos 127 dias.
A redução da atividade da enzima polifenoloxidase em sementes secas do lote BR 310 coincide com a redução da concentração de tanino. Isso demonstra que, com a manutenção da estrutura da membrana das sementes, reduz-se a presença dessa enzima, que se mantém compartimentalizada nos plastídeos.
Existem, na literatura, muitas controvérsias em relação à atividade da enzima polifenoloxidase. Murata, Tsurutani, Tomita, Homma, e Kaneko (1995), observaram decréscimo na atividade específica da PPO durante o amadurecimento de frutos de maçã ‘Fuji’. Em outros frutos, têm-se registrado incrementos que, segundo Mowlah e Itoo (1982), podem estar associados à queda no teor de polifenóis. Outra questão para a diferença na atividade dessa enzima pode ser o excesso de produto formado, o que pode reduzir a atividade. Essas diferenças podem, ainda, estar ligadas ao processo de extração e detecção da atividade dessa enzima e, até mesmo, ao processo de determinação dos compostos fenólicos.
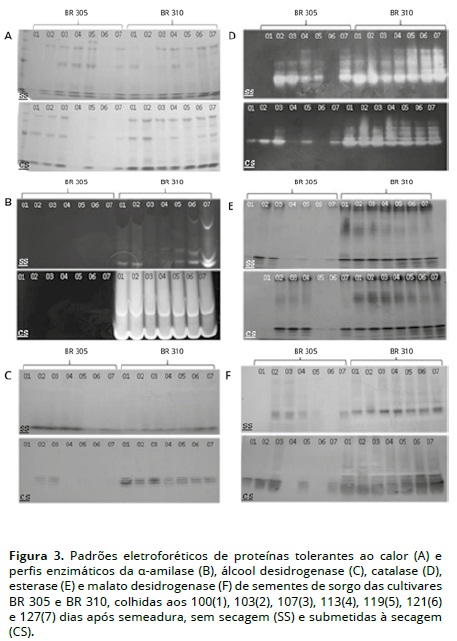
Analisando-se os padrões de bandas de proteínas resistentes ao calor, apresentado na Figura 3A, fica evidente a ausência de algumas bandas nas sementes colhidas em estádios menos avançados de maturação e sem secagem, para as duas cultivares. Pode-se observar um padrão de bandas semelhante nas sementes submetidas à secagem do lote BR 310. Ficou evidenciado também o fato de a secagem induzir o aparecimento de bandas dessa proteína em sementes colhidas com altos teores de água.
No entanto, sementes que não foram submetidas ao processo de secagem apresentaram ausência de algumas bandas.
Faria, Von Pinho, Von Pinho, Guimarães, e Freitas (2004), avaliaram sementes de milho em diferentes estádios de maturação e detectaram menor intensidade de banda naquelas não submetidas à secagem e maior intensidade quando foram secadas, demonstrando o acúmulo dessa proteína durante a secagem e a maturação. As diferenças no padrão dessa proteína são esperadas e coincidem com as variações fisiológicas observadas nos testes de germinação, principalmente no lote com baixo tanino (BR 310) em que, a partir dos 107 dias e sem secagem, houve o aparecimento de bandas e, quando as sementes foram submetidas à secagem, esse padrão foi uniforme.
As proteínas resistentes ao calor são de fundamental importância nas sementes ortodoxas, por possuírem importante papel na proteção das estruturas citoplasmáticas das sementes, durante a desidratação (Marcos Filho, 2005). Baixa atividade dessas enzimas pode ser devido à sua complexação com compostos fenólicos (Liu, Wang, Han, e Mao, 2009). Para estes autores, um dos problemas na utilização do sorgo é o alto conteúdo de compostos fenólicos, uma vez que as proteínas se ligam fortemente ao tanino e essa interação pode influenciar na análise eletroforética. A interação tanino-proteína pode ter sido responsável pela ausência de bandas nas variedades com alto conteúdo de tanino.
De maneira geral, foram observadas maiores atividades enzimáticas nas sementes do lote BR 310 e submetidas à secagem (Figura 3B, 3C, 3D, 3E, 3F). Isso demonstra que a secagem, para as sementes ortodoxas, é de fundamental importância, uma vez que, favorece ajustes na organização dos sistemas de membranas e na síntese de enzimas. Entretanto, para as sementes do lote BR 305, após a secagem, isso não foi observado. A secagem próxima ou após o ponto de máximo acúmulo de matéria seca pelas sementes deve alterar o comportamento de alguns compostos, promovendo o desaparecimento ou a inativação de outros, (Marcos Filho, 2005).
A menor atividade da catalase em sementes com alta concentração de tanino (Figura 3D) pode ser explicada, uma vez que, de modo geral, os flavonoides protegem as células do estresse oxidativo pela quelação, inativação ou captação de radicais livres produzidos pelo sistema de transporte de elétrons Harbone (1994). Para Paiva, Heringer, Figueira e Kaplan (2002), os taninos têm ação antioxidante, pois eles atuam no processo de estabilização dos radicais livres superóxido e peróxido de hidrogênio. Durante o desenvolvimento da semente, na fase em que ocorre acúmulo matéria seca, o teor de água é mantido em altos níveis. Por outro lado, à medida que a sementes mantêm alto teor de água e seu conteúdo de massa seca aumenta sua intensidade respiratória também aumenta (Carvalho e Nakagawa, 2000). Isso pode ser observado na Figura 3F, na qual a atividade da malato desidrogenase nas sementes sem secagem durante o desenvolvimento é mantida. A baixa atividade da MDH nas sementes da cultivar BR 305 pode ser devido à diminuição da entrada de oxigênio nas mitocôndrias e cloroplastos, devido à presença de compostos fenólicos nas sementes. A atividade dessa enzima se dá continuamente, uma vez que a energia gerada no ciclo de Krebs é fundamental, tanto para as reações de biossíntese de produtos quanto à degradação de compostos para o crescimento da plântula (Moreland e Novitzky, 1988).
Após secagem as sementes da cultivar BR 310, os padrões de atividade da α-amilase (Figura 3B) foram semelhantes, independentemente do estádio de desenvolvimento. A secagem proporciona a ativação dessa enzima, favorecendo o processo de germinação, no entanto, no cultivar BR 305, não houve atividade dessa enzima. Oishi e Bewley (1990), em pesquisa com milho, relatam que a secagem causa o declínio de ácido abscísico e permite que a camada de aleurona torne-se sensível ao ácido giberélico, produzindo a α-amilase. Vale ressaltar que a α-amilase é secretada no endosperma, onde ocorre a degradação do amido e a glicose formada é transportada para os locais onde demandam gastos de energia.
As alterações nos perfis enzimáticos que ocorreram nas sementes da cultivar BR 305, independentemente da secagem, podem ser devido a outros fatores além da presença de taninos na semente, uma vez que o comportamento de compostos secundários na semente ainda não está bem elucidado.
Conclusões
- Secagem de sementes de sorgo colhidas em estádios precoces do desenvolvimento favorece a germinação. A incidência de dormência é maior em sementes não submetidas à secagem. Houve maiores atividades das enzimas em sementes do cultivar com baixa concentração de tanino e submetidas à secagem artificial. Não há relação entre a concentração de tanino e a dormência, em semente de sorgo.
Referências
Alfenas A.C., Peters, I., Brune, W., Passador, G.C. (1991). Eletroforese de proteínas e isoenzimas de fungos e essências florestais. Brasil: Universidade Federal de Viçosa. xiv, 242 p. [ Links ]
Andrade, R.V., Oliveira, A.C. (1988). Maturação fisiológica do colmo e da semente de sorgo sacarino. Revista Brasileira de Sementes, 10(3), 19-31. [ Links ] Bewley, J.D., Black, M. (1994). Seeds: physiolgy of development and germination. Plenum. New York, USA, 455 p. [ Links ]
Borba, C.S., Andrade, R.V., Azevedo, J.T., Oliveira, A.C. (1993). Maturação fisiológica das sementes das cultivares BR 007 a e BR 007 b de sorgo (Sorghum bicolor (l.) Moench). Revista Brasileira de Sementes, 15, 105-108 [ Links ]
Brasil. Ministério da Agricultura. Regras para análise de sementes. Brasília: SND/CLAV, 2009. 399 p. [ Links ]
Carvalho, N.M., Nakagawa, J. (Ed.). (2000). Sementes: ciência, tecnologia e produção. (4ª ed.). Jaboticabal, Brasil. Funep. 588 p. [ Links ]
Dias, D.C.F. (2001). Maturação de sementes. Seed News, 5, 22-24 [ Links ]
Faria, M.A.V.R., Von Pinho, R.G., Von Pinho, E.V.R., Guimarães, R.M., Freitas, F.E.O. (2004). Germinabilidade e tolerância à dessecação em sementes de milho colhidas em diferentes estádios de maturação. Revista Brasileira de Milho e Sorgo, 3(2), 276-289. [ Links ]
Harbone, J.B. (1994) The flavonoids: advances in research since 1986. London, England. Chapman & Hall. pp. 589-618 [ Links ]
Kermode, A.R. (1997). Approaches to elucidate the basis of desiccation-tolerance in seeds. Seed Science Research, 7(02), 75-95. http://doi.org/10.1017/S0960258500003421 [ Links ]
Liu, M.-X., Wang, Y.-W., Han, J.-G., & Mao, P.-S. (2009). The content and distribution of condensed tannins in different species of the genus sorghum (Sorghum Moench) and their effect on seed protein electrophoresis. Journal of the Science of Food and Agriculture, 89(9), 1446-1452. http://doi.org/10.1002/jsfa.3593 [ Links ]
Marcos Filho, J. (2005). Fisiologia de sementes de plantas cultivadas. Piracicaba, Brasil: Fealq. 495 p. [ Links ]
Moreland, D. E., & Novitzky, W. P. (1988). Interference by flavone and flavonols with chloroplast-mediated electron transport and phosphorylation. Phytochemistry, 27(11), 3359-3366. http://doi.org/10.1016/0031-9422(88)80732-5 [ Links ]
Mowlah, G., & Itoo, S. (1982). Quantitative changes in guava polyphenols and the polyphenoloxidase (PPO) at different stages of maturation, ripening and storage. Nippon Shokuhin Kogyo Gakkaishi, 29(7), 413-417. http://doi.org/10.3136/nskkk1962.29.7_413 [ Links ]
Murata, M., Tsurutani, M., Tomita, M., Homma, S., & Kaneko, K. (1995). Relationship between Apple Ripening and Browning: Changes in Polyphenol Content and Polyphenol Oxidase. Journal of Agricultural and Food Chemistry, 43(5), 1115-1121. http://doi.org/10.1021/jf00053a001 [ Links ]
Muscolo, A., Panuccio, M. R., Sidari, M., & Nardi, S. (2001). The ascorbate system during the early stage of germination in pinus larício seeds treated with extracts from two different sources of humus. Seed Science and Technology, 29(1), 275-279 [ Links ]
Oishi, M. Y., & Bewley, J. D. (1990). Distinction between the Responses of Developing Maize Kernels to Fluridone and Desiccation in Relation to Germinability, alpha-Amylase Activity, and Abscisic Acid Content. Plant Physiology, 94(2), 592-8. [ Links ]
Paiva, S. R. de, Heringer, A. P., Figueiredo, M. R., & Kaplan, M. A. C. (2002). Taninos condensados de espécies plumbaginaceae. Floresta e Ambiente, 9, 153-157. [ Links ]
Ribeiro, A.C.; Guimarães, P.T.G.; Alvares, V.V.H. (1999). Recomendações para o uso de corretivos e fertilizantes em minas gerais: aproximação (5ª ed.). Viçosa, Brasil, SBCS. 359 p. [ Links ]
Tillmann, M.A.; Peters, J.A.; Mello, V.D.C.; Silva, J.B. (1985). Maturação e qualidade fisiológica de sementes de sorgo sacarino provenientes de diferentes localizações na panícula. Revista Brasileira de Sementes, 7(2), 101-112. http://doi.org/10.17801/0101-3122/rbs.v7n2p101-111 [ Links ]
Vanderlip, R. L., & Reeves, H. E. [ Links ] (1972). Growth Stages of Sorghum [Sorghum bicolor, (L.) Moench.]. Agronomy Journal, 64(1), 13. http://doi.org/10.2134/agronj1972.00021962006400010005x