Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.65 no.3 Palmira July/Sep. 2016
https://doi.org/10.15446/acag.v65n3.44485
http://dx.doi.org/10.15446/acag.v65n3.44485
Extracción secuencial de metales pesados en dos suelos contaminados (Andisol y Vertisol) enmendados con ácidos húmicos
Sequential extraction of heavy metals in two contaminated soils (Andisol and Vertisol) amended with humic acids
Luis Enrique Cortes Páez 1*, Isabel del Socorro Bravo Realpe 2, Francisco José Martin Peinado 3 y Juan Carlos Menjivar Flores 1
1 Universidad Nacional de Colombia sede Palmira. Grupo de Investigación en uso y manejo de suelos y aguas, con énfasis en degradación de suelos Palmira, Colombia. 2 Universidad del Cauca, Departamento de Química. Grupo de Agroquímica, Popayán, Colombia. 3 Universidad de Granada, Departamento de Edafología y Química Agrícola. Granada, España. *Autor para correspondencia: lecortesp@unal.edu.co
Rec.: 18.07.2014 Acep.: 05.01.2015
Resumen
En suelos Andisoles y Vertisoles, bajo condiciones controladas, se evaluó el efecto de ácidos húmicos purificados en concentraciones de 0%, 2.5% y 5% (peso/peso) sobre la extracción secuencial de metales pesados después de incubación a 60 y 90 días. El fraccionamiento de los metales (Ni, Cu, Zn, Cd y Pb) en suelos contaminados y enmendados con ácidos húmicos se realizó mediante extracción secuencial de Tessier. La movilidad de los metales se redujo con la adición de dichos ácidos, con mayor retención de Ni, Cu, Zn y Cd en la matriz del suelo (fracción residual). El Pb en ambos suelos y el Zn en Vertisol experimentaron incremento significativo en su movilidad, mayor biodisponibilidad y potencial de afectación de diferentes componentes del medio–ambiente. El incremento del tiempo de incubación permitió la interacción de los metales con los componentes de los suelos, generando disminución de su movilidad por mecanismos como formación de complejos estables y/o incremento de la capacidad de intercambio catiónico (CIC) de los suelos. Los ácidos húmicos pueden ser utilizados, en general, como enmienda orgánica para la recuperación de suelos contaminados con metales pesados.
Palabras clave: Contaminación, factor de movilidad, fraccionamiento, leonardita.
Abstract
Purified Humic Acids were added to 0%, 2.5% and 5% (w / w), to two soils Andisol and Vertisol, contaminated individually with five heavy metals, followed by incubation at 60 and 90 days, with the aim of observe their mobility and their possible effect on the environment. Fractionation of metals (Ni, Cu, Zn, Cd and Pb) in contaminated soils amended with humic acids and was performed by sequential extraction of Tessier. The mobility of the metals are reduced by the addition of such acids, achieving greater retention of Ni, Cu, Zn and Cd in the soil matrix (residual fraction). The Pb in both soils, and Zn in the vertisol, showed significant increase in their mobility, greater bioavailability and affectation potential for different environmental components. Increased incubation time allowed for interaction of metals with the components of the soil, generating decreasing its mobility for mechanisms such stable complex formation and / or increased CIC of soils. The humic acids can be used, in general, as an organic amendment for the recovery of contaminated soils with heavy metals.
Keywords: Contamination, mobility factor, fractionation, leonardite.
Introducción
La contaminación de suelos por metales pesados afecta el medio ambiente y es un riesgo para la salud humana, por esta razón su identificación permite desarrollar políticas de control, recomendaciones para su gestión y/o para realizar programas de remediación (Xu et al., 2014; Yu et al., 2014). Tecnologías de remediación como la excavación, el tratamiento térmico y la electrorecuperación no son adecuadas para uso en campo debido a su alto costo, baja eficiencia y potencialidad de afectación al medio ambiente; por otra parte las tecnologías de fitorremediación presentan una baja tasa de remoción de estos metales. Como resultado de lo anterior, en los últimos años ha recibido especial atención el uso de enmiendas orgánicas e inorgánicas para la inmovilización de metales pesados en el suelo (Li y Xu, 2015; Fan et al., 2012). Estas enmiendas se basan en la adsorción, la formación de complejos estables, la precipitación de minerales y el intercambio iónico (Janoš et al., 2010).
Como enmienda orgánica, las sustancias húmicas son utilizadas para promover el crecimiento y nutrición de plantas, principalmente en suelos con bajo contenido de arcilla y materia orgánica y para promover la formación de macroagregados, aumentar la capacidad de intercambio catiónico y el contenido de carbono orgánico en el suelo (Clemente y Bernal, 2006). Los ácidos húmicos (AH) adsorben los metales en sus grupos funcionales, carboxílicos, hidroxílicos y fenólicos, y su movilidad depende de características como fuerza iónica, potencial redox, presencia de bases, grado de madurez, pH, estabilidad del complejo húmico – metal y de la interacción de este complejo con los constituyentes del suelo (Özkaraova y Bekbölet, 2010).
Esta investigación tuvo como objetivo evaluar el efecto en la movilidad de los metales níquel (Ni), cobre (Cu), zinc (Zn), cadmio (Cd) y plomo (Pb) debido a la aplicación de ácidos húmicos (AH) en la extracción secuencial de metales pesados en dos tipos de suelos contaminados (Andisol y Vertisol) con propiedades contrastantes bajo condiciones controladas.
Materiales y métodos
La investigación se realizó en el Laboratorio de Edafología y Química Agrícola y en el Centro de Instrumentación Científica de la Universidad de Granada, España (37° 10' 41'' N, 3° 36' 3'' O) en muestras de suelos (0 – 20 cm de profundidad) provenientes de Colombia: Andisol Typic Melanudand (IGAC, 2009) (2° 37' 26'' N, 76° 34' 23'' O) y Vertisol Epiaquert ústico arcilloso fino isohipertérmico (3° 24' 35'' N, 76° 20' 52'' O) que fueron secadas al ambiente y tamizadas por malla No.10. Los ácidos húmicos (AH) fueron extraídos a partir de leonardita natural española localizada a 40° 35' 0'' N, 1° 01' 0'' O, según la metodología propuesta por Mosquera et al. (2007) utilizando soluciones extractoras de Na2B4O7 0,1 N pH 9.3, Na4P2O7 0.1 N pH 10.2 y NaOH 0.1 N pH 12.1. Los AH fueron separados de los fúlvicos mediante precipitación con H2SO4 hasta pH < 2, purificados con HCl–HF (1%), ultracentrifugados y diálizados en membrana de 12000 Da y finalmente liofilizados en equipo FLEXI–DRY–µP.
Caracterización de suelos y ácidos húmicos
La caracterización de los suelos se hizo por determinación de textura (Pipeta de Robinson), mineralogía de arcillas, pH (1:2.5), carbono orgánico por Walkley y Black (IGAC, 2006), bases intercambiables y Capacidad de Intercambio Catiónico (CIC) (acetato de amonio 1N a pH 7) y contenidos de Ni, Cu, Zn, Cd y Pb. Las determinación realizadas en los AH fueron: pH (1:2.5) (USDA, 1999), Capacidad de Intercambio Catiónico (CIC) y bases intercambiables (acetato de amonio 1N a pH = 7) determinadas por espectrofotometría de absorción atómica en equipo Varian Spectraa–220Z, carbono orgánico por Walkley and Black (IGAC, 2009) y composición química por espectrometría ICP_MS, espectroscopía infrarroja por transformada de Fourier, FTIR, UV–Vis y espectrometría CPMAS 13C NMR, Py–GC/MS–THMA.
Contaminación de los suelos e incubación
Los metales fueron agregados a cada una de las muestras de suelo utilizando soluciones patrones hasta superar los umbrales andaluces propuestos para el nivel de intervención de suelos agrícolas (mg/kg): Ni (329 – 367), Cu (600 – 652), Zn (1178 – 1351), Cd (24 – 30), y Pb (631 – 688) (CMAJA, 1999). La incubación de las muestras de suelo contaminadas se hizo en un equipo GROW470/HR en condiciones de invernadero: 25°C, 60% de humedad ambiental, con simulación de ciclo diurno/nocturno de 12 horas (12/12), durante 60 y 90 días, manteniendo la humedad gravimétrica en 60%, con el fin promover el equilibrio entre las asociaciones de los metales y los constituyentes del suelo (Halim et al., 2003).
Extracción secuencial de metales
La extracción secuencial de los metales pesados se hizo en muestras de suelos contaminados con AH en proporción 1:2.5 y 1:5.0 (suelo:AH) y sin adición de AH. La cuantificación de metales de cada extracción se realizó en equipo ICP_MS NEXION 300D. Los factores de movilidad (FM) fueron determinados de acuerdo con Osakwe (2010), quien relaciona las concentraciones de metales en fracciones móviles (intercambiable y asociada a carbonatos) con la totalidad de las fracciones:
Diseño experimental y análisis de datos
Para evaluar el efecto de los ácidos húmicos en la extracción de los metales se utilizó un diseño completamente al azar con 60 tratamientos, correspondientes a dos suelos, cinco metales, tres concentraciones de AH [0%, 2.5% y 5% (peso/peso)] y dos tiempos de incubación (60 y 90 días) en tres repeticiones. Las unidades experimentales consistieron en tubos plásticos Eppendorf de 50 cm3. La normalidad de los datos obtenidos fue verificada mediante la prueba de Shapiro Wilk y la homocedasticidad por la prueba de Levene. Los datos fueron sometidos a Anova, comparación de medias de Tukey (P < 0.05) y correlaciones de Pearson (P < 0.01, 0.05). Se utilizó el software SPSS Versión 20.0 ®.
Resultados y discusión
Caracterización de suelos y ácidos húmicos
Los ácidos húmicos presentaron pH fuertemente ácido, una elevada CIC que se asocia a su alto nivel de CO y deficiencia de bases, excepto Na. El Andisol tiene un pH con acidez media, alto nivel de CO, elevada CIC, contenidos medios de Ca y Mg, alto nivel de K y normal en Na y arcillas, propiedades que contrastantes con las del Vertisol, que presenta arcillas tipo 2:1 (Tabla 1).
En los ácidos se encuentran compuesto de C (57.74%), O (36.81%), bajo contenido de N (1.44%) y S (0.01%) con predominio de compuestos aromáticos con estructuras altamente condensadas, cadenas laterales con bajo grado de oxidación, alta estabilidad y madurez reflejados en los valores de las relaciones C/O (2.10), C/H (1.20) y E4/E6 (4.88), índices OR (R1 = 0.69 y R2 = 0.57), factor de aromaticidad (72.27%) e índice de hidrofobicidad (3.22). La composición molecular corresponde a ácidos grasos (62.6%), compuestos aromáticos (23.7%), compuestos de N y S (11.6%) y compuestos terpénicos (2.1%) sin presencia de polisacáridos, por lo que se infiere su origen vegetal.
Efecto de la adición de ácidos húmicos en la extracción secuencial de metales
La evaluación del efecto de la adición de AH sobre la extracción secuencial de metales se efectuó mediante la comparación de cada uno de los tratamientos, con y sin aplicación de AH (Tablas 2 y 3) y para cada metal por separado, ya que las dosis de cada uno de ellos fueron diferentes.
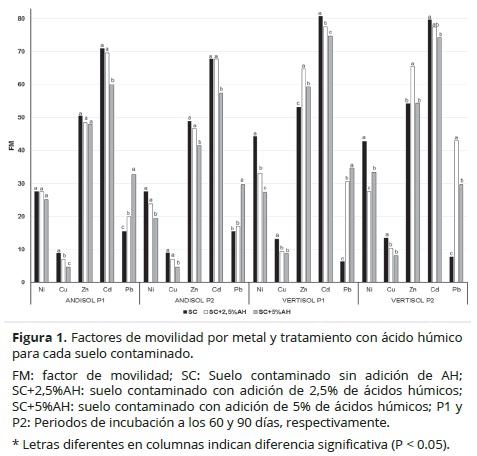
Níquel. En el suelo Andisol, el efecto de la adición de AH en el factor de movilidad (FM) del Ni (Figura 1) sólo se reflejó en la reducción significativa (P < 0.05) para la dosis 5%, en el segundo periodo de incubación. En el Vertisol, en el primer periodo de incubación (P1 = 60 días) dicho efecto se presentó como reducción (P < 0.05) con el incremento de la dosis de AH, mientras que en el segundo periodo (P2 = 90 días) la reducción fue más alta (P < 0.05) para la dosis de AH de 2.5%. Cuando se compararon los tratamientos con AH en este suelo, se observó un efecto significativo de retención de Ni con la adición de esta enmienda a nivel de 5% en el periodo 1 (P < 0.05) y de 2.5% en el segundo periodo (P < 0.05), pero no entre ellos.
La retención de Ni es afectada por el incremento significativo (P < 0.05) en la fracción residual (F5) (–0,744**) y, a su vez, se correlaciona positivamente con la fuerza de retención (n), (0,829**) y negativamente con la máxima capacidad de adsorción (K), (–0,829**), indicando de esta manera que este metal tiene gran afinidad por dicha fracción y que un posible incremento en su movilidad podría darse cuando éste se asocie con la fracción de carbonatos (F2), (0,748**). Dicho comportamiento fue similar al encontrado por Osakwe (2010), en suelos de Nigeria.
La reducción significativa del FM (mayor retención) de Ni por la adición de AH a ambos suelos puede ser debida, en general, al incremento de los sitios de intercambio (Janoš et al., 2010), lo cual se corrobora con las correlaciones negativas con CO y CIC (–0.724**) y se asocia principalmente a su adsorción a las cargas negativas superficiales de dichos ácidos, generadas por la 'desprotonación' progresiva y creciente de sus grupos carboxílicos e hidroxílicos, a valores de pH ácidos y alcalinos, respectivamente, lo cual se confirma con la correlación positiva con el pH y la máxima capacidad de adsorción (k) (0.724** y –0.724**, respectivamente). Durante la absorción, los H+ y otros cationes intercambiables, por ejemplo, las bases, con las cuales poseen correlaciones positivas, son intercambiados por dichos metales y por tanto son liberados hacia la solución del suelo (Havelcová et al., 2009, Zhou et al., 2005).
Cobre. En el suelo Andisol, en el primer periodo de incubación el efecto de la adición de AH en el FM de Cu se reflejó en una reducción significativa y constante del elemento en la medida que se incrementó la dosis aplicada; mientras que en el segundo periodo este mismo comportamiento sólo se observó para la dosis de 5%. Al comparar los tratamientos con AH en ambos periodos de incubación, se observa que existe un efecto de retención cuando aquellos se aplicaron en la dosis de 5%, no obstante las diferencias entre periodos de incubación no fueron significativas (P > 0.05).
En el suelo Vertisol, el efecto de las enmiendas se manifestó como un descenso significativo en el FM de Cu (P < 0.05) en ambos periodos de incubación, tanto en la dosis de 2.5% como de 5% de AH. La alta calidad de los AH y el incremento de las dosis implican una mayor presencia de grupos funcionales carboxílicos y fenólicos y en consecuencia, mayor retención del metal, principalmente en valores de pH cercanos a la neutralidad (Bravo et al., 2014; Pérez–Esteban et al., 2014).
La movilidad de Cu, al igual que la de Ni, depende de su concentración en la F2 (0.939**), y su retención puede depender de la F5 que posee una correlación altamente significativa con la fuerza de retención (n) (0.868**); este comportamiento también fue reportado por Nannoni et al. (2011), e indica que los AH inducen la retención de este metal en la matriz del suelo, disminuyendo significativamente su movilidad.
Zinc. En el suelo Andisol, el efecto de la adición de AH en el FM del Zn se manifestó como una reducción significativa de éste en la dosis de 5% (P < 0.05), durante el segundo periodo de incubación. En el suelo Vertisol, por el contrario, en el primer periodo de incubación dicho efecto se manifestó como un incremento significativo del FM (P < 0.05), con el valor más alto en la dosis de 2.5%. En el segundo periodo sólo se presentó un incremento significativo con la dosis de 2.5% (P < 0.05). La comparación de los tratamientos con AH en ambos periodos de incubación muestra un efecto de movilización cuando los AH se aplicaron a 2.5% (P < 0.05), aunque sin diferencias significativas entre ellos.
La correlación negativa con la F5 (–0.823**) indica inmovilización, principalmente en el Andisol, sin embargo esta fracción se correlaciona negativamente con n y k (–0.851**), lo que indica movilidad del metal. En el suelo Vertisol las correlaciones con F1 (0.763**), n y k (0.574**) indican un efecto negativo de los AH aplicados (movilización), comportamiento similar al encontrado por Pérez–Esteban et al. (2014) trabajando con compost vegetal de corteza de pino. Özkaraova y Bekbölet (2010), por otra parte, encontraron que la aplicación de AH en suelos de Turquía permite la liberación de zinc, aumentando su biodisponibilidad y movilidad en el suelo, debido a la disponibilidad de las moléculas de AH en la solución y a la formación de complejos con dicho metal, lo cual depende principalmente del pH de la solución y de las propiedades del suelo. Janoš et al. (2010) encontraron que el Zn posee gran afinidad con la fracción residual del suelo y presenta correlación negativa con CO y CIC, por lo que la adición de enmiendas orgánicas posiblemente impide la retención en dicha fracción o la movilizaría hacia otros componentes del suelo, incrementando significativamente su FM (correlación positiva con la fuerza de retención, n).
Cadmio. En el suelo Andisol, en ambos periodos de incubación la adición de AH en dosis de 5% ocasionó reducción significativa (P < 0.05) en el FM del Cd, no obstante entre periodos de incubación la diferencia no fue significativa. En el suelo Vertisol, durante el primer periodo se observó reducción significativa (P < 0.05) del FM con el incremento de la dosis de AH, pero en el segundo periodo la reducción sólo ocurrió con la dosis de 5% (P < 0.05), nuevamente no se presentaron diferencias entre periodos; comportamiento similar encontraron Janoš et al. (2010) en suelos de República Checa.
La reducción de la FM se debe a sus correlaciones negativas con F3 (–0.571**), F4 (–0.531**) y F5 (–0.929**), de las cuales las fracciones F3 y F5 son las que más contribuyen en la retención en ambos suelos, debido a la correlación positiva con la fuerza de retención n (0.734** y 0.757**, respectivamente) y negativa con K (–0.734** y –0.757**, respectivamente). Esta reducción de la FM puede ser debida a la formación de complejos superficiales binarios ≡S2OCd y ternarios ≡S2OCdL1 y ≡S2OCdL3 y de CdX2 a bajos valores de pH (Hizal y Apak, 2006).
La fracción F1, puede generar incremento en movilidad, lo cual se comprueba con la correlación positiva (0.737**) y a que ésta fracción es contraria a la fuerza de retención n (–0.778**) e incrementa con la máxima capacidad de adsorción K (0.778**), comportamiento similar al reportado por Kosolsaksakul et al. (2014).
Plomo. En el suelo Andisol, durante el primer periodo la adición de AH aumento el FM de este elemento (P < 0.05), mientras que durante el segundo periodo este aumento sólo ocurrió con la concentración de 5% (P < 0.05). La comparación de los tratamientos con AH en ambos periodos de incubación muestra un efecto de movilización del Pb con la adición de AH al 5% (P < 0.05), aunque éste no fue significativo. En el suelo Vertisol, el efecto de la adición de AH sobre FM de Pb en el primer periodo, fue similar al encontrado para el suelo Andisol en el mismo periodo; en el segundo periodo de incubación el mayor incremento del factor se presentó con la dosis de 2.5% (P < 0.05). En este suelo, en ambos periodos de incubación, la movilización de Pb fue significativa con la aplicación de AH a 2.5% (P < 0.05) después de 90 días de incubación.
El FM de Pb mostró correlación positiva con las fracciones F1, F2 y F3 (0.828**, 0.451** y 0.540**, respectivamente) e indica que los AH pueden promover la movilización del Pb al incrementar las fracciones fácilmente extraíbles (Clemente y Bernal, 2006), efecto que se confirma con las correlaciones negativas presentadas entre F1 y F3 con n (–0.375* y –0.365**, respectivamente) y con k (–0,375* y –0,365**, respectivamente); mientras que la retención está influenciada por la asociación con la F4 (–0.813**) ya que la materia orgánica retiene este metal en formas más estables que los minerales del suelo (Tai et al., 2013).
Conclusiones
- Los ácidos húmicos agregados a suelos contaminados (Andisol y Vertisol) con metales pesados modifican la asociación con los diferentes componentes edáficos, disminuyendo, en general, los factores de movilidad.
- El Pb en ambos suelos y el Zn en el suelo Vertisol, presentaron incrementos significativos en movilidad, por tanto tienen mayor biodisponibilidad y capacidad para migrar hacia la solución del suelo, afectando las propiedades a través del perfil de los diferentes componentes medioambientales.
- El Cd, presentó un mayor factor de movilidad, el cual disminuyó con la adición de los ácidos húmicos como consecuencia del incremento de los sitios de intercambio.
- El incremento del tiempo de incubación, permitió la interacción de los metales con los diferentes componentes de los suelos y la reducción de su movilidad por mecanismos como la formación de complejos estables y/o el incremento de la capacidad de intercambio catiónico en el suelo.
Agradecimientos
A Ismael Vivas y Damián Blanco Salas, por su invaluable aporte. A la Comisión Europea por la beca Erasmus Mundus Interntational Coopen lot 21b, 2010–2012.
Referencias
Bravo. R. I. Arboleda. P. C. & Martín. P. F. (2014). Efecto de la calidad de la materia orgánica asociada con el uso y manejo de suelos en la retención de cadmio en sistemas alto–andinos de Colombia. Acta Agron, 63(2), 164–174. doi: 10.15446/acag.v63n2.39569. [ Links ]
Clemente. R. Bernal. M. P. (2006). Fractionation of heavy metals and distribution of organic carbon in two contaminated soils amended with humic acids. Chemosphere, 64(8), 1264 – 1273. doi: 10.1016/j.chemosphere.2005.12.058. [ Links ]
CMAJA (Consejería de Medio Ambiente de la Junta de Andalucía). (1999). Los criterios y estándares para declarar un suelo contaminado en Andalucía y la metodología y técnicas de toma de muestra y análisis para su investigación. http://www.ugr.es/~fjmartin/Criterios%20y%20estandares.pdf. 04.11.2014 [ Links ]
Fan. W. Jia. Y. Li. X. Jiang. W. & Lu. L. (2012). Phytoavailability and geospeciation of cadmium in contaminated soil remediated by Rhodobacter sphaeroides. Chemosphere, 88(6), 751 – 756. doi: 10.1016/j.chemosphere.2012.04.047. [ Links ]
Halim. M. Conte. P. & Piccolo. A. (2003). Potential availability of heavy metals to phytoextraction from contaminated soils induced by exogenous humic substances. Chemosphere, 52(1), 265– 275. doi: 10.1016/S0045–6535 (03)00185–1. [ Links ]
Havelcová. M. Mizera. J. Sýkorová. I. & Pekar. (2009). Sorption of metal ions on lignite and the derived humic substances. J. Hazardous Materials, 161, 559 – 564. doi:10.1016/j.jhazmat.2008.03.136.
Hizal. J. & Apak. R. (2006). Modeling of cadmium (II) adsorption on kaolinite–based clays in the absence and presence of humic acid. Appl Clay Sci., 32, 232 – 244. doi:10.1016/j.clay.2006.02.002. [ Links ]
IGAC (Instituto Geográfico Agustín Codazzi). (2009). Estudio general de suelos y zonificación de tierras del departamento del Cauca, Colombia. Escala 1:100000. Imprenta Nacional de Colombia. Bogotá. 556 p. [ Links ]
Janoš. P. Vávrová. J. Herzogová. L. & Pilařová. V. (2010). Effects of inorganic and organic amendments on the mobility (leachability) of heavy metals in contaminated soil: A sequential extraction study. Geoderma, 159 (3–4), 335 – 341. doi:10.1016/j.geoderma.2010.08.009. [ Links ]
Kosolsaksakul. P. Farmer. J. G. Oliver. L. W. & Graham. M. C. (2014). Geochemical associations and availability of cadmium (Cd) in a paddy field system, northwestern Thailand. Environ Sci Pollut R, 187, 153–61. doi:10.1016/j.enpol.2014.01.006. [ Links ]
LI. J. & XU. Y. (2015). Immobilization of Cd in a paddy soil using moisture management and amendment. Environ Sci Pollut R, 22(7), 5580–5586. doi: 10.1007/s11356–014–3788–5. [ Links ]
Mosquera. C. Bravo. I. & Hansen. E. (2007). Comportamiento estructural de los ácidos húmicos obtenidos de un suelo Andisol del Departamento del Cauca. Rev Col Quím, 36 (1), 31 – 41. [ Links ]
Nannoni. F. Protano. G. & Riccobono. F. (2011). Fractionation and geochemical mobility of heavy elements in soils of a mining area in northern Kosovo. Geoderma, 161(1–2), 63 – 73. doi: 10.1016/j.geoderma.2010.12.008. [ Links ]
Osakwe. S. A. (2010). Chemical speciation and mobility of some heavy metals in soils around automobile waste dumpsites in northern part of Niger Delta, South Central Nigeria. J Appl Sci Environ Manag, 14(4), 123 – 130. doi: 10.4314/jasem.v14i4.63284. [ Links ]
Özkaraova. G. E. & Bekbölet. M. (2010). Zinc release by humic and fulvic acid as influenced by pH, complexation and DOC sorption. Geoderma, 159,131 – 138. doi: 10.1016/j.geoderma.2010.07.004. [ Links ]
Pérez–Esteban. J. Escolástico. C. Masaguer. A. Vargas. C. & Moliner. A. (2014). Soluble organic carbon and pH of organic amendments affect metal mobility and chemical speciation in mine soils. Chemosphere, 103,164 – 171. doi: 10.1016/j.chemosphere.2013.11.055. [ Links ]
Tai. Y. Mcbride. M. B. & Li. Z. (2013). Evaluating specificity of sequential extraction for chemical forms of lead in artificially – contaminated and field–contaminated soils. Talanta, 107,183 – 188. doi: 10.1016/j.talanta.2013.01.008. [ Links ]
Yu. H. Ni. S–J. He. Z–W. Zhang. C–J. Nan. X. Kong. B. & Weng. Z–Y.(2014). Analysis of the spatial relationship between heavy metals in soil and human activities based on landscape geochemical interpretation. J Geochem Expl, 146,136 – 148. doi:10.1016/j.gexplo.2014.08.010. [ Links ]
Xu. X. Zhao. Y. Zhao. X. Wang. Y. & Deng. W. (2014). Sources of heavy metal pollution in agricultural soils of a rapidly industrializing area in the Yangtze Delta of China. Ecotox Environ Safe, 108, 161 – 167. doi: 10.1016/j.ecoenv.2014.07.001. [ Links ]
Zhou. P. Yan. H. & Gu. B. (2005). Competitive complexation of metal ions with humic substances. Chemosphere, 58 (10), 1327 – 1337. doi:10.1016/j.chemosphere.2004.10.017. [ Links ]