Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Agronómica
versão impressa ISSN 0120-2812
Acta Agron. vol.65 no.3 Palmira jul./set. 2016
https://doi.org/10.15446/acag.v65n3.45689
http://dx.doi.org/10.15446/acag.v65n3.45689
Evaluación de la sensibilidad colorimétrica para la determinación de nanoestructuras compuestas de polidiacétileno/lípidos, usando espectroscopia de absorción electrónica y UV–Vis fluorescencia
Colorimetric sensibility assessment for the composed polydiacetylene/lipid nanostructures measurement, using electronic absorption spectroscopy and UV–Vis fluorescence
Yuri Lorena Moreno 1*, Nathalie Becerra 1, Sandra Patricia Chaparro 1y Julia Reyes Cuellar 2
1Universidad Pedagógica y Tecnológica de Colombia– Sede Tunja, Boyacá, Colombia. 2Nanoscience Exploration and Research Development. Chemistry and Biochemistry Department. Southern Illinois University Carbondale– SIUC, United States. *Autora para correspondencia: yuri.moreno@uptc.edu.co
Rec.: 24.09.2014 Acep.: 10.06.2015
Resumen
El desarrollo de sensores basados en nanoestructuras de polidiacétileno (PDA) se atribuye a sus propiedades cromáticas, actuando como transductor colorimétrico. Este material único permite un acercamiento de primer nivel de investigadores de ciencias básicas y aplicadas e ingeniería de biomiméticos cromáticos en el país, hacia la síntesis, características y propiedades de bloques nanométricos denominados liposomas para la construcción de sensores basados en polidiacétileno. En el presente estudio, se evaluó el periodo de fotopolimerización y el efecto de estímulos como temperatura, pH, interacción covalente y reconocimiento biomolecular sobre las propiedades cromáticas de los liposomas, su caracterización física se llevó a cabo mediante dispersión de luz dinámica, microscopía electrónica de barrido, y espectroscopia UV–Vis y Fluorescencia. Para efectos de comparación, el indicador denominado respuesta colorimétrica (RC%) se calculó a partir de los espectros de absorción UV–Vis. Una población dispersa de liposomas de tamaño nanométrico se utilizó para todos los experimentos. El valor de RC% más intenso (37,3%) se alcanzó cuando se adicionó una solución básica a los liposomas. En contraste, un RC% moderado de 14,0% y 12,0%, se obtuvo en los ensayos con liposomas funcionalizados con N–hidroxisuccinimida o Tripsina para reconocimiento de Albúmina de Suero Bovino (BSA). Los resultados muestran que los liposomas en solución son estables y facilitan el desarrollo de aplicaciones analíticas colorimétricas sencillas.
Palabras clave: Liposomas, polidiacétileno (PDA), fotopolimerización, respuesta colorimétrica.
Abstract
The development of Polydiacetylene (PDA) sensor due to their conjugation ability of biological or chemical recognition elements; which act as a colorimetric transducer. This particular material allows an approach to synthesis, characteristics and chromatic properties of nanometric blocks called liposomes for chromatic sensors based on PDA. In this research, were studied time of photopolymerization, and the effect of stimuli such as temperature, pH, covalent interaction and biomolecular recognition on chromatic properties of liposomes. Physical characterization of liposomes was performed by scattering light dynamic, scanning electronic microscopy, and UV –Vis and fluorescence spectroscopy. For comparison, the indicator called colorimetric response (CR %) was calculated from the UV –Vis spectra of absorption. A population of dispersed liposomes with nanosized was used for all experiments. The highest CR value was reached when a basic solution was added to the liposomes. In contrast, moderate CR % of 14.0% and 12.0%, was obtained in the trials with liposomes functionalized with N – hydroxysuccinimide or Trypsin for recognition of Bovine Serum Albumin (BSA). The results show that the liposomes are stable in solution and facilitate the development of simple colorimetric analytical applications.
Keywords: Liposomes, polydiacetylene, photopolymerization, colorimetric response.
Introducción
Los liposomas usados tradicionalmente para modelar la membrana celular, también son apreciados por sus características de nanomateriales, denominados nanoliposomas o vesículas submicrométricas de lípidos en doble capa, debido a la capacidad de encapsulación de la bicapa lipídica que es aplicada como vehículo de transporte y liberación de medicamentos o de agentes de contraste y se desempeñan como nanoreactores (Tavares et al, 2006). Las membranas biomiméticas lipídicas poseen dos regiones características a las cadenas hidrofóbicas y las cabezas hidrofílicas de los lípidos que la constituyen, permitiendo modificación de la composición y la configuración estructural o la conjugación funcional de la superficie del liposoma (Gómez y Fernández, 2005). Por consiguiente, se han estudiado liposomas compuestos de ciertos monómeros anfifílicos que se autoensamblan en la bicapa lipídica junto a lípidos naturales y al ser polimerizados incrementan la rigidez y estabilidad de la nanoestructura en estudios de modelamiento celular, como por ejemplo los monómeros de metacriloilos, vinilos o diacetilenos (Rotello & Thayumanavan, 2008; O'Brien, 1985). El Polidiacetileno (PDA) de cadena larga despliega propiedades cromáticas y fluorescentes excepcionales que promueven su uso como el elemento de transducción en sensores ópticos. La cadena polimérica de PDA formada durante el proceso de fotopolimerización se compone de dobles y triples enlaces alternados, que se comportan como cromóforos a 650 nm. Cuando el PDA se estimula por agentes externos que afectan la conjugación polimérica, la intensidad de la interacción causa un cambio en la disposición espacial de la cadena polimérica que induce el desplazamiento de la señal de absorción de luz a 540 nm y representa un cambio visual de azul a rojo ( Kim et al., 2012; Yuan, 2008). La posibilidad de modificar el Diacetileno (DA) monomérico con elementos de reconocimiento biológico y molecular incrementa el número de nanoestructuras de mezclas de diacetileno y lípidos disponibles para el análisis de interacciones químicas y biológicas. La propiedad de los liposomas para desempeñarse simultáneamente como el elemento sensor de la interacción física o química con el analito y como el elemento de transducción de la señal analítica debido a la transformación colorimétrica causada, promueve la explotación de sensores ópticos constituidos por liposomas para la detección de virus, toxinas, bacterias y analitos químicos de interés (Sun et al., 2010; Jaworski et al., 2011; Dogra et al., 2012; Lee et al., 2012). Entre las modificaciones superficiales de los liposomas de PDA/lípido para reconocimiento de analitos, se utilizan frecuentemente la inserción por afinidad química o inmovilización covalente. Por ejemplo, una reacción química de acoplamiento inmoviliza ligandos en el monómero DA que pueden ser agentes de reconocimiento químico o biológico, como aminoácidos, oximas y péptidos, que facilitan la determinación química de pH, fluorofosfatos de diisopropilo, y trinitrotolueno (Jaworski et al., 2011; De Oliveira et al., 2013). En cuanto a los receptores biológicos covalentemente inmovilizados en la membrana lipídica de los liposomas algunos como biotina, epitopes específicos, glicolípidos y lisina se han aprovechado para el reconocimiento de estreptavidina, anticuerpos, Escherichia coli y Salmonella, entre otros (Jaworski et al., 2011; Dogra et al., 2012; Lee et al., 2012 . La Albúmina Sérica Bovina (BSA), puede formar enlaces covalentes con el ligando éster de hidroxisuccinimida, al igual que sirve de substrato para la actividad proteolítica de la enzima tripsina modelable para diversos sistemas bioquímicos (Kim et al., 2010; Sun et al., 2010). Por lo tanto, se seleccionó como modelo para las interacciones con el ligando molecular y con el ligando biológico.
Las herramientas analíticas basadas en liposomas poliméricos cuantifican la conversión de los liposomas conjugados azules a rojos mediante el indicador, respuesta colorimétrica porcentaje (RC%) que ofrece la ventaja de una parametrización sencilla de la transición colorimétrica resultante de la interacción entre el analito con el PDA o el ligando del PDA modificado. El indicador estándar del cambio colorimétrico se define a través de la ecuación 1, reportada por Sun et al. (2010):
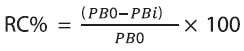
Donde PB0 = Aazul / (Aazul+ Aroja). PB0 y PBi corresponde a la relación de la máxima absorbancia entre la banda azul (Aazul, a 650 nm) y la banda roja (Aroja, a 540 nm) presentada por la muestra no perturbada (PB0) y por la muestra perturbada (PBi), respectivamente. Este estudio presenta un acercamiento a la síntesis, características y propiedades de los bloques nanométricos denominados liposomas para la construcción de sensores basados en polidiacteileno, distinguiendo quimiosensores de pH, afinidad molecular y reconocimiento biológico para la formación de primer nivel de investigadores de ciencias básicas y aplicadas e ingeniería de biomiméticos cromáticos en el país.
Materiales y métodos
Reactivos
El ácido 10, 12–pentacosadiinoico (APCD o DA, C25H41O2) se obtuvo de GFS chemicals. Dimiristoil– sn–glicero–3–fosfocolina (DMPC) se adquirió de Avanti Polar Lipids. N–hidroxisuccinimida (NHS), buffer de fosfato salino pH 7.4 (PBS), ácido clorhídrico, hidróxido de sodio, BSA, tripsina, fueron obtenidas de Sigma Aldrich. La membrana de diálisis de éster de celulosa de 300 KDa, se adquirió a Spectrum Laboratories.
Preparación de liposomas
Los liposomas se prepararon a partir de una mezcla de DA (80%) y DMPC (20%) obteniendo una concentración final de 1 mM, siguiendo el método de depósito de capa delgada combinado con tratamiento de ultrasonido e hidratación con PBS a 10 mM y pH 7.4 presentada por Jiang et al. (2015). Lo anterior se realizó disolviendo los cristales de DA y DMPC en diclorometano y luego se filtró y se llevó a roto evaporación bajo condiciones de vacío durante 30 minutos hasta la deposición de una capa delgada y uniforme; seguido se llevó la capa de hidratación en baño ultrasónico bajo un poder de sonicación de 110 W hasta disolución de la capa en el buffer de fosfato salino a 10mM y pH 7.4. La dispersión lechosa obtenida se llevó a homogenización por ultrasonido bajo las condiciones de 75°C, 25 % de amplitud de onda, ciclo de pulso de 1:5 s y una emisión energética de 3000 J; posteriormente se filtró usando una membrana de policarbonato de tamaño de poro 1 µm. La formación de nanoliposomas se promovió bajo refrigeración durante 8 horas. Previamente para cada ensayo, los liposomas se fotopolimerizaron en un contenedor de vidrio refrigerado mediante irradiación UV (λ=245 nm) emitida por una lámpara de mercurio de sonda Entela modelo PS1, durante 5 minutos. Los liposomas sin polimerización se funcionalizaron con N–hidroxisuccinimida (DA–NHS), reemplazando un 20% del monómero de DA por el monómero DA–NHS.
Caracterización de liposomas
Los liposomas se caracterizaron usando un espectrofotómetro Perkin Elmer Lambda 25 y un fluorómetro Perkin Elmer LS 55. La apertura de ventana del espectro de absorción fue 1 nm y una velocidad de escaneo de 60 nm por minuto. Las condiciones del espectro de emisión fueron 4 nm, la longitud de onda de excitación fue de 440 nm y velocidad de escaneo 250 nm por minuto. Las imágenes de liposomas se tomaron en un microscopio electrónico de barrido FEI–Quanta 450 mediante depósito de la solución de liposomas tinturadas con óxido de osmio (0,5%) sobre una gradilla metálica. La distribución de tamaño de los liposomas se analizó por la técnica de dispersión de luz dinámica (DLS) empleando el instrumento DynaPro– MSXTC adquirido a Wyatt Technology y el software DYNAMICS, la dilución adecuada de la suspensión obtenida se llevó a 37 °C para exploración de luz incidente a 90° y se registraron los datos cada 10s.
Comportamiento óptico a diferentes estímulos
El estudio del comportamiento de los liposomas incluyó el tiempo de polimerización y el efecto de temperatura, pH, interacción química y biológica. Para todos los ensayos se utilizaron 2.0 mL de una solución recién preparada de liposomas, contenidos en una celda de vidrio de 1.0 cm.
Tiempo de fotopolimerización a 254 nm. 2 mL de liposomas se polimerizaron durante 3 ,5 10, 20 y 30 minutos de exposición a luz UV. Inmediatamente el espectro de absorción se registró.
Efecto de temperatura. Los liposomas se polimerizaron 5 minutos y se introdujeron en un baño de agua termostatado a 55 °C, durante 10 minutos. El espectro de absorción se obtuvo antes y después del procedimiento. También se determinó la emisión fluorescente aplicando una longitud de onda de excitación de 440 nm en el rango de 500 a 700 nm (De Oliveira et al, 2013).
Efecto del pH. A 2 mL de liposomas polimerizados se les adicionó 120 µL de hidróxido de sodio 0,5 M o ácido clorhídrico 0,5 M, respectivamente para cada pH y dejados en reposo durante 10 min. El pH de las soluciones finales se determinó con un pHmetro y se registró el espectro de absorción (Charoenthai et al., 2011)
Efecto de la interacción química y biológica. La evaluación del efecto de interacción entre el DA–NHS y ligandos que contienen grupo amino accesible consistió en una reacción de 2 mL de liposomas que contienen DA–NHS, DA y DMPC con 220 µL de una solución de BSA a 1 µM. La determinación de la interacción biológica se basó en inmovilizar tripsina a 1 µM en la superficie de las liposomas sin polimerizar. La tripsina libre se removió mediante diálisis. 2 mL de la solución de liposomas con tripsina inmovilizada en la superficie se polimerizó por 5 minutos y se adicionaron 200 µL de Albumina Sérica Bovina a una concentración de 1 µM, como substrato biológico. Después de 10 minutos de reacción, se obtuvo el espectro de absorción.
Los liposomas expuestos a efecto de pH, interacción química y biológica fueron registrados fotográficamente, estas imágenes se analizaron por el valor RGB obtenido del software image J®.
Resultados y Discusión
Caracterización de liposomas
Los liposomas de DA: DMPC en una relación molar de 8:2 y de DA: DA–NHS: DMPC en una relación molar de 6:2:2, fueron obtenidos en base al auto–ensamblamiento de los lípidos naturales y sintéticos promovido por las fuerzas hidrófobas de afinidad en conjunto con interacciones de Van der Waals, fuerzas de hidratación e interacciones electrostáticas que poseen las cadenas hidrocarbonadas dispersas en el medio acuoso durante la preparación de los liposomas, como se presenta en la figura 1A. La interacción de la fase acuosa y lipídica permitió la organización de la doble capa lipídica que limita dos fases acuosas independientes semejantes a los sistemas intra y extracelular así como membranal, semejantes a los liposomas bilipídicos estudiados por Rotello & Thayumanavan (2008), y Oliver & Parikh (2010). En la figura 1B, se presenta la reacción de polimerización de los monómeros lipídicos de DA y DA–NHS activada por la irradiación con luz ultravioleta, la cual induce el proceso de topo–polimerización mediante la activación de radicales libres, a una velocidad de reacción de primer orden y mecanismo de adición 1,4 descrita por Pingshng et al. (2003) y Berrehar et al. (2004).
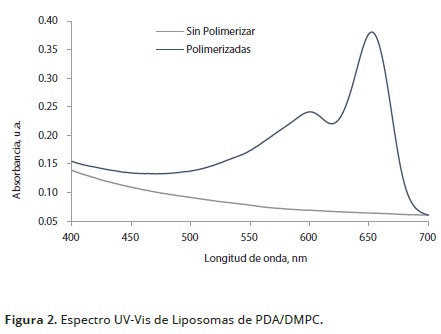
La solución de liposomas polimerizados a 1 mM, constituidos por una mezcla de DA y DMPC se caracterizó por espectroscopia de absorción como se muestra en la Figura 2. En el espectro de absorción molecular del PDA (trazo azul) se identifica la banda de absorción característica de la forma azul a 651 nm, que corresponde a la transición –*, resultante de la conjugación polimérica de la cadena ene – ino que contiene los electrones según lo afirma Yuan y Hanks (2008). Además de esta banda de excitación, se presenta un hombro a 593nm que corresponde a la absorción de vibración del PDA descrita por Kim et al. (2012). Cuando el espectro visible se compara con el espectro de los liposomas sin polimerización, estas bandas de absorción están ausentes (trazo verde). Los centros reactivos del triple enlace solamente rotan, mientras que el empaquetamiento espacial de la cadena polimérica se forma de una cadena alternada de dobles y triples enlaces ordenados, reportadas también por Reppy y Pinzola (2007). Las estructuras resultantes, tanto en el caso de los liposomas como de otros sistemas macromoleculares organizados de PDA acumulan estrés a lo largo de la cadena polimérica inferido por Filhol et al. (2009). Este estrés contribuye a cambios en la deslocalización de los orbitales , que hace a los liposomas sensibles a varias perturbaciones externas, que incluyen, temperatura, polaridad del solvente, pH, presión, interacciones químicas y biológicas.
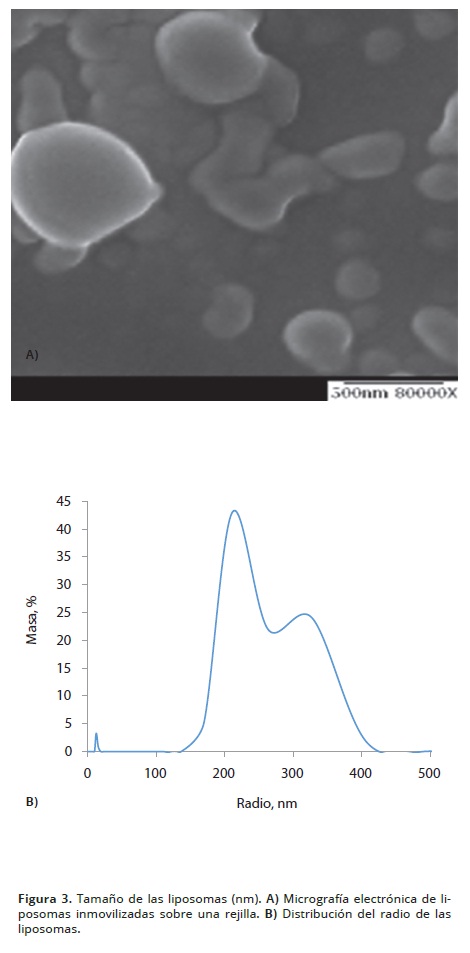
La Figura 3A, presenta la micrografía electrónica (SEM) de los liposomas con un tamaño promedio de 250 nm de radio. Para confirmar el tamaño de los liposomas la solución se evaluó mediante DLS (Figura 3B) con radio promedio de 211 nm para el 50 % de la masa de la muestra y de 324 nm para el 27%, que permitió establecer un promedio general de 258 ± 10 nm. El tamaño de la población de los liposomas apareció muy disperso, como se ha demostrado para este tipo de compuestos sintetizados por el método de ultrasonido como los liposomas obtenidos por Reppy y Pinzola (2007).y Kim et al. (2010).
Comportamiento óptico a diferentes estímulos
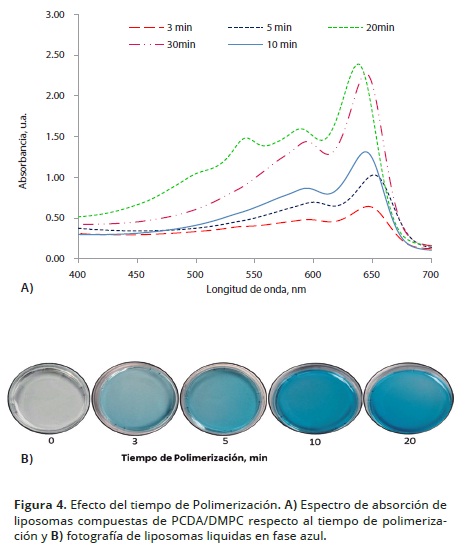
La Figura 4A presenta los espectros UV–Vis de los liposomas en función del tiempo de polimerización. El comportamiento observado consistió en un incremento gradual de la intensidad de absorción a 651 nm con respecto al periodo de fotopolimerización. La mayor intensidad de absorción se obtuvo cuando los liposomas se expusieron a la luz UV por 20 minutos; sin embargo, la longitud de onda de la máxima absorción experimentó un cambio hipsocrómico de 651 a 644 durante irradiación prolongada, de 10 a 20 minutos. Este comportamiento indica la inducción de un fenómeno irreversible en la transición colorimétrica correspondiente al cambio de configuración de la longitud del enlace de la cadena conjugada del polidiacétileno. Lo anterior, limita la capacidad de transducción colorimétrica de los liposomas en las interacciones biológicas o químicas que incluyen comportamientos como baja sensibilidad o respuestas analíticas erróneas. Por lo tanto, se escogió 5 minutos como el tiempo de polimerización de los liposomas.
En el caso de exposición de los liposomas a 30 minutos de irradiación, se observan dos bandas adicionales a 547 y 500 nm, mientras la intensidad máxima de la banda azul disminuyó un 55% y presentó un desplazamiento hacia 635 nm. Esta nueva fase de los liposomas, se designan como liposomas rojos debido al cambio colorimétrico característico que experimentan, reportadas por Sun et al. (2010). Aunque no está completamente entendido el fenómeno de transición colorimétrica, se conoce que cuando la cadena lateral del PDA interactúa con agentes físicos o químicos, se libera tensión de las cadenas laterales a la cadena conjugada polimérica. La transferencia de este efecto perturbador distorsiona parcialmente los orbitales * deslocalizados, afectando la extensión total de la conjugación que resulta en un nuevo arreglo espacial con acortamiento de la longitud de los enlaces descrito por Siano et al. (2011), y Bhushan et al. (2013). Se estima que en el proceso de sobreirradiación induce a la deslocalización y la relajación de los enlaces en la cadena conjugada, que conducen a la fase roja de los liposomas.
La Figura 4B, presenta el incremento gradual de la intensidad del color azul perceptible a simple vista como función del tiempo de polimerización. Aquí se observa un aparente aumento de la intensidad de la coloración preservando su tonalidad azul como las observadas por Mehravar y Sardari (2011).
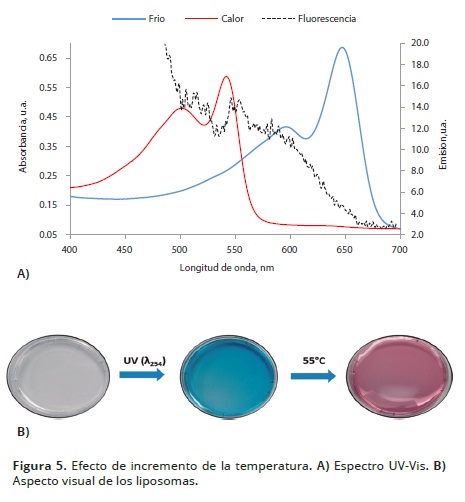
La Figura 5, contiene los espectros UV–Vis de los liposomas sometidos a tratamiento térmico. En el espectro de los liposomas polimerizados de la Figura 5A (trazo azul), se muestra la banda de absorción de la fase azul característica a 646 nm. Sin embargo, cuando los liposomas se exponen a un incremento gradual de temperatura hasta 55°C, se obtiene el espectro denotado por la curva roja. En esta aparece una nueva banda de absorción a 547 nm, mientras que la intensidad de la banda a 646 nm disminuyó. Este comportamiento resulta de la reorganización espacial de la cadena polimérica en respuesta a la perturbación externa. Esta transición colorimétrica es perceptible visualmente como se muestra en la figura 5B. La curva a trazos representa el espectro de fluorescencia característico de liposomas de PDA resultante del cambio colorimétrico de azul a rojo, después de exponer la solución de liposomas a la temperatura de 55ºC. En este espectro se observó una banda de emisión a 560 nm que se superpone sobre una banda de menor intensidad a 610 nm como la observada por Bhushan et al. (2013). Se presume que la perturbación termocrómica reduce la longitud conjugada efectiva de la cadena polimérica y cambia la banda de absorción electrónica a longitudes de onda más cortas descritas por Yuan y Hanks (2008).
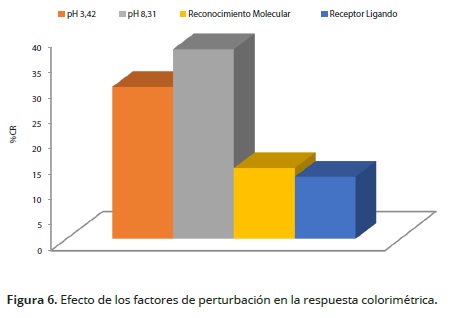
El cambio óptico de los liposomas en respuesta a la adición de ácido, base, enlace covalente de una proteína (interacción receptor–ligando) y actividad enzimática fueron evaluados mediante la respuesta colorimétrica porcentual (RC%). En la Figura 6 se aprecia que la mayor respuesta colorimétrica se obtuvo en presencia de NaOH a pH 8.31, con un RC de 37,3%. Se interpreta como la interacción entre el hidrogenión del grupo carboxilo del PDA y el hidroxilo proveniente del hidróxido de sodio, mientras que la adición de ácido clorhídrico tuvo un efecto menor en la respuesta colorimétrica (29,9%), similar a los resultados obtenidos por Charoenthai et al. (2011).
La inmovilización covalente del elemento de reconocimiento químico o biológico en la superficie del liposoma, facilita la interacción con una molécula reactiva o con el sustrato biológico y promueve una transformación colorimétrica. La reacción química entre la N–hidroxisuccinimida y el grupo amino del aminoácido lisina, proveniente de la albúmina sérica bovina (BSA) origina la transición colorimétrica, con un CR de 13,9%. Por otra parte, el reconocimiento biológico entre el receptor tripsina y el ligando BSA, ocasionó la transición colorimétrica con un CR de 12,0%.
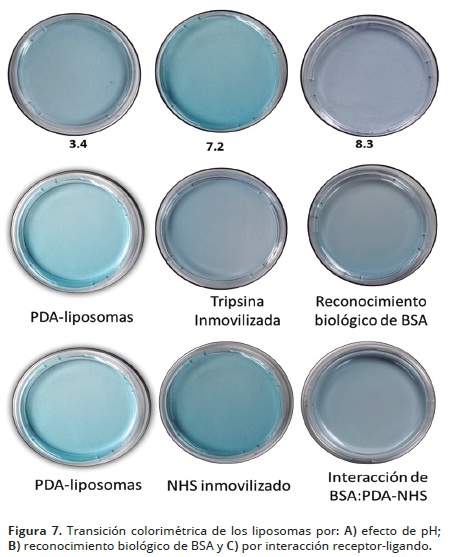
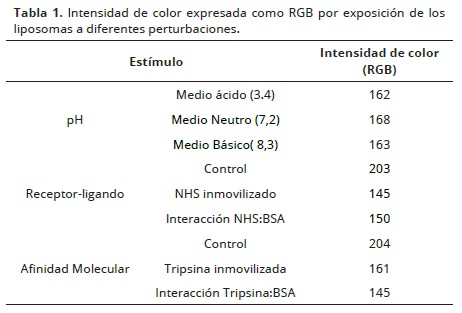
La Figura 7, contiene las fotografías de las transiciones colorimétricas resultantes de aplicar las perturbaciones de pH, reconocimiento molecular y receptor ligando. De tal forma que encontramos cambios en la intensidad de la tonalidad azul alcanzando un cambio del azul a un tono morado que se hace más oscuro en medio básico (figura 7A), actividad tripsina: BSA (figura 7B) e interacción covalente del grupo hidroxisuccinimida: BSA (Figura 7C). Las fotografías muestran que los liposomas polimerizados sin y con funcionalización del receptor de BSA o con tripsina, posterior a la polimerización, corresponde al color azul característico. En adición a lo anterior, se presentan cambios de intensidad de color como el púrpura, posiblemente como consecuencia de la clase de interacción de los grupos laterales de la cadena conjugada del PDA con el estímulo presentado en el medio que rodea los liposomas. Así, la intensidad de color perceptible visualmente analizado con el parámetro valor RGB (azul, verde, rojo por sus siglas en inglés) se presenta en la Tabla 1. Los liposomas expuestos a cambio de pH, interacción receptor–ligando e interacción molecular (actividad enzimática) presentaron una reducción del valor RGB, siendo mayor la reducción para el sistema enzima: sustrato seguido del sistema liposoma de APCD–NHS: BSA e interacción de grupos hidroxilos o protones con la cabeza polar del PDA. Lo anterior indica que el análisis de RGB de los diferentes ensayos de los liposomas presentó cambios en las intensidades de color del rojo, verde y azul registrados mediante el análisis de la imagen.
Conclusión
- Los factores como tiempo de polimerización, temperatura y pH afectan las propiedades cromáticas de las vesículas. Este polímero expone las interacciones moleculares de carácter químico y biológico desarrolladas en la superficie de la nanoestructura mediante el %RC. Por lo tanto, las vesículas de diacetileno, pueden ser usadas como plataformas de especificidad de analitos de interés por inmovilización de receptores químicos y biológicos en la superficie. Las propiedades de emisión del polidiacétileno pueden ser una alternativa explorable como señal de detección para el diseño de herramientas analíticas portables y de uso sencillo.
Referencias
Berrehar. J. Lapersonne–Meyer. C. Schott. A. M. Weiserg. (2004). A high energy exciton in polydiacetylene chains, involving electrons localized on the triple bond. Chem Phys, 303, 129–136. doi:10.1016/j.chemphys.2004.05.018. [ Links ]
Bhushan. B. Kundu. T. & Singh. B. P. (2013). Nonlinear optical properties of two differ nanoassemblies of polydiacetylene (PDA): PDA nanovesicles and PDA nanocrystals. Opt Phot J, 3, 278–286. doi: 10.4236/opj.2013.34042. [ Links ]
Charoenthai. N. Pattanatornchai. T. Wacharasindhu. S. & Sukwattanasinitt. M. Traiphol. R. (2011). Roles of head group architecture and side chain length on colorimetric response of polydiacetylene vesicles to temperature, ethanol and pH. J Colloid Interf Sci, 360(2), 565–573. doi: 10.1016/j.jcis.2011.04.109. [ Links ]
De Oliveira. T. Soares. N. de F.F. Silva. D. J. De Andrade. N. J. Medeiros. A. A. Badaró. A. T. (2013). Development of PDA/phospholipids/lysine vesicles to detect pathogenic bacteria. Sensor Actuat B–Chem, 188, 385–392. doi: 10.1016/j.snb.2013.06.022. [ Links ]
Dogra. N. Li. X. & Kohli. P. (2012). Investigating ligand–receptor interactions at bilayer surface using electronic absorption spectroscopy and fluorescence resonance energy transfer. Lagmuir, 28(36), 12989–12998. doi: 10.1021/la300724z. [ Links ]
Filhol. J.–S. Deschamps. J. Barisien. T. Legrand. L. Dutremez. S. G. Boury. B & Schott. M. (2009). Polymorphs and colors of polydiacetylenes: A first principles study. J Am Chem Soc, 131(20), 6976–6988. doi: 10.1021/ja803768u. [ Links ]
Jaworski. J. Yokoyama. K. Zueger. C. Chung. W–J. Lee. S–W. Majumdar. A. (2011). Polydiacetylene incorporated with peptide receptors for the detection of trinitrotoluene explosives. Langmuir, 27(6), 3180–3187. doi: 10.1021/la104476p. [ Links ]
Jiang. L. Luo. J. Dong. W. Wang. C. Jin. W. Wang. H. Ding. H. Jiang. L. He. H. & Xia. Y. (2015). Development and evaluation of a polydiacetylene based biosensor for the detection Of H5 influenza virus. J Virol Methods, 219, 38–45. doi: 10.1016/j.jviromet.2015.03.013. [ Links ]
Kim. G. Song. S. Lee. J. Kim. J. (2010). Size–controlled fabrication of supramolecular vesicles for the construction of conjugated polymer sensors with enhanced optical properties. Langmuir, 26(23), 17840–17842. doi: 10.1021/la103920p. [ Links ]
Kim. Y. R. Jung. S. Ryu. H. Yoo. Y.E. Kim. S.M. Jeon. T. J. (2012). Synthetic biomimetic membrane and their sensor applications. Sensor, 12(7), 9530–9550. doi:10.3390/s120709530. [ Links ]
Lee. J. Seo. S. & Kim. J. (2012). Colorimetric detection of warfare gases by polydiacetylenes toward equipment–free detection. Adv Funct Mater, 22(8), 1632–1638. doi: 10.1002/adfm.201102486. [ Links ]
Mehravar. M. & Sardari. S. (2011). Screening of antimicrobial membrane–active metabolites of soil micro fungi by using chromatic phospholipid/polydiacetylene vesicles. J Mycol Med, 21(3), 188–197. doi: 10.1016/j.mycmed.2011.07.005. [ Links ]
O'Brien. D. Klingbiel. R. Specht. D. TyminsKi. P. (1985). Preparation and characterization of polymerized liposomes. Ann N Y Acad Sci, 446, 282–295. doi: 10.1111/j.1749–6632.1985.tb18408.x. [ Links ]
Oliver. A. E. & Parikh. A. N. (2010). Templating membrane assembly, structure, and dynamics using engineered interfaces. Biochim Biophys Acta, 1798(4), 839–850. doi: 10.1016/j.bbamem.2009.12.029. [ Links ]
Reppy. M. A. & Pindzola. B. A. (2007). Biosensing with polydiacetylene materials: structures, optical properties and applications. Chem Commun, 42, 4317–4338. doi: 10.1039/B703691D. [ Links ]
Rotello. V. & Thayumanavan. S. (2008). Molecular recognition and polymers: control of polymer structure and self–assembly. Nueva Jersey. Editorial Wiley. 440 p. [ Links ]
Siano. A. Humpola. M.V. Rey. M. C. Simonetta. A. & G. G. Tonarelli. G.G. (2011). Interaction of acylated and substituted antimicrobial peptide analogs with phospholipid–polydiacetylene vesicles. Correlation with their biological properties. Chem Biol Drug Des, 78(1), 85–93. doi: 10.1111/j.1747–0285.2011.01099.x.
Sun. S. Chen. T. Huang. S. Li. L. Peng. H. (2010). Chromatic polydiacetylene with novel sensitivity. Chem Soc Rev, 39, 4244–4257. doi: 10.1039/C001151G. [ Links ]
Tavares. G. Viana A. C. M. Araújo. B. J.G.V.C. Ramaldesa. G. A. Carvalho. C. W. S. Pesquerob. J. L. Vilelad. J.M.C. Andrade. D. M. S. de Oliveira. A. M. C. (2006). Development and physico–chemical characterization of cyclodextrin–DNA complexes loaded liposomes. Chem physics letters, 429, 507–512. doi:10.1016/j.cplett.2006.08.043. [ Links ]
Yuan. Z. Hanks. T. (2008). A reversible colorimetric and fluorescent polydiacetylene vesicle sensor platform. Polymer, 49(23), 5023–5026. doi: 10.1016/j.polymer.2008.09.008. [ Links ]