Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.65 no.4 Palmira Oct./Dec. 2016
https://doi.org/10.15446/acag.v65n4.51013
http://dx.doi.org/10.15446/acag.v65n4.51013
Evaluación del efecto de la bioestimulación sobre la biorremediación de hidrocarburos en suelos contaminados con alquitrán en Soacha, Cundinamarca – Colombia
Evaluation of the biostimulation over the bioremediation of hydrocarbons in contaminated soils with tar in Soacha, Cundinamarca– Colombia
Victoria Eugenia Vallejo Quintero*, John Jairo Sandoval Cobo, Sandra Catalina Garagoa Barahona y Johannes Bastos Arenas
Universidad Central de Colombia. Grupo Agua y Desarrollo Sostenible, Facultad de Ingeniería. Bogotá D.C., Colombia. *Autora para correspondencia: evallejoq@ucentral.edu.co
Rec.:03.06.2015 Acep.:11.08.2015
Resumen
El presente estudio, evaluó el efecto de la bioestimulación en la biorremediación de un suelo contaminado con alquitrán generado durante la producción de carbón vegetal artesanal. Se empleó suelo contaminado con alquitrán (∼12,000 mg TPH/kps) proveniente del área de estudio y se montaron ocho (8) mesocosmos (n=2), simulando condiciones de biolabranza bajo un entorno controlado en laboratorio por un periodo de 60 días. Se evaluaron dos tratamientos: fertilizante inorgánico compuesto (FIC) y urea más K2HPO4 (U), además de dos controles: atenuación natural y abiótico. Adicionalmente, se realizó el seguimiento del proceso de biorremediación a través de la medición de variables fisicoquímicas (Temperatura, pH, porcentaje de humedad, carbono orgánico, nutrientes e hidrocarburos totales de petróleo–TPHs) y microbiológicas (Recuento en placa de microorganismos heterótrofos y de degradadores de alquitrán). El mayor porcentaje de remoción de TPHs, se obtuvo en el tratamiento con FIC (28%), seguido del tratamiento con U (24%) y por último, el control de Atenuación Natural (6%). Se concluyó, que la adición de nutrientes estimuló la densidad de microorganismos heterótrofos y degradadores, lo cual optimizó el proceso de biodegradación de suelos contaminados con alquitrán, evidenciado por una disminución significativa en la concentración de TPHs en los tratamientos al final del estudio.
Palabras clave: Alquitrán, biolabranza, Hidrocarburos Totales de Petróleo (TPHs), recuperación de suelos, tratamientos biológicos.
Abstract
In this research, the effect of biostimulation on the bioremediation of a soil contaminated with tar generated during the production of artisanal charcoal was evaluated. Eight (8) laboratory mesocosm (n=2) containing tar–contaminated soil (12,000 mgTPH/kgps) taken from an artisanal charcoal factory were evaluated during 60 days under two land farming treatments and two control systems: addition of inorganic compound fertilizer (FIC), addition of urea plus K2HPO4 (U), abiotic control and natural attenuation. In addition, the performance of the bioremediation treatments was evaluated through monitoring of physiochemical (temperature, pH, moisture content, organic carbon, nutrients and total petroleum hydrocarbons–TPHs) and microbiological parameters (heterotrophic plate count microorganisms and degraders of tar). The highest removal percentage of TPH was obtained through FIC treatment (28%), followed by treatment with U (24%) and natural attenuation (6%). It was concluded that the addition of nutrients stimulated a growth in the density of heterotrophic microorganisms and degraders, which optimized the biodegradation process of the soil contaminated with tar, as evidenced by a significant decrease in the concentration of TPH for the treatments at the end of the study.
Keywords: Biological treatments, landfarming, Soil remediation, Tar, Total Petroleum Hydrocarbons (TPHs).
Introducción
En Colombia, la extracción, producción y utilización de leña y carbón vegetal se ha mantenido vigente e incluso, se ha incrementado, a nivel doméstico, industrial y comercial. No obstante, en años recientes se ha promovido la valorización y aprovechamiento de residuos de madera (p.e., fábricas de muebles, material de embalaje, entre otros), que, de otra forma, terminarían dispuestos de una forma inadecuada.
En Soacha, Cundinamarca – Colombia, se lleva a cabo la mayoría de producción de carbón vegetal de forma artesanal, empleando hornos de parvas o de tierra (hornos rústicos), con quemas a cielo abierto y emisiones no controladas, con las resultantes afectaciones de salud tanto a sus trabajadores como a las comunidades aledañas. En esta, como en varias zonas del mundo la fabricación artesanal de carbón a partir de madera emplea una baja tecnología en el proceso y no incorpora protocolos adecuados para el manejo y disposición de los residuos y subproductos (contaminantes) generados.
Algunos de los contaminantes generados durante la producción de carbón vegetal artesanal son de gran interés ambiental: aldehídos, el ácido acético, los ácidos carboxílicos y los alquitranes. Estos últimos son particularmente abundantes y contienen entre otros: hidrocarburos totales de petróleo (TPHs), hidrocarburos policíclicos aromáticos (HPAs), compuestos fenólicos y bases nitrogenadas aromáticas, sustancias que dadas sus características eco–toxicológicas (mutagénicas, teratogénicas y carcinogénicas) representan un alto riesgo ambiental (Cerqueira et al. 2014). Adicionalmente, muchas de las sustancias contenidas en los TPHs, y en particular los HPAs, son clasificadas como peligrosas y persistentes por la EPA (Agencia de Protección Ambiental de los Estados Unidos).
Durante los últimos años ha sido objeto de intensa investigación la evaluación de tratamientos biológicos enfocados a recuperar suelos contaminados con TPHs y HPAs provenientes de distintas actividades (Suja et al. 2014; Vallejo et al. 2005). La biorremediación se considera una alternativa económica, relativamente sencilla, ambientalmente amigable y aplicable a grandes áreas que permite, bajo condiciones ambientales y edáficas ideales, la mineralización completa de contaminantes a compuestos menos tóxicos o inocuos, como: CO2 y H2O (Cunningham & Philp, 2000).
Los suelos contaminados con TPHs generalmente presentan un exceso de carbono proveniente del contaminante, mientras que elementos como el nitrógeno y el fósforo se encuentran en bajas concentraciones para mantener un balance de nutrientes (C: N: P) limitando el proceso de biodegradación (Vallejo et al. 2005; Gómez, 2009; Arrieta, 2011; García et al. 2011; Arrieta et al. 2012).
La remoción eficiente de TPHs en suelos contaminados con hidrocarburos mediante bioestimulación con base en la adición de FIC, SIS, urea y residuos orgánicos, ha sido reportada por distintos autores (García et al. 2011; Ikhajiagbe et al. 2011; Agamuthu et al. 2013).
El objetivo del presente estudio, consistió en evaluar la eficiencia de la bioestimulación en la remoción de TPHs presentes en un suelo contaminado con alquitrán, proveniente de una fábrica artesanal de carbón vegetal, comparando la adición de dos fuentes de nutrientes: un FIC y CO(NH2)2 más K2HPO4 (U).
Materiales y métodos
Suelo
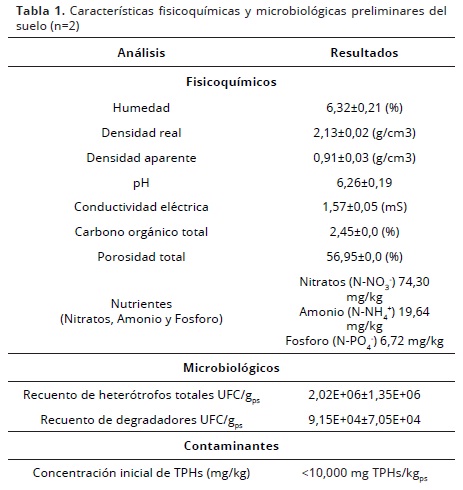
El suelo utilizado fue tomado de una de las carboneras más representativas del sector productivo artesanal en el municipio de Soacha, Cundinamarca– Colombia (4° 33' 38,61'' N; 74° 12' 46,98'' W). Las muestras se tomaron a una profundidad de 15 cm, provenientes de dos laderas de las carboneras cercanas a los hornos de producción. Para lo cual, se delimitaron 4 cuadrantes representativos (2 × 2 m) y a partir de ellos se tomaron 4 muestras compuestas aleatorias (∼500 g), cada una, constituidas de 15 submuestras de suelo. Las muestras se recolectaron haciendo uso de barrenos rectos (1m de largo y un diámetro de 1''), y fueron empleadas para la estandarización de pruebas fisicoquímicas y microbiológicas, así como para la realización de la caracterización inicial del suelo (Tabla 1).
Los análisis iniciales indicaron una concentración de TPHs <10,000 mg.kg-1 (Tabla 1); dicha concentración se considera que no proporciona el carbono necesario para mantener un crecimiento y actividad óptimo de los microorganismos degradadores (EPA, 2004), por lo que se decidió incrementarla artificialmente para los ensayos. De otro lado, la mayoría de propiedades fisicoquímicas y microbiológicas se encontraron dentro de los rangos adecuados para implementar estrategias de biorremediación, excepto por el pH y la humedad que debieron ser ajustados previo al inicio de los experimentos para llevarlos a rangos considerados como adecuados (6,0 – 8,0 para pH y 10 – 30% de humedad) para este tipo de tratamientos (EPA, 2004).
Contaminación del suelo y montaje de los tratamientos
La contaminación del suelo se hizo adicionando alquitrán líquido obtenido del proceso de fabricación. Se requirieron de tres adiciones de alquitrán, seguido de una etapa de intemperización y homogenización por una semana a través de volteos manuales para alcanzar una concentración final de ∼12,000 mg TPH/kgps. La mezcla suelo–alquitrán se distribuyó en 8 mesocosmos (n=2) (cajas de aluminio con una dimensión de 30 X 40 X 15 cm) hasta alcanzar una altura de ∼10 cm. Cada mesocosmo se llenó con ∼25,92 kg de la mezcla suelo–alquitrán y se ubicó en una terraza tipo invernadero perteneciente a la facultad de Ingeniería ambiental de la Universidad Central en Bogotá.
Con base en las concentraciones de N y P presentes en el suelo original (Tabla 1) se ajustó la relación de nutrientes: C: N: P (100:10:1), reportada como eficiente en numerosos estudios de biorremediación de hidrocarburos (Vallejo et al. 2005; Gómez et al. 2009; García et al. 2011; Acuña et al. 2012). Los dos tratamientos de bioestimulación con diferentes tipos de fertilizantes y los dos controles se describen a continuación:
Tratamiento 1: FIC (NPK) marca ABONAGRO® en una relación: 100:10:1: Para la adición de los nutrientes se tuvo en cuenta la cantidad de TPHs presente en el alquitrán (12,000 mg.Kg-1ps TPHs), así como la cantidad inicial de nutrientes presentes en el suelo de estudio (Ntotal: Nitratos + Amonio= 74,30 y 19,64 mg.Kg-1, respectivamente y P Soluble= 6,72 mg.Kg-1) (Tabla 1). De acuerdo a lo anterior, se disolvieron ∼192 g de FIC (que contenía 15 g N.100 g-1 fertilizante) por cada mesocosmo.
Tratamiento 2: CO (NH2)2 y K2HPO4 (U): Se adicionaron 20,79 g de K2HPO4 y 79,22 g de CO (NH2)2 (Proporción 100:10:1) por cada mesocosmo.
Control de atenuación natural: sin adición de fertilizante, ni volteo periódico ni adición de agua.
Control abiótico: adición de HCl 2M y formaldehido (CH2O) para inhibir el crecimiento microbiano.
Los tratamientos de bioestimulación fueron aireados (2 veces por semana) utilizando palas de jardinería con el objetivo de suministrar el oxígeno necesario para los microorganismos degradadores y favorecer la degradación de los TPHs, bien sea a través del volteo periódico o del arado. Así mismo, se mantuvo una proporción de humedad adecuada y constante durante el proceso, mediante la adición de agua una vez por semana, intentando mantener la capacidad de campo de los mesocosmos, evitando la sobresaturación de agua.
Métodos fisicoquímicos y análisis del contaminante
Para el monitoreo de la biorremediación se evaluaron las siguientes propiedades fisicoquímicas: pH, humedad y carbono orgánico total. Adicionalmente, se determinó nitratos, amonio y fósforo empleando un espectrofotómetro de HACH (DR– 2700). Finalmente, para el análisis de TPHs, se utilizó el método de extracción por agitación mecánica y determinación gravimétrica, modificado por Vallejo et al. (2005), empleando como solventes una mezcla en proporción 1:1 diclorometano–acetona.
Métodos microbiológicos
Para el recuento de microorganismos heterótrofos se empleó el método de recuento en placa en medio agar nutritivo. Posteriormente, las cajas fueron incubadas a una temperatura de 23°C durante 4 días. Para el recuento de microorganismos degradadores se implementaron dos métodos:
(A) Siembra en placa. De cada una de las diluciones se tomó 0,1 ml para inocular las cajas (10-2 – 10-6), quienes contenían un medio mínimo de sales solidificado, descrito por Fernández et al. 2006. Adicionalmente, se agregó como fuente de carbono alquitrán, haciendo uso de un sensidisco impregnado con dicho contaminante. Las cajas se incubaron a una temperatura de 23°C durante 7 días antes de realizar el conteo (Fernández et al. 2006).
(B) Técnica de número más probable (NMP). Se utilizó el método de NMP en placas de 96 pozos, empleando como medio de cultivo Bushnell–Haas. Se utilizaron 20µl de cada dilución (10-2 – 10-6), y como única fuente de carbono se adicionó diésel (5µl) (Brown & Braddock, 1990; Wrenn & Venosa, 1996). Las placas se incubaron por 15 días a 20°C y se adicionó como indicador una sal de tetrazolio de nueva generación (XTT– 2mM) durante 18 h (Vallejo et al. 2010). Posteriormente, se observó el cambio de coloración en los pozos (naranja). Los resultados fueron introducidos en el programa Most Probable Number Calculator Version 4.04 y expresados como NMP/gps.
Análisis estadístico
Se realizó un test de Shapiro Wilk para determinar si los datos seguían una distribución normal. De las variables evaluadas, que no siguieron una distribución normal (p>0.05) se normalizaron con logaritmo en base 10. Posteriormente, se utilizó un análisis de varianzas (p<0,05) para comparar las medias de cada una de las variables analizadas y se realizó un análisis de comparaciones múltiples–TUKEY para identificar diferencias significativas entre los tratamientos evaluados, por medio del paquete estadístico SPSS v.s 19®. Finalmente, se realizó un análisis de correlación entre las variables medidas, las cuales fueron determinadas por medio de correlaciones de Pearson.
Resultados y discusión
Análisis de pH
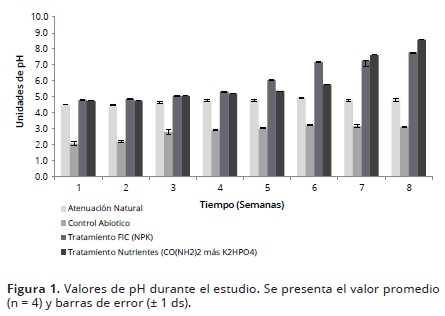
Al inicio del estudio, el pH del suelo presentó un valor de 6,26 ± 0,19 considerado como neutro. Sin embargo, después de la adición del alquitrán y los nutrientes, se observó una disminución significativa en sus valores (p<0,05) (Tabla 1, Figura 1). Lo anterior, podría indicar una baja capacidad tampón de los suelos, la cual es dependiente de la cantidad de materia orgánica y las arcillas, quienes reducen los cambios en el pH como consecuencia de la fertilización.
Por lo tanto, fue necesaria la adición de cal apagada en polvo (Ca(OH)2: 95%) para alcanzar valores cercanos a la neutralidad. Lo anterior fue realizado debido a que estudios previos han demostrado que el crecimiento de muchos microorganismos degradadores es máximo en un intervalo de pH entre 6.0 – 8.0, con un óptimo de 7.0; valores menores o iguales a 4.0 pueden inhibir el crecimiento y actividad de los microorganismos degradadores de TPHs, disminuyendo así, las tasas de biodegradación (Mathew et al. 2006; Vallejo et al. 2005). Después de la corrección del pH en los tratamientos con nutrientes, se evidenció una tendencia de incremento de dicha variable, con un aumento significativo después de la quinta semana (p<0,05), con respecto a los controles (Figura 1).
Se ha reportado que la aplicación de fertilizantes amoniacales y la urea, aunque son considerados uno de los mejores fertilizantes a emplear en estudios de biorremediación, dado su alto aporte de N, podrían afectar el pH del suelo induciendo a su acidificación. Lo anterior, podría ser consecuencia de la nitrificación bacteriana, así como a la pérdida o limitación de cationes básicos (p.e., Ca2+, Mg2 y K+) en el suelo (Okolo et al. 2005; Osuji & Opiah, 2007). Otros autores han asociado este comportamiento a una activación del metabolismo microbiano en presencia de un exceso de carbono (alta concentración de TPHs). Los procesos metabólicos microbianos generan CO2 y ácidos orgánicos acidificantes, quienes se comportan como ácidos libres en el suelo (García et al. 2011; Vallejo et al. 2005).
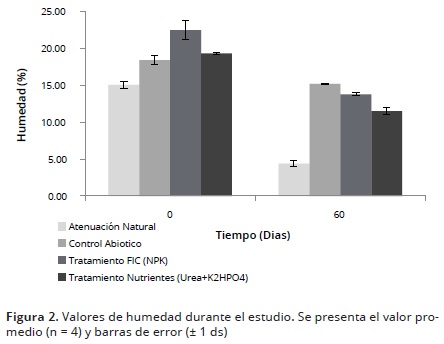
Humedad
En la primera semana de estudio, los mayores porcentajes de humedad lo presentaron el control abiótico (15,7 ± 0,5%) y los tratamientos con FIC y U (15,5 ± 0,48 y 14,5 ± 1,2%, respectivamente) (Figura 2). Por otra parte, el control de atenuación natural evidenció una disminución significativa en los valores de esta variable a partir de la semana 5, alcanzando un valor de 2,2 ± 0,40%, al final del estudio; lo cual coincidió con una disminución en la densidad de microorganismos degradadores a partir del día 45. Lo anterior fue soportado por la correlación positiva (datos no mostrados) que se presentó para estas dos variables. Esto demuestra la importancia de las adiciones periódicas de agua para un mantenimiento óptimo de humedad, así como la influencia de esta variable en el crecimiento tanto de los microorganismos heterótrofos y degradadores.
Para el caso de los tratamientos con FIC y U, estos presentaron un promedio de 15,5 y 14,4%, respectivamente. Estos valores se encontraron dentro del rango considerado como óptimo para llevar acabo procesos de biorremediación con bioestimulación y biolabranza.
Evaluación de los nutrientes (Nitratos, Fósforo y Amonio)
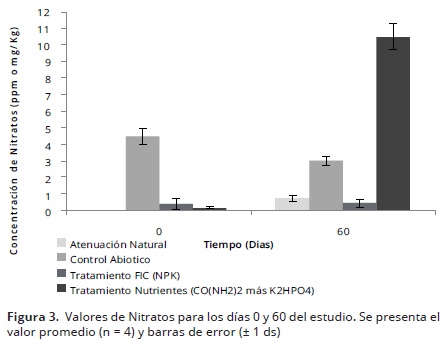
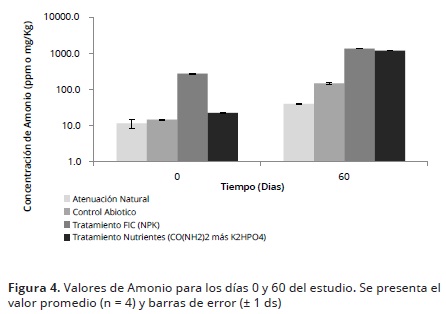
Nitratos y Amonio. Para el día 60, se logró observar que la concentración más alta de nitratos la presentó el tratamiento U, mostrando diferencias estadísticamente significativas (p<0.05) con el FIC y los controles (Figura 3). Lo anterior podría deberse a que este fertilizante, se caracteriza por tener una mayor concentración de nitrógeno (N) por unidad de producto (46% de N) y más alta solubilidad en el suelo en comparación con otros fertilizantes. Así mismo, el aumento significativo en los valores de nitratos en dicho tratamiento pudo ser el resultado del proceso de nitrificación, llevado a cabo por los microorganismos a partir de la urea presente en el fertilizante al utilizar el amonio como donador de electrones en presencia de oxígeno como aceptor de electrones.
Por su parte, el tratamiento con FIC, presentó una baja concentración de nitratos (N–NO3-), lo cual podria ser atribuido a que el amonio es la fuente principal de nitrógeno en este fertilizante, y el resto se encuentra en forma nítrica. Adicionalmente, es importante resaltar que el FIC, es un fertilizante nitrogenado de lenta liberación, por lo cual genera un aporte de nutrientes al suelo, en este caso de nitratos de forma tardía y durante un periodo más largo, en comparación con otros fertilizantes (Vallejo et al. 2005). Este tipo de fertilizantes ha demostrado una mayor eficiencia en el uso de los nutrientes en comparación con fertilizantes solubles como las sales inorgánicas, ya que su disponibilidad se extiende durante largos periodos de tiempo (Garcia et al. 2011). Debido al aporte continuo de nutrientes por este tipo de fertilizantes, se podría favorecer el crecimiento y actividad de los microorganismos degradadores; sin embargo, resulta indispensable contemplar un periodo superior (> 60 días) de seguimiento de la biorremediación para validar esta hipótesis.
En cuanto al contenido de amonio se evidencio que aunque fue mayor en el FIC, este no presentó diferencias significativas (p>0,05) con U (Figura 4). Por lo tanto, los dos tratamientos de bioestimulación generaron el mismo aporte de dicho nutriente.
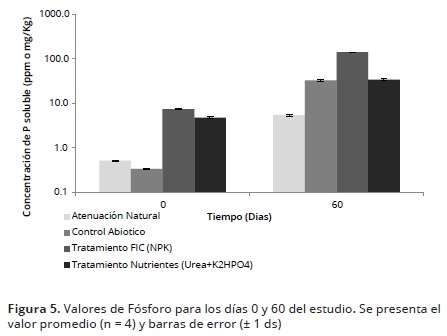
Fósforo. El contenido de fósforo en el día 0 fue significativamente más bajo (p<0,05) en ambos controles, en comparación con los tratamientos (Figura 5). Lo anterior es debido a la ausencia de fertilizantes en los controles que proveen una fuente de P para los microorganismos. Adicionalmente, se observó una diferencia significativa entre en los dos tratamientos evaluados, siendo mayor en el FIC en comparación con la U al final del estudio.
El comportamiento del P presentado en el tratamiento con FIC se asemeja a lo reportado por García et al (2011), quien al inicio del estudio alcanzó un valor de 107,5±10,6 mg P/kgps después de adicionar FIC (N: P: K, 28:12:7), y al finalizar mostró un aumento significativo en su concentración (112,9±21,6 mg P.kg-1ps) (Figura 5).
En general, el comportamiento de los nutrientes (Nitratos, Fosforo y Amonio) fue similar para los tratamientos con FIC y U, presentando un aumento significativo hasta el día 60, momento en el cual termina la etapa experimental.
Evaluación microbiológica (heterótrofos totales y degradadores)
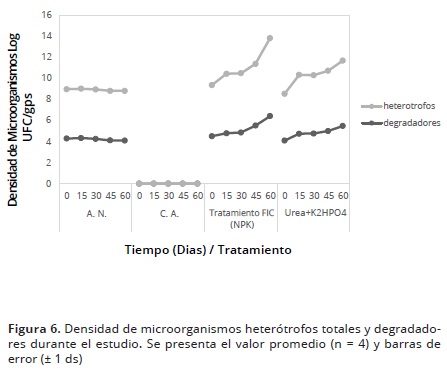
Después de realizar la contaminación del suelo con alquitrán, se presentó una disminución significativa de la población de microorganismos heterótrofos totales (datos no mostrados). Lo anterior, puede haber sido debido a que el alquitrán aporta una gran variedad de hidrocarburos de alto peso molecular que son tóxicos para los microorganismos edáficos. Se evidenció claramente que independiente del tratamiento de bioestimulación, ambos incrementaron la población de microorganismos heterótrofos y degradadores en comparación con el control de atenuación natural donde la densidad de microorganismos permaneció constante en el tiempo (Figura 6). Lo anterior, ha sido bien documentado por diversos autores quienes demuestran la importancia y necesidad de la adición de nutrientes en estudios de biorremediación de suelos contaminados con TPHs o HPAs (Cerqueira et al. 2014; Andreolli et al. 2015; Vallejo et al. 2015).
Densidad de Microorganismos Degradadores
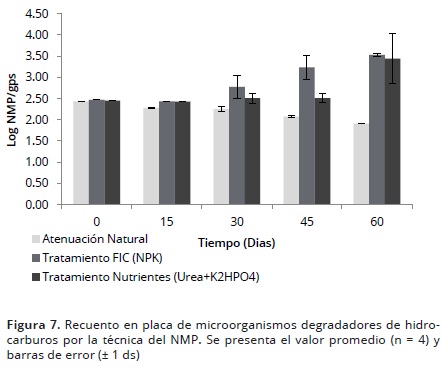
Independiente del método utilizado, el comportamiento de los degradadores fue el mismo, siendo mayores los recuentos en los tratamientos con bioestimulación en comparación con el control de atenuación natural (datos no mostrados). Por este motivo, se muestra a continuación únicamente el seguimiento con la técnica del NMP (Figura 7).
Se pudo observar que durante el estudio los tratamientos con FIC y U mostraron un aumento significativo (p<0,05) en la densidad de microorganismos degradadores en el tiempo, en comparación con el control de atenuación natural (Figura 7). Lo anterior permite concluir que las condiciones de pH, humedad y suministro de oxígeno en los tratamientos fueron ideales para el crecimiento y posiblemente para la actividad de los microorganismos degradadores. Adicionalmente, esto demuestra que ambos tipos de fertilizantes en la relación empleada (100:10:1) aportaron las condiciones nutricionales óptimas para la población de microorganismos degradadores. No obstante, el presente estudio difiere a lo reportado por otros autores quienes han encontrado diferencias significativas en la densidad de microorganismos degradadores como respuesta a distintos tipos de fertilizantes en estudios de biorremediación en suelos contaminados con TPHs (García et al. 2011).
Por el contrario, los microorganismos degradadores presentes en el control de atenuación natural mostraron una reducción significativa en su densidad hacia el final del estudio, lo cual podría asociarse a un desbalance en los nutrientes por el exceso de carbono y por la disminución del porcentaje de humedad y pH al inicio del estudio, que afectan el crecimiento de los microorganismos.
Biodegradación de TPHs y porcentajes de remoción
La concentración inicial de TPHs en el suelo después de haber realizado la contaminación con alquitrán y posteriormente una homogenización se encontró en un valor de ∼ 12,000 mg TPHs.Kg-1ps.
La alta variabilidad de TPHs entre controles y tratamientos, fue evidenciada aun después de haber realizado un proceso estricto y riguroso de homogenización de la mezcla suelo:alquitrán durante 1 semana. Lo anteriormente mencionado, es frecuente en este tipo de estudios debido a la característica hidrófoba de los TPHs y su capacidad para formar agregados de contaminación en el suelo.
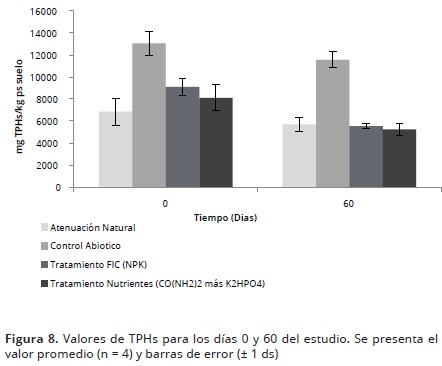
Al finalizar la presente investigación, se presentaron diferencias significativas (p<0,05) en las concentraciones de TPHs entre los tratamientos y controles con respecto a las concentraciones iniciales (Día 0); siendo significativamente menores, las concentraciones de contaminante en los tratamientos con bioestimulación (Figura 8).
La disminución de la concentración de TPHs para el tratamiento con NPK, se encuentra en el rango obtenido por casos exitosos, en el cual, en un periodo aproximado de 1 a 3 meses, se obtuvo un porcentaje de remoción de TPHs entre 21,4 – 53% (Vallejo et al. 2005; Mathew et al. 2006; Garcia et al. 2011). Es importante resaltar, que aunque estos estudios no emplearon el mismo tipo de suelo y evaluaron la remoción en distintos derivados de hidrocarburos (p.e. petróleo, residuos de alquitrán y diesel, respectivamente), muestran la misma tendencia de disminución del contaminante en suelos en donde se aplicó este tipo de fertilizante.
Los resultados obtenidos en el presente estudio concuerdan con lo reportado por Andreolli et al (2015), quienes evaluaron la biorremediación en suelos provenientes de un área forestal al norte de Italia. Los autores obtuvieron mayores tasas de biodegradación de hidrocarburos tóxicos en los tratamientos con bioestimulación en comparación con la bioaumentación y la atenuación natural. Lo anterior fue atribuido a la presencia de microorganismos nativos capaces incluso de degradar hidrocarburos recalcitrantes en el suelo, así como a la estimulación de los microorganismos degradadores por el mejoramiento en el balance de nutrientes en el suelo.
Conclusiones
- Los niveles de remoción de hidrocarburos obtenidos durante los 60 días de evaluación en los tratamientos con FIC y U (28 y 24% de remoción), demostraron que independiente del fertilizante, la adición de nutrientes inorgánicos a la concentración seleccionada (C: N: P 100:10:1), y bajo condiciones óptimas (pH, temperatura, humedad y aireación), son adecuadas para estimular la densidad de microorganismos degradadores de alquitrán y llevar a cabo exitosamente la degradación de contaminantes (TPHs) como el alquitrán.
Agradecimientos
A la Facultad de Ingeniería de la Universidad Central de Colombia y a la Fundación para la Promoción de la Investigación y la Tecnología (FPIT) del Banco de la Republica por la financiación de esta investigación.
Referencias
Abdulsalam. S. & Omale. A. (2009). Comparison of biostimulation and bioaugmentation techniques for the remediation of used motor oil contaminated soil. Braz arch biol technol, 52(3), 747–754. doi: 10.1590/S1516–89132009000300027. [ Links ]
Acuña. A. J. Tonín. N. L. Díaz. V. Pucci. G. N. & Pucci. O. H. (2012). Optimización de un sistema de biorremediación de hidrocarburos a escala de laboratorio. Ing invest y tecnol, 13(1),105–112. [ Links ]
Agamuthu. P. Tan. Y. & Fauziah. S. (2013). Bioremediation of hydrocarbon contaminated soil using selected organic wastes. Procedia Environmental Sciences, 18, 694 – 702. doi:10.1016/j.proenv.2013.04.094. [ Links ]
Andreolli. M. Lampis. S. Brignoli. P. & Vallini. G. (2015). Bioaugmentation and biostimulation as strategies for the bioremediation of a burned woodland soil contaminated by toxic hydrocarbons: A comparative study. J Environ Manage, 153, 121–131. doi: 10.1016/j.jenvman.2015.02.007. [ Links ]
Arrieta. O. Rivera. A. Arias. L. Rojano. B. Ruiz. O. & Cardona. S. (2012). Biorremediación de un suelo con diesel mediante el uso de microorganismos autóctonos. Gestión y Ambiente, 15(1), 27–40. [ Links ]
Cerqueira. V. Peralba. M.C. Camargo. F.A. & Bento. F.M. (2014). Comparison of bioremediation strategies for soil impacted with petrochemical oily sludge. Int Biodeter Biodegr, 95(B), 338–345. doi:10.1016/j.ibiod.2014.08.015. [ Links ]
Cunningham. C. & Philp. J. (2000). Comparison of bioaugmentation and biostimulation in ex situ treatment of diesel contaminated soil. Land Contamination & Reclamation, 8(4), 261–269. doi: 10.2462/09670513.575. [ Links ]
EPA. (2004). How to Evaluate Alternative Cleanup Technologies for Underground Storage Tank Sites. Landfarming. http://www.epa.gov/swerust1/pubs/tum_ch5.pdf.18.04.2015. [ Links ]
Fernández. L. Rojas. G. Roldán. T. Ramírez. M. Zegarra. H. Uribe. R. Reyes. R. Flores. D. & Arce. J. (2006). Manual de técnicas de análisis de suelos aplicadas a la remediación de sitios contaminados. Semarnat, México.112 p. [ Links ]
García. E. Roldán. F. & Garzón. L. (2011). Evaluación de la bioestimulación (nutrientes) en suelos contaminados con hidrocarburos utilizando respirometría. Acta biol Colomb, 16(1), 195–208. [ Links ]
Gómez. W. Gaviria. J. & Cardona. S. (2009). Evaluación de la bioestimulación frente a la atenuación natural y la bioaumentación en un suelo contaminado con una mezcla de gasolina–diesel. Dyna, 76(106), 83–93. [ Links ]
Ikhajiagbe. B. Anoliefo. G. Oshomoh. E. & Agbonrienrien. B. (2013). Effects of watering regimes on the intrinsic qualities of bioremediated waste engine oil–polluted soil. Annu Rev Res Biol, 3(2), 107–123. [ Links ]
Lee. S.H. Lee. S. Kim. D.Y. & Kim. J.G. (2007). Degradation characteristics of waste lubricants under different nutrient conditions. Journal of hazardous materials, 143(1–2), 65–72. doi:10.1016/j.jhazmat.2006.08.059. [ Links ]
Mathew. M. Tan. L. Su. Q. Yang. X. Baxter. M. & Senior. E. (2006). Bioremediation of 6% (w/w) diesel contaminated mainland soil in singapore: comparison of different bioestimulation and bioaugmentation treatments. Eng Life Sci, 6(1), 63–67. doi: 10.1002/elsc.200620119. [ Links ]
Okolo. J.C. Amadi. E.L. & Odu. C.T. (2005). Effects of soil treatments containing poultry manure on crude oil degradation in a sandy loam soil. Appl Ecol Env Res, 3(1), 47–53. [ Links ]
Osuji. L. Egbuson. E. & Ojinnaka. C. (2005). Chemical reclamation of crude– oil–inundated soils from Niger Delta, Nigeria. Chem Ecol, 21(1), 1–10. doi: 10.1080/02757540412331335988. [ Links ]
Osuji. L. & Opiah. U. (2007). Hydrocarbon contamination of a terrestrial ecosystem: the case of Oshire–2 oil spill in Niger Delta, Nigeria. The Environmentalist, 27(3), 337–340. doi: 10.1007/s10669–007–9034–7. [ Links ]
Suja. F. Rahim. F. Raihan. M. Hambali. N. Razali. R. Khalid. A. & Hamzam. A. (2014). Effects of local microbial bioaugmentation and biostimulation on the bioremediation of total petroleum hydrocarbons (TPH) in crude oil contaminated soil based on laboratory and field observations. Int Biodeter Biodegr, 90, 115–122. doi:10.1016/j.ibiod.2014.03.006. [ Links ]
Vallejo. V. Salgado. L. & Roldan. F. (2005). Evaluación de la bioestimulación en la biodegradación de TPHs en suelos contaminados con petróleo. Rev Colomb Biotecnol, 7(2), 67–78. [ Links ]
Vallejo. V. Yanine. H & Roldan. F. (2010). Aplicación de sales de tetrazolio de nueva generación (XTT) para la estimación de la densidad de microorganismos degradadores de hidrocarburos empleando la técnica del número más probable. Acta Biol Colomb, 15(3), 75–90. [ Links ]