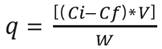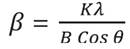Introducción
La ß-D-fructofuranosidasa (EC 3.2.1.26) de Saccharomyces cerevisiae, conocida también como invertasa, es empleada industrialmente en la hidrólisis de sacarosa para la obtención de azúcar invertido, el cual es ampliamente utilizado por su mayor carácter humectante, menor tendencia a cristalizar, baja higroscopicidad y menor acción cariogénica, en comparación con la sacarosa, su predecesor. Diferentes métodos químicos y enzimáticos se utilizan para la obtención de este producto, sin embargo los métodos químicos tradicionales, efectúan hidrólisis ácida con ácido clorhídrico o sulfúrico en proporciones 1:8 sustrato:ácido y con tiempos de reacción de 24 a 48h (Jiménez et al,, 2012, En el transcurso de la hidrólisis algunos monosacáridos son deshidratados formando compuestos tóxicos, como 5-(hidroximetil)-2-furfural (HMF) y furfural. Especialmente, el HMF se considera un agente tóxico y potencial carcinógeno involucrado en lesiones respiratorias en roedores, por lo que representa un riesgo para la salud humana.
La hidrólisis enzimática de la sacarosa es la reacción de preferencia en la industria de confites, por presentar un producto de reacción incoloro, En comparación con la hidrólisis ácida, las enzimas ofrecen ventajas como mayor selectividad y condiciones de reacción moderadas de temperatura y pH, ya que ocurren en el intervalo entre 40 y 60°C y en un rango de pH entre 4 y 8; además, la ß-D-fructofuranosidasa empleada para la inversión de la sacarosa es inocua y ambientalmente más segura (Guadix et al,, 2000), Por ser hidrosoluble, la aplicación de esta enzima a gran escala es limitada por su baja estabilidad y su alto costo en el mercado; por tanto, no puede ser recuperada de la fase acuosa y una vez obtenido el azúcar invertido, se eleva la temperatura para desnaturalizarla (Kotwal y Shankar, 2009).
La inmovilización es una opción que muestra ventajas en comparación con la aplicación de la enzima libre, Este proceso consiste en la fijación de la enzima a un soporte sólido mediante métodos físicos o químicos. Dentro de la inmovilización por unión química se encuentra el método de unión covalente, que está basado en la activación de grupos funcionales del soporte para que reaccionen con los grupos nucleófilos de las proteínas, La inmovilización presenta algunas ventajas, entre ellas, fácil manipulación de los derivados inmovilizados, mayor resistencia a la desactivación por el efecto de la temperatura o de los disolventes orgánicos o del pH, además, la carga de la proteína permanece constante (Arroyo, 1998).
La inmovilización de enzimas por unión covalente se ha realizado sobre: microporos de poli(2-hidroxietil metacrilato-glicidil metacrilato) (Danisman et al., 2004), lecitina obtenida de la leguminosa Cajanus cajan usando glutaraldehído (Ahmad et al., 2001), superficies de polianilina modificadas por copolimerización con ácido acrílico (Chen et al,, 2000), tubos de cloruro de polivinilo (Kumar et al,, 2008), microperlas de poli(estireno-2-hidroxietil metacrilato) activadas químicamente (Altinok et al., 2008), esferas de quitosano en reactores de lecho empaquetado y lecho fluidizado (Lorenzoni et al., 2015), matriz de poli(metacrilato de 3-metiltienilo)/poli(ácido 3-tiofenacético) (Dizge et al., 2008), entre otras.
La enzima ß-D-fructofuranosidasa ha sido inmovilizada sobre: electrodos de polímeros funcionalizados con pirrol y recubiertos con poliazotetrahidrofurano y politetrahidrofurano (Erginer et al,, 2000), dietilaminoetil celulosa (Taylor et al,, 2014), resina de intercambio de aniones de poli 2-metilbutil-2-(3-tienil) acetato/ polipirrol) (I§ik et al., 2003), copolímeros conductores de 3-metiltienilo de metacrilato (Cirpan et al,, 2003), celita y poliacrilamida (Mansour et al., 2003). En la mayoría de estas investigaciones se encontró un incremento de la estabilidad enzimática y retención de la actividad.
Por su parte, las nanopartículas de ferrita ofrecen una alta superficie reactiva, son químicamente estables y poseen tamaño uniforme; además, han generado gran interés por su carácter superparamagnético, estabilidad, biocompatibilidad y baja toxicidad. La ferrita de cobalto es un óxido binario de hierro (III) y cobalto (II), con fórmula química CoFe2O4, Es ampliamente estudiada por su anisotropía magnética, moderada magnetización de saturación, estabilidad química y dureza mecánica, y caracterizada por presentar un campo coercitivo alto (Pillai y Shah, 1996).
La inmovilización de la ß-D-fructofuranosidasa EC 3.2.1.26 sobre NPM-CoFe2O4, aparece como alternativa para su recuperación y reúso, Sin embargo, el proceso de inmovilización puede modificar el comportamiento catalítico. Este cambio puede ser debido a, la desnaturalización por las condiciones del método, la presencia de una desactivación por un grupo reactivo en el sitio activo que participa en la reacción con el sustrato, o también, a fuerzas de enlace que mantienen la molécula en una configuración inactiva por cambios conformacionales (Westheimer, 1985; Arroyo, 1998); de esta manera, la actividad de la enzima inmovilizada puede ser diferente en comparación con su estado libre, por tanto es necesario evaluar el efecto que tiene la inmovilización covalente en la actividad catalítica de la enzima.
El objetivo de este trabajo fue desarrollar una metodología para la hidrólisis de la sacarosa a escala de laboratorio por medio de la inmovilización de la ß-D-fructofuranosidasa que permita su reúso. Debido a que los estudios previos que aparecen en la literatura advierten un posible cambio en la actividad catalítica, se estudió el efecto de la inmovilización de la ß-D- fructofuranosidasa de Saccharomyces cerevisiae sobre NPM-CoFe2O4, en la actividad enzimática, y posteriormente su capacidad de reúso.
Materiales y métodos
Reactivos y equipos
Los reactivos utilizados fueron de grado analítico. Se empleó sulfato de hierro heptahidratado (95.5%), sulfato de cobalto heptahidratado (97%), hidróxido de sodio (97%), todos de la casa comercial Merck®. Etilenglicol (99%), acetato de sodio anhidro (99%), ácido acético (99.7%), glutaraldehído (25%), ácido-3,5-dinitrosalicílico (98%), tartrato de sodio y potasio (99%) de la casa comercial Aplichem Panreac®. Quitosano (98%) y la enzima ß-D-fructofuranosidasa (Ref I4504-1G invertase grado VII) de la casa comercial Sigma Aldrich®. Todas las soluciones fueron preparadas con agua tipo I obtenida de un Q-millipore de conductividad 0.05 μS.
Síntesis de NPM-CoFe2O4
Para la síntesis de nanopartículas Co50Fe50 se prepararon soluciones de 0.040M y 0.036M de CoSO4.7H2O y FeSO4.7H2O, en etilenglicol. Las soluciones se mezclaron, el pH se ajustó a 10 con NaOH. La mezcla se llevó a reflujo a 105°C por 4h y una vez transcurrido el tiempo de reacción, la mezcla se enfrío a temperatura ambiente y se filtró por gravedad. El precipitado fue secado a 120°C por 2h y luego calcinado a 650°C por 4h (Chiriac, Moga y Gherasim, 2008).
Recubrimiento con quitosano a las NPM- CoFe2O4 y activación con glutaraldehído
Para determinar la proporción óptima de quitosano y glutaraldehído que permita un mayor rendimiento de la inmovilización de la ß-D-fructofuranosidasa, se realizaron cuatro ensayos de modificación con concentraciones de 0.2 y 0.4% de quitosano y de 1 y 2% de glutaraldehído. Se pesaron las nanopartículas de NPM-CoFe2O4 y se adicionaron a una solución al 0.2% de quitosano en ácido acético al 0.35M y finalmente se ajustó el pH a 10 con NaOH. Se agitó a 250 r.p.m. a temperatura ambiente por 1h, posteriormente la mezcla se calentó a 80°C por 30 min y se obtuvieron las nanopartículas de NPM-CoFe2O4 recubiertas con quitosano que se denominaron NPM-Q. Estas NPM-Q se suspendieron en una solución de glutaraldehído al 1% en tampón acetato 0.1M de pH 4.5 y se llevó a agitación a 250 r.p.m. durante 1h a 37°C (Xie y Wang, 2012). Finalmente, se obtuvieron NPM-Q activadas tipo I.
Siguiendo el mismo procedimiento se empleó glutaraldehído al 2%, resultando en NPM-Q activadas tipo II. Las NPM-Q activadas tipo III y tipo IV fueron obtenidas por recubrimiento con quitosano al 0.4% y activación con glutaraldehído al 1 y 2%.
Inmovilización de la ß-D- fructofuranosidasa sobre NPM-Q activadas
Las NPM-Q activadas fueron adicionadas a una solución de 10mL de ß-D-fructofuranosidasa al 0.2% en tampón acetato 0.1M de pH 4.5, se incubó por 20h a 37°C. Se tomó una alícuota de la solución de la enzima antes de la inmovilización y otra del sobrenadante después del tiempo de incubación para determinar la cantidad de la ß-D-fructofuranosidasa inmovilizada y el rendimiento de la inmovilización, mediante el método espectrofotométrico para la cuantificación de proteína de Bradford (Bradford, 1976). Se elaboró una curva de calibración por triplicado, usando como patrón seroalbúmina bovina, en el rango de 1 - 60 ppm. La ß-D-fructofuranosidasa inmovilizada sobre NPM-Q se denominó NPM- BFR; este procedimiento se realizó para las NPM-Q activadas tipo I, II, III y IV. El rendimiento de la inmovilización se determinó por medio de la Ecuación 1 (Akgol et al., 2001).
Donde, q es la cantidad de enzima enlazada a las nanopartículas; Ci y Cf son la concentración de enzima en la solución inicial y en el sobrenadante final; V es el volumen del medio de reacción y, W es el peso de las NPM-Q activadas. El valor se expresa como mg de enzima inmovilizada/g de soporte.
Caracterización de las NPM-CoFe2O4 y NPM-BFR
La composición, características estructurales y tamaño del cristalito de las NPM-CoFe2O4 fueron evaluados por difracción de rayos X (DRX) en un difractómetro PANalytical X-Pert-PRO, con ánodo de Cobalto, radiación Ka de λ=1,794 Å, velocidad de barrido de 23.97°S-1, filtro de Fe, patrón de calibración de silicio policristalino de alta pureza, ángulo de paso 0,013° y temperatura de 25°C.
Los espectros se obtuvieron en el rango de 5 - 90° en 2θ. Se realizó refinamiento de Rietveld con la base de datos COD Cristalographic data y el cálculo del tamaño de partícula mediante la Ecuación 2 de Debye-Scherrer (Vorokh, 2018).
Donde, ß es el tamaño medio del cristalito; K es un factor de forma adimensional; λ es la longitud de onda de la radiación Kα; B es el ancho medio del pico más intenso; θ es el ángulo correspondiente al pico más intenso.
El comportamiento magnético de las NPM- CoFe2O4 fue determinado en un magnetómetro Versalab, de Quantum Design, con la técnica de muestra vibrante (VSM), a 25°C con campos aplicados de hasta 1591,5 kAm/m.
La morfología de las NPM-CoFe2O4 se evaluó por microscopía electrónica de barrido (SEM) en un microscopio Carl ZEISS Ref. EVO Ma10, con una corriente (EDH) de 20,00 kV, distancia ocular (WD) de 10,00 mm, detector de electrones secundarios (SE1) y magnificación de 20.000 aumentos.
La distribución de tamaño se evaluó por microscopía electrónica de transmisión (TEM) en un microscopio JEOL modelo JEM 1200X. Las micrografías fueron obtenidas usando negativos Kodak Electron y se revelaron de manera tradicional, Para digitalizar los negativos se empleó un escáner Epson Perfection 4490 Photo y el programa es Epson Scan Ink. Se realizaron mediciones de tamaño a las partículas empleando el software Image-Pro Analyzer 6.3 de Media Cybernetics.
Para el análisis de los tipos de funciones químicas presentes en las NPM-CoFe2O4 y NPM- BFR se utilizó espectroscopía infrarroja con transformada de Fourier (FTIR) y reflectancia total atenuada (ATR), en un espectroscopio Shimadzu IRPrestige-21, a 25°C con barrido de 32 scans y resolución de 6 cm-1, en el rango de 4000-400 cm-1.
Determinación de pH y temperatura óptimos de la ß-D-fructofuranosidasa
Para la determinación de azúcares reductores por el método DNS (ácido-3,5-dinitrosalicílico) se elaboró por triplicado la curva de calibración, utilizando como patrón glucosa analítica, en un rango de 20 - 500 ppm (Ávila et al,, 2012), Para la determinación del pH óptimo de la enzima libre, la reacción se evaluó con sacarosa al 10 mM, ß-D-fructofuranosidasa al 0.2% (20 mg/10 mL) y soluciones tampón de acetato de pH 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0 y 7,0, Las ocho reacciones resultantes fueron incubadas por 10 min a 50°C. Para la cuantificación de azúcares reductores se siguió el método DNS y se determinó la absorbancia a 540 nm, Para la determinación del pH óptimo de la enzima inmovilizada se tomaron las NPM-BFR del ensayo que tuvo mayor rendimiento de inmovilización de acuerdo a las proporciones de quitosano y glutaraldehído, y se siguió un procedimiento igual para la determinación del pH óptimo de la enzima libre.
Para la determinación de la temperatura óptima de la enzima libre, la reacción fue evaluada con sacarosa al 10 mM, ß-D-fructofuranosidasa al 0,2% y una solución de tampón acetato al pH óptimo anteriormente determinado; cinco reacciones fueron incubadas por 10 min, a 40, 50, 60, 70 y 80 °C, se siguió el método DNS y se determinó la absorbancia a 540 nm, Para la determinación de la temperatura óptima de la enzima inmovilizada se siguió el mismo procedimiento anterior.
Determinación de la actividad enzimática de ß-D-fructofuranosidasa libre e inmovilizada
Diseño experimental.
Se realizaron mediciones de la actividad enzimática a 12 reacciones individuales de la ß-D-fructofuranosidasa libre (Muestra A), del mismo modo, se realizaron 12 mediciones para la ß-D-fructofuranosidasa inmovilizada sobre NPM- CoFe2O4 (Muestra B); las reacciones de la Muestra A y de la Muestra B, fueron incubadas por 10 min cada una, a su correspondiente pH y temperatura óptimos, Con el objetivo de comparar la media de la Muestra A y de la Muestra B, las cuales no están relacionadas entre sí, se realizaron pruebas de homocedasticidad y normalidad, para finalmente realizar una prueba paramétrica aplicando la prueba de hipótesis de dos colas con el test de Student (‘t’) para muestras independientes, Se evaluó la hipótesis nula de igualdad con un nivel de significancia de 0.05.
Para el grupo de la Muestra A se determinó la actividad enzimática con el método DNS de 12 reacciones iguales e independientes con la ß-D-fructofuranosidasa libre en tampón acetato de pH óptimo e incubadas por 10 min a la temperatura óptima. Para el grupo de la Muestra B se siguió el mismo procedimiento empleando ß-D-fructofuranosidasa inmovilizada sobre NPM- CoFe2O4.
Para este estudio se definió una unidad internacional de actividad (UI) como un micromol de sacarosa hidrolizada por minuto (μmol/min).
Determinación de parámetros cinéticos.
Se determinó la actividad enzimática con el método DNS de soluciones de sacarosa con concentraciones de 5, 10, 15, 20, 30, 40, 50 y 60 mM, para la ß-D- fructofuranosidasa libre e inmovilizada a pH y temperatura óptimos. A partir de los resultados se realizó la representación de la cinética enzimática mediante el diagrama de Lineweaver-Burk y se determinaron los valores de constante de Michaelis- Menten (Km) y velocidad máxima (Vmax).
Evaluación de la reutilización de la f-D- fructofuranosidasa inmovilizada.
La evaluación de la reutilización de la ß-D- fructofuranosidasa inmovilizada sobre NPM- CoFe2O4 se realizó bajo condiciones óptimas de pH y temperatura. Se tomó una alícuota de la enzima inmovilizada y se sometió a ensayo de la actividad enzimática. Se empleó la misma concentración de solución de sacarosa (10 mM) en cada ensayo y se determinó la actividad enzimática con el método DNS. Terminado cada ciclo, la enzima inmovilizada se recuperó por medio de un campo magnético externo, se lavó tres veces con tampón acetato a pH óptimo y se almacenó en solución tampón acetato 0.1 M de pH 4.5 a 4°C. La actividad enzimática inicial en la primera utilización se tomó como el 100% de actividad.
Resultados y discusión
Difracción de Rayos X (DRX)
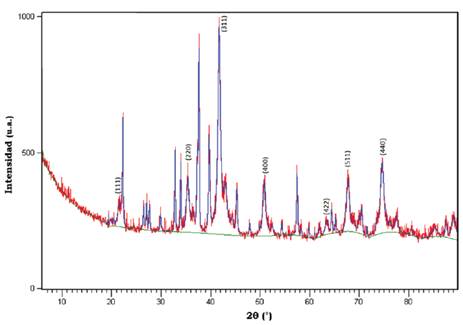
En la Figura 1 se observa la presencia de siete picos característicos en 2θ 21.386°, 35.276°, 41.623°, 50.745°, 63.311°, 67.648° y 74.601° los cuales corresponden a los siguientes índices de Miller y distancias interplanares: [111] (d1=4.821 Å), [220] (d2=2.952 Å), [311] (d3=2.518 Å), [400] (d4=2.088 Å), [422] (d5=1.704 Å), [511] (d6=1.607 Å), [440] (d7=1.476 Å), respectivamente.
El material obtenido cristalizó en un sistema cúbico centrado en las caras (FCC), con grupo espacial fd -3m y parámetros de red a = b = c = 8.35 Å y α = ß = γ= 90°. La reflexión del pico más intenso corresponde a la orientación cristalográfica del plano [311] asignada a la formación del sistema cubico tipo espinela inversa, estos resultados concuerdan con los asignados para una nanopartícula de CoFe2O4 (Bensebaa et al., 2004; López et al., 2012). Por otra parte, el tamaño medio del cristal de CoFe2O4 se determinó mediante la ecuación de Debye-Scherrer, a partir del ancho del pico de la reflexión [311] a la altura media, y fue de 7.75 nm.
Los nanocristales de ferrita de cobalto (CoFe2O4) se formaron en un porcentaje de 54.6% y adicionalmente se formaron cristales de tenardita (Na2SO4) en un 29.7%. Este compuesto se formó debido a los sulfatos (SO4 -2) remanentes de las sales precursoras de Fe y Co al reaccionar con el ion Na+ proveniente del NaOH. También se evidencia la presencia de cristales de etilenglicol (C2H602) en un 15.7%, compuesto que presenta tendencia a cristalizar cuando se somete a calentamiento, debido a la alta viscosidad de su fase líquida. La tenardita y el etilenglicol cristalizaron en un sistema ortorrómbico.
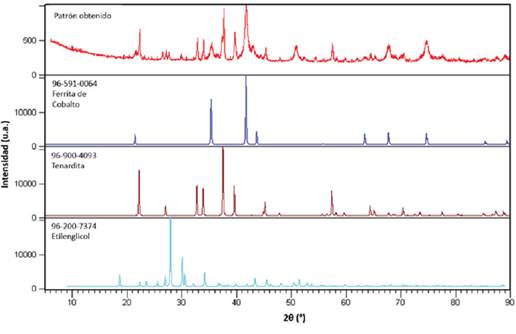
En la Figura 2 se incluyen los patrones de referencia de la base de datos Cristallographic Open Database (COD, por sus siglas en inglés) con su respectivo código de carta cristalográfica, para la ferrita de cobalto (96-591-0064), la tenardita (96-900-4093) y el etilenglicol (96-200-7372), comparados con el difractograma obtenido experimentalmente.
Magnetometría de Muestra Vibrante
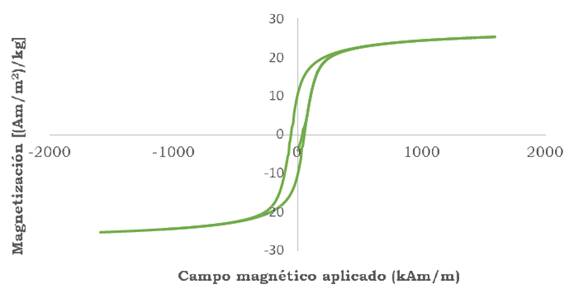
En la Figura 3 aparece la curva de magnetización que inicia en -4.14 (Am/m2)/kg y aumenta a la par con el campo magnético (H). Las NPM- CoFe2O4 exhiben su magnetización de saturación (Ms) en 25.31 (Am/m2)/kg al aplicar un campo magnético de 1591.15 kAm/m; como se observa en este punto todos los momentos magnéticos no atómicos están alineados en el sentido del campo magnético aplicado, Cuando se retira el campo aplicado, el material no presenta una magnetización nula, sino una magnetización remanente (Mr) de 10.20 (Am/m2)/kg.
A continuación, se aplicó un campo magnético de sentido opuesto al anterior para anular la magnetización remanente, La magnitud de este campo aplicado es conocida como coercividad o campo coercitivo (Hc) y fue de 53.78 kAm/m. El valor de la magnetización remanente y del campo coercitivo de un material dependen de su tamaño; a medida que este decrece, por debajo de un cierto tamaño crítico, 10 nm aproximadamente, las partículas magnéticas presentan un único dominio magnético, por lo que se comportan como un espín gigante, dado que se produce un confinamiento de electrones. O sea, a tamaños del orden de las decenas de los nanómetros o menores, el material presenta menos magnetización (López et al,, 2012).
La magnetización remanente mostrada en la curva de histéresis (Figura 3) es característica de un material ferromagnético y propio de las ferritas cúbicas; por otra parte, un ciclo de histéresis estrecho implica una pequeña cantidad de energía disipada invirtiendo repetidamente la magnetización y es característico de un material blando, es decir, que es fácil de imanar y desimanar, esto es consecuente con lo encontrado por Londoño-Calderón et al, (2016).
Microscopía electrónica de barrido
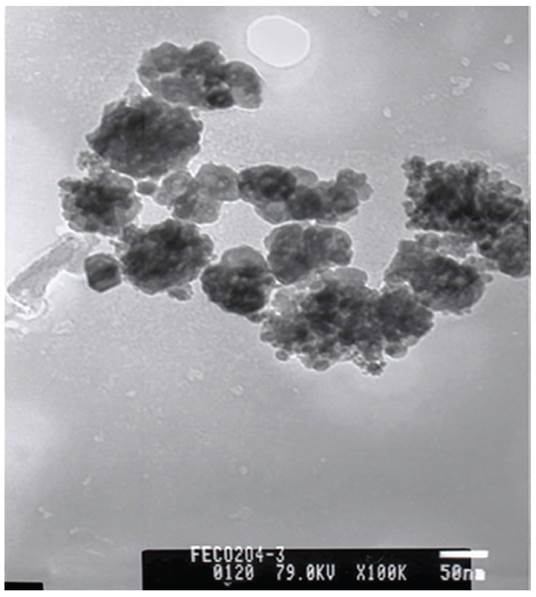
La micrografía SEM de las NPM-CoFe2O4 y la barra de la escala μ 1 (m aparecen en la Figura 4. Se observan gránulos de forma irregular formados por aglomerados de nanopartículas. Este comportamiento es debido a la relación superficie/volumen, por lo cual las NPM-CoFe2O4 tienden a aglomerarse para minimizar la energía superficial total del sistema (Chiriac, Moga y Gherasim, 2008; Deng et al., 2005).
Microscopía electrónica de transmisión
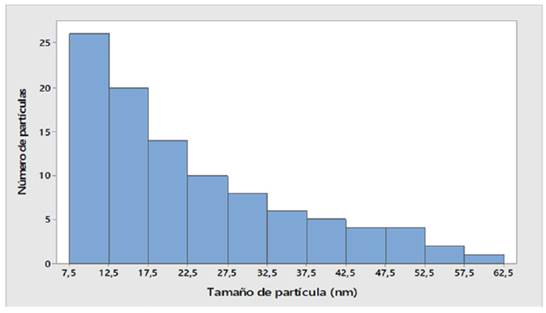
En la Figura 5 se presentan la micrografía TEM de NPM-CoFe2O4 y la barra de la escala 50 nm, donde se observan gránulos de forma esférica y aglomerados de nanopartículas de forma irregular. A partir del análisis de 50 nanopartículas, en la Figura 6 se muestra la distribución de tamaño de las NPM-CoFe2O4, la cual presenta sesgo a la derecha; la barra más alta identifica los valores más comunes en la muestra, los cuales corresponden al 45% de las partículas con tamaños comprendidos entre los 7,5 y 12,5 nm, Este rango de valores es congruente con el tamaño de partícula de 7,75 nm, determinado a partir del difractograma de rayos X, mediante la Ecuación 2 de Debye-Scherrer.
Espectroscopia infrarroja (FTIR)
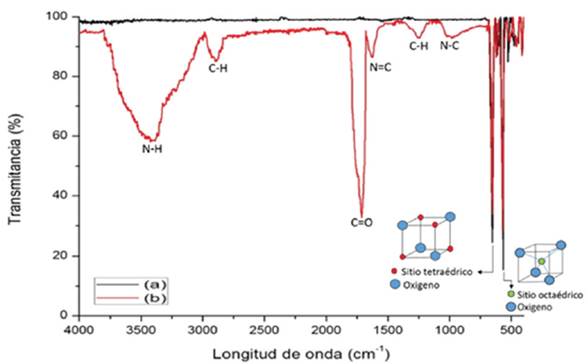
En la Figura 7a se presenta el espectro IR para las NPM-CoFe204, donde se observa una señal intensa en el intervalo de 640 - 660 cm-1 que corresponde a las vibraciones intrínsecas de los grupos tetraédricos y en el rango entre 560-590 cm-1 se encuentran las absorciones de los grupos octaédricos de la CoFe204; estas señales son características de la estructura de espinela inversa (López et al., 2012).
El espectro IR de las NPM-BFR (Figura 7b) presenta las bandas características de los grupos tetraédricos y octaédricos de la CoFe204 y nuevas señales. Una de ellas en el rango de 1010 - 1030 cm-1 asignada a una flexión del grupo N-C y en el intervalo de 1620 - 1630 cm-1 vibraciones de estiramiento del grupo N=C que corresponden al grupo imino; estas señales confirman la formación de bases de schiff. La señal en el rango de 1700 - 1720 cm-1 corresponde a vibraciones de estiramiento del grupo C=O y en el rango 3400 - 3430 cm-1 a vibraciones del grupo N-H; estas señales pertenecen a los grupos carbonilos y aminas primarias de los aminoácidos de la proteína. También se observan señales en 2880-2900 cm-1 que son vibraciones de estiramiento del grupo C-H y en el rango de 1240 - 1260 cm-1 son vibraciones correspondientes a flexiones del grupo C-H. La enzima inmovilizada con base de Schiff presenta estas señales (Li, 2014).
Determinación de la relación óptima soporte/activador
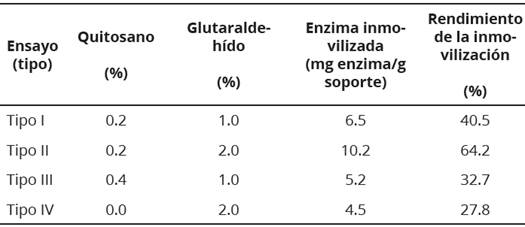
En la Tabla 1 se incluyen los resultados de la cantidad de enzima inmovilizada determinada con la Ecuación 1, además se presenta el rendimiento de la inmovilización de los ensayos tipo I, II, III y IV. La inmovilización de la ß-D- fructofuranosidasa sobre NPM-CoFe204 alcanza un mayor rendimiento (64.16%) cuando se emplea quitosano al 0.2% y glutaraldehído al 2%, por tanto, el ensayo Tipo II se seleccionó para obtener las NPM-BFR.
pH y temperatura óptimos
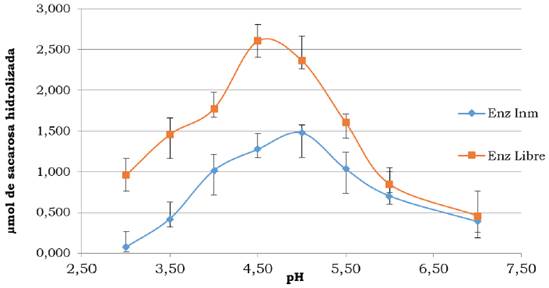
En la Figura 8 se incluyen los micromoles de sacarosa hidrolizados a diferentes niveles de pH. A partir del máximo de conversión de sacarosa se determinó que para la enzima libre el pH óptimo es de 4.5 y para la enzima inmovilizada es de 5.0, ya que éste se desplazó ligeramente hacia una región menos ácida. En la literatura se cita como rango de pH óptimo de la ß-D-fructofuranosidasa valores entre 4.5 y 5.0 (Amaya-Delgado et al., 2006; Sanjay y Sugunan, 2005). Este cambio puede atribuirse a la presencia de interacciones secundarias entre la enzima y el soporte polimérico, las cuales pueden ser de tipo iónicas, polares o por puentes de hidrógeno.
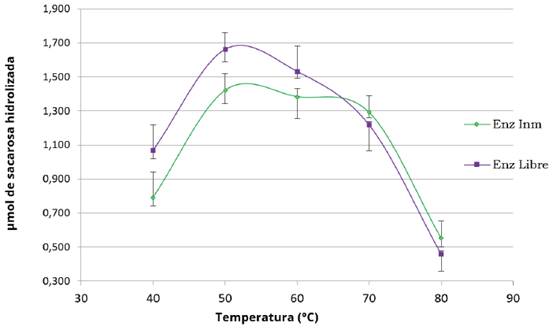
Los micromoles de sacarosa hidrolizada a diferentes temperaturas aparecen en la Figura 9. El valor máximo de conversión de sacarosa para las enzimas libre e inmovilizada ocurrió a la temperatura óptima de 50°C. La inmovilización de la enzima incrementó la estabilidad hasta una temperatura de 70°C; después de este nivel ambas enzimas perdieron actividad debido a procesos de desnaturalización. Según Amaya- Delgado et al. (2006) y Sanjay y Sugunan (2005) para esta enzima la temperatura óptima se encuentra entre 50 y 65°C. La retención de la actividad se atribuye a un aumento en las fuerzas de unión entre la enzima y el soporte, lo que reduce los porcentajes de pérdida.
Evaluación de la actividad enzimática
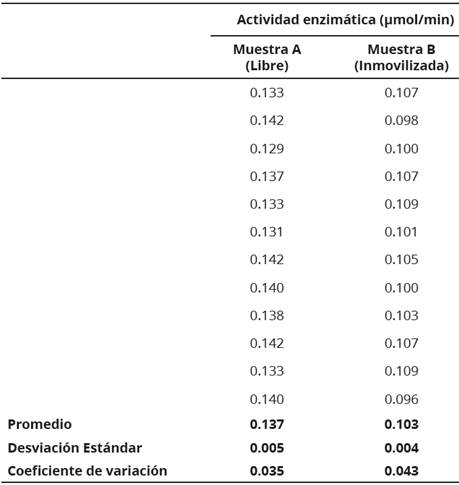
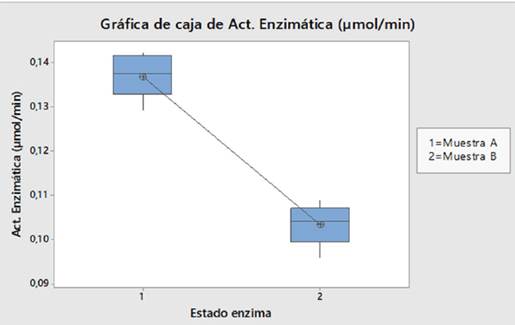
En la Tabla 2 se incluyen los valores de actividad enzimática determinados para las enzimas libre, a pH 4.5 y a 50°C, e inmovilizada, a pH 5.0 y a 50°C. A partir del promedio de la actividad de la Muestra A (0.137 μmol/min) y de la Muestra B (0.103 μmol/min) se determinó que la actividad de la ß-D-fructofuranosidasa inmovilizada es un 75.18% de la actividad de la enzima libre.
Para la prueba de hipótesis, primero se estableció que las muestras no están relacionadas entre sí. Por medio de la prueba de comparaciones múltiples se demostró que los datos son homocedásticos (P = 0.779) y por la prueba de Anderson-Darling se encontró que los valores de las Muestra A y B tienen una distribución normal, con valores de P = 0.114 y 0.272, respectivamente.
Finalmente, para comprobar la existencia de diferencia estadísticamente significativa entre las medias de las muestras se realizó una prueba paramétrica inferencial de dos colas, lo que se hizo mediante el test de Student para muestras independientes. En la Figura 10 se muestra el diagrama de cajas para la Muestra A y B. Se observa que la dispersión de las cajas de ambas muestras es similar, pero la media de la Muestra A es mayor que la media de la Muestra B. El valor P de la prueba de Student fue de 0.017, el cual es < 0.05, por lo que se rechaza la hipótesis nula a favor de la hipótesis alternativa la cual se afirma que: existen diferencias significativas entre la media de la actividad enzimática de la ß-D-fructofuranosidasa libre y la media de la actividad enzimática de la ß-D-fructofuranosidasa inmovilizada sobre NPM-CoFe204.
Parámetros cinéticos
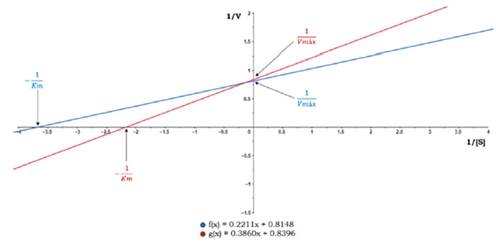
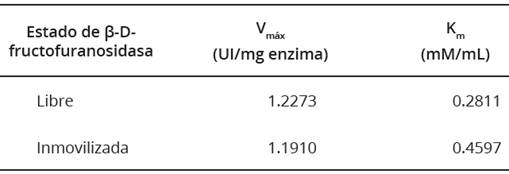
Para estas mediciones se determinaron las constantes de Michaelis-Menten (K m ) y las velocidades máximas (Vmáx .) de la reacción de ambas muestras, a pH y temperatura óptimos. Estas constantes son específicas para la ß-D- fructofuranosidasa así como para las condiciones en las cuales se llevó a cabo la reacción. Se empleó el diagrama de Lineweaver-Burk (Figura 11) y se observa que la recta de la ß-D-fructofuranosidasa libre presenta el intercepto con el eje Y en 0.8148 correspondiente a 1/ V máx , por lo tanto, la V máx es 1.2273 Ul/mg enzima; el intercepto con el eje ‘X’ se encuentra en -3,5571 y corresponde a -1/Km, y la K m es 0.2811 mM/mL.
La ß-D-fructofuranosidasa inmovilizada sobre NPM-CoFe2O4 presentó intercepto en eje de las ordenadas en 0.8396 y en el eje de las abscisas en -2.1751. Se obtuvieron valores de V máx . = 1.1910 Ul/mg enzima y K m = 0.4597 mM/mL (Tabla 3). Se concluye que la K m de la ß-D-fructofuranosidasa inmovilizada aumentó aproximadamente 1.7 veces respecto a la enzima libre. Para la ß-D-fructofuranosidasa inmovilizada sobre diferentes soportes se han encontrado factores de incremento de 2.3 a 3.3 (Akgol et al., 2001; Amaya-Delgado et al., 2006; Valerio et al., 2013).
El valor K m representa la afinidad de la ß-D- fructofuranosidasa y significa la concentración de sacarosa a la cual la mitad de las moléculas de la enzima se encuentran saturadas formando el complejo enzima-sustrato. La reducción de la afinidad de la enzima inmovilizada es debida a los cambios estructurales provocados por el proceso de inmovilización, lo que conlleva a un menor acceso de las moléculas de sustrato al sitio activo de la enzima y a una reducción de la actividad catalítica (Westheimer, 1985).
Un valor alto de la constante Km indica menor afinidad y por tanto una menor velocidad catalítica. En el caso de la ß-D-fructofuranosidasa inmovilizada el valor de V máx . disminuyó en 2.96%. La reducción de la velocidad máxima se atribuye a posibles cambios no favorables en la estructura de la enzima durante el proceso de inmovilización, los cuales disminuyen la capacidad de disociación del producto del complejo enzima-producto (Westheimer, 1985; Akgol et al., 2001; Sanjay y Sugunan, 2005).
Reutilización de la -D- fructofuranosidasa inmovilizada
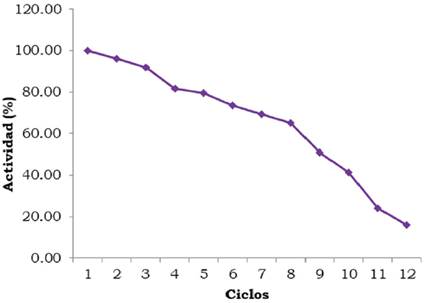
La evaluación del reúso de la ß-D- fructofuranosidasa inmovilizada sobre NPM- CoFe2O4 se incluye en la Figura 12. La actividad cuantificada en el primer ciclo se estableció como 100%, en el segundo y tercer ciclo se conserva un porcentaje de actividad del 95.89 y 91.79%, respectivamente. Con el transcurso de los ciclos se observa una reducción en la actividad; no obstante después de nueve ciclos continuos la enzima retiene aproximadamente 50% de su actividad inicial (50.81%). En la literatura se encuentran valores de reúso entre 10 y 21 ciclos para la ß-D-fructofuranosidasa inmovilizada sobre diferentes soportes (Akgol et al., 2001; Sanjay y Sugunan, 2005; Azodi et al., 2011; Tu et al., 2000).
Conclusiones
Se encontraron diferencias significativas (P < 0.05) entre las medias de la actividad enzimática de la ß-D-fructofuranosidasa tanto libre como inmovilizada. El valor de la constante de Michaelis-Menten (Km) aumentó en 1.7 veces en la enzima inmovilizada mientras la velocidad máxima (Vmáx ,) disminuyó en 2.96%. Esta reducción de la afinidad es debida a los cambios estructurales inducidos por el proceso de inmovilización, lo que disminuye la accesibilidad de las moléculas de sacarosa al sitio activo de la ß-D-fructofuranosidasa.
Las NPM-BFR presentan un pH óptimo de 5.0 y una retención de la actividad desde 50 hasta 70°C, lo cual se debe al aumento posterior al proceso de inmovilización en las fuerzas de unión entre la enzima y el soporte.
La ß-D-fructofuranosidasa inmovilizada sobre NPM-CoFe2O4 presentó, respectivamente, en el segundo y tercer ciclo 95.89 y 91.79% de actividad enzimática retenida, no obstante, hasta el noveno reúso mantiene 50,81% de actividad.