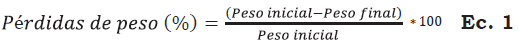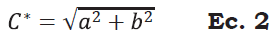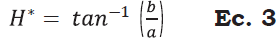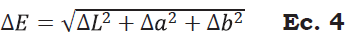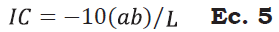Introducción
En poscosecha, los frutos de aguacate (Persea americana Mill.) cultivar (cv.) Hass presentan un comportamiento climatérico en el cual se identifican cuatro estados fisiológicos (Lallum et al., 2004) como respuesta al tratamiento con etileno: (1) inhibición, que constituye un periodo donde el fruto no es sensible al etileno exógeno (Iqbal et al., 2017); (2) preclimatérico, el etileno exógeno favorece la producción autocatalítica de etileno en el fruto; (3) climatérico, con producción autocatalítica de etileno asociada con el estímulo de los cambios inherentes a la maduración; y (4) posclimatérico, con descenso en la producción de esta fitohormona. Este comportamiento permite asumir la posibilidad fisiológica de adelanto del proceso de maduración mediante el estímulo de la síntesis de etileno en frutos en estado preclimatérico (Iqbal et al., 2017; Wei et al., 2020). Uno de los problemas poscosecha en aguacate cv. Hass y en su caso cv. Méndez, es la heterogeneidad en la maduración de los frutos debido a diferencias en el momento de amarre y la incapacidad de los frutos para madurar en el árbol, lo cual se traduce en inconsistencias en la calidad de estos, así como diferencias en la respuesta a la aplicación de tecnologías de conservación y procesamiento (Pedreschi et al., 2014; Hernández et al., 2016).
De acuerdo con diversos estudios (Arpaia et al. 2015, 2018; Wei et al., 2020) la aplicación de etileno exógeno en fase preclimatérica promueve y homogeniza la maduración, situación que en frutos de aguacate resulta importante al contar con frutos en fase de madurez comestible antes de tiempo y con lotes con calidad homogénea para fines de consumo en fresco y procesamiento. El 2-cloroetil fosfónico (Etefón) es un ácido orgánico líquido soluble en agua que se hidroliza a pH fisiológico (> 5) para formar etileno (CH2=CH2), fosfato (H2PO4 -) y iones cloro (Cl-), por tanto, en poscosecha de frutos constituye una alternativa al uso de gas etileno para adelantar y homogeneizar la maduración, lo cual permite contar con frutos listos para consumo en fresco o con fines de procesamiento. La cantidad de etileno liberado depende del pH de la solución y de la humedad relativa del ambiente; además la efectividad de respuesta varía de acuerdo con la especie, cultivar, tecnología de producción, dosis, forma de aplicación y temperatura (Arshad y Frankenberger, 2002; Pokhrel, 2013; Hu et al., 2017). Por lo anterior, el objetivo del presente estudio fue evaluar el efecto de la aplicación de dos concentraciones de ácido 2-cloroetil fosfónico en el tiempo y homogeneización de la maduración de los frutos de cultivares de aguacate cvs. Hass y Méndez.
Materiales y métodos
Material vegetal y tratamientos
Se cosecharon frutos de aguacate cultivares Hass y Méndez con 23.4 ± 0.5% y 24.0 ± 0.3% de materia seca (MS), respectivamente, desarrollados en la zona productora de Salvador Escalante (Michoacán, México). Previo al establecimiento del experimento se eliminaron aquellos frutos que presentaron daños externos y posteriormente, fueron separados en tres lotes de 38 frutos cada uno: uno de ellos permaneció como testigo, otro fue tratado durante 5 min por inmersión con una solución de 500 mg/l de etefón y el tercero recibió 1000 mg/l del producto anterior por un tiempo igual de 5 min. Las dos soluciones de etefón se prepararon con el compuesto Ethrel 240® de BAYER a 21.70 % en peso de ácido 2-cloroetil fosfónico, ambas soluciones se ajustaron a pH 5 con NaOH (10 N). Los frutos tratados fueron almacenados a 20 ± 2 °C y humedad relativa de 60 ± 5 % durante 11 días, para evaluar su maduración con base en variables fisiológicas, biofísicas y bioquímicas.
Intensidad respiratoria y producción de etileno
Se determinaron diariamente por cromatografía de gases de acuerdo con el método del espacio de cabeza (Tovar et al., 2011); para esto, de cada tratamiento se tomó una muestra al azar de ocho frutos, con los cuales se establecieron cuatro unidades experimentales (repeticiones) de dos frutos cada una, que fueron colocados en recipientes cerrados herméticamente de 2.12 l de capacidad durante 1 hora. Se tomó una muestra de 1 ml del gas del espacio de cabeza y se inyectó a un cromatógrafo de gases (Hewlett Packard, modelo 5890 serie II), con columna tipo abierta, empaque de capa porosa de sílica de gel que fue conectado simultáneamente a un detector de ionización de flama (FID) y a un detector de conductividad térmica (TCD). Las condiciones de operación fueron: temperatura de la columna 150 °C, FID 180 °C y TCD 180 °C; se utilizó un estándar de CO2 con 500 μl/l y de etileno con 20 μl/l, ambos de INFRA®. Los datos de respiración se reportaron como ml/l por hora de CO2 y la concentración de etileno en μl/kg por hora.
Pérdida de peso y de firmeza de frutos
Las pérdidas de peso se determinaron midiendo cada 2 días el peso de cinco frutos por tratamiento de manera individual con una balanza digital ALSEP EY-2200; para la obtención de datos se aplicó la Ecuación 1. La firmeza se determinó con un texturómetro (Wagner Force Five modelo FDV- 30) con puntal cónico de 7 mm de diámetro; las medidas se realizaron cada 2 días en una muestra de cinco frutos por tratamiento. Los valores se reportaron en Newton (N).
Cambio de color en el epicarpio
Se determinó de manera individual, en una muestra de cinco frutos por tratamiento, utilizando un colorímetro de reflexión HunterLab (Reston Virginia modelo D25-PC2) con un sistema de iluminación D65 y un ángulo de observador de 2°. Con los valores obtenidos (L*, a* y b*) se calculó la luminosidad (L*), el Índice de saturación o croma (C*), el ángulo de tono o hue (H*), el cambio de color y el índice de color (IC) de acuerdo con las Ecuaciones 2, 3, 4 y 5 (Henao-Rojas y Rodríguez, 2016; Medina- Torres et al., 2017; Wrolstad y Smith, 2017).
Cuantificación de fenoles totales (FT)
La extracción de FT se realizó a partir de 1 g de pulpa y la adición de 10 ml de una solución metanol- agua (8:2 v/v), seguido de agitación hasta lograr un macerado homogéneo. La cuantificación se llevó a cabo según el método propuesto por Pío- León et al. (2012) con algunas modificaciones, entre ellas, a una alícuota de 200 de extracto se le agregó, en el orden siguiente: 2.5 ml de agua destilada, 100 μl del reactivo Folin Ciocalteu- agua (1:1 v/v) y 200 μl de Na2CO3-agua (2:8 p/v); luego fueron conservados en oscuridad por 30 min y finalmente, se realizaron las lecturas de la densidad óptica (OD) a 765 nm en un espectrofotómetro digital (GENESYS 10V Thermo Electron Corporation), los resultados se reportaron como contenido de ácido gálico en mg/100 g de pulpa fresca (mg AG 100/g pf).
Extracción y cuantificación de clorofila y carotenoides totales
Para la extracción de clorofila (a, b y total) se empleó 1 g de pulpa a la cual se le agregaron 10 ml de acetona-agua (8:2 v/v), se maceró y dejó reposar por 24 h en oscuridad a 4 °C. La determinación se realizó siguiendo la metodología de Pompelli et al. (2013), para lo cual se emplearon 3 ml del extracto y se tomaron las lecturas de la OD a 645 y 663 nm, los resultados se reportaron como μg de clorofila a, b y total/g de pulpa fresca. La extracción de carotenoides totales se hizo a partir del método propuesto por Acacio-Chirino et al. (2013) con algunas modificaciones, a 10 g de pulpa se le agregaron 20 ml de acetona, se maceró, agitó y decantó. Se agregó acetona hasta extraer completamente los pigmentos. Luego, al extracto le fueron adicionados 20 ml de éter de petróleo y 20 ml de agua destilada, se mezcló en forma suave y se dejó reposar por 10 min, transcurrido este tiempo se desechó la capa inferior y se repitió el proceso dos veces más. Una vez obtenido el extracto libre de acetona, se adicionaron 10 ml de hidróxido de sodio-agua (4:6 p/v) para saponificar la muestra. Finalmente, se hizo un lavado con 10 ml de Na2SO4 anhidro-agua (1:9 p/v) y se realizó la lectura a 454 nm. Los resultados se expresaron como μg de β-caroteno/g en pulpa fresca. La extracción y cuantificación de clorofila y carotenoides se realizó después de 11 días de almacenamiento a 20 °C.
Análisis estadístico de datos
Se utilizó la prueba de Kruskal-Wallis como una alternativa no paramétrica del análisis de varianza (ANOVA) para determinar la diferencia estadísticamente significativa entre las medianas con un nivel del 95% de confianza. Para clorofila y carotenoides se usó un diseño experimental completamente al azar con arreglo factorial 2 x 3 (cultivar Hass y Méndez) y dosis de etefón (0, 500 y 1000 mg/l) asimismo, se realizó una comparación de medias Tukey con un nivel del 95% de confianza. Los datos fueron analizados con el paquete estadístico SAS software versión 9.0 (Brunner et al. 2018).
Resultados y discusión
En frutos de aguacate, el inicio del proceso de maduración está relacionado con los cambios en la sensibilidad a etileno en la fase preclimatérica, lo que significa la ocurrencia de producción autocatalítica de esta fitohormona hasta una concentración de estímulo fisiológico que favorece los cambios relacionados con la maduración (Lallum et al., 2004; Saltveit, 2019); además el etileno exógeno acelera la respiración y adelanta el climaterio (Hernández et al., 2016; Liu y Chervin, 2017; Saltveit, 2019). En este sentido, los frutos presentaron el patrón climatérico de respiración durante la maduración (Figura 1). En cv. Hass, el climaterio respiratorio resultó más elevado con un máximo de 122.93 ml/kg por hora de CO2 luego de 8 días de almacenamiento a 20 °C en el tratamiento con 1000 mg/l de etefón; en el tratamiento con 500 mg/l resultó en el día nueve y, en el control, el máximo ocurrió a los 10 días bajo las mismas condiciones.
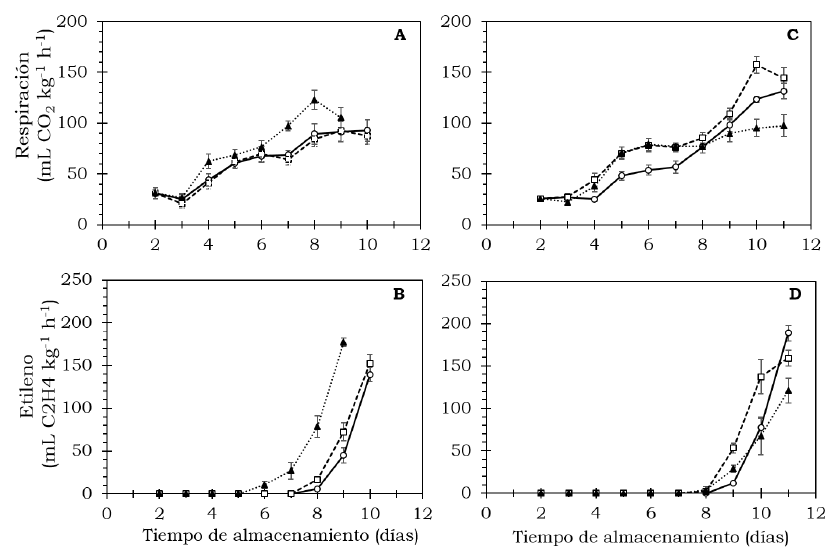
Figura 1 Intensidad respiratoria y producción de etileno en frutos de aguacate cv. Hass (A, B) y cv. Méndez (C, D) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg/l de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 4.
) mg/l de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 4.
Por su parte, en los frutos de cv. Méndez, el tratamiento con 500 mg/l de etefón estimuló la mayor celeridad de respiración con un máximo de 157.34 ml/kg por hora de CO2 a los 10 días de almacenamiento, seguido del control y tratamiento con 1000 mg/l, después de 11 días a 20 °C (Figura 1A, C). Para el caso de etileno, en cv. Hass, la producción auto catalítica se presentó a los 5 días de almacenamiento en los frutos tratados con 1000 mg/l y a los 7 días en los otros dos tratamientos (Figura 1B). Con respecto a cv. Méndez, los tratamientos con 500 y 1000 mg/l presentaron la producción auto catalítica a los días, mientras que en el control ocurrió a los días a 20 °C (Figura 1D). De manera similar, Blakey et al. (2012) encontraron en aguacate cv. Hass tratado con etefón (50 ml/l) un incremento significativo de la respiración y producción de etileno luego de seis horas de almacenamiento a 21 °C. Sañudo-Barajas et al. (2008) lograron en frutas de papaya Maradol adelantar la aparición del máximo climaterio en el día 3 después de la aplicación de 2.5 g/l de etefón, en comparación con el testigo que ocurrió el día 7, sin cambios significativos en la respiración.
Durante la maduración, las pérdidas de peso se incrementaron (P < 0.05) a medida que avanzó el tiempo de almacenamiento (Figura 2, Tabla 1). En frutos del cv. Hass la perdida correspondió a 5.28%, 6.05% y 6.74 % para el control, etefón 500 mg/l y etefón 1000 mg/l, respectivamente, después 9 días de exposición a 20 °C (Figura 2A). Los frutos de este cultivar tratados con etefón mostraron un deterioro severo después de 11 días de almacenamiento. En el cv. Méndez, después del mismo periodo de almacenamiento, las pérdidas de peso resultaron menores en el control (4.08%) en comparación con el tratamiento etefón 500 mg/l (5.32%) y etefón 1000 mg/l (5.73%) (Figura 2C). Bower y Jackson (2003) y Bower y Papli (2006) encontraron en frutos de aguacate que las pérdidas de peso constituyen uno de los principales factores de deterioro de la calidad, principalmente cuando estás superan 6%, condición que se mantiene para el cv. Méndez los días de almacenamiento. Martin y Rose (2014) indicaron que el contenido y composición de ceras cuticulares, epicuticulares e intracuticulares, acumuladas durante el desarrollo de los frutos influyen de manera importante en la sensibilidad a pérdidas de agua durante el manejo poscosecha, lo cual significa que, entre ambos cultivares evaluados, existen diferencias en acumulación de estos compuestos siendo más sensible la del cv. Hass (Figura 2).
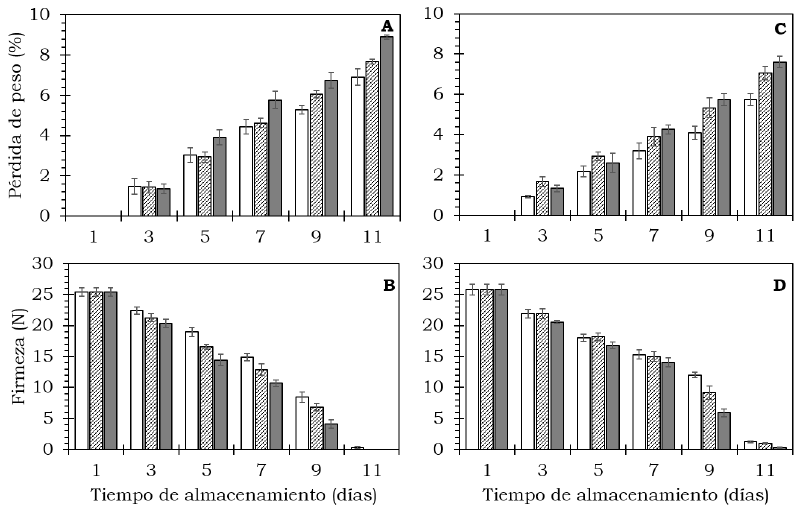
Figura 2 Comportamiento de firmeza y pérdida de peso en frutos de aguacate cv. Hass (A, B) y cv. Méndez (C, D) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
Por otra parte, en ambos cultivares la firmeza de la pulpa disminuyó (P < 0.05) con el avance del proceso de maduración (Figura 2, Tabla 1).
Tabla 1 Resultados del p-valor de los principales efectos e interacciones de la dosis de etefón y tiempo de almacenamiento en los análisis mediante la prueba de Kruskal-Wallis, en variables de calidad poscosecha para los cultivares de aguacate Hass y Méndez.
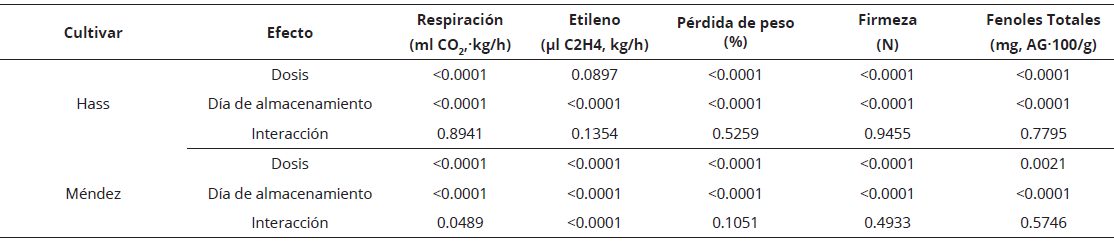
p-valor en negrita indica efecto significativo (p <0.05, prueba X2).
Los frutos sin tratamiento (control) de ambos cultivares, mostraron una firmeza mayor respecto a los frutos tratados con etefón, lo que sugiere un mayor avance en la maduración de estos últimos (Figura 2). Luego de 11 días de tratamiento, en los frutos del cv. Hass ocurrió un avanzado deterioro por senescencia (Figura 2B). En el caso de cv. Méndez, la reducción de la firmeza después de 11 días de almacenamiento resultó mayor en los frutos tratados con 1000 mg/l de etefón con respecto al control (Figura 2D). La reducción de la firmeza en los frutos disminuye como resultado de los procesos fisiológicos característicos de la maduración. De acuerdo con Prasanna et al. (2007) y Pedreschi et al. (2019) esta disminución ocurre debido a cambios en el metabolismo de los componentes de la pared celular y a un incremento en la actividad de enzimas como pectilmetilesterasa, poligalacturonasa y pectatoliasa. En frutos de tomate tratados con etefón (500, 1000 y 1500 mg/l) también se registró disminución significativa de la firmeza (Dhall y Singh, 2013).
El color externo de los frutos de aguacate cambió significativamente (P < 0.05) (Tabla 2). Se observaron cambios en la disminución de la luminosidad (L*) e índice de saturación (C*), así como un incremento del ángulo de tono (H*) durante el proceso de maduración luego de 11 días a 20 °C (Figura 3). Durante la etapa de maduración, el cambio en color (AE) aumentó de manera significativa (P < 0.05) respecto al valor inicial (Figura 4); mientras que el IC disminuyó durante la maduración en ambos cultivares, siendo menor a los 11 días (P < 0.05) (Figura 5, Tabla 2). El color es sin duda un indicador de maduración importante para el sector industrial y consumidores; Henao-Rojas y Rodríguez, 2016, mencionan que el IC disminuye durante la maduración y que los descensos importantes del IC se correlacionan con una mayor velocidad del proceso de maduración. Cox et al (2004) encontraron durante la maduración cambios en el color del epicarpio en frutos de aguacate desde una tonalidad verde a violeta oscuro como resultado de la acumulación de cianidina-3- glucósido.
Tabla 2 Resultados del p-valor de los principales efectos e interacciones de la dosis de etefón y tiempo de almacenamiento en los análisis mediante la prueba de Kruskal-Wallis, en color externo para los cultivares de aguacate Hass y Méndez.
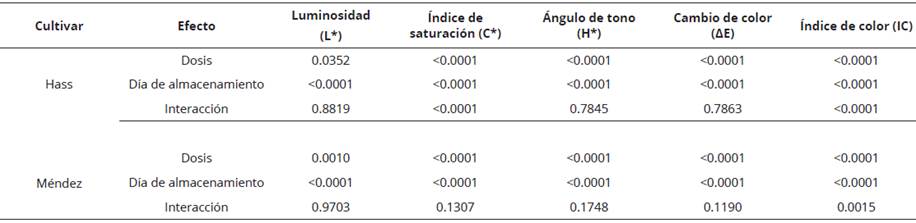
p-valor en negrita indica efecto significativo (p <0.05, prueba X2).
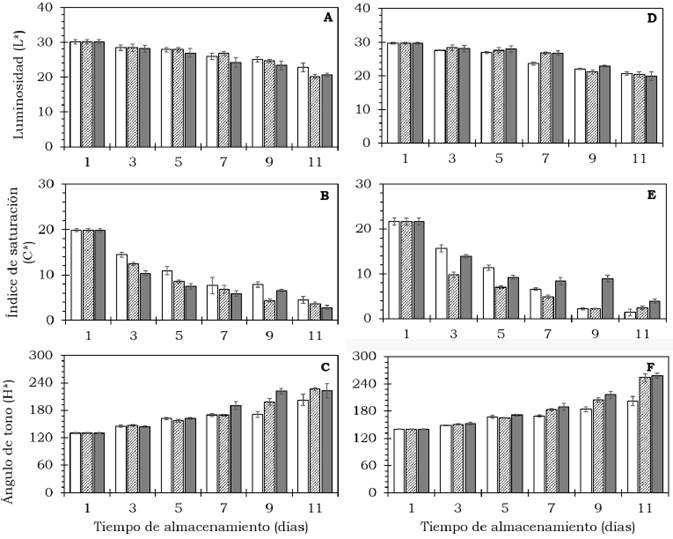
Figura 3 Comportamiento de los componentes del color en frutos de aguacate cv. Hass (A, B, C) y cv. Méndez (D, E, F) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
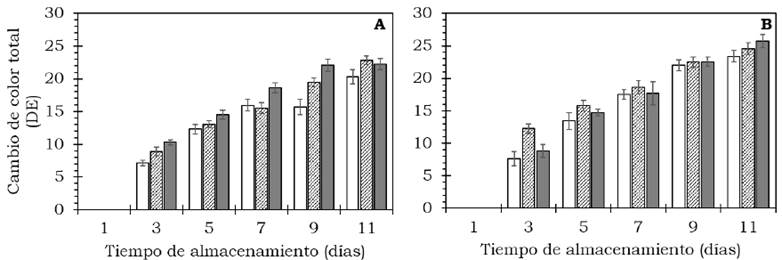
Figura 4 Cambio de color en frutos de aguacate cv. Hass (A) y cv. Méndez (B) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5.
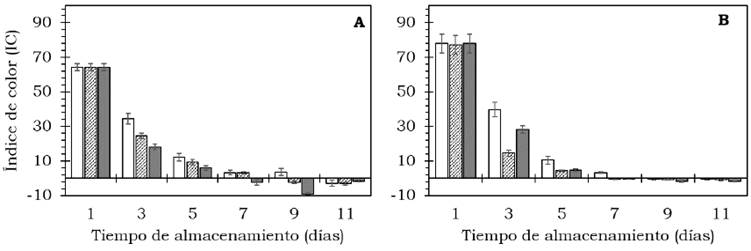
Figura 5 Índice de color en frutos de aguacate cv. Hass (A, B, C) y cv. Méndez (D, E, F) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5..
) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5..
La concentración de fenoles totales en los frutos de ambos cultivares determinados al momento de la cosecha resultaron de 60 mg/100 g de AG pf y alrededor de 30-40 mg/100 g de AG pf en estado de madurez de consumo. Para el tratamiento con 1000 mg/l de etefón, en ambos cultivares la concentración de FT disminuyó (P < 0.05) durante el proceso de maduración a 20 °C (Figura 6, Tabla 1). Por su parte, en los frutos del cv. Hass, después de 11 días de almacenamiento, el contenido de FT disminuyó un 56.89 % en los tratados con 1000 mg/l, 51.03 % en los que se usó 500 mg/l y, en el control, la pérdida de FT resultó de 36.57 % Por otro lado, el contenido de FT en la pulpa de frutos de aguacate cv. Méndez disminuyó un 49.12 % en los tratados con 1000 mg/l, 33.89 % en los tratados con 500 mg/l, mientras que en los frutos del control la pérdida de estos metabolitos fue de 29.85%. Villa- Rodríguez et al. (2011) reportaron un contenido de FT de 10 mg/100 g de AG pf en madurez fisiológica y 35 mg/100 g de AG pf en madurez de consumo. De acuerdo con Villa-Rodríguez et al. (2020) y Sousa et al. (2014) el contenido de compuestos fenolicos es significativamente afectado por el clima, el cultivar, la técnica de producción, las condiciones de maduración y conservación, entre otros, por tanto el contenido de fenoles encontrado en este estudio puede ser parcialmente explicado por estos factores.
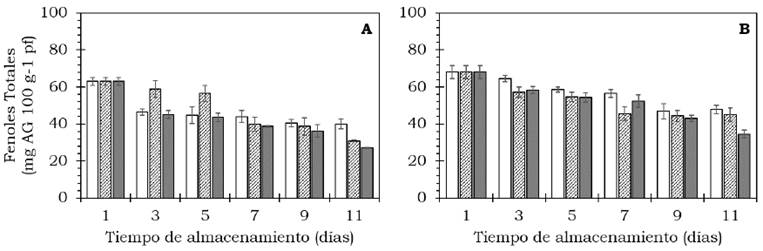
Figura 6 Cambio en el contenido de fenoles totales en frutos de aguacate cv. Hass (A) y cv. Méndez (B) tratados con: 0 (
 ), 500 (
), 500 (
 ) y 1000 (
) y 1000 (
 ) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5
) mg L-1 de etefón y almacenados a 20 ± 2 °C. Medias ± DE, n = 5
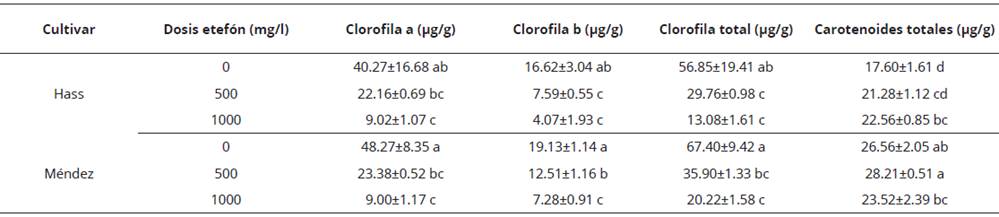
En los contenidos de clorofila se presentaron diferencias (P < 0.05) por efecto del cultivar y la dosis de etefón (Tabla 3). En ambos cultivares, en el tratamiento ocurrió el mayor contenido de clorofila total en estado de madurez de consumo. De igual forma, la concentración de carotenoides totales varió (P < 0.05) por efecto del cultivar y la dosis de etefón aplicada para inducir maduración; sin embargo, la pulpa de los frutos del cv. Méndez presentaron mayor contenido de carotenoides totales en comparación con el cv. Hass. Con el tratamiento 500 mg/l en el cv. Méndez ocurrió la mayor retención de este pigmento en el estado de madurez de consumo (28.21 ± 0.51 μg/g). Asimismo, se observó que la dosis de etefón favoreció la presencia de carotenoides (Tabla 3). Asociado con los cambios en color de la pulpa de tonalidad verde-amarillo a amarillo durante la maduración, el menor contenido de clorofilas (a, b y total) y mayor concentración de carotenoides, resulta significativamente importante en cuanto a la tonalidad de la pulpa con fines de consumo en fresco y procesamiento (Vergara-Domínguez et al., 2016). Cox et al. (2004) y Ashton et al. (2006) encontraron una reducción en la concentración de clorofilas en frutos de aguacate cv. Hass por efecto del proceso de maduración, tal como ocurrió en el presente estudio (Tabla 3). Lu et al. (2009) encontraron diferencias en los contenidos de carotenoides en pulpa de aguacate cv. Hass en estado de madurez de consumo por efecto de condiciones de desarrollo y época de cosecha, con variaciones desde 5 μg/g hasta 40 μg/g en carotenoides totales. Los valores encontrados en el presente trabajo varían entre 17 y 28 μg/g, lo cual permite asumir que el cultivar, el contenido de materia seca en cosecha y el manejo poscosecha también influyen en el contenido de estos pigmentos. Con respecto a estos pigmentos, el tratamiento con 500 mg/l favoreció una mayor acumulación que resulta importante por los beneficios que otorgan a la salud humana, por su capacidad antioxidante y la conservación de la funcionalidad de la pulpa de aguacate.
Conclusiones
El tratamiento con el liberador de etileno etefón en dosis de 1000 mg/l en frutos de aguacate cv. Hass y de 500 mg/l en frutos de cv. Méndez, almacenados a 20 ± 2 °C, adelanta el inicio de la producción auto catalítica y, por tanto, reduce en 2 días el proceso de maduración, en comparación con frutos no tratados, manteniendo de manera aceptable y homogénea la firmeza y el color del epicarpio. El tratamiento del fruto de aguacate con etefón, a diferencia del tratamiento con gas etileno, resulta más económico al no requerir instalaciones complejas, lo que permite su aplicación para la maduración de bajos volúmenes de producto, tanto para agricultores como para comercializadores; asimismo conduce a la homogeneización en la maduración de los frutos de aguacate y a la aceleración de las pérdidas del contenido de clorofila e incrementó de carotenoides en la pulpa, lo que permite ofrecer un producto con calidad uniforme en cuanto a características organolépticas y funcionales, logrando mayor aceptación por parte de los consumidores.