Introducción
El cacao (Theobroma cacao L.) es uno de los cultivos comerciales más importantes para países en desarrollo como Costa de Marfil, Indonesia, Ecuador y Colombia. La producción mundial es aproximadamente de 4.6 millones de toneladas métricas al año, esta actividad vincula a seis millones de productores y es esencial para la supervivencia de 40 millones de personas en todo el mundo (International Cocoa Organization [ICCO], 2018). Colombia es el décimo productor de cacao a nivel mundial, con un área establecida de 173.016 ha y una producción de 56.861 toneladas métricas de cacao al año. Este cultivo provee el sustento de más de 35.000 familias, principalmente campesinas y genera alrededor de 155.000 empleos (Federación Nacional de Cacaoteros [FEDECACAO], 2018).
La producción nacional se concentra en 10 de los 32 departamentos del país y Antioquia ocupa el segundo puesto, solo por debajo de Santander, con una producción anual de 5285 toneladas métricas. Actualmente, en el departamento, el 92 % de esta producción se concentra en las subregiones de Urabá, Magdalena medio, Bajo cauca y el Nordeste y que suman aproximadamente 40 municipios productores de cacao, los cuales generan cerca de 22.000 empleos directos (FEDECACAO, 2018).
Los bajos rendimientos y la asistencia técnica insuficiente, son los principales retos que afronta el sector cacaotero. Actualmente, el promedio nacional de producción es de 400 kg/ha/año, lo que dista de los 800 kg/ha/año que se requieren para que la producción sea considerada como rentable (FEDECACAO, 2018). Las causas principales de esta baja productividad, son el manejo de los problemas fitosanitarios y el cambio climático, las que constituyen un gran desafío para el sector.
En Colombia, como en el resto del mundo, el cultivo de cacao es afectado por enfermedades que reducen su producción, entre ellas, la mazorca negra y el cáncer del tallo (Jaimes y Aranzazu, 2010). Estas enfermedades son causadas por diferentes especies del género stramenopilo Phytophthora y generan pérdidas del 30 % en mazorcas y muerte del 10 % de los árboles, superando los 400 millones/año en pérdidas (Caicedo et al., 2014). Aunque estas enfermedades son conocidas en el país desde hace más de 60 años, es poco lo que se sabe acerca de las especies de Phytophthora asociadas y de las pérdidas que estas generan. De acuerdo con Phillips-Mora y Cerda (2009), existen al menos ocho especies de Phytophthora causantes de estas enfermedades, las cuales difieren en su distribución, ocurrencia y agresividad. P. palmivora está ampliamente distribuida en todas las regiones donde se produce cacao, mientras que P. megakarya, es endémica del este y centro de África, donde se concentra gran parte de la producción. Las especies P. capsici, P. citrophthora, P. nicotianae var. parasitica, P. arecae, P. megasperma y P. katsurae se han reportado en diferentes zonas productoras y son menos agresivas (McMahon y Purwantara, 2004).
Teniendo en cuenta lo anterior, se planteó un estudio para identificar las especies de Phytophthora asociadas a la mazorca negra y al cáncer del tallo, presentes en los cultivos de cacao del departamento de Antioquia, con el objetivo de definir estrategias de manejo más efectivas.
Materiales y métodos
Colecta de muestras, aislamiento y conservación del oomiceto.
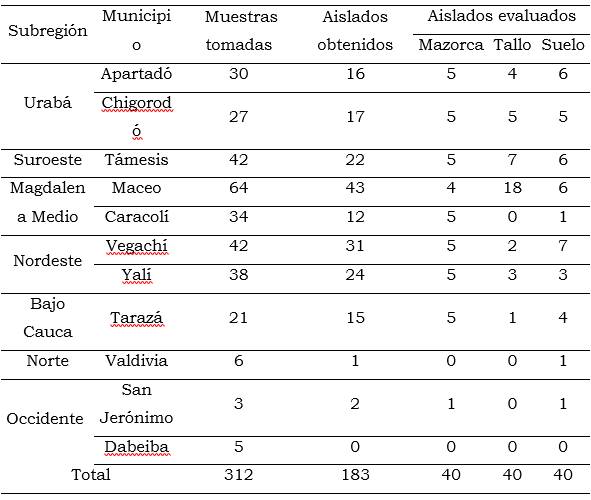
Se realizaron muestreos en 11 municipios productores de cacao, de diferentes subregiones de Antioquia (Tabla 1). En cada municipio se tomaron muestras de tejidos con síntomas típicos de mazorca negra, cáncer del tallo y muestras de suelo en los árboles afectados. Adicionalmente se tomó información de los clones sembrados, de la edad, el área, el estado fitosanitario del cultivo, del material de siembra, la procedencia de la semilla y de las especies acompañantes. Se georreferenciaron todos los puntos de muestreos, las muestras se marcaron y se llevaron al laboratorio de Sanidad Vegetal de la Universidad Nacional de Colombia, sede Medellín.
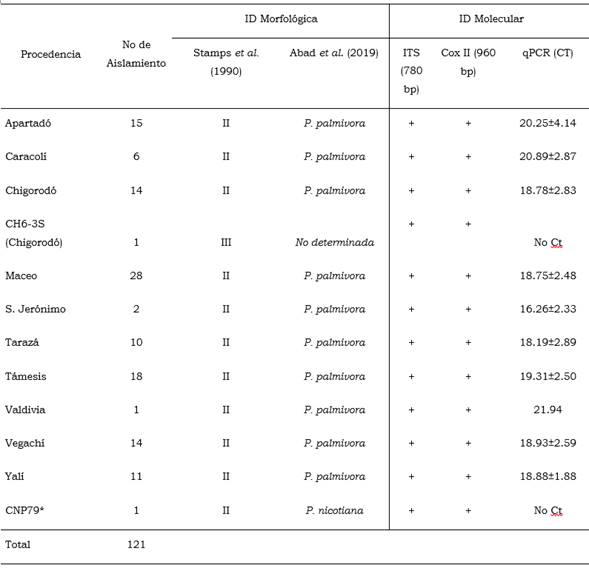
Para el aislamiento del oomiceto, se hicieron cortes de la zona de avance de la lesión, se tomó tejido interno de mazorcas y de tallo y se sembraron fragmentos de 0.5 mm en caja de Petri con medio arveja, sucrosa, agar (AAE) suplementado con antibióticos (ampicilina 250 µg/L, rifampicina 10 µg/L y penicilina 400 µg/L). Los aislamientos de las muestras de suelo se realizaron usando el método de trampeo con tejido vegetal (trozos de cáscara de cacao), descrito por Erwin y Ribeiro (1996)) y siembra en AAE. Todos los cultivos se incubaron a temperatura ambiente (24 ºC +/-1 °C) y luz continua durante siete días. Con los aislados obtenidos, se hicieron cultivos monoesporangiales y se almacenaron a temperatura ambiente (24 ºC+/-1 °C) en viales con agua corriente estéril. Se realizó la caracterización morfológica y molecular de 120 cultivos de Phytophthora representativos de las diferentes zonas de muestreo, de los clones en campo y del tejido afectado (Tabla 1).
Morfología y crecimiento de la colonia
Los aislados se crecieron en medio de cultivo Agar Zanahoria (AZ) en condiciones de oscuridad a 25 °C. Se midió el radio de cada una de las colonias, durante cuatro días, cada 24 horas. Al séptimo día se calculó el área bajo la curva para el crecimiento de la colonia (AUGPC) y se determinó el patrón de crecimiento, de acuerdo con los parámetros establecidos por Erwin y Ribeiro (1996).
Evaluación del homotalismo/heterotalismo
Los aislados se crecieron en medio Agar Cebolla (ACA), este medio presenta un alto contenido de β-sitoesterol, el cual estimula la reproducción sexual de Phytophthora spp., tanto en especies homotálicas (autoinducción) como en especies heterotálicas (inducción cruzada) (Ko, 1985). Los cultivos se mantuvieron a 20 °C y en oscuridad durante 15 días. Los que presentaron estructuras de reproducción sexual se catalogaron como homotálicos y aquellos que no la presentaron, se asumieron como heterotálicos. En los aislados homotálicos, se determinó el tipo de oospora, la pared del oogonio y el tipo de acoplamiento anteridial.
Características morfológicas de esporangios y clamidosporas
Se prepararon suspensiones acuosas a partir de los cultivos crecidos por siete días en medio AZ a 25 °C en condiciones de oscuridad. De cada aislado se evaluaron 40 esporangios y se consideraron la forma, la caducidad, el tamaño (largo y ancho), la longitud de la papila y la longitud del pedicelo. Inicialmente se garantizó que los cultivos estuvierann en crecimiento por siete días en el medio Agar zanahoria. Este es un factor importante, ya que la edad y el tipo de cultivo donde se siembran los aislados, están directamente relacionados con la caducidad de los esporangios. Estos solo se desprenden al alcanzar la madurez y las longitudes de pedicelo son uniformes una vez se separan del esporangióforo. Otro factor que se tuvo en cuenta, es que al momento de preparar las suspensiones en agua, el micelio se desprendió suavemente del agar para evitar romper los esporangios.
Se evaluaron 40 clamidosporas, obtenidas de cultivos crecidos en medio PDA30 a 30 ºC en oscuridad, durante 15 días y se consideró la forma, la posición y el diámetro. Todas las observaciones y mediciones se hicieron con un aumento de 100X, utilizando un microscopio Nikon E200, provisto de una cámara digital y acoplado a un analizador de imágenes.
Se utilizó un diseño experimental de bloques al Azar (DBA), con cuatro repeticiones, y con los datos de las variables cuantitativas, se construyó un Modelo de escalamiento multidimensional (MDS) para establecer la similitud entre aislados, de acuerdo con la distancia euclidiana entre ellos.
La asignación de los aislados a los grupos morfológicos de Phytophthora, se hizo con base en la clave taxonómica de Stamps et al. (1990), mientras que la identificación a nivel de especies se hizo usando la clave lúcida de Abad et al. (2019).
Evaluación de temperaturas cardinales
Se evaluó una muestra de 18 aislamientos, representativa del tipo de tejido y/o sustrato del cual fueron aislados, del clon y del origen geográfico. La evaluación de las temperaturas cardinales se hizo en cultivos crecidos en medio AZ en condiciones de oscuridad a 10, 15, 20, 25, 30 y 35° C.
Se utilizó un DBA con dos repeticiones y se evaluó el radio de la colonia cada 24 horas, durante cuatro días. Con los datos obtenidos, se calculó el AUGPC de cada aislado a todas las temperaturas evaluadas y se ajustó un modelo polinomial de segundo orden para describir la relación entre crecimiento y temperatura, mediante el programa Statgraphics Centurion XVII y un análisis de varianza con un nivel de significancia del 5 %.
Identificación molecular de aislados
Cada aislado creció durante seis días en Caldo Arveja (CA), con luz permanente y sin agitación. La extracción y purificación de ADN se hizo siguiendo la metodología descrita por Álvarez et al. (2004). El ADN obtenido se resuspendió en 100 µL de buffer Tris EDTA (Tris HCl 10 mM, EDTA 1 mM; pH 8.0).
La identificación molecular a nivel de género se realizó con la técnica de PCR convencional, amplificando la región de los espaciadores internos transcritos (ITS) y la región del gen mitocondrial citocromo oxidasa II (Cox II) (Tabla 2).
Para la región ITS se hicieron reacciones de 30 µl que contenían: 1.8 µl de ADN (20 ng/μl), 3 µl de solución buffer 10X, 3 µl de MgCl2 100 mM, 0.24 µl de Taq Polimerasa 5 U/μl, 0.168 µl de cada primer a 50 µM, 1.8 µl de dNTP´s 10 mM completando el volumen con agua MilliQ estéril. El perfil de amplificación fue de 94 ºC durante 5 minutos, 35 ciclos de 94º C por 30 s, 60.7 ºC por 30 s y 72 ºC por 60 s, se programó un ciclo adicional a 72 ºC por 10 min, para la extensión final y 30 min a 15º C.
Para la región Cox II se hicieron reacciones de 30 µl, que contenían 1.2 μl de ADN (20 ng/μl), 3.0 µl de solución buffer 10X, 3.0 µl de MgCl2 100 mM, 0.5 µl de Taq Polimerasa 1U/μl, 0.5 µl de cada primer a 50 µM y 1.6 µl de dNTP´s 12.5 mM completando el volumen con agua MilliQ estéril. El perfil de amplificación fue de 94 ºC durante 4 min, 35 ciclos de 94 ºC por 30 s, 53.6 ºC por 30 s y 72 ºC por 90 s. Se programó un ciclo adicional a 72 ºC por 10 min, para la extensión final y 30 min a 15 ºC.
Como control negativo se usó la mezcla de reacción sin el ADN y la mezcla con ADN de la cepa CNP79 de Phytophthora nicotianae como control positivo. Las amplificaciones se hicieron en un Termociclador iCycler-BioRad™ y la detección de los productos de PCR se hizo mediante electroforesis en geles de agarosa al 1 % p/v, los fragmentos obtenidos se visualizaron con luz ultravioleta, utilizando un documentador de geles BiodocAnalyze Biometra.
La detección a nivel de especie se hizo mediante qPCR, usando la sonda Beacon® P-PHYTO-PB-1, específica para P. palmivora. La reacción de PCR de un volumen final de 25 µl estuvo compuesta de: 12.5 µl de MaximaProbe/ROX qPCR Master Mix, 1.5 µl de sonda P-PHYTO-PB-1 300 nM, 0.75 µl de cebador P-PHYTO-PF 300 nM, 0.5 µl de cebador P-PHYTO-PR 400 nM, 2 µl de ADN total (30 ng/μL), 7.75 μl de agua MilliQ estéril. Como control negativo absoluto se utilizó la mezcla de reacción sin ADN, como control negativo se utilizó la mezcla, más ADN de P. nicotianae y un control positivo, que consistió en la mezcla, más el ADN de una cepa conocida de P. palmivora de palma de aceite.
Las muestras se amplificaron en un equipo Stratagene Mx 3005P (Stratagene, La Jolla CA, USA) con el perfil de amplificación de 95 ºC durante 10 min; 35 ciclos de 95 ºC por 30 s; 60 ºC por 1 min y extensión a 72 ºC por 1 min.
Los resultados se analizaron en términos del valor del ciclo umbral (Ct) alcanzado. Las muestras con un valor de Ct < 35 se consideraron como positivas y las muestras con valores iguales o superiores a 35, como negativas.
Resultados
Obtención de aislados y caracterización morfológica
Se procesaron 312 muestras, de las cuales se obtuvieron 183 aislados. En 82 % de los predios visitados se confirmó la presencia de Phytophthora spp. Un mayor porcentaje de aislados se obtuvo de muestras de los municipios de Maceo y Vegachí, 43 y 31 aislados, respectivamente. En San Jerónimo y Valdivia solo se obtuvieron dos y uno, respectivamente, en Dabeiba no se obtuvo ninguno. El Magdalena medio y el Nordeste antioqueño fueron las regiones con mayor presencia del oomiceto, con 98 y 80 aislados respectivamente, seguidas por el Urabá y el Suroeste, con 57 y 42 aislados respectivamente. El Bajo Cauca, el Norte y el Occidente fueron las regiones con menor presencia de Phytophthora spp., con 21, 6 y 3 aislados respectivamente (Tabla 1).
De los 120 aislados evaluados, 119 presentaron patrones de crecimiento estrellados con ligeras variaciones; micelio aéreo algodonoso y abundante hacia el centro de las colonias (Figura 1A, C y D). La cepa CH6-3S presentó un patrón diferente, radiado con poca producción de micelio (Figura 1B). Todos los aislados fueron similares en términos de crecimiento y al cuarto día la mayoría había cubierto completamente la caja.

Figura 1 Patrones de crecimiento observados en aislados de Phytophthora spp. en medio AZ, crecidos durante 4 días a 25 ± 1°C en oscuridad. A) VA3-2S, B) CH6-3S, C) TM1-5M, D) M8-10T.
Se observó alta variabilidad en la forma y el tamaño de los esporangios entre aislados y dentro de un mismo aislado. En relación con la forma de los esporangios, se identificaron ocho morfotipos (Figura 2). El 96 % de los aislados presentaron tres o más de estas formas: todos presentaron esporangios ovoides y elipsoides, siendo los primeros los más abundantes. La cepa CH6-3S produjo esporangios globosos principalmente y las cepas TM2-2S, TM2-2T, TM2-3M, TM2-3S, CH3-2M, MA2-5M y CA4-2M produjeron esporangios elipsoides principalmente.
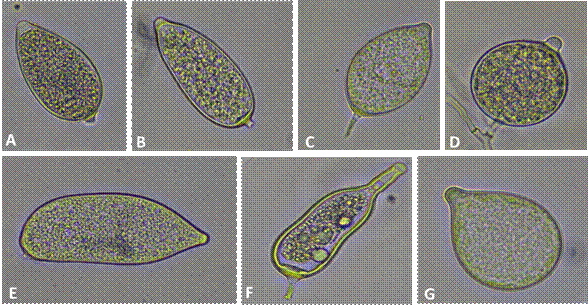
Figura 2 Morfotipos más frecuentes en los esporangios de Phytophthora spp. A) Ovoide, B) Elipsoide, C) Limoniforme, D) Globoso, E) Irregular, F) Constreñido, G) Obpiriform
El tamaño de los esporangios osciló entre 26-75 x 24-36 µm (promedio 52 x 29 µm), con una relación largo/ancho entre 1.4 µm y 2.2 µm (promedio 1.8 µm). El 80 % de los aislados presentaron esporangios papilados, el 20 % con esporangios semipapilados. La longitud de la papila osciló entre 1.45 µm y 5.6 µm (promedio 3.5 µm) y todos los esporangios presentaron pedicelo corto, con una longitud que osciló entre 1.4 µm y 5.1 µm (promedio 3.0 µm). La mayoría de los aislados produjeron esporangios caducos, a excepción de la cepa CH6-3S, cuyos esporangios fueron no caducos, semipapilados (1.83 µm) con un tamaño promedio de 42 x 25 µm, con una relación largo/ancho de 1.77 (Tabla 3).
Tabla 3 Características morfológicas de aislados de Phytophthora spp., obtenidos a partir de muestras de cacao.

El 100 % de los aislados produjeron clamidosporas esféricas, con un diámetro que oscila entre 24 µm y 39 µm (promedio 30 µm) (Tabla 3).
Solo la cepa CH6-3S fue homotálica. El resto de aislados fueron heterotálicos. Ante la imposibilidad de conseguir cepas de referencia A1 y A2 para hacer las pruebas de compatibilidad sexual, no se reportan datos sobre el tipo de compatibilidad sexual de las cepas heterotálicas. La cepa CH6-3S presenta oogonios sin ornamentaciones, acoplamiento anteridial parágino y oosporas apleróticas (Figura 3).
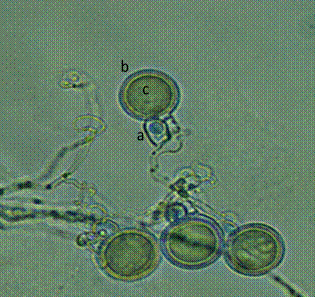
Figura 3 Estructuras sexuales observadas en la cepa CH6-3S. A) Anteridio parágino, B) Oogonio de pared lisa, C) Oospora aplerótica.
El Análisis de Escalamiento Multidimensional mostró que el 83 % de los aislados de Phytophthora spp. analizados conforman un grupo y esto indica una alta similitud en relación con sus atributos morfológicos, independientemente de su procedencia. El 17 % restante conforman grupos más pequeños que difieren significativamente del grupo principal en al menos un caracter. Los aislados CH6-3S y MA9-10T presentan esporangios y clamidosporas más pequeños que el resto de los aislados, pero estos a su vez, difieren entre sí, en la relación largo/ancho de los esporangios. Los aislados CA4-1S CH5-1T y CA2-3M presentan esporangios más grandes que el resto y difieren entre sí por el tamaño de sus clamidosporas (Tabla 3). El grupo formado por los aislados TM4-4M, VG1-6S y TM1-14T presenta esporangios más pequeños, pero con papilas más grandes que la mayoría de los aislados, y el grupo formado por los aislados VG5-1T, YA4-7M y MA6-10T presenta esporangios más pequeños y una relación largo/ancho en los esporangios, menor que la mayoría de los aislados (Figura 4).
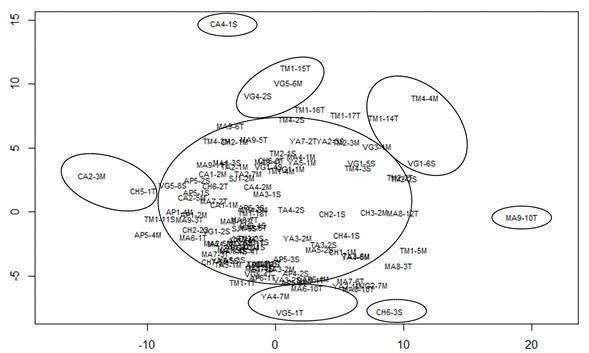
Figura 4 Análisis de escalamiento multidimensional. Similitud entre aislados de Phytophthora sp., basada en la distancia euclidiana.
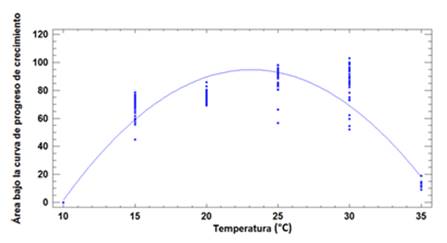
Para el estudio de las temperaturas cardinales se ajustó un modelo polinomial de segundo orden que describe en un 89 %, la relación entre crecimiento y temperatura. La ecuación del modelo ajustado es
Crecimiento = -195.108 + 25.0855*Temperatura 0.542663*Temperatura2
El análisis de varianza estableció que existen diferencias estadísticamente significativas con un nivel de confianza del 95 %, en el crecimiento de los diferentes aislados de Phytophthora spp., cuando se evaluaron bajo las diferentes temperaturas. A 10 °C, ninguno de los aislados creció, mientras que, a 35 °C, los aislados AP1-2M, AP4-2S, TA3-4T TM1-11S y YA3-1T presentaron un escaso crecimiento, con un valor de AUGPC no mayor a 10. A 15 °C y 30 °C todos los aislados desarrollaron colonias, con valores de AUGPC de 60 y 65, respectivamente. El mayor crecimiento de las colonias se observó a 20 °C y 25 °C, con valores de AUGPC de 85 y 74 respectivamente. La temperatura óptima de crecimiento fue 23 °C con un valor de AUGPC superior a 90 (Figura 5).
Identificación
De acuerdo con la clave taxonómica de Stamps et al. (1990), se determinó que 119 de los aislados de Phytophthora spp. pertenecen al grupo morfológico II. Este grupo se caracteriza por presentar esporangios caducos, papilados con engrosamiento hialino apical hemisférico de al menos 4 µm de profundidad y generalmente abundantes en medios de cultivo sólidos. Todas las especies de este grupo son heterotálicas. La cepa CH6-3S pertenece al grupo morfológico III, el cual presenta esporangios que pueden ser persistentes o caducos, semipapilados o escasamente papilados con un engrosamiento hialino apical hemisférico menos profundo que el grupo II. Todas las especies de este grupo son homotálicas, con anteridios predominantemente paráginos.
Conforme a la clave dicotómica para especies de Phytophthora, propuesta por Ho et al. (1995) y la clave lúcida de Abad et al. (2019), se determinó que 119 aislados pertenecen a P. palmivora, la cepa CH6-3S no se identificó a nivel de especie.
La amplificación de las regiones ITS y Cox II, permitió la identificación de los 120 aislados como pertenecientes al género Phytop hthora. Al evaluar los valores Ct en la qPCR para los diferentes aislados, se pudo establecer que 119 cepas resultaron positivas para la especie P. palmivora, con valores que oscilan entre 13.51 y 28.9, con un valor promedio de 19. De esta manera se corrobora lo encontrado en la caracterización morfológica. Tanto la cepa CH6-3S, como la cepa CNP79 (P. nicotianae) no cruzaron el umbral de ciclo, por tanto fueron consideradas negativas para P. palmivora (Tabla 4).
Discusión
La prevalencia en campo de la mazorca negra y el cáncer del tallo a menudo es influenciada por condiciones ambientales tales como la precipitación, la temperatura y la humedad relativa. Diversos estudios han demostrado que existe una correlación directa entre algunos parámetros climáticos y el desarrollo de estas enfermedades en el cultivo de cacao. De acuerdo con Jaimes y Aranzazu (2010) la precipitación y la humedad relativa altas, con bajas temperaturas, son condiciones favorables para la liberación y dispersión de las zoosporas, lo que conlleva al desarrollo de lesiones en frutos y tallos. Esto concuerda con los resultados obtenidos en este estudio, al encontrar que en municipios como Vegachí y Maceo, con una temperatura promedio de 23 °C, una humedad relativa del 61 % y una precipitación media anual de 2870 mm y 2700 mm respectivamente; la incidencia fue mayor que en municipios como San Jerónimo, donde la temperatura promedio es de 29 °C, la humedad relativa del 55 % y la precipitación media anual de 1390 mm. En municipios como Apartadó y Chigorodó, donde se observó una prevalencia intermedia de estas enfermedades, la precipitación media anual es de 2635 mm y 3313 mm respectivamente, con una humedad relativa cercana al 100 %, pero con temperaturas promedio superiores a los 27 °C, lo que no sería favorable para la liberación de zoosporas.
En lo que respecta a la caracterización de los aislados, el patrón de la colonia se utiliza a menudo como un atributo complementario para la identificación, ya que no permite diferenciar entre especies de Phytophthora. No obstante, algunas especies desarrollan patrones de crecimiento que persisten bajo una variedad de condiciones de cultivo, como es el caso de P. citricola, que generalmente presenta colonias en forma de crisantemo o roseta; P. palmivora, que presenta colonias en una forma estrellada (como se demuestra en este estudio) y P. cinnamomi, donde las colonias son generalmente petaloides (Erwin y Ribeiro, 1996).
Los descriptores morfométricos utilizados para la identificación de los 119 aislados de P. palmivora han sido históricamente usados en trabajos de identificación morfológica. No obstante, su uso lleva a la superposición entre las especies, debido a las variaciones significativas entre individuos de una misma especie. Además de la alta demanda de tiempo y la amplia experiencia con la que debe contar el investigador (Abad et al., 2011). Por esta razón, en la actualidad, estos se usan como algo complementario a la identificación molecular.
Debido a estas limitaciones, no fue posible identificar el aislado CH6-3S. De acuerdo con la clave lúcida de Abad et al. (2019), los caracteres morfológicos y fisiológicos evaluados en este estudio, coinciden con cuatro especies dentro del grupo morfológico III de Phytophthora (P. elongata, P. constricta, P quercetorum y P. obscura), ninguna de estas especies, ha sido reportada como agente causal de la mazorca negra y del cáncer del tallo en cacao.
Es necesario realizar estudios adicionales que permitan su adecuada identificación. También es necesario hacer estudios patogénicos, etiológicos y epidemiológicos, con el fin de confirmarla como un patógeno del cacao y del riesgo que representa la especie para el cultivo.
Con respecto al MDS, el patrón de agrupamientos observado entre los aislados de P. palmivora, obedece posiblemente a una baja tasa de variación intraespecífica. No existe relación entre la variabilidad de los aislados y su procedencia, ni tampoco con el tipo de tejido de donde fueron aislados. Es probable que la población de P. palmivora en Antioquia presente una estructura genética altamente homogénea, producto de la reproducción asexual de los individuos. La poca variabilidad observada, puede estar asociada con la ocurrencia natural de variación, generalizada entre los patógenos, la cual les permite adaptarse a las condiciones cambiantes del medio ambiente y evolucionar a nuevos patotipos.
Se ha documentado que algunas especies del Phytophthora presentan una diversidad muy marcada, tanto interespecífica, como intraespecífica (Machado et al., 2013). La diversidad intraespecífica es modelada por las fuerzas evolutivas, como son la migración o el efecto fundador en nuevas plantaciones, la recombinación sexual o asexual y las mutaciones que pueden superar la resistencia existente al emerger nuevos patotipos más agresivos (Cooke et al., 2012).
La cepa CH6-3S, por tratarse de una especie diferente a P. palmivora, es normal que muestre una tendencia a separarse de la matriz principal. Consideramos que esta distancia es reducida porque el análisis solo contempla las variables cuantitativas de la fase asexual (esporangios y clamidosporas) y no otras variables como el patrón de la colonia, la forma de los esporangios, la estrategia reproductiva del oomiceto y por ende la formación de estructuras sexuales.
Los resultados obtenidos en este estudio sugieren que la temperatura óptima para el crecimiento de las cepas estudiadas es de 23 °C, la temperatura mínima es de 15 °C y la temperatura máxima es de 35 °C. Estos resultados concuerdan con los reportes de Erwin y Ribeiro (1996), donde se demuestra que todas las especies de Phytophthora asociadas con la mazorca negra y el cáncer del tallo en cacao, tienen un rango óptimo de crecimiento entre 24 °C y 30 °C. Rao (1970) encontró que los aislados de P. palmivora tienen una temperatura óptima de crecimiento entre 26 °C y 28 °C, con crecimiento bajo a 10 °C y 32.5 °C y crecimiento nulo a 5 °C y 37 °C. En un estudio reciente, Puig et al. (2018) reportaron que existe una influencia diferencial de la temperatura sobre el crecimiento micelial y el desarrollo de lesiones sobre frutos de cacao, entre P. palmivora y P. megakarya. Mientras que P. palmivora tiene una temperatura máxima de crecimiento de 34 °C, con un rango óptimo de 28 a 32 °C, P. megakarya presenta una temperatura máxima de 30 °C, con un rango óptimo de 23 a 26 °C. Ninguna de las dos especies crece por debajo de 11 °C. Este rango de temperatura más amplio en el que crece P. palmivora parece darle una ventaja frente P. megakarya, lo que podría estar asociado a su carácter cosmopolita.
Las regiones ITS y Cox II, utilizadas en esta investigación, han sido frecuentemente consideradas en estudios filogenéticos y en el desarrollo de ensayos de diagnóstico en patógenos de plantas. Estas regiones pueden amplificarse con cebadores universales, se presentan en copias múltiples en el genoma y poseen secuencias polimórficas conservadas. Con la aplicación de técnicas basadas en el ADN, se ha avanzado en la identificación molecular de Phytophthora, convirtiéndose en una alternativa adicional a los métodos tradicionales y que supera en la mayoría de los casos, los problemas de delimitación entre especies (Cooke et al., 2007).
La sonda molecular Beacon® P-PHYTO-PB-1 y los cebadores específicos utilizados en este estudio para la prueba de qPCR, fueron diseñados originalmente para la detección temprana de P. palmivora en palma de aceite, en un trabajo llevado a cabo por Álvarez (2013). Sin embargo, los resultados del presente estudio permiten demostrar que también pueden ser usados para la detección en muestras procedentes de cacao. Esto se debe a que esta sonda se diseñó a partir de la región ITS, la cual se caracteriza por ser muy estable y por ser altamente polimórfica, que se conserva a través de las especies de Phytophthora, pero difiere entre las especies dentro del género (Cooke et al., 2007). De acuerdo con lo anterior, esta misma sonda podría tener una aplicación importante en zonas tropicales, donde P. palmivora está reportado como el agente causal de enfermedades en un amplio rango de hospederos. El desarrollo de sondas similares para la detección de las especies Phytophthora reportadas en cacao, puede ser una alternativa para estudios futuros en el departamento y a nivel nacional, esto permitiría un diagnóstico rápido de las especies presentes en el país. El presente trabajo solo muestra los resultados de Antioquia y faltaría explorar otras zonas productoras importantes como Santander y Arauca, departamentos donde se produce la mayor cantidad de cacao en Colombia y además por ser departamentos fronterizos, representan un riesgo alto para el ingreso de nuevos patógenos.
Conclusiones
En Antioquia se encontraron dos especies de Phytophthora. P. palmivora y Phytphthora sp. (CH6-3S) asociadas a la mazorca negra y al cáncer del tallo del cacao. Es necesario realizar estudios de identificación molecular del aislado CH6-3S.
Los datos de variabilidad genética obtenidos en este estudio, son indicativos de que la población de P. palmivora en Antioquia es muy homogénea probablemente con una estructura genética de origen clonal. Es necesario hacer otro tipo de estudios, donde se considere la evaluación de parámetros morfológicos junto con el uso de marcadores moleculares.