Introducción
La marchitez vascular del tomate (Solanum lycopersicum L.) causada por el hongo Fusarium oxysporum f. sp. lycopersici es una de las enfermedades más limitantes del cultivo, debido a que puede causar pérdidas en el rendimiento hasta del 60 %. Los síntomas de la enfermedad en plantas infectadas en etapas tempranas inician con epinastía en hojas viejas, posteriormente se presenta un marchitamiento de las hojas; además el interior del tallo se torna de color marrón, el cual también se marchita y consecuentemente lleva a la muerte de la planta (Agrios, 2005).
El hongo ingresa por la raíz directamente o por heridas causadas por otros patógenos, insectos o debido a prácticas culturales. Por lo tanto, la dificultad de manejo de la enfermedad se debe a colonización del hongo por el sistema vascular, lo que reduce el transporte de nutrientes y agua (Takken y Rep, 2010). Fusarium desarrolla tres tipos de esporas: microconidias, macroconidias y clamidosporas, estas últimas con capacidad de sobrevivencia en el suelo y en restos de cultivo por largos periodos (Agrios, 2005).
Se ha investigado en nuevas estrategias como la contribución del silicio para reducir la incidencia y severidad de enfermedades. Este se acumula en algunas plantas formando una doble capa de cutícula, que además de reducir las pérdidas de agua por transpiración, dificulta el ingreso de patógenos creando una barrera física (da Silva et al., 2015).
El uso del hongo antagonista Trichoderma se ha desarrollado como una alternativa para el manejo de fitopatógenos. A través de diferentes mecanismos como micoparasitismo, antibiosis, desactivando enzimas del patógeno y competencia por sustrato, este hongo contribuye a disminuir pérdidas en un amplio rango de cultivo (Infante et al., 2009).
El objetivo de este trabajo es evaluar la capacidad antagónica de Trichoderma viride y la aplicación de silicio como inductor de resistencia a través del análisis de la concentración de la enzima Polifenoloxidasa, para reducir la marchitez vascular causada por el hongo Fusarium oxysporum f.sp. lycopersici.
Materiales y métodos
El experimento se desarrolló en la sede central de la Universidad del Tolima en Ibagué Tolima, Colombia (4°26’16”N; 75°12’02”O a 1285 m s.n.m.). Se utilizó el material Tomate Chonto Santa Clara obtenido por la Importadora de Semillas S.A.S. IS.
Obtención de muestras para inóculo de F. oxysporum f.sp. lyxopersici
Se colectaron 10 muestras de raíz de plantas con síntomas característicos de la enfermedad en el municipio de Cajamarca Tolima a una altura de 1852 m s.n.m. y temperatura promedio de 13 °C en cultivo de tomate Híbrido Aslam (el día 16 de junio del 2017) y estas se llevaron al Laboratorio de Fitopatología de la Universidad del Tolima para realizar la desinfección y aislamiento del patógeno.
Aislamiento, cuantificación e identificación del patógeno
Las muestras fueron desinfectadas y transferidas a cajas de Petri con PDA e incubadas durante siete días a una temperatura de 24 °C y posteriormente se preparó la suspensión conidial de 106 de acuerdo a lo propuesto por Quilambaqui (2005).
La identificación morfológica se realizó observando al microscopio óptico (40X) características macroscópicas y la caracterización molecular la realizó el Instituto de Biotecnología de la Universidad Nacional de Colombia (IBUN) concluyendo que a través de la metodología propuesta por Hirano y Arie (2006) el aislamiento enviado pertenece a la forma especial F. oxysporum f. sp. lycopersici raza fisiológica 1.
Inoculación del patógeno
Las plantas se inocularon con la suspensión conidial después de 25 días del tratamiento con silicio y después se trasplantaron a bolsas de polietileno negro en sustrato turba de acuerdo a la metodología propuesta por Boix et al. (2014).
Obtención de T. viride y época de aplicación
Fue proporcionado por la empresa BIOCULTIVOS S.A., el bioinsumo tiene una composición de 1*107 conidias ml-1. Se preparó una solución de 5 ml del bioinsumo (Trichoderma viride) por litro de agua y de esta se aplicaron 15 ml a cada bolsa en las siguientes épocas: ocho días antes de trasplante, en el momento de trasplante y ocho días después de trasplante.
Obtención del silicio y época de aplicación
Fue proporcionado por la empresa AGROMIL S.A. y BIOEST S.A.S., tiene una composición de silicio soluble en agua de 0.97 g lt-1, silicio total de 360 g lt-1 y densidad de 1,22 g lt-1. La aplicación de silicio se realizó durante 25 días en la etapa de semillero. Se preparó una solución de 1 ml lt-1 de agua recomendada por el fabricante y se aplicó 10 ml de la solución por alvéolo diariamente hasta el momento del trasplante.
Evaluación del efecto del silicio y T. viride sobre los parámetros epidemiológicos de la enfermedad
La incidencia y severidad de la enfermedad se evaluó 25, 33 y 41 días después de la inoculación (DDI). Para la evaluación se utilizó la escala desarrollada por el Schoonhoven y Pastor (1987). Además, se evaluó la coloración radicular, realizando un corte trasversal de los haces vasculares y de acuerdo con la escala desarrollada por Corrales et al. (1987) y Schoonhoven y Pastor (1987) se determinó el grado de coloración vascular.
Evaluación del efecto del inductor del silicio
El efecto del silicio como inductor de resistencia se evaluó a través de la actividad de la enzima Polifenoloxidasa (PPO). Se tomaron aleatoriamente tres muestras (50 g cada una) por cada tratamiento para un total de 24 muestras, las cuales fueron congeladas en nitrógeno líquido y trasportadas al laboratorio del Grupo de Investigación en Productos Naturales de la Universidad del Tolima. Las muestras fueron conservadas a -80 °C hasta el desarrollo del análisis. Posteriormente, se realizó una maceración del tejido con nitrógeno (N2) líquido y posteriormente se sometió a extracción con buffer fosfato de sodio 100 mM (pH 7.4). Finalmente, las muestras se centrifugaron a 11.000 rpm por 15 min y se recuperó el sobrenadante. El contenido de proteína se cuantificó con el método de Bradford (1976).
La actividad de enzima Polifenoloxidasa (PPO) se determinó espectrofotométricamente de acuerdo con la metodología descrita por Jiang et al. (2005). En la reacción se emplearon 8 µL del extracto enzimático y 200 µL de una solución de buffer fosfato de sodio 100 mM (pH 7.4) que contenía Catecol 100 mM. El ensayo se llevó a cabo en un espectrofotómetro lector de microplacas MultiSkan GOTM marca Thermo Fisher Scientific a una longitud de onda de 412 nm, se empleó un coeficiente de extinción de 1260 y la actividad se cuantificó en U/mg de proteína.
Diseño estadístico y análisis de datos
Para el experimento 1 se empleó un diseño factorial con ocho tratamientos y 12 réplicas que correspondían a una planta:
T1 (silicio +T. viride+ patógeno), T2 (silicio - T. viride+ patógeno), T3 (- silicio +T. viride+ patógeno), T4 (- silicio -T. viride+ patógeno), T5 (silicio +T. viride- patógeno), T6 (silicio -T. viride- patógeno), T7 (- silicio +T. viride - patógeno) y T8 (- silicio -T. viride- patógeno). La unidad experimental era una planta. Todas las variables fueron sujetas a análisis de varianza (ANAVA) y las medias de los tratamientos fueron comparadas por test Tukey (p ≤ 0.05) usando el software estadístico InfoStat.
Resultados
Efecto del silicio y T. viride sobre los parámetros epidemiológicos de la enfermedad
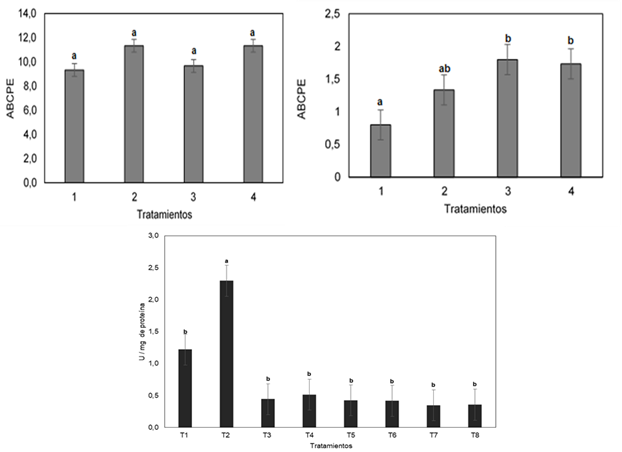
La severidad de la enfermedad las plantas tratadas con silicio e inoculadas y no inoculadas con T. viride fue menor a la severidad de la enfermedad en plantas que no tuvieron silicio y que fueron inoculadas y no inoculadas con T. viride siendo que el área bajo la curva del progreso de la enfermedad (ABCPE) para las plantas tratadas con silicio e inoculadas y no inoculadas con T. viride fue significativamente menor (p ≤ 0,05).
Evaluación del efecto inductor del silicio sobre la enzima Polifenoloxidasa (PPO)
La actividad enzimática evaluada a los 60 días después de la inoculación fue mayor en los tratamientos T1 (silicio +T. viride+ patógeno) y T2 (silicio - T. viride+ patógeno) en comparación con los demás tratamientos. La mayor actividad en los tratamientos con silicio e inoculados con el patógeno (T1 y T2) puede ser atribuida a la capacidad del agente inductor para activar los mecanismos de defensa en la planta incluida la actividad de la Polifenoloxidasa (PPO). (Figura 1).
Discusión
Primer experimento: Efecto del silicio y T. viride sobre los parámetros epidemiológicos de la enfermedad
Investigaciones realizadas por Haran et al. (1996) encontraron que Trichoderma tiene capacidad de producir enzimas como polisacáridos, proteasas y lipasas, involucradas en la degradación de la pared celular de F. oxysporum f.sp. radicis-lycopersici. Al igual John et al. (2010) demostraron la capacidad de T. viride como agente de biocontrol de F. oxysporum f.sp adzuki y Pythium arrhenomanes y promotor de crecimiento vegetal en ensayos in vitro y de campo en plantas de soja. Adicionalmente encontraron una reducción de la severidad de la enfermedad asociada a la destrucción de testa de los patógenos por T. viride y una promoción del crecimiento vegetal en las plantas que fueron tratadas con el microorganismo.
Además, en otro estudio realizado por García et al. (2006), se evaluó el efecto de T. harzianum en diferentes cultivos simultáneamente. Los autores encontraron reducción de la enfermedad en los tratamientos con T. harzianum cepa T12 respecto a los tratamientos testigo en las interacciones: Rhizoctonia solani-papa (29 % en reducción de la enfermedad respecto al testigo), R. solani-café (25 %), Sclerotiun cepivorum-ajo (45 %), Fusarium oxysporum y Fusarium sp.-tomate (30 %), Sclerotium rolfsii-tomate (45 %), Phytopthora sp.-tomate (45 %), Sclerotinia sclerotiorum-fríjol (25 %) y Erwinia carotovora-plátano (48 %).
La menor severidad de la marchitez vascular ocasionada por F. oxysporum f.sp. lycopersici en los tratamientos T1 y T2 comparado con los tratamientos T3 y T4 también está relacionada con las alteraciones físicas y bioquímicas que el silicio induce en las plantas de tomate como activación de mecanismos de defensa.
En trabajos, Huang et al. (2011) hallaron una correlación entre el aumento de la concentración de silicio en la raíz de plantas de tomate a las que se les proporcionó el elemento con la reducción en la severidad de la enfermedad en las raíces, la corona y los tallos. Esta disminución en la severidad se atribuyó al endurecimiento de las paredes celulares, lo que condujo a un retraso en el inicio de la infección fúngica en las raíces. Además de los mecanismos físicos que probablemente proporcionó el silicio a las plantas de los tratamientos T1 y T2, la reducción de la severidad de la marchitez en estos tratamientos, se puede relacionar con las alteraciones bioquímicas que induce el elemento en las plantas. En investigaciones se ha demostrado el papel del silicio en el aumento de la actividad de enzimas como la polifenol oxidasa, peroxidasa y fenilalanina amoniliasa, las cuales participan en la biosíntesis de compuestos fenólicos, fitoalexinas, y otros compuestos con propiedades antifúngicas, activando diferentes mecanismos de defensa en las plantas frente al ataque de patógenos (Rodrigues y Datnoff, 2017; Jukanti, 2017).
Fortunato et al. (2012) también demostraron el efecto del silicio en la reducción en la severidad de la marchitez causada por F. oxysporum f.sp. cubense en plantas de banano, los autores encontraron un aumento en la concentración de compuestos fenólicos, aspecto que está relacionado con el retraso de la colonización del patógeno.
Evaluación del efecto inductor del silicio sobre la enzima Polifenoloxidasa (PPO)
De acuerdo con Beckman (2000) y Jukanti (2017) la PPO juega un papel importante en la síntesis de compuestos fenólicos como lo evidenciado por Fortunato et al. (2012) en la interacción banana-Fusarium oxysporum f.sp. cubense donde el incremento de la actividad de la PPO estuvo directamente relacionado con el aumento en compuestos fenólicos en plantas tratadas con silicio y que presentaron menor severidad de marchitez.
De acuerdo con trabajos realizados anteriormente es probable que el aumento de la actividad de la PPO esté relacionado con la estimulación del metabolismo secundario y consecuentemente con el incremento en los niveles de compuestos fenólicos. Así, se ha determinado que la PPO participa en rutas metabólicas que derivan en el aumento de la concentración de compuestos fenólicos en células parenquimáticas del xilema, en la biosíntesis de lignina y en el fortalecimiento de la pared celular (Beckman, 2000). El papel del silicio y la correlación entre la actividad enzimática y el contenido de compuestos fenólicos permiten crear una hipótesis del incremento de la PPO y la reducción de la severidad en los resultados presentados.
Los estudios que demuestran la capacidad de la PPO para inducir defensa en las plantas en contra del ataque de patógenos son limitados, sin embargo, se han reportado los mecanismos más posibles a través de los cuales las PPO pueden afectar la defensa. Principalmente se relaciona la aparición de los productos de reacción de la PPO que afectan directamente el desarrollo de los patógenos. También se relaciona con el incremento en la producción de quinonas, que poseen propiedades antibióticas y favorecen lignificación en los tejidos y como consecuencia se obstruye el paso de los patógenos. Por otro lado, la resistencia física inducida por la PPO se genera con la acumulación de agregados insolubles de silicio conocidos como fitolitos bajo la cutícula y agregados solubles como el ácido ortosilísico los cuales se entrelazan con la celulosa para proporcionar resistencia y flexibilidad a la pared celular (Taranto et al., 2017; Jukanti, 2017).
Los resultados encontrados en este trabajo concuerdan con otros presentados al relacionar un incremento en la actividad de la PPO cuando las plantas son tratadas con un agente inductor. En este caso el silicio incrementó la actividad en más de 2,0 U mg - 1 de proteína en el tratamiento T2 (silicio - T. viride+ patógeno) que presentó mayor actividad respecto a los demás. Además, se muestra una relación en este tratamiento entre la actividad enzimática y la reducción de la severidad foliar de la enfermedad. Así, se atribuyen las alteraciones provocadas por el silicio en la inducción de la actividad de la PPO como alternativa para el manejo de la marchitez vascular del tomate frente al ataque de F. oxysporum f.sp. lycopersici.
Conclusiones
Las alternativas utilizadas para el manejo de la marchitez vascular en tomate de mesa causada por Fusarium oxysporum f.sp lycopersici como uso de inductores de resistencia (silicio) y microorganismos antagonistas (Trichoderma viride) como agente bioestimulador presentaron resultados positivos en la investigación.
Bajo las condiciones evaluadas el suministro de silicio en etapa de semillero y aplicaciones de Trichoderma viride redujeron la severidad de la marchitez vascular en las plantas de tomate observándose diferencia significativa (p ≤ 0,05) entre los tratamientos T1 (silicio +T. viride+ patógeno) y T2 (silicio - T. viride+ patógeno) frente a los tratamientos T3 (- silicio +T. viride+ patógeno) y T4 (- silicio -T. viride+ patógeno). Estos resultados evidencian el potencial del silicio como inductor de resistencia y de Trichoderma viride como hongo antagónico, ambas como estrategias alternativas para el manejo integrado de la enfermedad marchitez vascular en tomate de mesa causada por Fusarium oxysporum f.sp. lycopersici.
El efecto del silicio como agente inductor de la actividad de la enzima polifenoloxidasa PPO evaluada a los 60 días después de trasplante presentó diferencias estadísticas (p ≤ 0,05) entre el T2 (silicio - T. viride+ patógeno) con los demás. Así, puede considerarse que el suministro de silicio durante la etapa de semillero incrementa la actividad de enzimas de defensa como la PPO y consecuentemente promueve la producción de compuestos fenólicos, eventos relacionados con la disminución de la severidad de la enfermedad.
Recomendaciones
Es importante determinar la efectividad de diferentes fuentes de silicio presentes en el mercado, es decir, evaluar el efecto inductor en ensayos contrastando dosis y fuentes de ácido monosilícico.
Es importante desarrollar ensayos de campo a nivel comercial y semicomercial de la mano de empresas e instituciones interesadas en el desarrollo del cultivo de tomate y así validar los resultados en la presente investigación.
Debido al espacio y tiempo disponible para realizar los ensayos, estos no se pudieron llevar hasta la etapa productiva. Es recomendable realizar ensayos de invernadero y a campo abierto para evaluar el efecto del silicio y de Trichoderma viride para el control de Fusarium oxysporum f.sp. lycopersici en el cultivo de tomate.