Introducción
Restaurar los agroecosistemas severamente dañados es uno de los propósitos de la comunidad científica. Para lograrlo, uno de los indicadores necesitados de atención es el relacionado con la recuperación equilibrada de los componentes bióticos de los suelos, para lo cual, se han creado biofertilizantes que enriquecen la biota del suelo, con organismos benéficos como los hongos micorrísizos (Restrepo et al., 2019); y las bacterias facilitadoras de la fijación nutrientes (Escobar et al., 2019) con el propósito de mejorar la productividad de los cultivos. Estos sin embargo son muy afectados por competencia interespecífica con las arvenses, las que pueden reducir los rendimientos de los cultivos hasta un 30 % (Kandel et al., 2019).
El método más exitoso que se utiliza para combatir las arvenses es el control químico (Kandel et al., 2019). Sin embargo, han provocado cambios estructurales en sus relaciones interespecíficas con dominancia de las de mayor plasticidad ecológica, cuyo manejo se hace ininteligible (Nakabayashi y Leubner, 2021). Por ello, recuperar el equilibrio ecológico de las arvenses, con menores daños a los cultivos, implica elevar la diversidad y disminuir la dominancia, para lo cual se estudian y utilizan nuevos y diversos métodos de manejo agroecológicos (Blanco, 2016).
Como las arvenses, albergan en su rizófora microorganismos diversos, las de mayor riqueza microbiana aportan mayor diversidad y equilibrio al sistema en la relación interespecífica. La profusa presencia de arvenses en convivencia con los cultivos, fuera del período crítico, de competencia cultivo- arvenses (entre los 21 y 45 días posteriores a la germinación de los cultivos de maíz y frijol, fortalecen el proceso de restauración de los suelos, sin daños económicos a los cultivos y mejoraría las propiedades de los suelos (Blanco y Leyva, 2011).
Sin embargo, la cantidad, diversidad y dominancia de microorganismos en las rizófera de las arvenses no son conocidas, dado que no se han encontrado estudios científicos sobre este tema en la literatura nacional e internacional, siendo este el primer paso para descifrar la composición microbiológico presente en las principales especies de arvenses dominantes en los cultivos económicos del trópico, como restauradoras de los suelos severamente dañados entre otros posibles beneficios aun no identificados.
Con base en este análisis, el objetivo de este trabajo fue determinar los microorganismos de mayor relevancia en la rizófora de las principales especies de arvenses colectadas en los cultivos de maíz y frijol sembrados en sucesión durante tres años.
Materiales y métodos
Se estableció un sistema productivo de maíz y frijol sembrados en sucesión en la misma superficie durante tres años (2017-2019), en el Instituto Nacional de Ciencias Agrícolas, San José de las Lajas, Cuba. El maíz fue sembrado en abril de cada año y el frijol en octubre sobre un suelo del tipo Ferralítico Rojo Lixiviado agrogénico eútrico (Hernández et al., 2019) y Tipic Rhodustalf, Soil Taxonomy (Soil Survey Staff, 2010).
Se establecieron dos tratamientos uno consistió en el manejo de las arvenses y el otro sin manejar las arvenses mientras duró el ciclo de cada cultivo. El manejo de las arvenses se realizó haciendo uso del azadón como instrumento de trabajo manual cada siete días.
Los datos climatológicos fueron tomados de la Estación Meteorológica No. 78.374 ubicada a 350 metros del área experimental, ubicada en San José de Las Lajas, km 3% de la carretera a Jamaica, teniendo su centro en los 22°59’40,79” de latitud Norte y 82°8’21,88” de longitud Oeste. La temperatura media mensual de los años que abarcó la investigación osciló entre 17 y 27.4 oC en correspondencia con los meses menos calurosos y menos lluviosos (noviembre-abril) y los más calurosos y lluviosos (mayo-octubre) (Gil et al., 2020). Las precipitaciones variaron desde 3.4 mm en la etapa menos lluviosa a 423.0 mm en la más lluviosa. La humedad relativa se comportó entre un 70 % y un 86 %.
Las muestras de suelo fueron tomadas al concluir la cosecha de cada cultivo: el maíz, cosechado como maíz tierno a los 78 días de la germinación y el frijol en seco, 115 días de la germinación. Las mismas se tomaron de la capa arable del suelo a una profundidad de 20 cm, con un total de 10 muestras por tratamientos en diferentes puntos utilizando el método de bandera inglesa. Se realizó en ambos tratamientos para posteriormente comparar.
Las especies de arvenses se coleccionaron en cada cultivo en el tratamiento sin manejo durante todo el ciclo, seleccionando 15 especies de arvenses de las más comunes en la asociación interespecífica en ambos cultivos en su estado de desarrollo adulto, dentro del m2 utilizado para el muestreo al azar con tres muestras por parcela utilizando el método de bandera inglesa. Se realizó cuando culminó el ciclo de cada cultivo, las que fueron moteadas y llevadas al laboratorio previamente identificadas.
Se cuantificó la diversidad de la microflora del suelo expresada en bacterias, hongos y actinomicetos totales (Escobar et al., 2019) y algunos nematodos saprófitos o microfauna (Smart y Nguyen, 1990). Para cuantificar los microorganismos viables existentes en la muestra, se determinó la distribución de los principales grupos microbianos en las muestras mediante el método de diluciones cuantitativas y siembra en placas (Novo, 2009).
Medios de cultivos utilizados, tiempo de incubación y órdenes de dilución
Grupo microbiano de bacterias: medio de cultivo de agar nutriente con un tiempo de incubación de 24-72 h y un orden de dilución de 104-105(ufc/mL).
Grupo microbiano de hongos: medio de cultivo de agar saboreaud con un tiempo de incubación de 72 h (7 días) y un orden de dilución de 103-104 (ufc/mL).
Grupo microbiano de actinomiceos: medio de cultivo de agar almidón amoniacal con un tiempo de incubación de 7 (14 días) y un orden de dilución de 102-103 (ufc/mL).
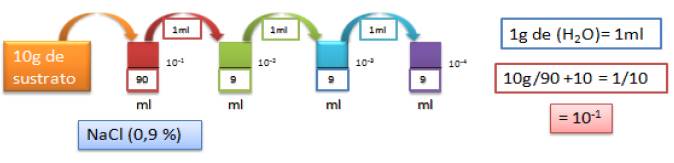
La técnica se fundamenta en realizar diluciones en serie base 10, tomando 10 g de las muestras de suelo rizosférico para suspenderlos en 90 ml de agua destilada estéril, según lo recomendado por Novo (2009) (Figura 1).
Identificación de las bacterias: se realizó según la metodología empleada por Llenque (2011).
En todos los experimentos el diseño experimental fue de bloques al azar con cuatro réplicas por cada tratamiento. Los datos obtenidos fueron procesados mediante el análisis de varianza de clasificación doble y en los casos necesarios se aplicó la prueba de rangos múltiples de Duncan al 5 % de probabilidad.
Resultados
Análisis de la composición de las arvenses presentes durante el crecimiento y desarrollo de los cultivos del maíz y del frijol sembrados en sucesión.
El registro de las arvenses realizado posterior al período crítico en el cultivo de maíz (Tabla 1) mostró la existencia de 15 especies de arvenses de las cuales S. halepense, R. exaltata y C. rotundus, resultaron ser las de mayor dominancia), aunque R. exaltata presentó una dominancia media. El resto, fueron especies subordinadas, con escasa presencia en la superficie experimental.
Tabla 1 Familias, especies e individuos registrados en relación interespecífica con el cultivo del maíz y frijol

Especies de arvenses señaladas en negritas, indican las de mayor dominancia en el cultivo.
En el cultivo del frijol se registraron 11 familias y 16 especies (Tabla 1). Aunque hubo una mayor abundancia de arvenses dicotiledóneas, dominaron las monocotiledóneas C. rotundus y S. halepense; aquí, sin embargo, ambas fueron acompañadas en la dominancia por Commelina diffusa Burm. f. y Lepidium virginicum L., las cuales no aparecieron en el cultivo del maíz, cuya presencia parece estar ligada al cultivo del frijol y por tanto ser especies específicas acompañantes del cultivo.
El análisis general de la presencia de arvenses en mayor o menor cantidad por cultivos es un tema enigmático aún. Durante el crecimiento y desarrollo del cultivo del maíz C. rotundus, R. exaltata y S. halepense., representaron solo el 20 % del total de las arvenses registradas.
Las familias restantes estuvieron representadas con ocho especies, entre las cuales aparecieron Ch. hyssopifolia y E. heterophylla de la familia Euphorbiaceae. Algunas de ellas (E. heterophylla, P. hysterophorus, P. oleracea, K. máxima y A. dubius) no llegaron a cumplir un rol significativo en el sistema, tanto por su escasa cobertura dentro del espacio agrícola del cultivo como por su paulatina desaparición durante el crecimiento y desarrollo del cultivo; de manera que las monocotiledóneas resultaron ser las especies dominantes y con mayor influencia en la relación interespecífica.
Para el cultivo del frijol en el grupo taxonómico de las arvenses dicotiledóneas algunas mostraron una elevada cobertura. En ese grupo sobresalieron las especies L. virginicum, M. quinqueflora, Boerhavia sp., A. dubius y P. hysterophorus. Las especies que no sobrevivieron al concluir el ciclo del cultivo, como E. colonum, B. extensa, L. rugosa, P. oleraceae y P. hysterophorus, pudieran estar relacionadas con la propia relación intraespecífica de las especies.
Principales microorganismos encontrados en la rizósfera de algunas de las arvenses presentes en el sistema sucesional.
La diversidad microbiana asociada a la rizósfera de las arvenses, supone ser una problemática en extremo novedosa e interesante para los trabajos relacionados con la aplicación de principios agroecológicos, dirigidos al manejo y conservación en los agroecosistemas, dada la elevada diversidad de microorganismos presentes en el suelo y la complejidad de sus interacciones.
La evaluación de la diversidad microbiana presente en la rizósfera de algunas especies de las arvenses en el sistema sucesional maíz-frijol se ofrecen en la Tabla 2. De las especies evaluadas, cinco mostraron ser las más integrales al albergar la diversidad edáfica (bacterias, hongos y actinomicetos). Ellas fueron: E. indica; L. virginicum; P. hysterophorus; M. quinqueflora y S. halepense; mientras que el resto se mostró más selectivas como: A. mexicana; C. echinatus; C. plectostachium; Boerhavia sp. y B. pilosa, solo albergaron bacterias. Las causas de tal selectividad no parece que haya sido estudiada y pudiera ser de origen genético.
Las arvenses que albergaron mayor abundancia de bacterias fueron C. plectostachium y C. difusa, con 1,41 x 106 y 8 x 106 UFC g-1 respectivamente; mientras que las de mayor diversidad fueron P. oleracea, con ocho morfotipos; C. plectostachium y C. diffusa con siete morfotipos de bacterias cada una. Para concluir en el caso de los hongos, ocho especies registraron su presencia, dentro de las cuales E. indica mostró la mayor abundancia y A. dubius la menor.
Los actinomicetos, a pesar de no ser típicamente microorganismos rizosféricos, fueron abundantes en las especies L. virginicum, P. hysterophorus y E. indica, encontrándose en el mismo orden que las bacterias.
Se puso en evidencia (Tabla 3) las diferencias entre las especies para albergar microorganismos. Así la arvense C. diffusa presentó mayores poblaciones de bacterias y hongos totales que L. virginicum.
De las 15 especies procesadas, se aislaron 54 morfotipos bacterianos, 12 de hongos, dentro de ellos, cuatro levaduras y un morfotipo de actinomiceto idéntico en todas las muestras.
Importante destacar las diferencias entre especies para albergar microorganismos. Así la arvense C. diffusa presentó mayores poblaciones de bacterias y hongos totales que L. virginicum. La inexistencia de investigaciones precedentes en este tema, permite deducir que, las especies de arvenses pueden servir para la reproducción microbiana de determinada especie o para identificar su presencia en los agroecosistemas ya sean a favor o en contra de los procesos productivos o como fuente de reserva para investigaciones de otra naturaleza.
El haber abordado este tema como complemento científico al conocimiento de las arvenses y su accionar en el agroecosistema, sienta las bases no solo para las investigaciones agrarias, sino también para el campo de la biotecnología, la sanidad vegetal y la farmacología dentro de las ciencias médicas y agronómicas; por ello, será necesario continuar profundizando en los beneficios del conocimiento de las arvenses y sus relaciones de interespecíficas con la microbiología edáfica dentro de la visión integradora en los agroecosistemas.
Efecto de la sucesión de los cultivos maíz-frijol sobre los microorganismos del suelo.
En el análisis del suelo se pudo apreciar que existieron diferentes microorganismos que habitan en la microflora. Los hongos y bacterias totales, que se encontraron en el tratamiento con arvenses todo el ciclo del cultivo, presentaron el mayor número de colonias de bacterias, hongos y actinomicetos totales, con 8 x 107, 3 x 105 y 3 x 1 06 UFC g-1, respectivamente.
Este comportamiento no fue similar cuando fueron manejadas las arvenses encontrándose menores cuantías en estos microorganismos (3 x 107, 1 x 105 y 1 x 106 UFC g-1).
En el caso específico de las bacterias no existieron muchas unidades formadoras de colonias, ya que la variabilidad fue escasa. Los hongos mostraron más variabilidad, debido a que poseen una mayor plasticidad en su adaptación a los cambios que se produjeron en el agroecosistema que influye en la densidad de los hongos y de las bacterias.
Para el tratamiento que se mantuvo libre de arvenses todo el ciclo del cultivo la presencia de la microflora fue insignificante, debido quizás a que bajo las condiciones de suelo sin cobertura se produce un aumento de la temperatura y una disminución de la humedad edáfica por estar expuesta su superficie a la acción directa de los rayos solares y a la erosión eólica.
Discusión
A raíz del análisis de la composición de las arvenses presentes durante el crecimiento y desarrollo de los cultivos del maíz y del frijol sembrado en sucesión, las que resultaron de mayor dominancia son de gran plasticidad ecológica. La dominancia de C. rotundus se debe a su característica de especie perenne agresiva e invasora de difícil control (Boutin et al., 2014).
Dentro de las arvenses dicotiledóneas estudiadas algunas mostraron una elevada cobertura llegando a alcanzar un grado cinco, es decir un nivel muy fuerte de “enmalezamiento”, lo que ha sido corroborado por Cerna (2013). Sin embargo, este es un tema sobre el cual no se tienen aún resultados conclusivos desde la visión agronómica, tal vez debido a la complejidad de factores que intervienen en el proceso, incluyendo los efectos alelopáticos o exudados radicales de algunas especies inhibitorias o estimuladoras ante la presencia de otras, como ocurre con S. halepense, D. sanguinalis, R. exaltata, P. oleracera, E. crus-galli y C. rotundus (Blanco y Leyva, 2011).
La competencia arvenses-cultivos causan importantes pérdidas de rendimiento en ecosistemas agrícolas, que pueden variar dependiendo de la especie analizada y de las condiciones ambientales prevalecientes (Pratibha et al., 2021). La alta capacidad competitiva de las arvenses se explica parcialmente por las características biológicas de estas plantas, las cuales presentan adaptaciones morfológicas y fisiológicas en sus sistemas radicales, permitiendo una mayor absorción de agua y nutrientes (Conceição, 2019).
Las asociaciones entre las arvenses y los microorganismos del suelo pueden promover aumentos tanto en crecimiento como en la resistencia a patógenos (Menalled et al., 2021). Aunque varios estudios han demostrado el efecto perjudicial de la competencia entre las arvenses y los cultivos, pocos estudios se han realizado con relación a los aspectos microbiológicos.
El manejo agronómico realizado en los cultivos ha venido afectando el componente microbiano en cuanto a variedad y densidad poblacional; manifestándose en la progresiva pérdida de fertilidad y empobrecimiento de los suelos (Aguirre et al., 2018). Estas consecuencias se deben a la constante interrupción de los ciclos biogeoquímicos realizados por la biota edáfica. Por lo que los microorganismos del suelo pueden ser indicadores potenciales para evaluar el impacto y la restauración de los ecosistemas, pues reflejan mejor las alteraciones en los suelos que las especies taxonómicas mayores (García et al., 2018).
Mayormente la comunidad edáfica, está conformada por microorganismos y provee al suelo equilibrio y mayor productividad, que es aportado por una serie de procesos realizados por el componente microbiano, en conjunto con las raíces de las plantas y la microfauna. Algunas de las funciones de la comunidad edáfica que les confieren estabilidad a los suelos son la porosidad, aireación, movimiento de la tierra, solubilización de sustratos y degradación de la materia orgánica (de la Peña, 2009).
Las plantas son capaces de promover cambios en la comunidad microbiana del suelo a través de la exudación de diferentes combinaciones de compuestos orgánicos de las raíces en función de las condiciones ambientales (Bainard et al., 2013). Las plantas cultivadas en condiciones óptimas o con baja disponibilidad de P o N tienden a presentar diferencias significativas en la composición de los exudados radiculares (Karanja et al., 2020), que a su vez provocan cambios en la población y densidad de grupos microbianos en el suelo (Johnson et al., 2005).
Los actinomicetos, al igual que los demás microorganismos, son indicadores de la fertilidad del suelo. Por otra parte, el grupo de los actinomicetos, a pesar de no ser típicamente microorganismos rizosféricos (Morocho y Leiva, 2019), fue abundante en algunas de las especies estudiadas.
Estos fueron encontrados en seis especies de arvenses, lo cual constituye un hecho de gran importancia para los procesos de descomposición de la materia orgánica, por su capacidad de funcionar degradando azúcares simples, proteínas, ácidos orgánicos y substratos muy complejos, hasta la obtención del humus en el suelo, siendo los más eficientes para la producción de sustancias húmicas (Yang et al., 2017).
Los exudados de las plantas pueden influir de forma determinante en la dinámica de las poblaciones de la rizósfera (Horwath, 2017). Las especies de plantas presentan diferencias fisiológicas y composiciones bioquímicas distintas y generan exudados radiculares diferenciales (Grayer et al., 2004).
Debe destacarse la importancia que tienen muchos de estos microorganismos encontrados en diferentes procesos (Tabla 3), como es el caso del ciclo del N; pues según Escobar et al. (2019), Pseudomonas y Micrococcus son bacterias aerobias que actúan en la alcalinización que provoca la urea al aplicarse al suelo.
Algunos de los microorganismos encontrados en la investigación como Bacillus, Pseudomonas y Lactobacillus son de las que más participan en los suelos agrícolas transformando los compuestos orgánicos a inorgánicos y a su vez favorecen la nutrición de las plantas, también el caso del hongo Aspergillus que junto con géneros bacterias como Bacillus tienen capacidad solubilizadora de nutrientes como el potasio y bioindicadores de suelos y abonos orgánicos (Escobar et al., 2019).
Estas condiciones edáficas no garantizan la abundancia y desarrollo funcional de estos organismos (Menalled et al., 2021). Este resultado está en correspondencia con la visión agroecológica que insta a la conservación de la cubierta vegetal en los cultivos. Mejor con arvenses que limpio sin ellas (Osorio-Espinoza et al., 2017) y sugiere a los actores incorporar el concepto de manejar las arvenses en los cultivos solo en el período crítico de competencia (Latif et al., 2021).
El aumento de asentamientos antrópicos transforma o destruyen el hábitat natural de miles de especies, generando una pérdida considerable de la biodiversidad (Ouverson et al., 2021), lo cual afecta la comunidad edáfica también. Actualmente, factores de la biota edáfica, son usados como criterios del manejo de los suelos, permitiendo llevar la producción agrícola hacia nuevas técnicas de manejo sostenible que permitan la recuperación de los mismos (Karanja et al., 2020).
Conclusiones
Las arvenses monocotiledóneas dominaron en el sistema sucesional maíz-frijol, con mayor presencia de especies dicotiledóneas en el cultivo de frijol.
La presencia de arvenses en los cultivos Z. mays y P. vulgaris, garantiza la presencia de una flora microbiana edáfica diversa con mayor riqueza en las especies E. indica; L. virginicum; P. hysterophorus; M. quinqueflora y S. halepense.
Las especies de arvenses que albergaron mayor presencia de bacterias fueron C. Plectostachium y C. diffusa mientras E. indica fue la principal para los hongos. El grupo de los actinomicetos, correspondieron a las especies L. virginicum, P. hysterophorus y E. indica.