Introducción
El cadmio (Cd) se considera un metal pesado no esencial para la vida (Raven, 2018) que a bajas concentraciones puede ser más tóxico que otros metales pesados no esenciales (Shakoor et al., 2017). El cadmio puede ser absorbido fácilmente por las raíces de las plantas y transportado a los brotes, lo que provoca síntomas tóxicos visibles que generan el retraso de crecimiento, clorosis de las hojas, marchitez y muerte celular (Daud et al., 2009; Song et al., 2017), así también, representa un peligro para la salud humana porque está presente en la cadena alimenticia (Vinothkumar y Senthilvalavan, 2018).
Este elemento es introducido al suelo de forma natural ya sea por emisiones volcánicas, erosión de suelos o por acciones antropogénicas como los residuos de minería, actividades agrícolas e industriales (Rehman et al., 2016).
El uso de plantas para remover contaminantes del suelo es la técnica de la fitorremediación la cual tiene un gran potencial para remediar suelos contaminados in situ con metales pesados debido a su baja rentabilidad y respeto con el medio ambiente (Gurajala et al., 2019; He et al., 2019). Dentro de esta tecnología se describe a la fitoestabilización, la cual se basa en la capacidad de acumular los contaminantes en el tejido radicular y absorber los mismos sobre la superficie radicular (Mang y Ntushelo, 2018). Las ventajas de esta técnica es que alivia la erosión del suelo y la escorrentía superficial (Montiel-Rozas et al., 2015) y minimiza la disponibilidad y la migración de metales pesados hacia aguas subterráneas (Barajas- Aceves et al., 2015).
Dentro del grupo de plantas que se utilizan en esta tecnología, el girasol (Helianthus annuus) es una buena alternativa porque presenta un rápido crecimiento, es fácil de cosechar, produce alta biomasa y transporta y acumula elevadas concentraciones de Cd en sus órganos (Motesharezadeh et al., 2016; Shakoor et al., 2017).
La información obtenida en este estudio permitirá plantear estrategias para reducir la disponibilidad de Cd en suelos contaminados, mejorar la supervivencia de especies vegetales y reducir el contenido de este metal en el producto de cosecha. En tal contexto, la presente investigación tiene como objetivo determinar la respuesta del girasol en suelos contaminados con Cd, evaluando su crecimiento, su capacidad de acumulación de dicho metal a diferentes concentraciones y la distribución del mismo durante el ciclo fenológico del cultivo.
Materiales y métodos
El trabajo de investigación se realizó en el patio de ensayo del Laboratorio e Invernadero de Fertilidad del Suelo (LIFS) “Sven Villagarcía Hermoza” de la Universidad Nacional Agraria La Molina (UNALM) cuyas coordenadas son 12°05’16”S y 76°56’10”W a 244 m s.n.m.
El experimento fue desarrollado entre los meses de agosto y diciembre del 2018, cuya temperatura promedio fue de 21 °C.
El suelo se recolectó de los primeros 15 cm de profundidad de una parcela experimental de la UNALM, cuyas características fisicoquímicas se muestran en la Tabla 1.
Tabla 1 Características fisicoquímicas del suelo en estudio
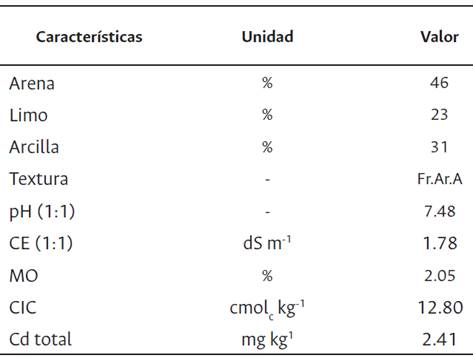
pH: valor del pH del suelo medido en proporción 1:1 de suelo y agua; CE: conductividad eléctrica medido en proporción 1:1 de suelo y agua; MO: materia orgánica; CIC: capacidad de intercambio catiónico; Fr.Ar.A: franco arcillo arenoso.
Las mediciones de pH y C.E del suelo en estudio fueron 7.48 y 1.78 ds m-1 respectivamente, se realizaron en una mezcla de suelo y agua en relación 1:1 y su clase textural fue franco arcilloso arenoso con 2.05 % de M.O. Además, el suelo presentó considerables cantidades de Cd total, siendo la concentración 2.41 mg kg-1, el cual fue determinado por espectrofotometría de absorción atómica.
El estudio consistió en dos experimentos. El primero donde se probaron cinco dosis de aplicación de Cd: 0, 10, 15, 20 y 25 mg kg-1 suelo con cuatro repeticiones. La cosecha se realizó 83 días después de la siembra (dds) y se empleó un diseño completamente al azar (DCA). El segundo donde se aplicó una dosis de 20 mg Cd kg-1 suelo y se evaluó la concentración de Cd en los órganos del girasol y planta entera a los 35, 49, 63, 75 y 84 dds, épocas que coincidieron con la cosecha de plantas.
Para ambos experimentos se emplearon macetas de plástico que contenían 4 kg de suelo. La fuente de Cd empleada fue nitrato de cadmio pentahidratado [Cd(NO3)-5H2O] al 99.0 % de pureza. A cada maceta se agregó 250 ml de solución de Cd(NO3)2-5H2O para lograr las dosis de Cd correspondiente. Posteriormente se regaron las macetas hasta capacidad de campo y se cubrieron con plástico. Luego de 15 días de equilibración, se sembraron 5 semillas por maceta, y después de la emergencia, se redujeron a 3 plantas. Estas últimas se fertilizaron con N (urea) a una dosis de 100 mg kg-1 suelo.
Durante las épocas de cosecha del girasol, estas se separaron por órganos (raíz, tallo, hoja e inflorescencia) y se llevaron a secar a estufa por 48 h a 70 °C para obtener su peso seco. Las muestras de materia seca fueron molidas y se procedió con la digestión húmeda, para lo cual se tomó una muestra de 2.5 g de materia seca y se agregaron 12 ml de solución nitro-perclórica en relación 1:5. Finalmente, se determinaron las concentraciones de Cd con el uso de un espectrofotómetro de absorción atómica.
Acumulación y translocación del metal en planta
Factor de Bioconcentración (FBC)
Este factor indica la eficiencia con la que una planta acumula un metal en sus tejidos desde el entorno (Ladislas et al., 2012). Esto se calculó siguiendo la relación indicada por Amin et al. (2018).
Donde C aéreo o raíz es la concentración de Cd aéreo (Tallo + hoja + inflorescencia) y Csuelo es la concentración del mismo metal en el suelo, ambos expresados en mg kg -1 .
Factor de translocación (FT).
Este factor indica la eficiencia con que la planta transloca un metal que se acumula en raíz hacia la zona aérea. Esto se calculó de acuerdo con Amin et al. (2018):
Donde C aéreo es la concentración de Cd en tallos, hojas e inflorescencia y [C raíz ] es la concentración del mismo metal en la raíz, ambas en mg kg -1 MS.
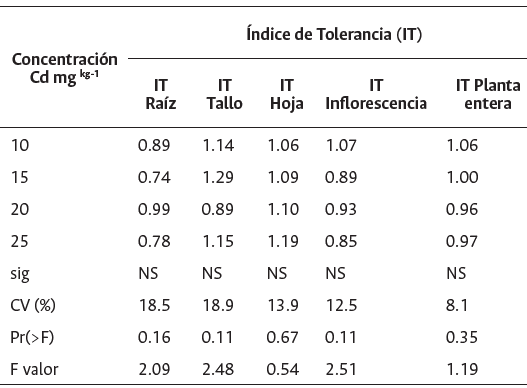
Índice de tolerancia (IT). Este índice se calculó de acuerdo con Pirselová et al. (2016):
Donde PS es el peso seco del órgano a evaluar.
Los análisis estadísticos se realizaron con el software SISVAR, ejecutando un análisis de varianza (ANOVA), prueba de medias mediante la prueba de Tukey (P < 0.05) y análisis de regresión (F < 0.05).
Resultados y discusión
Primer experimento.
Según la Tabla 2, no se observó una reducción significativa de altura de planta ni de biomasa hasta 25 mg Cd kg-1 suelo, aunque sí una ligera disminución conforme se incrementaron las dosis. Esto significaría que Helianthus annuus podría tolerar este metal hasta 25 mg kg-1 suelo como también se observó en Solanum nigrum bajo la misma dosis (Wei et al. 2006). En otros estudios, Alaboudi et al. (2018) y Ashraf et al. (2019) mostraron diferencias significativas en la reducción de altura y materia seca a partir de concentraciones de 10 y 20 mg Cd kg- 1, respectivamente. Esto podría deberse a que en estas investigaciones hubo mayor absorción de Cd en los tratamientos con respecto a su control con las variedades de girasol en estudio, así también el momento de cosecha se realizó 30 días (promedio) antes que nuestro estudio. Por otro lado, a 10 mg Cd kg-1 hubo un ligero incremento en la biomasa de la planta entera con respecto al control. Bajo la misma dosis, este incremento fue confirmado por Ramírez et al. (2018) y Jadia y Fulekar (2008) en sus estudios con Solanum nigrum y Helianthus annuus, respectivamente.
Tabla 2 Altura de planta, materia seca de planta entera y por órganos de girasol en suelos contaminados con diferentes concentraciones de Cd (mg kg-1 suelo)
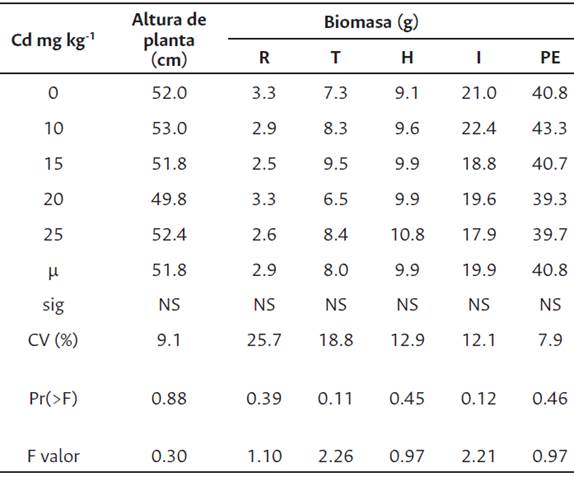
Valores son promedio (n = 4); NS: no hay diferencias significativas según Tukey (P > 0.05); coeficiente de variabilidad (CV); raíz (R); tallo (T); hoja (H); inflorescencia (I); planta entera (PE).
La Figura 1 muestra que las dosis de Cd en suelo y la concentración de Cd en biomasa de raíz, tallo, hoja e inflorescencia se ajustaron a una curva de regresión cuadrática (F < 0.05) con un R2 > 0.97 para todos los casos. Este resultado coincide con el estudio de Chaves et al. (2011), quienes reportaron una curva regresión cuadrática con un R2 > 0.93 para dosis similares. Conforme aumenta el Cd en suelo, se incrementa la concentración de Cd en el tejido (Zou et al., 2008; De Maria et al., 2013; Alaboudi et al., 2018; Ashraf et al., 2019; Chaves et al., 2011), siendo esta máxima en las raíces (33.1 mg kg-1) a dosis de 20 mg Cd kg-1 suelo.
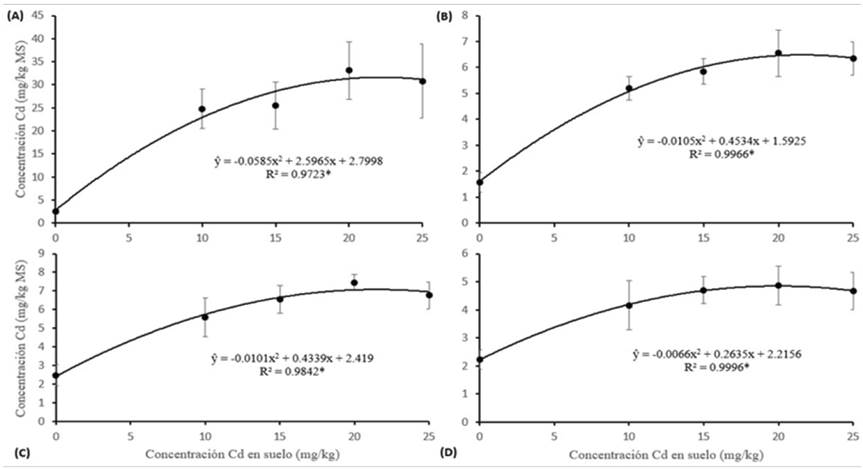
Figura 1 Análisis de regresión para concentraciones de Cd en materia seca de girasol y concentración de Cd en raíz (A); tallo (B), hoja (C) e inflorescencia (D); materia seca (MS). *Existen diferencias significativas según la prueba de Tukey (P < 0.05); valores son promedio (n = 4); ± desviación estándar.
El incremento de Cd en raíz, tallo, hoja e inflorescencia a dosis de 20 mg kg-1 superó al control en 12.02, 3.16, 2.01 y 1.19 veces más, pasando de 2.55 a 33.13, 1.58 a 6.55, 2.48 a 7.46 y de 2.22 a 4.87 mg Cd kg-1 MS, respectivamente. Por el contrario, a dosis de 25 mg kg-1 la curva comenzó a decaer en general. En otros estudios se expone similar secuencia de absorción: raíz > hoja > tallo, en la misma especie (Ashraf et al., 2019; De Maria et al., 2013; Chaves et al., 2011). Cabe destacar que la concentración promedio de Cd en raíz fue 62.6 % del total, mientras que en la zona aérea fue de 37.4 %. Porcentajes muy similares en raíz y zona aérea han sido documentados (Sewalem et al., 2014; Lopes et al., 2014). No se encontró en ningún órgano concentraciones mayores a 100 mg kg-1 (umbral), de modo que el girasol no podría ser clasificada como una planta hiperacumuladora bajo este criterio (Baker et al., 2000). Sin embargo, se ha encontrado que la rotación de cultivos anuales como girasol para aceite, colza y maní, pueden extraer más Cd del que ingresa al sistema en un suelo agrícola (Yang et al., 2021).
El factor de bioconcentración (FBC) y el factor de translocación (FT) son valores claves necesarios para estimar el potencial de una planta como fitoextractora o fitoestabilizadora (AL-Jobori y Kadhim, 2019). Según Sidhu et al. (2017), las especies de plantas con FBC > 1 y FT < 1 tienen el potencial de acumular altas concentraciones del metal en sus raíces y pueden ser utilizadas para fines de fitoestabilización. En promedio, el FBC y FT de los tratamientos (sin incluir al control) resultaron 1.69 y 0.62, respectivamente (Figuras 2 y 3). Estas cifras indicarían que Helianthus annuus se comporta como una especie fitoestabilizadora a concentraciones entre 10 y 25 mg kg-1.
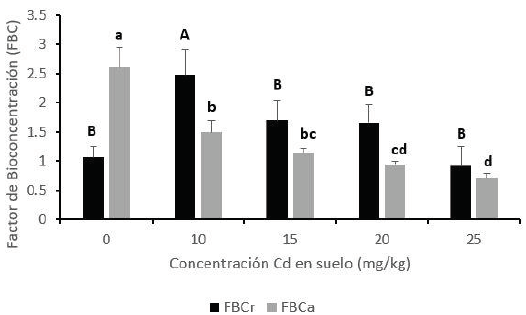
Figura 2 Relación entre el factor de bioconcentración (FBC) en raíz (FBCr) y zona aérea (FBCa) de girasol vs. las concentraciones de Cd en suelo. Valores son promedio (n = 4); ± desviación estándar. Letras diferentes en un mismo color de barra indican diferencias significativas mediante la prueba de Tukey (P < 0.05).
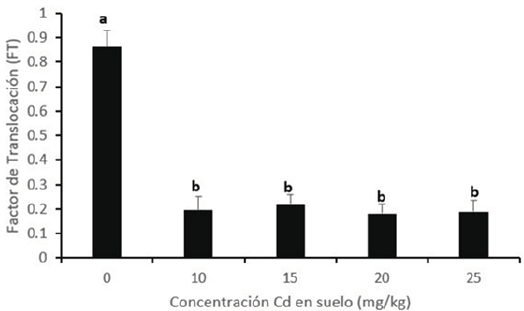
Figura 3. Relación entre el factor de traslocación (FT) y concentraciones de Cd en suelo. Valores son promedio (n = 4); ± desviación estándar. Letras diferentes indican diferencias significativas mediante la prueba de Tukey (P < 0.05)
La fitoestabilización no es una tecnología para extraer metales pesados del suelo, sino una forma de estabilizarlos para prevenir mayor difusión y transferencia a la cadena alimentaria (Nascimento et al., 2021). Algunas plantas pueden, a través de exudados radiculares, modificar la solubilidad y/o movilidad de los metales pesados (Nedjim, 2021).
Por otro lado, se muestra que el FBC de raíz (FBCr) y zona aérea (FBCa) decrecen a favor del incremento de Cd en suelo. Aproximadamente la relación entre el FBCr y FBCa es 0.67 veces más en todos los tratamientos. La transferencia de este metal desde el suelo hacia la raíz resultó en un FBC mayor a 1 por debajo de 25 mg kg-1 (Alaboudi et al., 2018).
El control presenta un FT cercano a 1, lo que podría significar que ante una baja o nula concentración de Cd (2.41 mg kg-1), se favorece la translocación hacia la zona aérea (Figura 3). Con la finalidad de incrementar la eficiencia de la fitorremediación se utilizan alternativas como agentes quelatantes, aplicación de biochar o asociación con micorrizas (Amna et al., 2015; Yadav et al., 2018). Conforme a la Figura 4, la concentración de Cd en suelo y la extracción de Cd por el girasol se ajustaron a una curva de regresión cuadrática (F < 0.05). En general, el incremento de Cd en suelo aumentó la extracción de este metal en planta hasta 20 mg kg-1 y decayó en el último tramo. La extracción de Cd en planta entera fue de 89.90 ug maceta-1 en el control y se incrementó a 319.77 ug maceta-1 a una dosis de 20 mg Cd kg-1, siendo la distribución en la extracción de Cd de 211.8 y 107.97 ug, en zona aérea y raíz, respectivamente. En promedio, la extracción de este metal en raíz para todos los tratamientos (sin incluir el control) fue de 28.6 % del total de extracción. Sin embargo, esto difiere con el estudio de Rivelli et al. (2014), pues los autores encontraron que la raíz extrajo en promedio cerca del 70 % de Cd. Esta diferencia se explicaría debido a que la variedad sembrada por los autores obtuvo una mayor producción de materia seca en raíz.
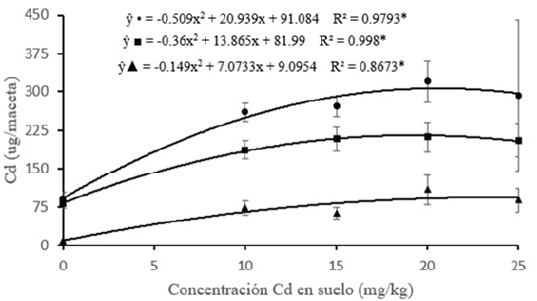
Figura 4. Análisis de regresión para la extracción total de cadmio en plantas de girasol por maceta (•), zona aérea (▲) y raíz (■) a diferentes concentraciones de Cd en suelo. Valores son promedio (n = 4); ± desviación estándar. *Existen diferencias significativas según la prueba de Tukey (P < 0.05).
La tolerancia de las plantas al estrés por metales pesados se estima en función de su inhibición del crecimiento de raíces y/o brotes por el metal presente en un medio (Malar et al., 2014). Sugieren Audet y Charest (2007) que si el valor del índice de tolerancia (IT) es menor a 1, la planta reduce su biomasa por el estrés del metal contaminante. Contrariamente, si el IT es mayor a 1 se incrementa la biomasa (hiperacumulador) debido a que desarrolla tolerancia. Finalmente, si el IT es igual a 1, la planta no es influenciada por el metal contaminante, lo que indica que no hay diferencias con el tratamiento control. Los resultados de la Tabla 3 muestran que no hay diferencias significativas entre el IT del control y los demás tratamientos. El IT de la planta entera fue 1 en promedio, valor que indicaría que el girasol no es afectado por las dosis aplicadas. Por otro lado, se observó una tendencia en la reducción del IT en raíz e inflorescencia en todas las dosis, lo que podría significar una mayor sensibilidad de estos órganos en la producción de materia seca. Según De Maria et al. (2013) sugieren que el girasol tiene un mecanismo de baja translocación de Cd desde las raíces hacia la parte aérea, evitando la toxicidad en los tejidos apicales fisiológicamente más activos, lo cual explica las bajas concentraciones de Cd en inflorescencias respecto a los demás órganos. Los cultivares de girasol que son capaces de mantener mayor concentración de Cd en raíces o incluso en tallos, respecto a hojas e inflorescencias, tienen mayor capacidad de evitar toxicidad debido a que no se afecta el metabolismo de carbohidratos (Cornu et al., 2020).
Segundo experimento.
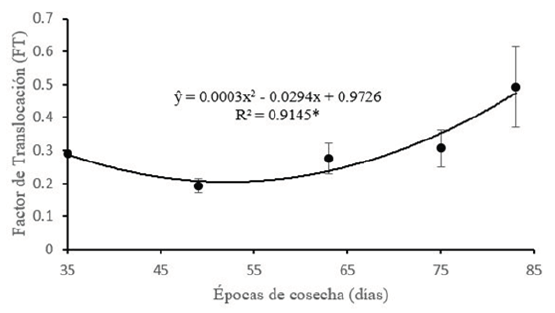
En general, la raíz presentó la máxima concentración de Cd en todas las épocas de cosecha y no se encontraron diferencias significativas entre el tallo, la hoja e inflorescencia, pero sí una marcada diferencia al compararlas con la raíz (p < 0.05) (Tabla 4). La Figura 5 muestra las curvas de regresión para la época de cosecha y la concentración de Cd en materia seca de los diferentes órganos. Según los análisis de regresión, estos dieron significativo (F < 0.05) y se ajustaron a una curva cuadrática, lineal y cúbica para los órganos de raíz e inflorescencia, tallo y hoja, consecutivamente, con coeficientes de determinación superiores a un r2 > 0.67. Estos resultados difieren a lo encontrado por De Maria et al. (2013), pues en su estudio la concentración de Cd disminuyó en todos los órganos evaluados. El análisis de regresión para el FT bajo diferentes épocas de cosecha dio significativo (F < 0.05) (Figura 6) y se ajustó a una curva de regresión cuadrática (R2 = 0.91). Como resultado de una alta concentración de Cd en las raíces el valor del FT fue menor a 1. El descenso del FT en el primer tramo de la curva (35-49 dds) se explicaría por la acumulación del Cd en la raíz. Así, el ascenso observado del siguiente tramo (49-84 dds) se explicaría por la translocación del Cd en la raíz hacia la zona aérea. De Maria et al. (2013) reportó que el FT se ajustó a una curva cuadrática (R2 = 0.91) a concentraciones por debajo de 20 mg Cd kg-1. En su estudio, la curva del FT descendió hasta el día 49 y en adelante hubo una tendencia a incrementar, lo cual coincide con el comportamiento de nuestra curva. Posiblemente hasta el día 49 la planta acumula este metal en la raíz limitando su translocación a los brotes y en una etapa más avanzada de crecimiento se incrementa la migración de Cd.
Tabla 4 Concentración de Cd en órganos individuales (raíz, hoja, tallo e inflorescencia) de Helianthus annuus en diferentes épocas de cosecha
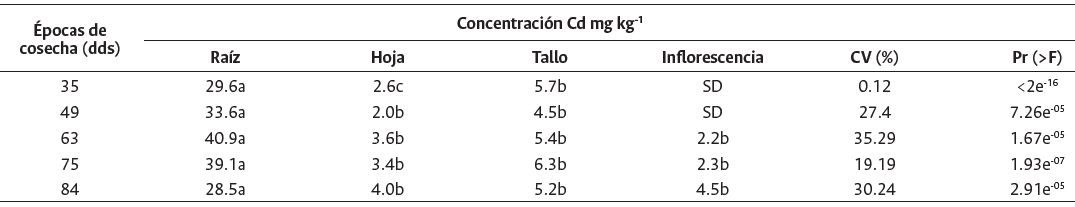
Valores son promedio (n = 3). Letras diferentes indican diferencias significativas (P 0.05) bajo una misma época de cosecha. Coeficiente de variabilidad (CV), SD = sin datos.
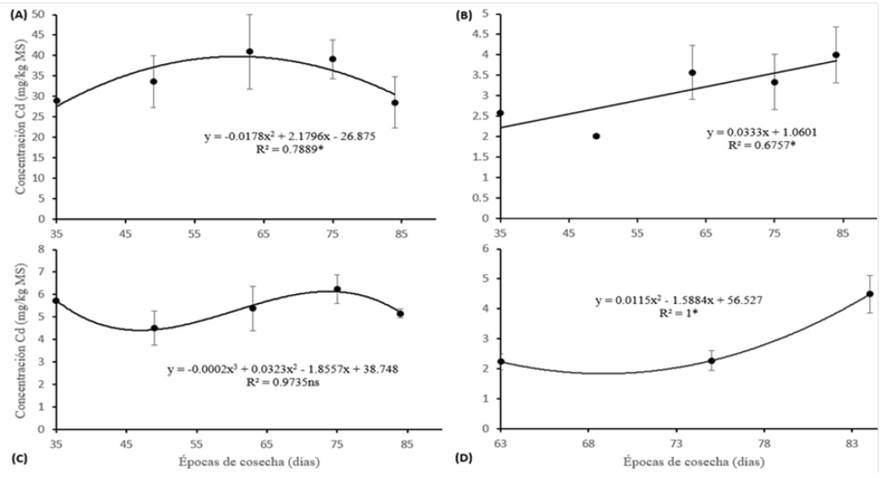
Figura 5. Análisis de regresión para la concentración de Cd en órganos de raíz (A); tallo (B), hoja (C) e inflorescencia (D) en girasol y las épocas de cosecha bajo una misma concentración de Cd (20 mg kg-1). (ns) no significativo. *Existen diferencias significativas según la prueba de Tukey (P < 0.05). Materia seca (MS). Valores son promedio (n = 3) ± desviación estándar.
Conclusión
Se concluye que el girasol acumula cantidades crecientes de Cd en los órganos al aumentar la contaminación de Cd en el suelo, sin mostrar efectos negativos en la producción de biomasa (IT = 1) y altura de planta, hasta niveles de 25 mg Cd kg-1 suelo. La raíz concentró un 62.6 % del total de planta y de acuerdo con los índices FBC > 1 y FT < 1, Helianthus annuus se clasificaría como una especie fitoestabilizadora hasta concentraciones de 25 mg Cd kg-1 suelo.
En todas las épocas de cosecha, la raíz del girasol superó en concentración a los demás órganos (FT < 1). Asimismo, el FT incrementó de forma continua hasta la última cosecha, lo cual sugiere que conforme pasa el tiempo, el Cd se moviliza hacia la zona aérea. Los resultados obtenidos son interesantes para considerar al girasol en programas de fitorremediación. Sin embargo, se deben realizar investigaciones en curvas de extracción de Cd en suelos contaminados in situ para determinar el momento óptimo de cosecha.