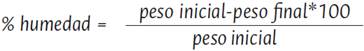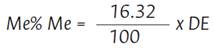Introducción
Las materias primas de origen natural son cruciales para diversas aplicaciones en la industria. Una de dichas sustancias es la pectina, constituida principalmente por ácido galacturónico y que gracias a sus propiedades gelificantes y de absorción se emplean en las industrias de alimentos, cosméticos y farmacéuticos (Chasquibol-Silva, Arroyo-Benites y Morales-Gomero, 2008).
Se han identificado y caracterizado varios polisacáridos distintos dentro del grupo de las pectinas. Los homogalacturonanos son cadenas lineales de ácido D-galacturónico enlazado a-(1-4). Los galacturonanos sustituidos se caracterizan por la presencia de residuos de sacáridos apéndices (como la D-xilosa o la D-apiosa en los casos respectivos del xilogalacturonano y el apiogalacturonano) que se ramifican a partir de una columna vertebral de residuos de ácido D-galacturónico (Buchanan et al., 2015).
Las pectinas Rhamnogalacturonano I (RG-I) contienen una columna vertebral del disacárido repetitivo 4)-a-D-ácido galacturónico-(1,2)-a-L- ramnosa-(1. A partir de muchos de los residuos de ramnosa, se ramifican cadenas laterales de varios azúcares neutros. Los azúcares neutros son principalmente D-galactosa, L-arabinosa y D-xilosa, y los tipos y proporciones de azúcares neutros varían según el origen de la pectina.
La granadilla es una planta perteneciente a la familia Passifloraceae originaria de los Andes, sus nombres comunes pueden variar: “granada china” o “granada de moco”. El fruto usualmente es de color naranja, dorado, pardo o amarillo con pequeñas pintas (Melgarejo, 2015). Por su parte, el pepino cohombro, es una especie perteneciente a la familia Cucurbitaceae, es una planta herbácea, anual y rastrera cubierta de tricomas, de raíces fasciculadas y desarrollo bastante superficial, encontrándose la mayor concentración de raíces entre los 25 y 30 cm (Huang, 2009).
El mercado global de pectina se estima en cerca de 60.000 toneladas métricas en 2016, y se espera que crezca al doble para el año 2020, alcanzando un valor de 2.4 billones de dólares (Ciriminna et al., 2016). Este panorama muestra que el mercado de pectina tiene un gran crecimiento en alimentos y productos farmacéuticos. Los países de América Latina, gracias a su posición geográfica y potencial agrícola, pueden generar fuentes alternativas de pectina para competir en el mercado y abastecer su consumo interno, aumentando la competitividad de la región.
Materiales y métodos
Material vegetal
El material vegetal de granadilla y pepino es adquirido en el mercado local y posteriormente es procesado para obtener el material de interés. Ambos materiales son llevados al laboratorio donde se remueve la suciedad con un lavado de agua corriente. El exocarpio de pepino se separa con la ayuda de un pelador de vegetales y es almacenado para su posterior uso. El mesocarpio de granadilla se obtiene abriendo los frutos, retirando primero las semillas y luego con la ayuda de una espátula de laboratorio, retirando el mesocarpio que se almacena para su uso.
Diseño experimental
El diseño experimental empleado en este estudio es un diseño factorial 23. Los factores estudiados fueron, factor 1: fuente de extracción, niveles pepino cohombro (Cucumis sativus) y granadilla (Passiflora ligularis); factor 2: pH, niveles 1,6 y 2,5 y factor 3: tiempo, niveles 40 y 80, cada combinación de factores se realiza por triplicado. Una muestra de pectina comercial de origen cítrico se emplea como modelo de comparación para las mediciones.
Extracción
Para evitar la proliferación de microorganismos en las matrices de estudio, los materiales se sometieron a ebullición en agua (300 gramos de material vegetal por litro), posteriormente se separa el líquido de ebullición y el material vegetal se somete a hidrólisis ácida.
La hidrólisis ácida se lleva a cabo empleando una solución de ácido clorhídrico ajustado al pH deseado, en el cual se sumerge el material vegetal a una temperatura de 60 °C y agitación constante. Terminado el tiempo de hidrólisis, se separa el sólido de la solución obtenida empleando etanol al 96 %, se realiza la precipitación de pectinas presentes en la solución. El precipitado se recupera a través de filtración y se somete a secado.
Medición de variables de respuesta
Las variables de respuesta medidas fueron rendimiento de extracción, porcentaje de humedad, contenido de metoxilo, grado de esterificación y pH final de la pectina obtenida. El contenido de humedad en las muestras de pectina obtenidas se determina mediante secado en horno convencional a 50 °C hasta obtener un peso constante, se emplea la siguiente ecuación (Hui, 2008).
El contenido de metoxilo se determina mediante la valoración del grado de esterificación, dado que la cantidad de metoxilo en el 100 % de pectina esterificada es 16.32 %, el porcentaje de metoxilo se calcula a partir de la siguiente ecuación (Zouambia et al., 2017)
Donde:
16.32: 16.32 % de metoxilo
100: 100 % de pectina esterificada
DE: Grado de esterificación
A su vez, el grado de esterificación se calcula empleando el método de valoración de Schultz. Para ello se considera como valoración (A) el volumen gastado de NaOH 0.1 N durante la acidez titulable en la muestra ensayada. Seguidamente, se añadieron 20 mL de hidróxido de sodio 0.5 N y se dejaron reposar por 30 minutos. A continuación, se agregaron 20 mL de ácido clorhídrico 0.5 N, y finalmente, la dilución se valora con hidróxido de sodio 0.1 N (valoración B), para determinar los valores de la variable se emplea la ecuación 6 (Curbelo Hernández et al., 2017)
* El volumen de hidróxido de sodio tanto en el numerador como en el denominador de la ecuación se utiliza el mismo.
El pH final de la pectina obtenida se mide disolviéndose en agua desionizada al 10 % para verificar que cumple con la especificación requerida de acuerdo con la industria (Loh, 2016).
Medición de ácido galacturónico por espectroscopia.
Como medida de calidad de las pectinas presentes en los productos vegetales ensayados, se emplea espectrometría UV-vis, midiendo la absorbancia a una longitud de onda de 525 nm, y el procedimiento establecido por Filisetti-Cozzi utilizando una curva de calibración de ácido galacturónico en agua (Cardona- Alzate y Cerón-Salazar, 2011).
La solución de m-hidroxibifenil se prepara a partir de 0.15 g del reactivo y llevando a 100 mL con una solución 0.5 % p/v de hidróxido de sodio, dejando en reposo por 24 horas en un lugar oscuro.
Se prepara una solución de tetraborato de sodio 75 mM con 1.5 gramos de tetraborato de sodio y 90 mL de ácido sulfúrico concentrado, se deja en agitación en una campana de extracción de gases por 24 horas hasta completa disolución. Se ajusta el volumen a 100 mL con ácido sulfúrico.
Para preparar la solución de ácido sulfámico 4M se toman 38.84 gramos del reactivo aproximadamente y se agrega 50 mL de agua en un balón aforado de 100 mL. Se adiciona continuamente solución saturada de hidróxido de sodio saturada agitando constantemente hasta disolución. Se ajusta el volumen con agua.
La generación de la curva de calibración de ácido galacturónico se realiza de la siguiente manera: se preparan 1 mL de soluciones seriadas de 40, 30, 20, 15, 10 y 5 μg/mL. Por cada concentración se toman dos tubos de ensayo y se adiciona 0.4 mL de cada solución en cada tubo de ensayo, obteniéndose 12 tubos de ensayo. A cada tubo de ensayo se le incorporan 40 μL de solución de ácido sulfámico y se someten a agitación por 30 segundos.
Pasado el tiempo, se agrega a cada tubo 2.4 mL de solución de tetraborato de sodio y se agitan los tubos por 1 minuto más. Posterior a la agitación, se llevan los tubos de ensayo a baño de María por 20 minutos y posteriormente a un baño de hielo por 10 minutos.
Finalmente se adiciona 80 μL de solución de m-hidroxibifenil y se agitan los tubos. Se deja en reposo por 10 minutos para el desarrollo de un color rosado. Se mide la absorbancia de las soluciones a una longitud de onda de 525 nm.
Análisis estadístico
Los valores obtenidos se sometieron a análisis ANOVA para comprobar la existencia de diferencias significativas entre ellos. Para determinar los valores máximos de las variables respuesta se emplea una superficie de respuesta.
Análisis a través de espectroscopia infrarroja.
Se realiza un análisis de espectro infrarrojo de las muestras de pectina obtenidas y de una muestra de pectina comercial. Los espectros son analizados a través de un patrón interno (pectina comercial) (Ogutu y Mu, 2017).
Resultados y discusión
Ensayos preliminares
En los ensayos preliminares, se estudia el impacto de emplear el mesocarpo y el exocarpo de los productos analizados, así como la cantidad de etanol necesaria para la precipitación de pectinas.
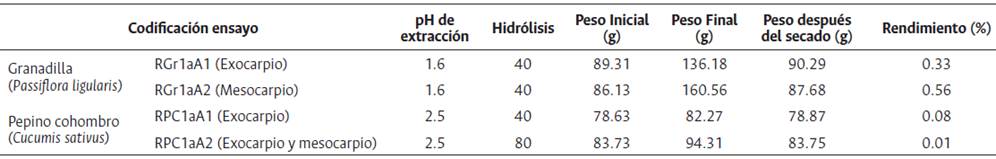
En la tabla 1 se observa que el mayor rendimiento se presenta en el mesocarpio de granadilla en pH 1.6, tiempo de hidrólisis 40 min con un resultado del 0.56 % de pectina obtenida; sin embargo, el rendimiento en exocarpio es 0.33 % lo cual indica que en dicho tejido se encuentra un porcentaje significativo de pectina. Adicionalmente en esta tabla se muestran los resultados obtenidos para pepino cohombro. Se observa que el mayor porcentaje de pectina se obtiene en el exocarpio dando como resultado 0.0793 % de pectina. Al realizar el ensayo con exocarpio y mesocarpio en conjunto el resultado del rendimiento es 0.0086 %.
Además, se observa que la presencia de cáscara afecta el aspecto del producto. La pectina obtenida a partir del exocarpio tuvo un color amarillo oscuro y la del mesocarpio tuvo una coloración amarilla clara.
Caracterización de la pectina comercial
De acuerdo con los valores obtenidos, el porcentaje de humedad y pH de la pectina cítrica comercial se encuentran en los rangos estándares (pH 3 en promedio) (Tabla 2) para las pectinas utilizadas en la industria de alimentos. El valor de metoxilo obtenido es de 6.67 %, inferior al estándar comercial (8 - 12 %) (Santos, Andrade y Gouveia, 2017).
Tabla 2 Resultados de la caracterización de la pectina cítrica comercial.

Rendimiento de extracción en pepino cohombro (Cucumís satívus)
Se emplean condiciones de pH: 1.6 y 2.5, tiempo de hidrólisis 40 y 80 minutos a una temperatura de 60 °C y precipitación con 60 % de etanol en relación con la solución péctica. Según los resultados obtenidos, se puede observar una diferencia entre los valores obtenidos en base húmeda y en base seca, debido principalmente al alto contenido de humedad del material vegetal.
Como se puede observar en la tabla 3, existe una diferencia significativa debido al factor pH, presentando el máximo de rendimiento a pH 1.5 y tiempo de hidrólisis 80 minutos. La misma combinación de tratamientos genera un máximo en base seca, pero el análisis estadístico no genera diferencias significativas en este conjunto de datos debido a la alta variación de los datos.
Tabla 3 Rendimiento en base húmeda y en base seca de pectina obtenida a partir del exocarpio del pepino cohombro

R: variable rendimiento, PC: pepino cohombro y aA1: número de ensayo. * Sin diferencia significativa ** diferencia significativa
Los rendimientos obtenidos en base seca y húmeda son inferiores a los reportados en calabaza (familia Cucurbitácea) dando como resultado 7.3 % utilizando agua acidificada con HCl a pH 2.5, en una RSS 1:50 durante 60 min a 85 °C (Molina Soler, 2016).
Las combinaciones de pH bajo contribuyen a la reducción del tamaño de las fracciones de pectina. Bajo esta condición, se incrementa también la hidrólisis de los grupos carboxilos, reduciendo el porcentaje de ésteres metílicos en las cadenas, por otro lado, en estas condiciones, se logra hidrolizar un porcentaje muy bajo de pectina, obteniéndose un bajo rendimiento (Zegada Franco, 2015). El mayor rendimiento en base seca fue de 1.27±0.6 % en condiciones de pH 1.6 a tiempo de hidrólisis 80 minutos, similares a los reportados por Damiani (Damiani et al., 2012)
En cuanto a la variable porcentaje de humedad, la combinación de tratamientos que genera la pectina con mayor nivel de humedad fue pH 2.5 e hidrólisis por 80 minutos, con una humedad de 1.44 % aproximadamente (tabla 4).
Tabla 4 porcentaje de humedad y pH de la pectina obtenida a partir del exocarpio de pepino cohombro
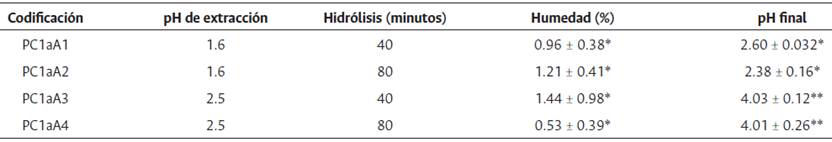
Las abreviaturas presentadas en la tabla hacen referencia a la codificación de los tratamientos empleados de tal forma que: PC: pepino cohombro y a A1: número de ensayo. * Sin diferencia significativa ** diferencia significativa.
La humedad de la pectina es un factor que incide directamente en su estabilidad porque puede permitir el crecimiento de microorganismos, especialmente hongos, además de incidir en parámetros fisicoquímicos claves para el desempeño de la pectina (Baltazar Flores et al., 2013).
El valor de pH medido en las pectinas obtenidas se puede observar en la tabla 4. A través del análisis estadístico, se evidencia diferencia significativa asociada al tiempo de hidrólisis. Sin embargo, los rangos de pH registrados son cercanos a 3, que es un valor ideal para evitar el crecimiento de microorganismos y aumentar su capacidad de gelificación (Correa et al., 1999).
Los valores hallados para la cantidad de metoxilo se reportan en la tabla 5. Como se puede evidenciar, todas las pectinas extraídas del exocarpio del pepino cohombro se encuentran por encima del 12 %, considerándose de alto metoxilo. El mayor contenido en metoxilo se obtuvo con los tratamientos pH 1.6 y tiempo de hidrólisis 80 minutos. Este resultado es congruente con los obtenidos en calabaza (Fissore et al., 2009).
Teniendo como base los valores de acidez libre y grado de metoxilo se calcula el grado de esterificación, valores que se relacionan en la tabla 5.
Tabla 5 Contenido de metoxilo (%) y grado de esterificación de pectina obtenida a partir del exocarpio de pepino cohombro

PC: pepino cohombro y aA1: número de ensayo. *sin diferencia significativa.** Diferencia significativa.
Los resultados obtenidos muestran que las pectinas obtenidas tienen alto grado de esterificación, y que el factor pH genera diferencia significativa en este parámetro. El mayor grado de esterificación se obtuvo con los tratamientos pH 2.5 y tiempo de hidrólisis 80 minutos.
La relación entre el contenido de metoxilo y grado de esterificación sugiere la presencia de otros grupos formando complejos con los grupos carboxilos del ácido poligalacturónico, el grado de esterificación de las pectinas con alto metoxilo influye mucho sobre sus propiedades.
Con los resultados obtenidos en el grado de esterificación el mayor porcentaje se encuentra en 87.37 % se puede indicar que la pectina extraída tiene un elevado porcentaje de esterificación en comparación con la pectina comercial (66.34 %) adicional el grado de esterificación obtenido en el exocarpio del pepino cohombro es superior al 53 % reportado para extracción de pectinas en calabaza perteneciente a la familia de las cucurbitáceas (Xiao, 2017).
Rendimiento en granadilla (Passiflora ligularis).
Los resultados de rendimiento tanto en base húmeda como seca se presentan en la tabla 6. Para el caso de base húmeda, el análisis estadístico no detecta diferencias significativas presentes en los valores, y un valor máximo en las combinaciones de tratamiento pH 1.6 y 40 minutos de hidrólisis. En base seca, se repite el máximo de rendimiento en la combinación de tratamientos, pero si se observa diferencia significativa asociada al factor pH.
Tabla 6 Rendimiento en base húmeda y en base seca para la pectina obtenida a partir del mesocarpio de granadilla

Los resultados difieren de los reportados en (Chasquibol-Silva et al., 2008), donde se reporta un rendimiento de 21.6 %, aunque no se especifica si es en base húmeda o seca. Un resultado de interés se observa al momento de secar la pectina, que sufre un leve pardeamiento probablemente ocasionado por la presencia de azúcares o de otras sustancias susceptibles al calor.
En cuanto al contenido de humedad de la pectina extraída oscila entre 0.61 %-1.04 %, al comparar el resultado con la pectina comercial se observa que es similar ya que se obtuvo un valor de 0.57 % (tabla 7). Estos valores también se diferencian de los obtenidos en el estudio reportado por Chasquibol-Silva.
Los valores de pH final registrados en las pectinas obtenidas de Passiflora ligularis están cercanos a 3, que es el valor ideal para una pectina desde el punto de vista fisicoquímico, mostrando que esta fuente de pectina y el proceso es adecuado para obtener un producto de calidad (tabla 7).
Tabla 7 Humedad (%) y pH de La pectina obtenida a partir del mesocarpio de granadilla
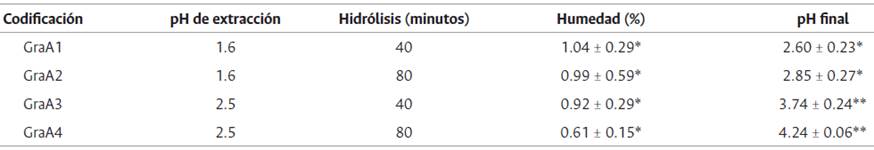
Gr: granadilla y aA1: número de ensayo. *sin diferencia significativa. ** Diferencia significativa
El contenido de metoxilo presente en las pectinas obtenidas del mesocarpio de la granadilla se resumen en la tabla 8. Se observa diferencia significativa debido al pH y un valor máximo de 11.72 %, clasificándose en una pectina de alto metoxilo. Usando los valores de acidez libre y grado de metoxilo se calcula el grado de esterificación de la pectina obtenida (tabla 8).
Tabla 8 Contenido de metoxilo (%) y grado de esterificación de la pectina obtenida a partir del mesocarpio de la granadilla

Gr: granadilla y aA1: número de ensayo. *sin diferencia significativa. ** Diferencia significativa
Como se puede observar, la pectina extraída obtiene un elevado porcentaje de esterificación (71.79 %) en condiciones de pH 1.6 y tiempo de hidrólisis 80, por lo tanto, es de alto metoxilo (tabla 8). Estos resultados son congruentes con los trabajos revisados sobre calabazas.
Determinación de la cantidad de ácido galacturónico.
Como se presenta en la tabla 9, todos los valores son cercanos entre sí, aunque los valores más altos se observan a pH 1.6, con el máximo a 40 minutos de hidrólisis.
Tabla 9 Concentración en mg de ácido galacturónico / 100 mg de pectina de exocarpio del pepino cohombro y granadilla.
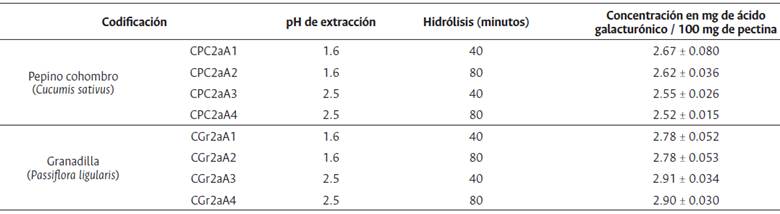
C: variable concentración, PC: pepino cohombro, Gr: granadilla, 2: método 2 y aA1: número de ensayo.
Una situación similar se observa con la concentración de ácido galacturónico en Passiflora ligularis, aunque en este caso los máximos se evidencian a pH 2.5 (Tabla 9). Los valores son congruentes con los reportados en diversos estudios en fuentes alternas de pectinas y son indicadores de calidad de las pectinas obtenidas (Voragen, 2009).
Análisis de espectroscopia infrarroja
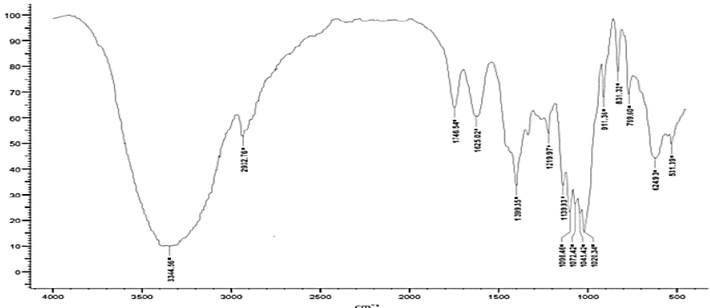
Al comparar los espectros de la figura 1(Pectina comercial) y figura 2(Cucumis sativus), se observa que son similares al mostrar picos de 3404 cm-1, 3403 cm-1, 3346 cm-1, 3317 cm-1 indicando estiramiento de grupos O - H; en los picos 2936 cm-1 y 2946 cm-1 indican estiramiento C - H, en la pectina comercial (figura 1) se presenta un pico de 2932 cm-1 el cual es muy similar con la pectina obtenida.; estas bandas son similares a las reportadas por (Chasquibol-Silva et al., 2008). En la figura 1 se presentan los picos en 1072 cm-1,1098 cm- 1,1139 cm-1 1045 cm-1 y 1020 cm-1 indicando el grupo C - O, este mismo grupo también se encuentra en los espectros de las figuras 2 y 3 presentan picos en 1063 cm-1, 1041 cm-1, 1100 cm- 1 y 1138 cm-1.
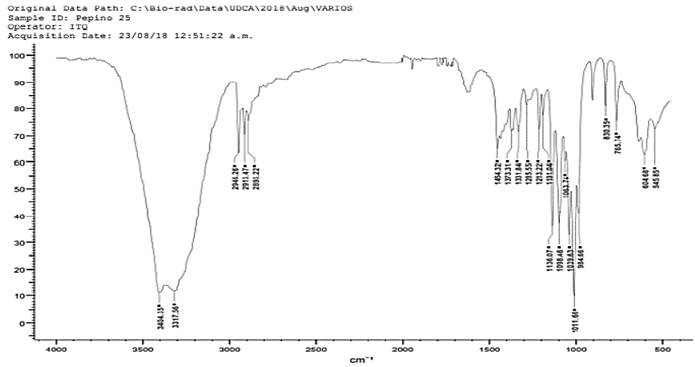
Figura 2 Análisis de IR en pectina obtenida a partir de exocarpio de Cucumis sativus a pH 2.5, hidrólisis: 80 minutos
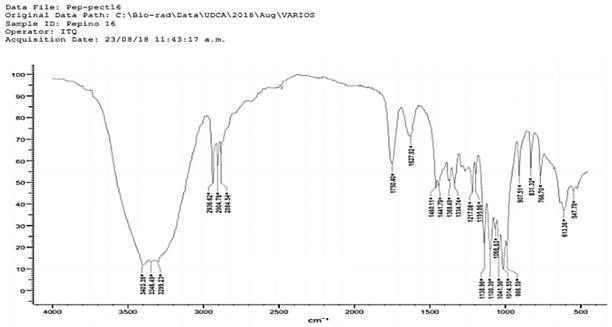
Figura 3 Análisis de IR en pectina obtenida a partir de exocarpio de Cucumis sativus a pH 1.6, hidrólisis: 40 minutos
La muestra de pectina comercial y los espectros correspondientes a las figuras 26 y 27, indican la presencia del grupo C - H, presentando picos en 2932 cm-1, 2946 cm-1,2913 cm-1 ,2936 cm-1 y 2904 cm-1. Al realizar comparación de los espectros, en la figura 1 y 3 presencia picos 1625 cm-1, 1627 cm-1, indicando la presencia del grupo C = O, mientras que en la figura 2 presenta ausencia de este grupo debido al bajo rendimiento.
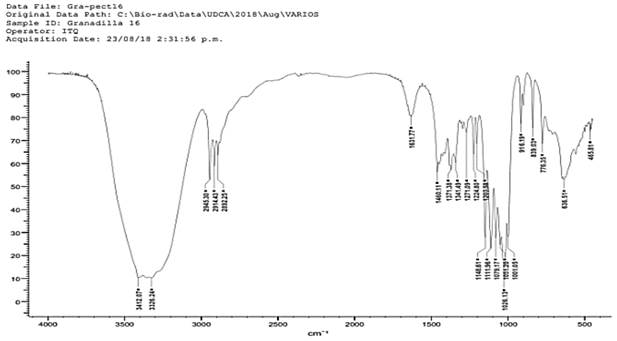
En las figuras 4 y 5 correspondientes a los espectros de la pectina obtenida a partir de granadilla se encuentran picos en 3412 cm-1, 3326 cm-1 indicando estiramiento de grupos O - H, en los picos de 2945 cm- 1, 2914 cm-1 y 2892 se indica la presencia del grupo CH. Realizando un paralelo entre los espectros de la pectina obtenida a partir de granadilla (figura 4 y 5) y el espectro de pectina comercial (figura 1) se establece que en los tres espectros hay presencia del grupo C = O ácido, en los picos 1625 cm-1 y 1631 cm- 1. En la figura 5 se encuentran los picos 1148 cm-1, 1111 cm-1, 1079 cm-1 los cuales indican la presencia de C - O, este grupo también se encuentra presente en la muestra de pectina comercial.
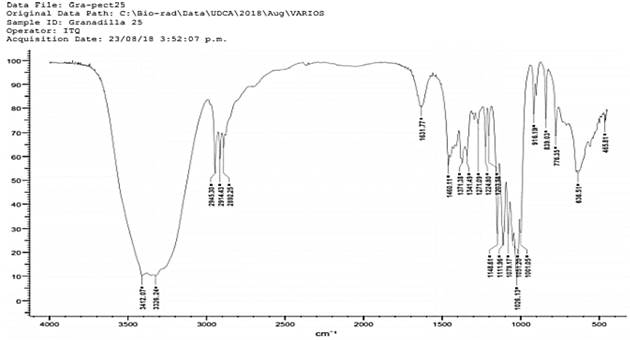
Figura 4 Análisis IR en pectina obtenida a partir de mesocarpio de Passiflora Ligularis pH 2.5 hidrólisis: 80 minutos.
Conclusiones
Es posible extraer pectina a partir de exocarpio de pepino cohombro (Cucumis sativus) y del mesocarpio de granadilla (Passiflora ligularis). El máximo porcentaje de pectina extraída para ambos materiales vegetales corresponde a las condiciones de trabajo de 60 °C, pH 1.6 y tiempo de 40 minutos alcanzando valores de 84 % en granadilla y 6.98 % en pepino cohombro.
El porcentaje de esterificación varía del 71 % al 87 %, lo que calificaría a las pectinas extraída a partir de los residuos del exocarpio de pepino cohombro (Cucumis sativus) y del mesocarpio de granadilla (Passiflora ligularis), como de alto metoxilo, esto hace que la pectina tenga propiedades gelificantes y sea apta para el uso en la industria.
El máximo porcentaje de pectina extraída a partir de exocarpio de pepino cohombro (Cucumis sativus) y del mesocarpio de granadilla (Passiflora ligularis) corresponde a una muestra obtenida a 60 °C, pH 1.6 y tiempo de 40 minutos. Las características de las pectinas obtenidas son satisfactorias y cumplen con los estándares de calidad requeridos por la industria para este tipo de material.