Introducción
Hedeoma teyucuarensis es un sufrútice aromático endémico del último relicto de cerrado en la Argentina, conocida comúnmente con el nombre de “mentita”. Es utilizada como aromatizante en bebidas refrescantes, pero también es una especie importante en la medicina popular, ya que a sus raíces se le atribuyen la propiedad de combatir los parásitos intestinales por medio de una infusión obtenida a partir de la decocción de las mismas. (Keller y Tressens, 2016).
En la actualidad solo existe registro de una única población de H. teyucuarensis, con tan solo 13 ejemplares, la cual se encuentra en un área menor a 0.1 ha, dentro del sitio conocido como Teyú Cuaré, ubicado en San Ignacio (Misiones-Argentina). La existencia de esta especie endémica en Teyú Cuaré, está asociada a la geología y edafología del lugar debido a la presencia de suelos arenosos, ácidos y altamente drenados, que se presentan únicamente en ese sitio en la provincia de Misiones (Velazco et al., 2018).
El uso medicinal de la especie implica la remoción de las raíces y esta modalidad de uso netamente extractiva determinan la pérdida del recurso genético en las poblaciones naturales nativas, ocasionando en este caso, como en otras especies de Hedeoma, que se encuentre en peligro de extinción (Lobo-Arias y Medina-Cano, 2009; Keller y Tressens, 2016; Díaz- Gabutti et al., 2018). La principal causa de desaparición de plantas y animales es la disminución de las áreas naturales y pérdida de hábitat por la excesiva fragmentación del paisaje debido a las actividades agroindustriales, forestales y construcciones urbanas (Hernández et al., 2009).
La población de H. teyucuarensis se encuentra ubicada en un área desprotegida de leyes ambientales provinciales o nacionales y con una población agrícola circundante que está en permanente aumento, esto hace que los factores antrópicos se constituyan en una amenaza creciente. Por otro lado, a la fecha, no se cuenta con información acerca de la factibilidad de propagación asexual de la especie, siendo esta, una herramienta clave para generar estrategias complementarias en la conservación in situ y ex situ y así evitar su extinción (Hernández et al., 2009; Keller y Tressens, 2016).
La propagación vegetativa es una metodología sencilla de bajo costo que puede contribuir a disminuir y evitar la presión sobre las poblaciones naturales. Asimismo, es una técnica que brinda la posibilidad de multiplicar genotipos selectos y admite un manejo económico productivo en el corto plazo (Cardoso dos Santos et al., 2013; Dirchwolf y Schroeder, 2015), permitiendo la conservación del recurso (Feria-Arroyo et al., 2010) y la transferencia de la técnica a pequeños productores y pueblos originarios.
Considerando la necesidad de generar estrategias aptas y accesibles para todo productor agrícola, resulta importante desarrollar técnicas de propagación sencillas, factibles de implementarse en la agricultura familiar, basados en los principios de la agricultura ecológica, integrando la producción de alimentos y productos no maderables del monte con la preservación de la biodiversidad. Permitiendo así, la convivencia armónica de especies endémicas del lugar, juntamente con los cultivos de interés económico, logrando de esta manera que el proceso productivo tenga eficiencia, sostenibilidad en el tiempo, y resiliencia (Moreno y Castro, 2018). En este sentido la propagación vegetativa viene a resolver problemas de costos, accesibilidad, producción y manejo sustentable de un recurso, ya que una de las primeras dificultades del establecimiento de cultivos de especies medicinales, particularmente de las nativas, es la ausencia de material de propagación en cantidad suficiente, para que los productores puedan implantarlas, domesticarlas y lograr así, un uso sostenible del recurso (Scheffer et al., 2005). Razón por la cual se debe contar con métodos de propagación que permitan obtener plantas en forma rápida y simple como es la propagación por estacas (Dirchwolf y Schroeder, 2015).
El presente trabajo plantea como objetivo desarrollar un protocolo de propagación vegetativa de H. teyucuarensis empleando la propagación vegetativa, con la finalidad de ser reconvertidas a plantas madre para la remultiplicación o uso en programas de restauración y domesticación de la especie.
Materiales y métodos
Especie de estudio
Hedeoma teyucuarensis es una planta subarbustiva de hasta 65 cm de altura cuyos tallos, hojas y flores, presentan indumentos de pelos simples. Sus ramas son erectas y poseen hojas elípticas obovadas de margen entero, sésiles o con un corto peciolo y filotaxis opuesta. El cáliz de las flores es tubular, bilabiadas de color verde mientras que la corola es infundibuliforme blanca con máculas violáceas, las cuales se agrupan en inflorescencias axilares cimosas y el fruto está conformado por clusas. (Keller y Tressens, 2016).
Recolección de material vegetal
Por favor aclarar de cuantas plantas se colectaron estacas, en qué época del año, qué tamaño aproximado tenían las plantas y las estacas.
Para realizar este estudio se procede a cosechar estacas de aproximadamente 15 cm de longitud de 7 plantas seleccionadas al azar en el sitio Teyú Cuaré (Municipio de San Ignacio, Misiones, Argentina), en el mes de abril (otoño) Las plantas seleccionadas para la cosecha se caracterizan por poseer una altura de 20 y 30 cm y un diámetro de follaje entre 15 y 25 cm. Las estacas inmediatamente después de ser cosechadas son colocadas en agua y en una heladera térmica portátil, para evitar la deshidratación de las mismas durante el traslado hasta el laboratorio de propagación vegetativa (Facultad de Ciencias Forestales-Universidad Nacional de Misiones).
Evaluación de concentración de fitohormonas.
Estacas sin ápice de 7 cm de longitud obtenidas del material vegetal cosechado en Teyú Cuaré son utilizadas para realizar una primera evaluación del porcentaje de enraizamiento a través del estudio del efecto del ácido 1-naftalenacético (ANA). Para ello, se realizó un experimento, donde las bases de las estacas son sumergidas en ANA en concentraciones de 100 y 250 mg.kg-1 y agua destilada (tratamiento testigo) durante 30 minutos y luego una solución fúngica (20g.L-1) durante 20 minutos. Las estacas son plantadas en macetas de 200 cm3 que contienen corteza de pino como sustrato. Estas se mantienen durante 60 días en un invernadero agrícola bajo un sistema de riego automático por microaspersores, a fin de mantener una humedad relativa cercana al 90 %, para evitar la deshidratación de las estacas. Transcurrido ese periodo se realiza la evaluación de las variables, las cuales son: número de brotes, porcentaje de enraizamiento, número de raíces, longitud de raíces. Además se calcula el índice de enraizamiento (IE) de acuerdo con la fórmula de Mancini et al. (2018), donde, R es cantidad de raíces y LR longitud promedio de tres raíces. Valores altos del IE expresa muchas raíces de corta longitud, mientras que valores bajos, pocas raíces de mayor longitud. Posteriormente las estacas enraizadas se trasplantan a macetas de 1000 cm3 que contienen arena y 3 g.cm-3 de fertilizante de liberación lenta. Las mismas se mantienen en invernáculo y se regaron hasta obtener la cantidad de brotes necesarios para posteriores ensayos.
Evaluación del efecto combinado de los factores fitohormonas, sustratos y tipo de estacas.
Las plantas obtenidas en el primer experimento son utilizadas para cosechar estacas apicales y subapicales de 7 cm de largo con cuatro a seis nudos. Estas son empleadas para evaluar el efecto del tipo de sustrato y estacas combinado con distintas concentraciones de ANA sobre la inducción de raíces adventicias. Las bases de las estacas son sumergidas en agua destilada (tratamiento testigo) o en una solución de ANA en las dosis 100 y 250 mg.kg-1, durante 30 minutos y luego en una solución fúngica por 20 minutos. Posteriormente son colocadas en macetas de 200 cm3, que contenían arena, perlita o corteza de pino compostada y permanecieron en un invernáculo con riego por micro-aspersión y una humedad relativa del 90 % durante 60 días. Las variables analizadas después ese periodo son las mismas que se mencionaron anteriormente.
Finalizado el ensayo las plantas obtenidas en los distintos tratamientos son trasplantadas a macetas de 1000 cm3 que contenían arena como sustrato.
Diseño experimental y análisis estadístico.
El experimento 1 se desarrolla con un diseño completamente aleatorizado en tanto que el segundo además de estar aleatorizado, los tratamientos presentan una distribución factorial 2 (estacas) X 3 (sustrato) X 3 (dosis de ANA), totalizando 3 tratamientos en el experimento 1 y 18 en el segundo con seis repeticiones cada uno. Los datos son sometidos a un análisis de normalidad mediante el test de Shapiro-Wilk modificado y de homocedasticidad mediante la prueba de Levene. Posteriormente en el primer experimento se procede a realizar un análisis de variancia, mientras que en el segundo se realiza un análisis empleando un modelo lineal generalizado mixto (Solís et al., 2015). Para determinar diferencias significativas, las medias se comparan a un nivel de 0.05 de probabilidad de error utilizando el test de Tukey para el primer experimento y el DGC para el segundo, para lo cual se utiliza el software INFOSTAT (Di Rienzo et al., 2020).
Resultados
La concentración de ANA utilizada no influye en el porcentaje de enraizamiento y número de brotes, pero sí en el número y longitud de raíces y por ende sobre el IE (Tabla 1). En el tratamiento testigo conjuntamente con el que contiene 250 mg.kg-1 de ANA, se observan los mejores porcentajes de enraizamiento, sin embargo, las diferencias fueron estadísticamente no significativas entre los distintos niveles de concentración (Tabla 1). El mayor número de raíces por estaca, longitud promedio de raíz e IE se encuentra en el tratamiento de 250 mg.kg-1 de ANA presentando diferencias estadísticamente significativas respecto del testigo (Tabla 1, Figura 1A). Por otro lado, en el número de brotes, no se observan diferencias estadísticamente significativas entre los tratamientos (Tabla 1, Figura 1B).

Figura 1 Plantas de H. teyucuarensis obtenidas por propagación vegetativa. Estacas subapicales enraizadas después de dos meses en corteza de pino (A), estacas subapicales con brotes en corteza de pino (B), estacas apicales enraizadas después de dos meses en arena (C), estacas brotadas en arena y perlita (D). La barra indica 2 cm.
Tabla 1 Efecto de la concentración de ANA sobre el enraizamiento de estacas de H. teyucuarensis (promedio ± desvío estándar)
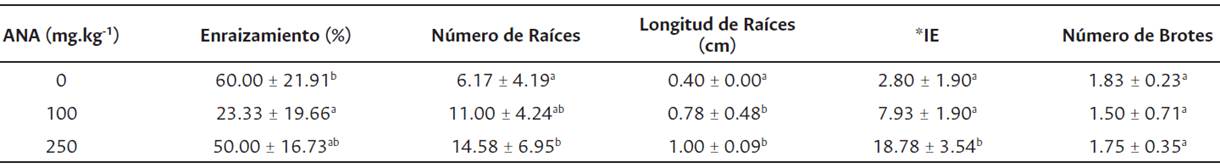
Letras distintas indican diferencias significativas entre concentraciones (p < 0.05).
*Índice de Enraizamiento
En el segundo experimento se observan diferencias estadísticas significativas (p = 0,0001) en las variables de porcentaje de enraizamiento, número de raíces y en el IE, en tanto que en las variables longitud de raíces y número de botes no muestran diferencias significativas (Tabla 2). En las estacas tanto apicales como subapicales se induce el desarrollo de raíces adventicias en todos los sustratos y en las distintas concentraciones de ANA (Tabla 2).
Tabla 2 Efecto del tipo de sustrato, concentración de ANA y tipo de estaca, sobre las variables estudiadas en H. teyucuarensis (promedio ± desvío estándar)
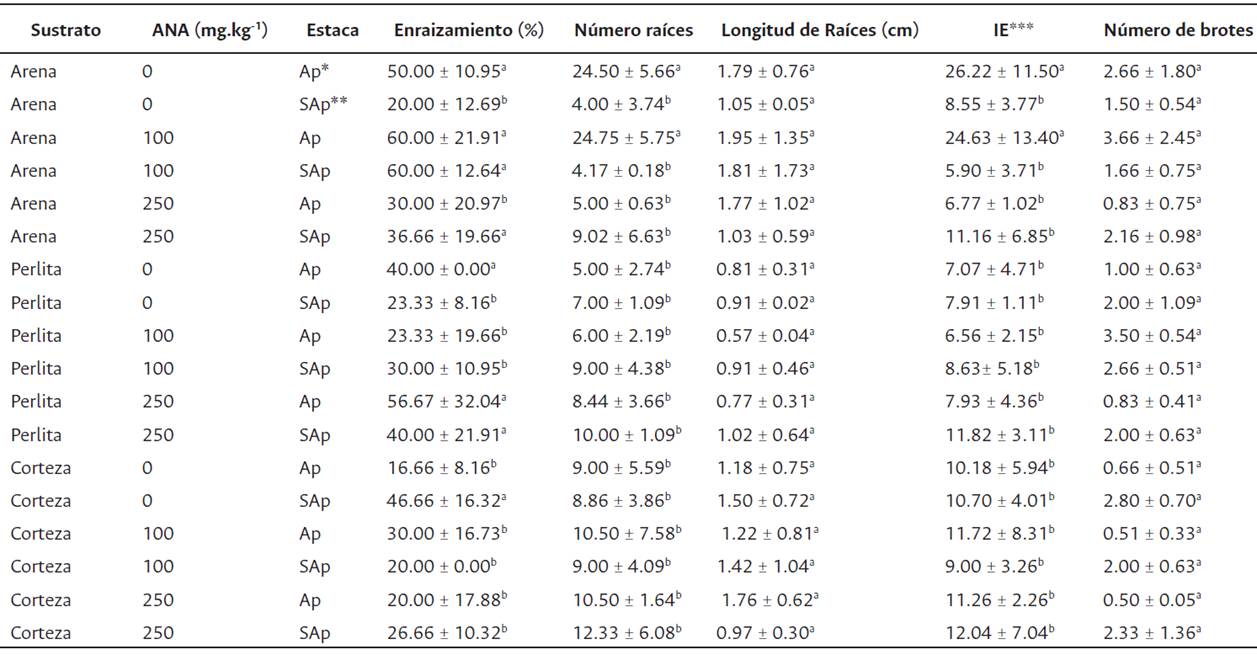
Letras distintas indican diferencias significativas entre tratamientos (p < 0.05). *Apical **Subapical.
***Índice de Enraizamiento
En la concentración 100 mg.kg-1 para el sustrato arena, se observa el mayor porcentaje de enraizamiento en ambos tipos de estacas, aunque sin diferencia significativa con el tratamiento testigo en la estaca apical. Asimismo, el número de raíces es mayor en la estaca apical, mientras que la longitud promedio de las raíces es similar entre estacas. Por lo tanto, se obtuvo un mayor IE en las estacas apicales. Por otro lado, el mayor número de brotes también se observa en las estacas apicales con la concentración 100 mg.kg-1(Tabla 2 1C).
La perlita si bien permite un buen desarrollo de raíces de las estacas en el tratamiento testigo y las distintas concentraciones de ANA utilizadas, con 250 mg.kg-1 de ANA se induce el mayor porcentaje de enraizamiento y principalmente en estaca apical. Sin embargo, no se encuentran diferencias estadísticamente significativas en el número y longitud promedio de raíces entre los distintos tipos de estacas y concentraciones de hormona. Contrariamente, el número de brotes es mayor en la estaca apical tratada con 100 mg.kg-1 (Tabla 2, Figura 1D).
En el sustrato corteza de pino en la estaca subapical del tratamiento libre de hormona se observa el mayor porcentaje de enraizamiento y número de brotes, no obstante, la cantidad de raíces desarrolladas son menores que en el tratamiento de 250 mg.kg-1 de ANA (Tabla 2).
En la arena y la perlita se observan la mayor cantidad de tratamientos con porcentajes de enraizamiento superiores al 36.66 ± 19.66 (Tabla 2), mientras que en la corteza de pino solo un tratamiento presenta diferencias significativas. Consecuentemente de acuerdo con estos resultados, la arena y la perlita son los sustratos más apropiados para inducir raíces adventicias en las estacas apicales, en tanto que la corteza de pino para las subapicales en un ambiente sin adicción exógena de ANA. En este sentido se demuestra que los factores tipos de estacas y sustratos son más influyentes en la inducción de raíces adventicias que la concentración de ANA, ya que dependiendo del tipo de estaca y sustrato la adición de auxina no manifiesta diferencia respecto de un tratamiento sin auxinas, pero si entre tipo de estacas y sustratos.
Discusión
Los resultados obtenidos en este estudio demuestran que las estacas de segmentos de tallos de H. teyucuarensis no necesitan ser tratadas con ANA para lograr el enraizamiento. Si bien la adición de hormonas para inducir el desarrollo de raíces en estacas es uno de los factores más estudiados en la propagación vegetativa y fue demostrado que la aplicación de auxinas tiene gran efecto sobre este proceso morfogénico en especies de la familia Lamiaceae (Sevik y Guney, 2013; Saglam et al., 2014; Shahhoseini et al., 2015). En este trabajo, al igual que los estudios de Bona et al. (2012) y Bezerra-Carvalho et al. (2015), la incorporación de hormona no es un factor relevante en la inducción de raíces.
La propagación vegetativa está influenciada por diversos factores como el sustrato, el tipo de estaca (Vásquez et al., 2011; Dirchwolf y Schroeder, 2015), la época de recolección de estacas (Uribe et al., 2011), el manejo de la planta madre (Ramírez y Rocha, 2017), el tipo y concentración de hormonas (Sevik y Guney, 2013), entre otros. Algunos de los cuales son analizados en este trabajo y de acuerdo con los resultados obtenidos el sustrato y el tipo de estacas demuestran ser los factores más influyentes en la inducción de raíces de tallos de H. teyucuarensis.
El sustrato fue uno de los factores que afecta la rizogénesis adventicia de H. teyucuarensis, confirmando lo observado por Soudre et al., (2011) y Doll et al., (2003) que el tipo de sustrato influye notablemente en este proceso morfogénico.
Para tener éxito en la propagación vegetativa el sustrato debe cumplir con las exigencias nutricionales de la especie, proporcionar soporte, brindar la humedad y la aireación adecuadas para el desarrollo de las raíces (Olivo y Buduba, 2006) y ser económico y fácilmente disponible (Soudre et al., 2011). Considerando lo anterior se pueden emplear sustratos de origen orgánico como la corteza de pino (Ramírez y Rocha, 2017; Duarte et al., 2018) e inorgánico o inertes como la perlita (Rivera-Rodríguez et al., 2016) y la arena (Carranza-Patiño et al., 2012; Solís et al., 2015).
La arena es uno de los sustratos más eficientes en el enraizamiento de estacas apicales de H. teyucuarensis, cuando la dosis de ANA es de 100 mg. kg-1 o nula, al igual que en Baillonella toxisperma Pierre (Mpeck y Atangana, 2007), Physalis peruviana L. (López Acosta et al., 2008) y Justicia tinctoria (Oerst.) D. N. Gibson, Fam. (Solís et al., 2015). La arena es cotidianamente usada en la propagación vegetativa sola o combinada con otros sustratos (Villa-Castorena et al., 2010), debido a la textura y al espacio poroso que posee características que facilitan la emisión y respiración de raíces (López Acosta et al., 2008; Miranda et al., 2009).
La perlita por su parte es un material inerte que también puede utilizarse solo o combinado con otros sustratos para mejorar el drenaje, por poseer menor retención de humedad y mayor aireación que otros sustratos (Latsague-Vidal et al., 2008; Rivera- Rodríguez et al., 2016; Candal-Couto, 2017, p. 144; Naumann et al., 2017). Esta puede retener agua cuatro veces su peso seco, pero a la vez aporta suficiente consistencia para un óptimo soporte de la estaca y desarrollo de las raíces, lo que lo convierte en un sustrato apropiado para la propagación vegetativa (Quiroga et al., 2013). A pesar de contar con todos estos aspectos positivos, la perlita fue el sustrato que manifestó los menores porcentajes de enraizamiento y raíces más cortas, exceptuando las estacas apicales de la concentración 250 mg.kg-1 (Tabla 2). Estos resultados son contrarios a los que observaron Cuevas-Cruz et al., (2015) en Pinus leiophylla Schiede ex Schltdl. et Cham. y Rivera-Rodríguez et al., (2016) en P. patula Schl. et Cham quienes obtuvieron los mayores porcentajes de enraizamiento en perlita.
El sustrato corteza de pino en este trabajo contribuye mayormente al proceso de rizogénesis adventicia en las estacas subapicales en el tratamiento testigo y con 250 mg.kg-1 de ANA. En este sustrato, el agua retenida es mayor que en la arena y la perlita, pero la cantidad de agua disponible para la planta es baja y por lo tanto se necesitan riegos frecuentes y de bajas dosis para logar un sustrato con condiciones de humedad apropiado para el enraizamiento de estacas (Arrieta y Terés, 1993; Martínez etal., 2006; Sánchez- Córdova et al., 2008; Segura-Castruita et al., 2008). Si bien la corteza de pino puede generar condiciones óptimas de humedad lo cual es importante para mantener la supervivencia de las estacas hasta desarrollar las raíces, la incorporación de corteza de pino en el sustrato de propagación podría afectar negativamente al desarrollo de raíces por la presencia de toxinas y sustancias inhibidoras de crecimiento (Arévalo et al., 2016).
La arena y la perlita son sustratos que poseen buen drenaje, pero poca retención (Velasco-Hernández et al., 2004; Candal-Couto, 2017, p. 144), características que contribuyen a evitar el exceso de humedad en las macetas, y así disminuir la mortalidad de las estacas. En cambio, la corteza de pino es un sustrato que retiene mayormente la humedad y el drenaje es más lento que otros sustratos (Arévalo et al., 2016).
El sustrato utilizado en la propagación vegetativa de H. teyucuarensis, tiene mayor influencia en el enraizamiento que la dosis de hormona utilizada tal como lo observaron Soudre et al. (2011) en Cedrelinga cateniformis Ducke y Ortiz et al. (2021) en Hypericum brasiliense Choysi.
El tipo de estaca fue otro de los factores que afecta la rizogénesis adventicia de H. teyucuarensis, siendo más eficientes las estacas subapicales en corteza de pino. Esto pudo deberse a que las estacas subapicales son más lignificadas y por lo tanto cuentan con tejidos que poseen paredes secundarias de mayor grosor, lo que podría haber contribuido a una mayor resistencia a la podredumbre, además poseen mayores reservas nutritivas lo que le confiere mayor predisposición al enraizamiento adventicio (Maia et al., 2008). Resultados similares fueron demostrados por Bezerra- Carvalho et al. (2015) en Hyptis pectinata L. quienes observaron que el porcentaje de enraizamiento se incrementó a medida que la estaca que se obtiene es más distante del ápice; no obstante Maia et al. (2008) observan que hay mayor inducción de raíces únicamente en las estacas de sección intermedia de Hyptis suaveolens (L.) Poit., Niella et al., (2012) al contrario obtienen más estacas enraizadas en las secciones apicales de Jatropha curcas L. como se observa en este trabajo en el sustrato perlita en la dosis de 250 mg.kg-1. Sin embargo, en el sustrato arena en ambos tipos de estacas, los porcentajes de enraizamiento no demarcan diferencias significativas en la concentración 100 mg.kg-1, pero sí en la cantidad de raíces desarrollas (Tabla 2).
Otra particularidad observada en este trabajo es que la brotación de las estacas apicales en algunos tratamientos es menor que de las subapicales, hecho que ya había sido revelado en otras especies como Malpighia mexicana A. Juss. y Byrsonima crassifolia (L) H. B. K. (Maldonado Peralta et al., 2017).
Siguiendo con los criterios de la domesticación participativa que involucra proporcionar técnicas adecuadas de acuerdo con las condiciones, situaciones y el entorno de los agricultores (Tchoundjeu et al., 2006), la metodología desarrollada en este trabajo podría ser empleada por los agricultores e integrantes de pueblos originarios, por su simplicidad y de costo relativamente bajo, permitiendo de esta manera alcanzar la domesticación de la especie. Además, los resultados obtenidos en este estudio proporcionan información sobre los principales factores que afectan el enraizamiento de H. teyucuarensis, que serían de utilidad a la hora de propagar la especie y así evitar su extinción en el corto plazo.
Conclusión
Los resultados de este estudio demuestran que las estacas apicales y subapicales de H. teyucuarensis tienen la capacidad de desarrollar raíces adventicias sin la aplicación exógena de auxinas. El tipo de estaca y el sustrato utilizado, es uno de los factores más influyentes en la inducción y desarrollo de raíces. Las estacas apicales en arena y perlita presentaron mayor capacidad de enraizamiento y brotación.














