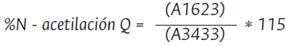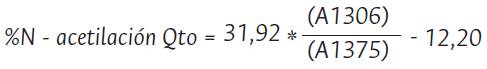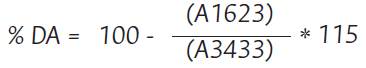Introducción
La quitina, identificada como el polímero poli (P-[1--acetil-D-glucosamina) (Nair & Laurencin, 2007) se considera el polisacárido más abundante en la naturaleza después de la celulosa. Aunque los animales marinos son sus principales fuentes, la mayoría de los insectos (escarabajos, saltamontes [Miranda et al., 2016], gusanos de seda, gusanos de la harina [Achinivu et al., 2022], moscas y las escamas de pescado (Kumari & Rath, 2014) contienen cantidades considerables de quitina (Kurita, 2001), pero son pocos los estudios reportados sobre la caracterización de su quitina y derivados (Kaya et al.,2015). Dentro de los trabajos encontrados cabe mencionar los realizados por Wu (2011) donde reportaron quitosano con alto porcentaje de desacetilación a partir de larvas de Clanis bilineata mediante métodos enzimáticos; los realizados por (Song et al., 2013), que determinaron las propiedades físicas, químicas y antioxidantes del quitosano de la larva Megacephala chrysomya; el estudio de (Miranda et al., 2016), sobre el contenido de quitina en los saltamontes, así como el de (Battampara et al., 2020), quienes reportaron un contenido de quitina del 18 % en crisálidas de gusano de seda y una conversión del 91 % de quitina en quitosano. Además, en este estudio ambos biomateriales presentaron actividad antimicrobiana.
Las diferentes orientaciones y empaquetamientos de las cadenas moleculares de la quitina dan como resultado tres formas polimórficas: a-, p- y y-quitina. Las dos primeras poseen cadenas antiparalelas y paralelas y se encuentran presentes en crustáceos, insectos y moluscos. La forma y presenta algunas similitudes con la p-quitina, sin embargo, la a-quitina incluye una gran cantidad de enlaces de hidrógeno y es la forma más estable (Khajavian et al., 2022; Zhang et al., 2000). La quitina extraída particularmente de larvas y crisálidas de gusano de seda se caracteriza por presentar una estructura química denominada forma Y, que le confiere mayor estabilidad y reactividad (Battampara et al., 2020), así como una mayor biodegradabilidad y biocompatibilidad respecto a las estructuras presentes en moluscos crustáceos (He et al., 2016; Kumari & Rath, 2014; Paz et al., 2012) y hongos (Achinivu et al., 2022; Kurita, 2001),
El quitosano es un polisacárido funcional derivado de la quitina. Presenta una cadena lineal compuesta por la repetición de unidades de 2-amina-2-desoxi-p- (1,4)-D-glucosamina y 2-acetamida-2-desoxi-p-(1,4)- D-glucosamina. Se obtiene por desacetilación parcial de la quitina en condiciones alcalinas y enzimáticas (Achinivu et al., 2022; Kurita, 2001; Miranda et al., 2016) crab and lobster shell, and fly larvae. Su estructura y propiedades presentan variaciones según el origen y los métodos de procesamiento (Nair & Laurencin, 2007). Este biomaterial tiene diversos usos, tales como películas en alimentos (Mihai & Popa, 2015; Muhammad et al., 2020), tratamiento de aguas (Al- Manhel et al., 2018; Kritchenkov et al., 2020) y en la industria agrícola, entre otros.
La sericultura (cría del Bombyx morí) deja como principal residuo las crisálidas. Aproximadamente, en la producción de 1 kilogramo de seda se generan 2 kg de crisálidas secas como residuo (Battampara et al., 2020; Cifuentes, 1999; Huet et al., 2020; Paulino et al., 2006; Zhang et al., 2000). La producción mundial de seda se estima en 1.6 millones de toneladas, al menos 3 millones de toneladas de crisálidas secas están disponibles cada año. Esta biomasa es considerada rica en carbohidratos, proteínas y lípidos (Battampara et al., 2020; Miranda et al., 2016; Smets et al., 2020). A partir de ella se puede obtener aceite (Gloria et al., 2010b) y proteínas con aplicaciones alimentarias y médicas (Koh et al., 2015; Singh & Jayasomu, 2003; Zhang et al., 2012). Las crisálidas poseen un contenido importante de carbohidratos y de quitina que varía entre razas y sexo (Battampara et al., 2020; Huet et al., 2020; Paulino et al., 2006; Zhang et al., 2000).
En la región conocida como el triángulo del café colombiano (Risaralda, Quindío y Caldas), la sericultura se introdujo para ser una fuente alternativa de recursos. Actualmente, la Universidad Tecnológica de Pereira (UTP), está a cargo del banco de germoplasma de Bombyx mori y de la producción periódica del Híbrido Pílamo 1, obtenido por mejoramiento genético, el cual se cría todo el año (Cifuentes, 1999). En esta universidad se han adelantado estudios para el aprovechamiento integral de subproductos de la sericultura (Gloria et al., 2010a, 2010b), continuando con este propósito, para este trabajo se realizó la extracción de quitina a partir de la crisálida del Híbrido Pílamo 1. Posteriormente se realizó el proceso de desacetilacion de esta para la obtención de quitosano y la caracterización de los biomateriales obtenidos.
Materiales y métodos
Obtención de quitina y quitosano
Se implementó una metodología adaptada en estudios previos que se presenta en el esquema de la Figura 1 (Battampara et al., 2020; Kumari & Rath, 2014; Paulino et al., 2006; Zhang et al., 2000).
Pretratamiento de las crisálidas
Este proceso hace parte de la etapa I (Figura 1). Se emplearon crisálidas de capullos de Bombyx mori Linn Híbrido Pílamo 1, adquiridos de la Asociación de Mujeres Mundo Café y Seda, que está ubicada en el municipio de Guática, Risaralda.
Desengrasado de las crisálidas
Este procedimiento se realizó empleando n-hexano como solvente, como lo sugiere la metodología descrita en estudios previos (Gloria et al., 2010a, 2010b). Las crisálidas desengrasadas se lavaron con agua destilada ultrapura y se secaron en estufa por 24h a 40° C. Posteriormente se refrigeraron en bolsas plásticas herméticas.
Obtención de quitina
Se llevó a cabo en tres pasos (ver etapa 2 de la Figura 1), adaptando metodologías propuestas por otros autores (Battampara et al., 2020; Kumari & Rath, 2014; Paulino et al., 2006; Zhang et al., 2000). El primer paso consistió en una desproteinización. Esta se realizó empleando NaOH al 10 % conservando una relación muestra-solvente 1:10 con las crisálidas desengrasadas. Se realizó un reflujo con agitación constante durante 6h a una temperatura 85° C y 200 rpm.
El segundo paso fue la Limpieza. Luego de terminar el reflujo, se retiró el exceso de NaOH y se lavó con agua destilada hasta pH neutro; el residuo se llevó nuevamente a reflujo con Na2CO3 al 0.4 % durante 6h a 85° C y 200 rpm. El tercer paso fue la desmineralización. Esta, se realizó al residuo neutralizado, al cual se le adicionaron 100 mL de HCL 1N con agitación constante durante 24h a 25° C y 200 rpm. Al finalizar el proceso, se realizó una centrifugación a 3500 rpm para recuperar el residuo, el cual se lavó con agua destilada microfiltrada hasta pH neutro; se secó a 40° C durante 24h, se pesó y se conservó en un recipiente hermético a temperatura ambiente para la obtención del quitosano.
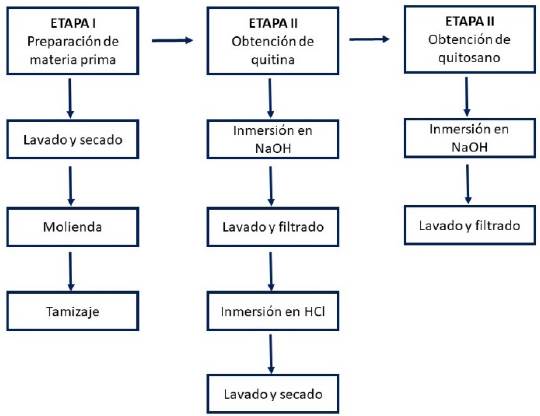
Figura 1 Etapas de obtención de quitina y quitosano. Fuente: modificada de estudios previos (Kumari & Rath, 2014).
Obtención del quitosano
Se realizó una adaptación, como se describe en la etapa 3 del esquema (Figura 1). Se adaptó la metodología con base en otros estudios (Battampara et al., 2020; Kumari & Rath, 2014; Paulino et al., 2006; Zhang et al., 2000). Igualmente, se inició con el proceso de desacetilación de la quitina empleando NaBH4 al 0.08 % en NaOH al 40 % con una relación muestra-solvente de 1:100 respecto a las crisálidas desengrasadas. Luego se realizó un reflujo con agitación constante durante 4h a 90° C y 200 rpm. Una vez finalizado el proceso, se lavó con agua destilada hasta neutralidad. La solución obtenida se filtró y el residuo se secó y se conservó a temperatura ambiente para su posterior caracterización (Battampara et al., 2020; Kumari & Rath, 2014; Paulino et al., 2006; Zhang et al., 2000).
Caracterización de la quitina y el quitosano obtenidos de crisálidas de ombyx mori L.
Para su caracterización se determinaron los siguientes parámetros:
El porcentaje y grado de N-acetilación
Se determinaron cuantitativamente a partir del área bajo la curva de los espectros de infrarrojo obtenidos según lo reportado por otros autores, donde el grado de N-acetilación corresponde al número de unidades de glucopiranos en la cadena del polímero que tienen el grupo N-acetil incorporado (Escobar et al., 2013).
Análisis infrarrojo (IR-TF)
Se realizó en un equipo marca Agilent Cary 630. Donde se compararon los espectros infrarrojo obtenidos con los de estándares comerciales de quitina y quitosano (Battampara et al., 2020; Kumari & Rath, 2014; Paulino et al., 2006; Zhang et al., 2000).
Microscopía electrónica de barrido (SEM) y análisis químico elemental de rayos X de energía dispersa (EDS)
Se realizaron con un equipo ESEM FEI Quanta-FEG 250 con Gatan Chroma CL, para obtener imágenes de alta resolución y diferenciación morfológica, identificación de fases, establecer la dispersión de partículas en escalas nanométricas y micrométricas, además del análisis químico elemental y su distribución en la superficie mediante la sonda EDAX.
Análisis termogravimétrico (TGA) y de calorimetría diferencial de barrido (DSC)
Se llevaron a cabo utilizando un equipo TGA-DSC marca Thermo a una velocidad de calentamiento de 10° C/min, en atmósfera de nitrógeno según la metodología descrita en estudios previos (Loganathan et al., 2017).
Análisis estadístico de datos
Los datos resultantes en el proceso de obtención de los biomateriales, el porcentaje y grado de N-acetilación de la quitina y quitosano fueron analizados por el test de comparación entre medias (ANOVA) con un nivel de confianza de 95 %. Mediante el software estadístico SPSS y Excel.
Resultados y discusión
Desengrasado de las crisálidas de Bombyx mori L. Híbrido Pílamo 1
El contenido de grasa retirado fue del 38.8±0.01 %. De las crisálidas desengrasadas y secas se extrajo la quitina, que correspondió al 1.86±0.02 %. El quitosano obtenido por derivatización corresponde al 93.97±1.05 % de transformación, que corresponde al 1.75±0.23 % de la crisálida desengrasada. Si bien el contenido de estos biomateriales es inferior a lo reportado para otros insectos e incluso otras razas de gusano de seda donde algunos logran alcanzar hasta 20 % de rendimiento (Miranda et al., 2016), este estudio permite hacer un acercamiento a un material poco estudiado, donde se deben mejorar las metodologías de extracción o implementar otras alternativas como los métodos de extracción enzimáticos. En la Figura 2 se observa el registro fotográfico de la quitina y el quitosano obtenidos en este estudio, que fueron similares en apariencia a los mismos biomateriales reportados en otros estudios (Battmpara et al., 2020; Paulino et al., 2006).
Caracterización de quitina y el quitosano de crisálida de Bombyx mori L.
Análisis infrarrojo (IR-TF)
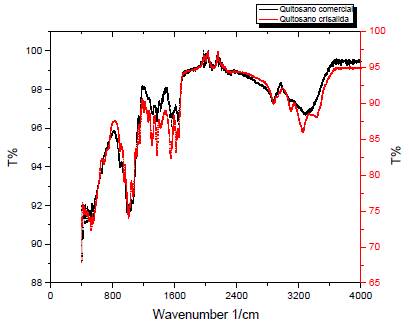
En la Figura 3 se presentan los espectros IR-TF, de la quitina comercial y la obtenida de la crisálida de Bombyx mori L. En el espectro IR-TF de la quitina comercial se observan las señales a 1618 cm-1 y 1655 cm-1 asociadas con al estiramiento de C-N y vibración C=O de la señal de amida I, lo que indica un estado amorfo. A 1545 cm-1 la señal correspondiente al estiramiento de N-H de la amina II, a 3256 cm-1 corresponde a los grupos NH2 y OH; la señal a 1306 cm-1 es atribuida a la deformación CO-NH y al grupo CH, (amida III), la señal a 1375 cm-1 corresponde a la deformación simétrica del grupo CH Todas las señales se encontraron en el espectro de 3a quitina de crisálida de Bombyx mori L., lo que confirma que el proceso implementado para la obtención fue efectivo; sin embargo, la quitina comercial, presenta señales de mayor intensidad, lo que podría atribuirse a la pureza de esta.
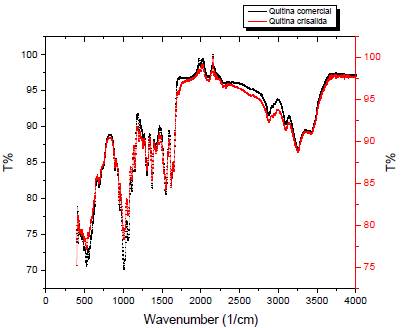
Figura 3 Espectros IR-TF de quitina comercial y obtenida de la crisálida de Bombyx mori L. Fuente: autores.
Los espectros IR-TF de quitosano comercial y el obtenido de Bombyx mori L. se muestran en la Figura 4. Para el comercial, la desacetilación se evidencia por la señal a 1590 cm-1 de mayor intensidad que la señal a 1654 cm-1 debido al aumento de grupos NH2. También se observa la señal a 3256 cm-1 dada por los grupos NH2 y OH, similar a la de quitina, aunque con mayor intensidad, lo que puede deberse al aumento de los grupos NH2 o la ganancia de humedad. En cuanto al espectro IR-TF del quitosano obtenido de Bombyx mori L. las señales observadas son similares a las señales de quitosano comercial. Estos resultados son similares a los obtenidos en otros estudios, en los que se evaluó la obtención de quitina de crisálida de gusano de seda de otras razas (Battampara et al., 2020; Huet et al., 2020; Paulino et al., 2006; Zhang et al., 2000).
Porcentaje y grado de N-acetilación de quitina y quitosano
Fue necesario realizar una deconvolución de las señales dada la baja resolución de estas (Figura 5), para esto su usó el software Origin Pro 9.1, con la correlación lineal. Se tomó la señal característica del grupo amida I ubicada a 1623 cm-1 (Figura 5a) y la banda de referencia del grupo hidroxilo a 3433 cm-1 (Figura 5b). La determinación del porcentaje de N-acetilación se realizó mediante la correlación del área de las bandas de vibración seleccionadas, usando las correlaciones expresadas en las ecuaciones 1 y 2 para quitina y quitosano respectivamente (Escobar et al., 2013).
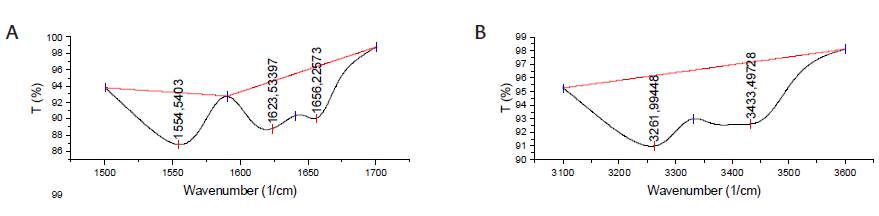
Figura 5. Gráficas de la Integración de las señales del espectro infrarrojo de quitina. Fuente: autores.
La evaluación del porcentaje de N-acetilación del quitosano (Oto) se realizó según la correlación lineal expresada en Ecuación 2. Para ello, se integraron las bandas características de la amida III localizada a 1306 cm-1 y como referencia se tomó la banda de grupos metilos a 1375 cm-1 (Figura 6), con uso del software Origin Pro 9.1
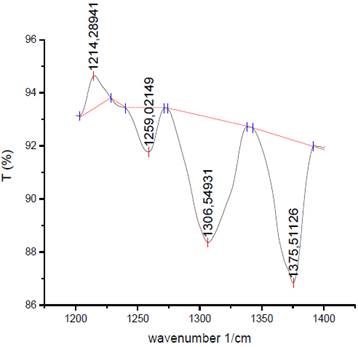
Figura 6 Gráfica de Integración de las señales del espectro infrarrojo de quitosano. Fuente: autores.
La determinación del grado de desacetilación (% DA) para quitina está dado por la Ecuación 3:
En la Tabla 1 se presentan los resultados obtenidos para los porcentajes de N-acetilación para quitina y quitosano y el grado de acetilación.
Tabla 1 Resultados de los porcentajes de N-acetilación para quitina (Q) y quitosano (Qto), y el grado de acetilación (%DA)

*Valores con letras diferentes dentro de la estadística a un nivel significancia del 5 %. misma fila indican diferencia
El porcentaje de desacetilación logrado para la quitina fue del 38.17±0.03 %, que corresponde a una quitina con alto grado de impurezas si se compara con reportes de otros autores (Battampara et al., 2020; Huet et al., 2020; Paulino et al., 2006; Zhang et al., 2000). Si bien estos resultados (p>0.05) no presentan diferencias significativas en el proceso de obtención, es necesario que en próximos estudios se realice un proceso de desmineralización y desproteinizacion más exhaustivo, con el fin de mejorar la pureza de la quitina.
En cuanto al grado de desacetilación del quitosano, según los cálculos realizados, fue del 87.63 %, el cual es similar a los resultados reportados por otros estudios (Battampara et al., 2020; Huet et al., 2020; Paulino et al., 2006; Zhang et al., 2000), lo que indica que el proceso de derivatización de la quitina implementado fue adecuado.
Microscopía electrónica de barrido (SEM) y análisis químico elemental de rayos x y energía dispersa (EDS)
El análisis SEM permitió obtener imágenes de alta resolución de las partículas de quitina y quitosano, tanto de los estándares comerciales, como de los obtenidos de Bombyx mori L. Se observan superficies cristalinas amorfas y de diferente tamaño tanto en los biomateriales comerciales, como en los obtenidos. Los biomateriales comerciales (Figura 7b, d, e) presentaron una morfología granular fibrosa, con tamaños entre 88-200 μm, mientras que la quitina y el quitosano obtenidos del gusano de seda presentaron una estructura escamosa continua en forma de hoja (Figura 7c, f.), lo que podría deberse a las características inherentes del material de partida, al método de extracción o al grado de desacetilación. Sin embargo, la diferencia morfológica de los biomateriales obtenidos es beneficiosa, ya que a partir de su fragmentación se puede lograr una mayor cantidad de material particulado. Estas diferencias morfológicas, coinciden con estudios de otros autores (Huet et al., 2020; Zhang et al.; 2000).

Figura 7 Micrografías de quitina (a, b quitina comercial; c, quitina de crisálida de Bombyx mori L.) y quitosano (d, e quitosano comercial; f, quitosano de crisálida). Fuente: autores.
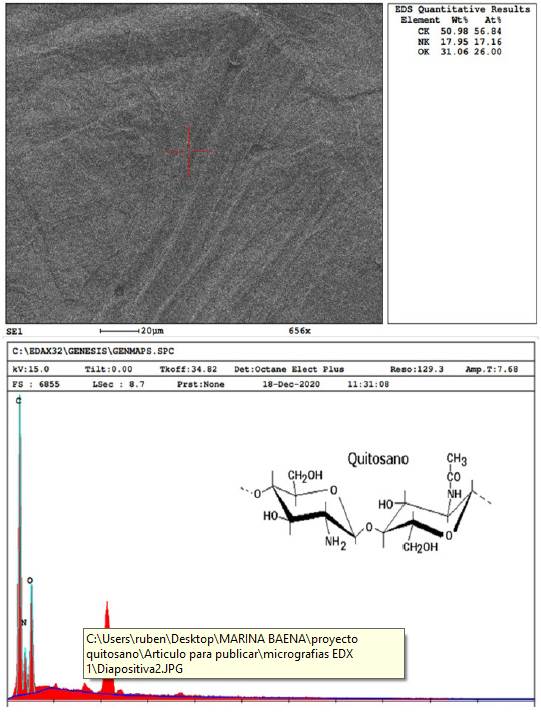
El análisis químico elemental de los biomateriales obtenidos se realizó mediante puntos de interés, a través de perfiles o mapas. En la Figura 8 se observa la ampliación microscópica para el análisis molecular elemental de la quitina obtenida a partir de la crisálida de gusano de seda, donde se encuentra en mayor abundancia el átomo de carbono 55.68 %, seguido de nitrógeno 12.39 % y oxigeno 25.91 %, lo cual coincide con la estructura química de la molécula de quitina. En menor proporción se encuentran los elementos de hierro y cloro que pueden deberse a residuales en el proceso de digestión de la crisálida.
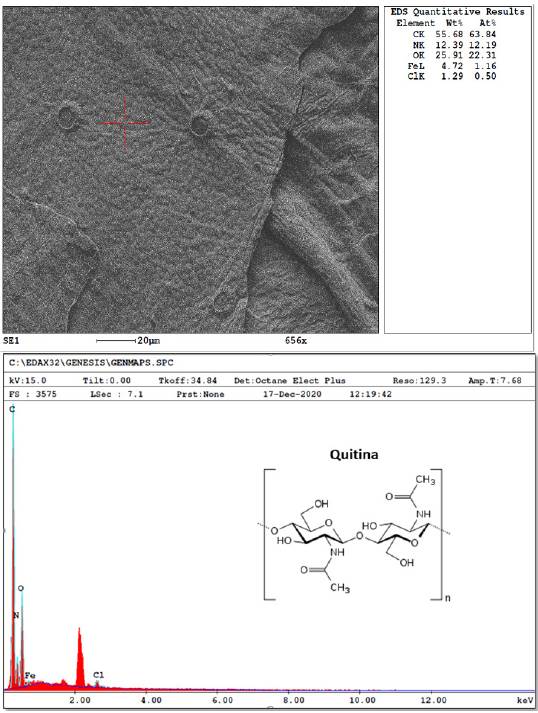
Figura 8 Análisis microscópico para de determinación de elementos principales en las moléculas y espectro de rayos x de energía dispersa (EDS) para quitina de crisálida de Bombyx mori L. Fuente: autores.
En la Figura 9 se observa el análisis micrográfico para las partículas de quitosano obtenidas a partir de quitina de crisálida. El contenido de carbono (50.98 %) disminuyó con relación al de quitina, mientras que los contenidos de nitrógeno (17.95 %) y oxigeno (31.06 %) aumentaron, lo que indica que efectivamente hay un proceso de desacetilación de la molécula de quitina, dando paso a su derivado.
Análisis térmico
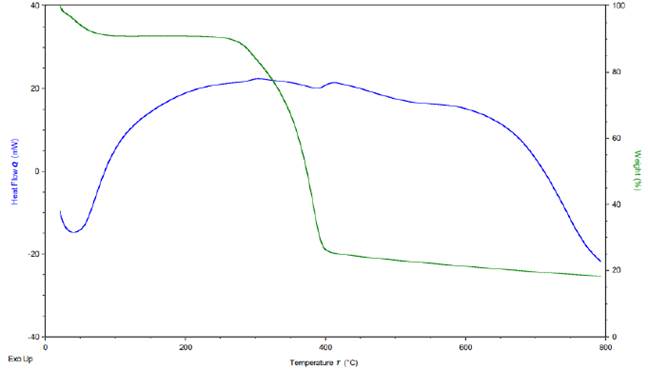
En las curvas calorimétricas de la quitina extraída de crisálidas de Bombyx mori L. (Figura 10) se observa un proceso de degradación simple, con dos puntos de descomposición similar a lo reportado en otros estudios (Battampara et al., 2020; Huet et al., 2020; Loganathan et al., 2017). La primera pérdida de masa se da entre 50-100° C atribuida a la pérdida de humedad, la cual es aproximadamente del 20 % de la masa total. La segunda pérdida de masa ocurre en el rango entre 250-400° C y puede ser atribuida a la degradación de la estructura molecular del monosacárido, incluida la deshidratación de este y la polimerización y descomposición de las unidades acetiladas y desacetiladas de quitina. El porcentaje residual después del calentamiento hasta 800° C fue aproximadamente del 20 %, el cual está por debajo de los reportado por otros estudios (Battampara et al., 2020; Huet et al., 2020; Loganathan et al., 2017); Esto podría deberse a las impurezas de la quitina obtenida.
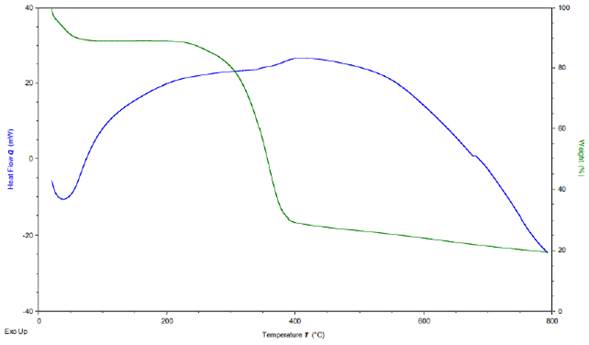
Figura 10 Análisis termogravimétrico (TGA) y de calorimetría diferencial de barrido (DSC) para quitina de crisálida de Bombyx mori L. Fuente: autores.
La curva de DSC obtenida para quitina de crisálida de Bombyx mori L. presenta una pérdida de calor entre 50-100° C que puede ser atribuida a la pérdida de agua. También se observa una ganancia de calor entre 100-250° C de 20 mW, la cual permanece medianamente fluctuante hasta 400° C, donde de nuevo se presenta una ganancia de calor entre 30-40 mW, logrando aproximadamente los 500° C. Esto se puede atribuir a un reacomodamiento estructural, finalmente a partir de los 550° C hasta los 800° C se observa la pérdida de energía hasta los -20 mW.
Según el análisis térmico de la quitina, la crisálida de Bombyx mori L. se puede decir que es un material altamente estable que presenta una degradación simple, lo que lo convierte en un biomaterial atractivo para investigación gracias a que su descomposición no genera gran cantidad de subproductos.
En la Figura 11 se observan las curvas calorimétricas para el quitosano obtenido mediante la derivatización de quitina de la crisálida de Bombyx mori L. La curva de TGA fue similar a la de quitina, pero con una leve deformación de la curva a los 350° C, lo que indicaría una posible desestabilización de la estructura molecular del quitosano. Por otro lado, el análisis DSC muestra que el material presenta una pérdida de calor entre 50-100° C por evaporación de agua. Desde los 100° C hasta los 250° C presenta una ganancia de calor hasta los 20 mW, sin embargo, en 400° C aproximadamente se presenta una pérdida de calor de alrededor de 5 mW, recuperándose hasta los 450° C, donde inicia una pérdida de calor paulatina que se intensifica entre 600-800° C. Esto indica que este biomaterial presenta una inestabilidad térmica que podría deberse a la degradación de parte de la molécula de quitina que fue desacetilada, tal como se sugiere en otros estudios relacionados (Battampara et al., 2020; Huet et al., 2020; Loganathan et al., 2017).
Conclusiones
Se logró obtener quitina y quitosano a partir de crisálidas desengrasadas de Bombyx mori L. Híbrido Pílamo 1, con características similares a los obtenidas por otros autores. Su estructura escamosa y amorfa facilita su manipulación y una posible pulverización. Sin embargo, es necesario continuar la investigación para mejorar los rendimientos y la pureza de los biomateriales obtenidos, así como de sus propiedades para llegar a establecer si es posible emplear al gusano de seda Híbrido Pílamo 1 procedente de Risaralda como una fuente promisoria para la obtención de quitina y quitosano.