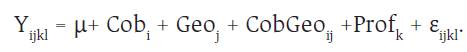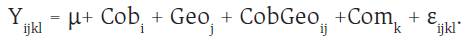Introducción
Los sistemas de ganadería bovina son considerados como emisores netos de gases efecto invernadero. Sin embargo, no todos los componentes de estos sistemas son emisores, los suelos de las pasturas de la ganadería son globalmente considerados como sumideros de carbono y ese carbono proviene principalmente de la biomasa de las plantas (Gavrilova et al., 2019; Hu et al., 2022). El suelo puede actuar como emisor o capturar carbono dependiendo de su manejo (Schrumpf et al., 2011) y de otros factores; en ocasiones, el sobrepastoreo, la baja producción de biomasa y otras prácticas inadecuadas, pueden exceder la capacidad del suelo para su recuperación (Wang et al., 2017; Medeiros et al., 2020). El carbono orgánico (C) del suelo influye en muchas de las propiedades químicas, físicas y biológicas que determinan la fertilidad, productividad y calidad (Post y Kwon, 2000) además de aumentar la capacidad de retención de agua y mejorar la productividad de las plantas (Wang et al., 2023); se considera que corresponde aproximadamente a las dos terceras partes de las reservas de C del suelo (Stockmann et al., 2013).
La dinámica del carbono orgánico del suelo y su respuesta al cambio de uso del suelo o al control climático, depende en gran medida de la profundidad del suelo (Balesdent et al., 2018). Sin embargo, a mayor profundidad, se reduce la dinámica de la descomposición del carbono que podría estar relacionada con varios procesos interactivos, como la disminución de la biomasa microbiana (Rumpel y Kogel-Knabner, 2011), la estabilización por los minerales del suelo (Mathieu et al., 2015) y el poco estímulo de la tasa de descomposición por el bajo suministro de carbono fresco a esas profundidades (Fontaine et al., 2007).
Muchos factores influencian la acumulación y el almacenamiento de C en los pastizales, especialmente factores bióticos como la intensidad del pastoreo, el tipo de animal y las especies de pastos (Conant et al., 2001; Murgueitio et al., 2014). La intensidad de pastoreo tiene el potencial de modificar la estructura, función y capacidad del suelo para almacenar C (Cui et al., 2005). Estos efectos están mediados por las condiciones climáticas, la cobertura del suelo, el suministro de materia orgánica y los procesos erosivos (Waters et al., 2017). El tipo de cobertura del suelo es un factor clave que influye en la emisión o captura de C por el suelo (Rivera et al., 2019). Los pastos C4 como el kikuyo, se adaptan a una alta intensidad de pastoreo al tener rizomas y otros órganos de almacenamiento que les permiten responder rápidamente a la defoliación (Dubeux et al., 2007). Además, los sistemas de raíces más profundos o extensos en algunos pastos como el híbrido Festulolium (ryegrass x festuca) tiene una mayor eficiencia en el uso de recursos, lo que podría mejorar el almacenamiento de C, la retención de agua y nutrientes y la oferta de biomasa (Humphreys et al., 2003; Kell, 2011). Los cambios en el uso y manejo del suelo alteran el equilibrio de la dinámica del C en los pastizales (Zhou et al., 2007); en general los cambios en diferentes atributos de la comunidad vegetal, como la riqueza de especies y la diversidad funcional, entre otros, influyen en las existencias de carbono en los ecosistemas vegetales (Restrepo et al., 2016; Magnano et al., 2023). Este trabajo tuvo como objetivo analizar las existencias de carbono en el suelo con pasto kikuyo por varios años y en suelos bajo cobertura de bosque y de helechal en fincas de producción de leche del norte de Antioquia. Asimismo, se evaluaron también las existencias de carbono de los diferentes compartimentos de las plantas bajo los diferentes usos del suelo.
Materiales y métodos
Zona de estudio
Se evaluaron cinco fincas ubicadas en los municipios de San Pedro de los Milagros, Bello y Belmira, en la zona norte del departamento de Antioquia, una de las regiones de lechería especializada más importantes de Colombia. Se incluyó un predio con cobertura de kikuyo de menos de 15 años ubicado en la vereda Alto Ingenio (coordenadas 6°26'39,4'' N; 75°31'59,8" O), San Pedro de los Milagros, un predio con cobertura de kikuyo entre 15 y 30 años ubicado en la vereda Cuartas Despiste (coordenadas 6°24'11,5'' N; 75°36'5,5'' O), Bello y un predio con cobertura de kikuyo de más de 30 años ubicado en la vereda Yarumo (coordenadas 6°23'11,4'' N; 75°36'51,5'' O) en Bello. El predio con cobertura de bosque se encuentra en la vereda Cerezales (coordenadas 6°24'40,6'' N; 75°34'7'' O) del municipio de San Pedro y el predio con cobertura predominante de helechal se encuentra en la vereda Salazar (coordenadas 6°33'42,1'' N; 75°36'46,5'' O) del municipio de Belmira.
Muestreo en campo
Se realizó un reconocimiento de las geoformas Relieve plano (Pn), Flanco cóncavo (Cc) y Flanco convexo (Cx). Se hicieron calicatas de un metro de ancho por un metro de profundidad en cada sitio seleccionado y se tomaron muestras de suelo a diferentes profundidades (0-20, 20-40, 40-60, 60-80 y 80-100 cm) para determinar densidad aparente y contenido de carbono. Para estimar la biomasa aérea se emplearon marcos de 0.5 x 0.5 m, muestreando en diferentes puntos representativos de la pastura. Para estimar la biomasa radicular se empleó un barreno para raíces de 70 cm de largo, un cilindro interior de 8 cm de diámetro y 25 cm de largo y terminaciones cortantes para recibir la muestra.
Determinaciones en el laboratorio
Para estimar la biomasa radicular, las raíces se separaron en raíces finas y raíces “gruesas” (denominadas así por provenir en su mayoría del desarrollo de los rizomas y los estolones de la planta) y luego se lavaron y secaron al horno a 60 °C hasta alcanzar peso constante. Las muestras se molieron utilizando un molino de cuchillas (Thomas Wiley®) y luego se pasaron por un tamiz de 0.5 mm. La biomasa aérea se midió para los compartimentos de hojas (H), tallos (T), biomasa muerta (BM) y estolones (Est) y se procesaron de forma similar a las raíces. La densidad aparente del suelo se determinó mediante el método del cilindro para cada una de las profundidades. El C orgánico total se determinó mediante la metodología de digestión por vía húmeda de Walkley y Black. El contenido de C orgánico del suelo por hectárea se calculó con base al contenido de C, la densidad aparente y el espesor de cada profundidad de muestreo.
Metodología estadística
Se empleó un diseño en bloques aleatorizados correspondientes al tipo de cobertura: cobertura de pasto kikuyo establecido hace menos de 15, pasto kikuyo establecido entre 15 y 30 y establecido hace más de 30 años (K15, K y K30, respectivamente), cobertura de bosque (B1) y cobertura de helechal (He). Los tratamientos estuvieron en arreglo factorial de tres geoformas (cóncavo Cc, convexo Cx y plano Pn) por cinco profundidades de muestreo (0-20, 20-40, 40-60, 60-80 y 80-100 cm). Se realizaron análisis de varianza para las variables: cantidad de C en el suelo y raíces finas y gruesas, tallos, hojas, estolones y biomasa muerta, densidad aparente y pH del suelo.
Para las variables C en el suelo y raíces, pH y densidad aparente se empleó el modelo:
Donde, (μ es el efecto promedio, Cob el efecto del tipo de cobertura (K15, K1530, K30, B y He), Geo es el efecto de la geoforma (Pn, Cc y Cx), Prof es el efecto de las profundidades (0-20, 20-40, 40-60, 60-80 y 80-100 cm) y e es el residuo.
Para la variable C en los compartimentos de las plantas, el modelo fue:
Donde Com es el efecto del compartimento (hojas, tallos, biomasa muerta y estolones).
Se midieron además la biomasa y el contenido de carbono de las plantas, excepto para la cobertura de bosque.
Resultados
Carbono en el suelo
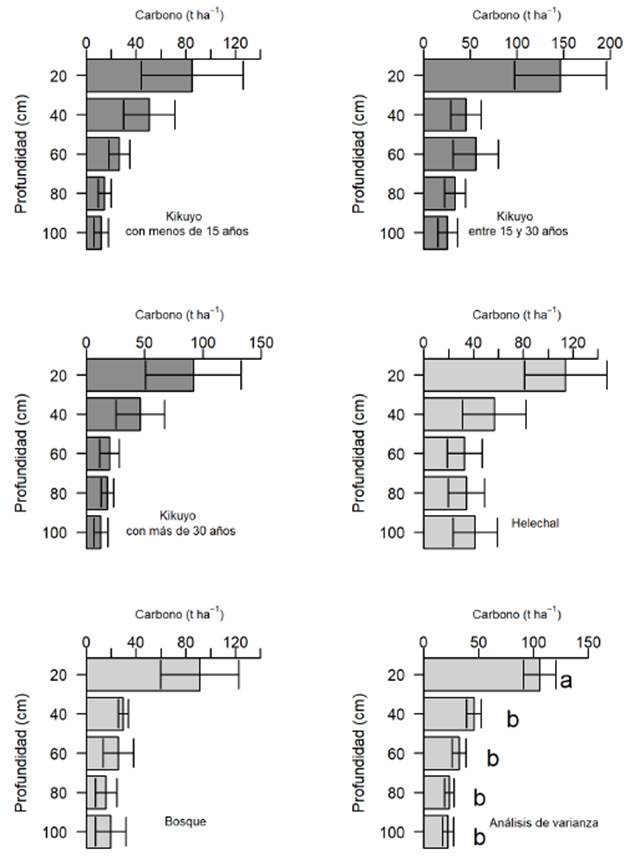
Hubo una disminución de las existencias de C orgánico a medida que aumentó la profundidad en el suelo (Figura 1). Las existencias de C en los primeros 0-20 cm de profundidad fueron de 100 t ha-1, mientras que a 80-100 cm de profundidad, fueron de solo 20 t ha-1 (P<0.05). El suelo bajo cobertura de kikuyo de diferentes edades de establecimiento sin tener en cuenta el tipo de relieve, presentó existencias de alrededor de 220 t ha-1 de C desde 0 cm y hasta los 100 cm de profundidad; y no se presentaron diferencias con las coberturas de bosque o de helechal.
Aporte de carbono por las raíces
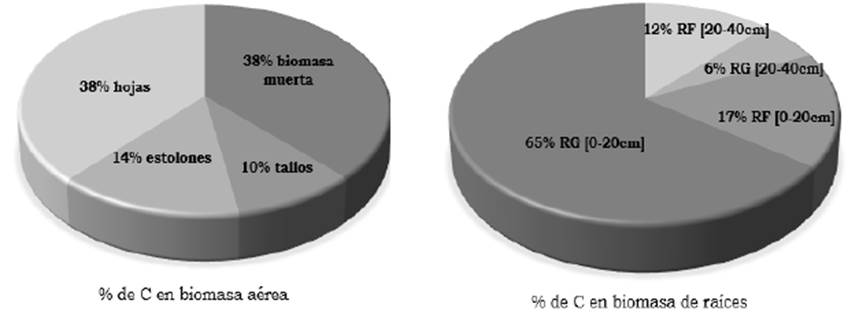
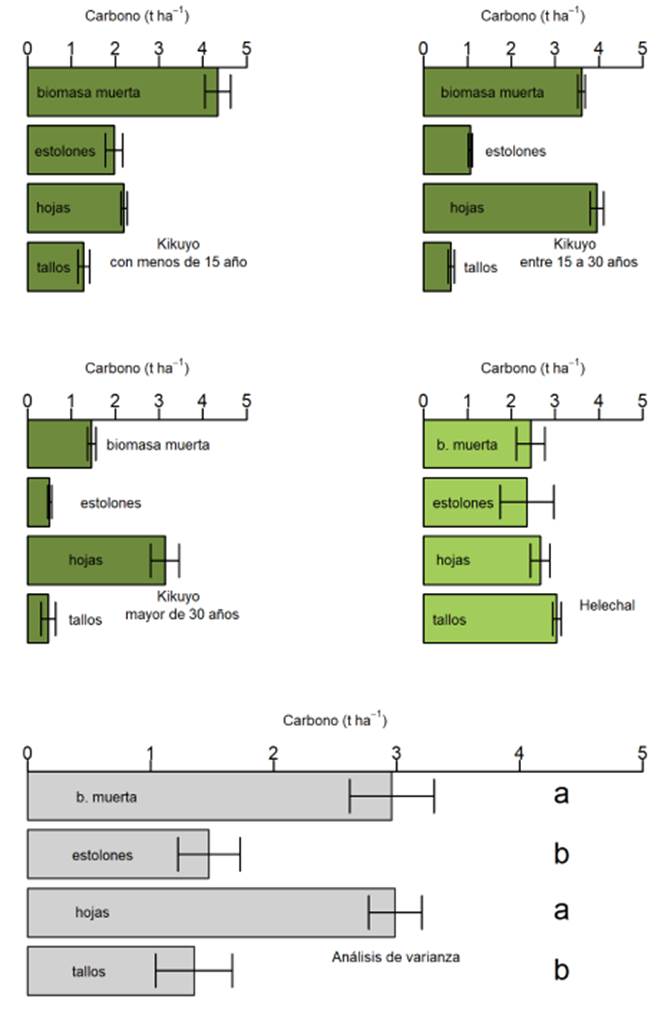
La mayoría de las raíces del pasto kikuyo tienden a ser finas. Sin embargo, frecuentemente se observaron raíces “gruesas”, así descritas por incluir tanto las provenientes de los rizomas como de los estolones, al no ser posible una separación física de las mismas. La distribución de raíces y su cantidad disminuyó al incrementarse la profundidad de muestreo en el suelo. El aporte estimado de C a partir de raíces finas fue de alrededor de 1.84 t ha-1 en los primeros 0-40 cm de profundidad del suelo, donde se observó la mayor presencia de raíces, especialmente en las praderas de pasto kikuyo. Hubo diferencia significativa en las existencias de carbono aportadas por las raíces a 0-20 y 20-40 cm de profundidad, siendo éstas de 1.8 y 0.45 t ha-1 respectivamente, independiente del tipo de cobertura evaluada (Figura 2). Bajo las condiciones evaluadas, el 70 % del C es aportado por las raíces “gruesas” (Figura 3).
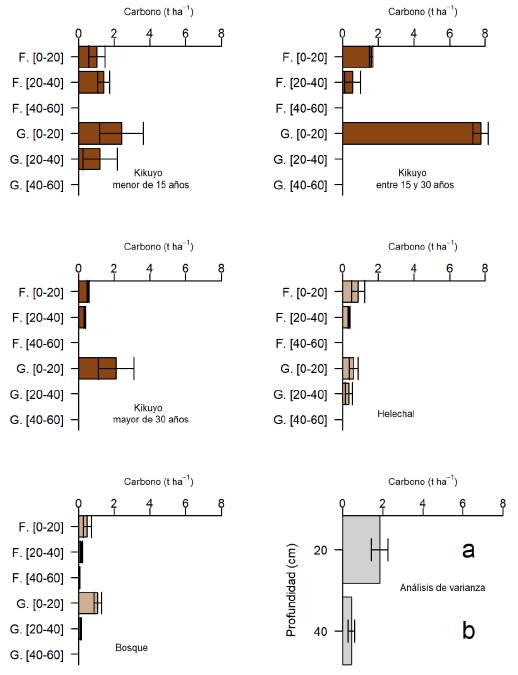
Figura 2 Carbono en la biomasa de raíces finas y gruesas a diferentes profundidades del suelo. F.: raíces finas, G.: raíces gruesas
Carbono en los compartimentos de las plantas.
Las mayores existencias de carbono en la biomasa aérea, se encontró en los compartimentos de hojas y biomasa muerta, cuyo aporte de carbono fue mayor al de estolones y tallos (P<0.05; Figura 4).
Cambios en densidad aparente y pH del suelo en el tiempo
La densidad aparente del suelo tendió a incrementar con la profundidad del perfil analizado, como sucede en la mayoría de los suelos por el efecto del peso de las capas superiores (Figura 5). Hubo diferencias significativas por efecto del relieve independiente del tipo de cobertura, encontrándose valores de 0.64 t m-3 para el relieve cóncavo, mientras que los valores para los relieves convexo y plano fueron de 1.03 y 1.06 t m-3, respectivamente. El suelo con pasturas de kikuyo por más de 30 años, mostró mayor pH con respecto a las demás coberturas evaluadas (Figura 5). Igualmente, los análisis físicoquímicos de los suelos a 0-20 cm de profundidad, también indicaron tendencias a cambios por el uso de pasturas de kikuyo con mayor contenido aparente de bases intercambiables y de algunos elementos menores (Tabla 1).
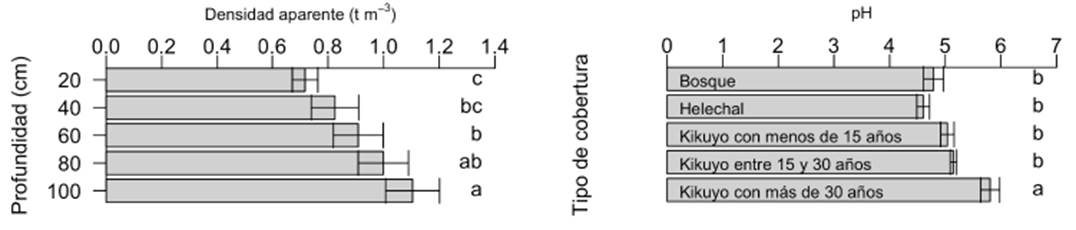
Figura 5 Cambios en los parámetros de suelo (a) densidad aparente de acuerdo con las diferentes profundidades de muestreo y (b) pH en los primeros 0-20 cm de suelo por efecto de la cobertura vegetal
Tabla 1 Análisis fisicoquímicos a 0-20 cm de profundidad de suelos bajo diferentes coberturas.
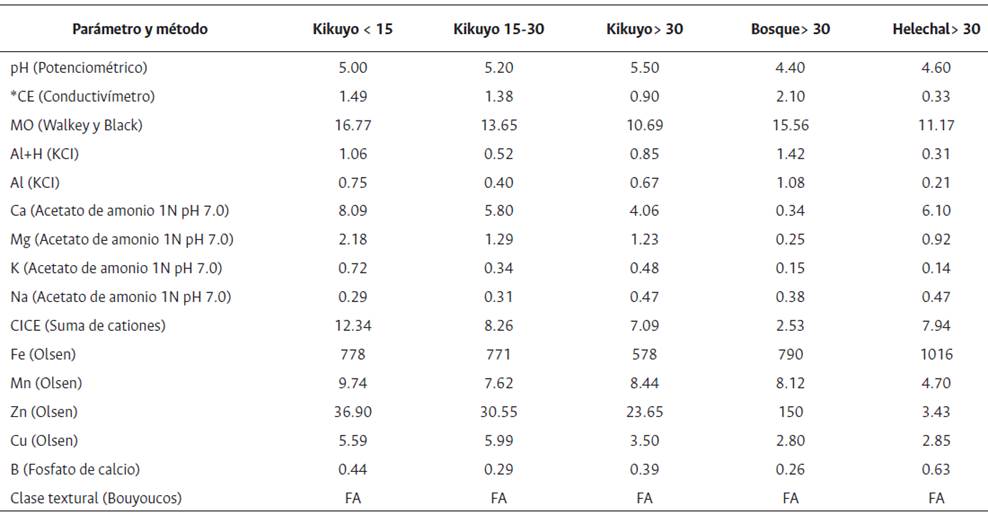
*Abreviaturas: CE = Conductividad eléctrica, MO = Materia Orgánica, Al+H Acidez intercambiable, Al = Aluminio intercambiable, Ca = Calcio intercambiable, Mg = Magnesio intercambiable, K = Potasio intercambiable, Na = Sodio disponible, CICE = Capacidad de Intercambio Catiónico Efectiva, Fe = Hierro disponible, Mn = Manganeso disponible, Zn= Zinc disponible, Cu = Cobre disponible, B = Boro disponible, FA= Franco-Arenoso, Olsen= Método Olsen modificado.
Discusión
Carbono en el suelo
En los primeros 0-20 cm de profundidad se encontró el 45 % de todas las existencias encontradas en los primeros 100 cm de suelo. Otros autores han reportado que los primeros 0-20 cm contienen hasta el 80 % de dicho C (Céspedes et al., 2012; Murgueitio et al., 2015); mientras otros reportes sugieren que cerca de la mitad del carbono orgánico del suelo se almacena en los primeros 30 cm de profundidad (Balesdent et al., 2018). Sin embargo, a esta profundidad el C orgánico se encuentra en constante descomposición y es más susceptible a factores externos (Robert, 2002) como la intensidad de pastoreo y la precipitación (Paruelo et al., 2010). La mayoría de los estudios solamente estiman el C en los primeros horizontes; aunque la captura de C a mayores profundidades es muy importante por considerarlo un C más estable (Fan et al., 2014); ya que los trabajos con marcadores para carbono han demostrado que la edad media del carbono a un metro de profundidad puede ser mayor a los mil años (Balesdent et al., 2018). Las existencias de C a mayores profundidades no presentaron diferencias significativas, como ha sido previamente reportado (Zhou et al., 2007), quizás porque a esta profundidad el almacenamiento de C es menos afectado por cambios de manejo (Fisher et al., 1994). Los pastizales cuyas raíces pueden penetrar más profundamente en el suelo, pueden contribuir a la captura de C a mayores profundidades en el suelo (Bojórquez et al., 2015), mejorando el almacenamiento de C, la retención de agua y nutrientes y los rendimientos de biomasa (Kell, 2011; Humphreys et al., 2003). Bajo las condiciones de este estudio, el cambio de uso del suelo a pasturas de kikuyo no presentó efectos significativos en las existencias de C entre 0 y 100 cm de profundidad (Figura 1), lo que indica que el establecimiento del pasto kikuyo no afecta las existencias de C del suelo en las condiciones analizadas. Otros autores, al comparar las coberturas de cultivos agrícolas, pasturas con árboles dispersos y bosques nativos, tampoco reportaron diferencias en las existencias de C orgánico del suelo (Rojas et al., 2018; Malepfane et al., 2022). Sin embargo, la cantidad de C orgánico del suelo se puede aumentar entre 20 y 100 % cuando se incorporan leguminosas arbóreas fijadoras de N2, ya que éstas promueven una mayor productividad de la pradera (Chará et al., 2017). Otros trabajos también en trópico alto en Colombia, pero en condiciones de páramo, reportaron disminuciones en el contenido de C por el cambio de uso del suelo de vegetación nativa a cultivo de papa (Montes-Pulido et al., 2017). El carbono orgánico del suelo es un indicador esencial de la salud del suelo y está vinculado a funciones importantes, incluida la mineralización de nutrientes, la estabilidad de los agregados, la transitabilidad, la permeabilidad al aire, la retención de agua, la infiltración y el control de inundaciones (Berryman et al., 2020).
Con respecto a la contribución general de carbono al suelo, de acuerdo con el tipo de cobertura; otros autores reportan que no hay diferencias en el carbono aportado por cobertura de pastos bajo diferentes manejos y cobertura de arbustos; pero sí reportan diferencias significativas en las pasturas con respecto a la cobertura de bosques (He et al., 2023).
Aporte de carbono por las raíces
En kikuyo, la mayor parte de raíces finas se encontraron en los primeros 0-40 cm del suelo, con un aporte de C de alrededor de 1.84 t ha-1. Las raíces finas presentan una tasa de degradación más rápida en el tiempo (Nair et al., 2009) que las gruesas. Las raíces aportan al suelo una gran cantidad de material orgánico y por ende de carbono, mediante material muerto y rizodeposición (Céspedes et al., 2012). Sin embargo, la tasa de crecimiento y el ciclo de renovación de las raíces son dos componentes importantes en las existencias de C y su medición permite entender el aporte de las raíces en el proceso de fijación de C de las pasturas (Rao et al., 2001). Trabajos en otras pasturas reportan la importancia de la presencia de las raíces finas al presentar cierta protección del carbono por otros mecanismos relacionados con la estabilización de los agregados del suelo y consideran que este proceso contribuye más a la estabilización del carbono en el sistema, que el aporte del carbono proveniente de la biomasa aérea de las pasturas (He et al., 2023), estos mismos autores reportan un aporte estimado de unas 0.6 t ha-1 de carbono por las raíces finas a solo 10 cm de profundidad, lo que indica el papel de estas raíces finas también en otras pasturas. Al evaluar el aporte de C por las raíces finas en Brachiaria brizantha,Rojas et al. (2009) reportaron un aporte promedio de 2.3 t ha-1 en los primeros 60 cm de profundidad en el suelo. El C almacenado a mayores profundidades es menor que en la superficie, pero es un C menos susceptible a cambios en el largo plazo (Watson, 2001; Robert, 2002; Piñeiro et al., 2006). Sin embargo, para el kikuyo no se encontraron aportes significativos a mayores profundidades. Estudios con pasturas de trópico bajo como Andropogon gayanus y Brachiaria humidicola, con sistemas radicales más profundos, son una opción para incrementar la acumulación de C en esos sistemas, porque pueden redistribuir el C en las capas más profundas del suelo donde es menos susceptible a la oxidación y a las pérdidas por el uso del suelo (Fisher et al., 1994; Murgueitio et al., 2015). El carbono aportado por las raíces “gruesas”, considerado un poco más estable, en este trabajo correspondió al 70 % del total aportado por las raíces y el restante 30% fue para las raíces finas desde la superficie del suelo y hasta 40 cm de profundidad (Figura 3). Otros estudios, también en trópico alto en Colombia, reportaron un aporte significativo de C al sistema por las raíces gruesas y finas del pasto kikuyo (Giraldo et al., 2008). En general, el carbono de la biomasa aérea de las pasturas sale del sistema, por su uso forrajero; mientras que el aporte del carbono de las pasturas al sistema está representado por la biomasa de las raíces (Basile-Doelsch et al., 2020).
Carbono en los compartimentos de las plantas analizadas
Las existencias de carbono en los compartimentos de hojas y biomasa muerta de la biomasa aérea fueron los de mayor aporte de C. Cabe anotar que el C de las hojas se pierde fácilmente porque corresponde a la parte consumible por el animal. Del C total aportado por la biomasa aérea, alrededor del 25 % (aportado por tallos y estolones) podría considerarse un poco más estable en el sistema (Figura 4). Ruyle et al. (1987), reportaron que la presencia y la altura de tallos residuales en Eragrostis lehmanniana Nees contribuyó a mayores tiempos entre las mordidas sucesivas de vacas en pastoreo, en comparación con las mordidas tomadas donde estos tallos se redujeron, lo que explica los mayores tiempos de permanencia de los colchones de forraje. El aporte de C por el compartimento de las raíces del pasto kikuyo, es muy significativo al sistema por ser una especie perenne, como lo indican otros autores que reportan la mayor contribución de las pasturas perennes por la rizodeposición de las raíces con respecto a las pasturas anuales (Attard et al., 2016).
Cambios en densidad aparente y pH del suelo en el tiempo
La densidad aparente del suelo tendió a incrementar con la profundidad del perfil (Figura 5); mientras que las existencias de carbono orgánico disminuyeron con la profundidad (Figura 1), como ha sido reportado previamente (Schrumpf et al., 2011; Conforti et al., 2016; Barros et al., 2015). Los incrementos en densidad aparente a medida que aumenta la profundidad del suelo también han sido reportados para pasturas perennes como el pasto elefante (Pennisetum purpureum Schumach.) con aumentos de hasta el 20% del valor a 20-40 cm de profundidad con respecto al valor encontrado de la densidad aparente en los primeros 10 cm de profundidad del suelo (de Lacerda et al., 2023). Esto puede deberse a la menor presencia de raíces a medida que aumenta la profundidad y por tanto hay una menor aireación del suelo y menor aporte de materia orgánica, similar a lo reportado por otros autores (García et al., 2022). El cambio observado en la densidad aparente por efecto de la geoforma también ha sido reportado (Wei et al., 2008) y corresponde a la mayor acumulación de materia orgánica que puede ocurrir en el relieve cóncavo, que contribuye a un suelo más orgánico y de menor densidad aparente. En este trabajo no hubo diferencias significativas en la densidad aparente del suelo por el cambio del uso del suelo a ganadería, lo cual es positivo ya que esta propiedad debe conservarse en el tiempo. En otros trabajos, en suelos invadidos por el pasto Urochloa decumbens, no se encontraron cambios significativos en los valores de la densidad aparente del suelo, lo cual podría estar asociado con la alta producción de raíces finas del pasto que promueven la aireación y proporcionan mejores condiciones para la descomposición por la biota del suelo (García et al., 2022), las cuales se pueden considerar algunas de las razones por las que no se encuentran efectos negativos en la densidad aparente del suelo por la presencia de algunas pasturas.
Con respecto al pH del suelo, en pasturas de kikuyo de más de 30 años, se encontraron valores de pH mayores que en las demás coberturas evaluadas (Figura 5). Lo mismo reportaron Montes-Pulido et al. (2017) para cambios de uso del suelo de vegetación natural a cultivo de papa en suelos andisoles de trópico alto en Colombia. También para varios cultivos con altas fertilizaciones en Brasil, reportan incrementos en los valores de pH en el tiempo (de Lacerda et al., 2023). El pH de los suelos tiende a ser una propiedad estable en el tiempo. Sin embargo, las actividades agrícolas como el riego, drenaje o la fertilización pueden alterar significativamente su valor (Huoyan et al., 2003). En nuestro trabajo, este aumento del pH por el uso de pasturas por más de 30 años puede deberse a las altas fertilizaciones del plan de manejo del pasto kikuyo en los sistemas de ganadería de leche especializada del norte de Antioquia. A 0-20 cm de profundidad, hubo mayor contenido aparente de bases intercambiables y de algunos elementos menores (Tabla 1), lo cual podría estar relacionado con las prácticas de manejo asociadas al uso ganadero, lo que incluye la fertilización continua del kikuyo por parte de los productores (Ruiz et al., 2019). Otro elemento para considerar en cuanto a los posibles incrementos de esos parámetros es el asociado con la excreción de nutrientes por parte de los animales, la cual es significativa en animales pastoreando en praderas de pasto kikuyo (Sossa et al., 2015). En animales recibiendo concentrado, como es el caso de las vacas lecheras, dicha excreción es una forma importante de importar nutrientes hacia la pastura. En suelos bajo diferentes coberturas se han encontrado correlaciones positivas entre la alta fertilidad del suelo, las existencias de carbono y las bases intercambiables (da Silva et al., 2022). En términos generales, la fertilización continua en las pasturas puede inducir cambios en algunas propiedades, como el posible incremento de las existencias de carbono en el suelo (Poeplau et al., 2018).
Conclusiones
Las mayores existencias de carbono (alrededor de 100 t ha-1) se encuentran en los primeros 0-20 cm del suelo y este contenido disminuye hasta alrededor de 20 t ha-1 a la profundidad 80-100 cm. A su vez, los compartimentos del pasto kikuyo correspondientes a hojas, biomasa muerta y raíces gruesas a 0-20 cm de profundidad son los que más aportan carbono al sistema. Las raíces de kikuyo hasta los 40 cm de profundidad aportan un carbono al suelo que podría ser más estable en el tiempo. En los suelos manejados bajo pastura de kikuyo se conservó la densidad aparente del suelo en el tiempo, lo cual es un indicador positivo sobre la conservación de la calidad de los suelos en sistemas ganaderos de lechería especializada. Bajo las condiciones de este estudio, el cambio de uso del suelo de bosque o de vegetación con predominancia de helecho hacia pasturas de kikuyo, no presenta cambios en las existencias de carbono desde los 0 cm hasta un metro de profundidad en el suelo.