Introducción
La explotación aurífera aluvial se caracteriza por el traslado de grandes cantidades de materiales y su acumulación en depósitos, lo cual crea huecos y escombreras que alteran la fisiografía de la zona y las características productivas del terreno; esto ocasiona problemas ambientales, ecológicos y paisajísticos (Cantero et al., 2015). Además, genera lodificación, contaminación fluvial, daños en la vegetación, pérdidas de suelos con su capa vegetal, desplazamiento de la fauna, cambios de la microbiota y de la flora del lugar (Alvarez-Berríos et al., 2016).
Por otra parte, se han investigado alternativas para mitigar los impactos negativos que genera la extracción aurífera (Valois-Cuesta y Martínez-Ruiz, 2017). Una de las alternativas más utilizadas es la siembra de plantas nativas del lugar perturbado y el restablecimiento de la vegetación del sotobosque mediante la plantación o la colocación directa de materiales del suelo superficial (Borisev et al., 2018) con el fin de mejorar la estructura del suelo, incrementar la disponibilidad de nutrientes, promover el crecimiento vegetal y reestablecer los ciclos biogeoquímicos (Macdonald et al., 2015).
Para mejorar el crecimiento y el establecimiento exitoso de plantas en suelos afectados por la minería aurífera aluvial, estas pueden ser inoculadas con microorganismos promotores del crecimiento vegetal o biofertilizantes (Daza y Osorio, 2011). El uso de estos mejora la fertilidad de estos suelos degradados incrementando la capacidad de retención de agua, creando su capa superficial y restableciendo las características fisicoquímicas, lo que le permite a las plantas adaptarse a los bajos niveles de nutrientes propios de estos ambientes deteriorados (Garbisu et al., 2007). Un ejemplo de una planta usada en los procesos de fitorremediación es la leguminosa Leucaena leucocephala (Borisev et al., 2018), debido a su capacidad de adaptarse y crecer rápidamente en suelos perturbados. Leucaena suele depender en gran medida de asociaciones con hongos micorrícico arbusculares (Martínez et al., 2019) y bacterias fijadoras de nitrógeno (Verman, 2016). La capacidad de establecer estas asociaciones le permite a esta planta adaptarse a diferentes ambientes, lo que ha incrementado el interés de utilizarla para rehabilitar sitios donde hubo explotación minera (Ferrari y Wall, 2004; Aguirre-Medina et al., 2018).
El objetivo de esta investigación fue evaluar el crecimiento y la adaptación de Leucaena leucocephala en suelos degradados por minería aurífera aluvial del municipio de Istmina, Chocó - Colombia, mediante la inoculación con microorganismos benéficos promotores del crecimiento vegetal Azospirillum brasilense, Rhizoglomus fasciculatum y Mortierella sp.
Materiales y métodos
Suelo
Las muestras se tomaron de una mina de explotación de oro aluvial recién abandonada, localizada en el municipio de Istmina, vereda Peradó (Lat: 5.178663 Long: -76.739744). La profundidad de muestreo fue de 0-25 cm (Moreno et al., 2016), posteriormente fueron enviadas al Laboratorio de Microbiología del Suelo de la Universidad Nacional de Colombia - Sede Medellín.
El suelo se secó al aire y se tamizó (4 mm) (Moreno et al., 2016), posteriormente se envió al Laboratorio Suelo Vital de la Universidad Católica de Oriente en Rionegro - Antioquia, para su análisis fisicoquímico; ello arrojó las siguientes características pH 4.6 (relación 1:2), materia orgánica 0.8 % (calcinación); P 4.66 mg/kg (Bray II); Al, Ca, Mg, Na y K intercambiables 0.32, 0.09, 0.08, 0.02 y N.D. cmolc Kg-1 (acetato de amonio); NO3 - 35.0, NH4+ 3.84 (potenciometría); Fe, Mn, Cu y Zn: 84.8, N.D, 1.9 y 0.6 mg/Kg (Olsen-EDTA); B 0.06 mg/kg (agua caliente).
El suelo se sirvió en bolsas plásticas de 12x12 cm con capacidad para 1 kg de suelo base seca. A cada bolsa se le adicionó 1 cm de materia orgánica proveniente de la vereda Peradó, ubicada en Istmina - Choco.
Material vegetal
Las semillas certificadas de Leucaena leucocephala fueron adquiridas en la empresa El Semillero S.A.S. Se escarificaron en ácido sulfúrico concentrado por 20 min, se lavaron con agua y posteriormente se dejaron germinar en cámara húmeda (Orozco- Cardona et al., 2010).
Inóculos microbianos
Los microorganismos fueron suministrados por la empresa Biofertilizar S.A.S. Azospirillum brasilense se mantuvo en medio OAB (Bashan y Holguin, 1993) en una concentración de 1x106 UFC/ml, y se usó una dosis 5 ml por planta; el hongo solubilizador de minerales (Mortierella sp.), se mantuvo en PDA en una concentración de 1x107 UFC/ml, se inocularon 5 ml por planta y el hongo micorrícico arbuscular Rhizoglomus fasciculatum fue suspendido en un suelo: se usó matriz de arena (3:1) y se aplicaron 30 g/kg de suelo con una concentración de 300 esporas/g de sustrato (Moreno et al., 2016).
Tratamientos
Los tratamientos se realizaron de la siguiente manera: (i) hongo micorrízico (HM), que contenía propágulos infecciosos de Rhizoglomus fasciculatum; (ii) microorganismo solubilizadores de minerales Mortierella sp. (MSM); (iii) inoculo con Azospirillum brasilense, bacteria promotora de crecimiento vegetal (PGPB, del inglés plant growth promotion bacteria); (iv) inoculación dual (HM + MSM); (v) inoculación dual (HM + PGPB); (vi) inoculación dual (MSM + PGPB); (vii) inoculación triple (HM + MSM + PGPB) y; (viii) control no inoculado. Se sembraron 2 semillas germinadas para cada uno de los tratamientos de Leucaena; transcurridos quince días se realizó un raleo dejando una sola plántula por bolsa. Se mantuvieron durante 110 días en el invernadero de la Universidad Nacional de Colombia - Sede Medellín bajo luz natural y temperatura entre 20 a 37° C (media 26° C). Las plantas se regaron a capacidad de campo con agua y solución Hoagland libre de P.
Variables
Al final del período de crecimiento se tomaron las medidas biométricas: altura de la planta (cm), masa seca aérea (MSA) (g) y masa seca radicular (MSR) (g) (secado en estufa a 60° C por 48 h).
Igualmente, se determinó el contenido de P foliar. Para tal fin se llevaron submuestras del tejido a una mufla (500° C, 4 h) y las cenizas obtenidas se disolvieron con HCl 1M. La concentración de P se midió por el método de azul de molibdato propuesto por Habte y Osorio (2001).
Por otro lado, se determinó la colonización micorrizal en raíces finas. Para esto se sometieron a aclaramiento con KOH (10 %) (Phillips y Hayman, 1970), luego se tiñeron con fucsina ácida 0.015 % (Kormanik et al., 1980) y posteriormente se midió la intensidad de colonización con el método del intercepto de cuadrícula de Giovannetti y Mosse (1980).
Diseño experimental
El diseño experimental fue completamente al azar con un arreglo factorial 2X2X2: 2: con o sin HM; 2: con o sin MSM y; 2: con o sin PGPB. Cada tratamiento consistió en la aplicación individual o combinada de los inóculos y se incluyó un control no inoculado. Cada tratamiento tuvo 10 réplicas.
Análisis de datos
La relación entre las variables se determinó mediante un análisis de varianza y para la separación de medias se empleó la prueba de rangos múltiples de Duncan. Ambas tuvieron un nivel de significancia (Valor p) <0.05. Estos análisis se realizaron con el software Statgraphics Centurion versión XVI.
Resultados y discusión
Después de 110 días de crecimiento de las plantas en el suelo de minería de aluvión inoculado con microorganismos benéficos, se procedió a cosechar el experimento.
En la Figura 1A se observa que las plántulas de L. leucocephala no presentaron diferencias estadísticamente significativas sobre la altura (cm) con relación a los diferentes tratamientos empleados. Los valores fluctuaron entre 12.45 a 14 cm. Un efecto similar se evidenció en los resultados de una investigación en la cual la inoculación de A. brasilense 8-INICA en la planta leguminosa Soya (Glycine max [L] Merr) no produjo cambios ni en la altura ni en la biomasa de las partes aéreas de la planta (Alberto-Casas et al., 2019).
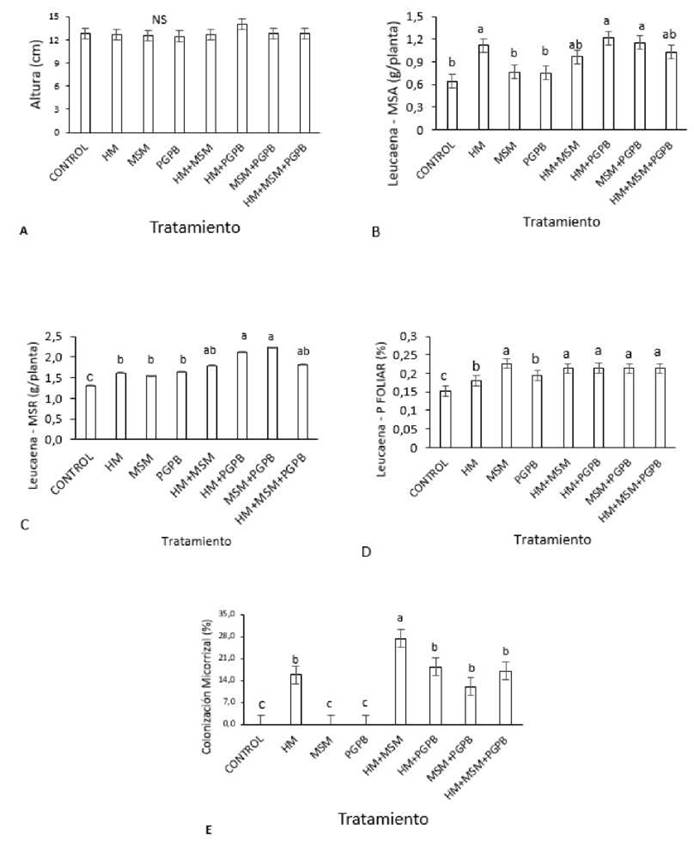
Figura 1 (A) Altura (cm), (B) MSA: masa seca aérea (g/planta), (C) MSR: masa seca radicular (g/planta), (D) concentración de fósforo foliar (%) y colonización micorrizal (%) de plántulas de Leucaena en función de los tratamientos con inoculación individual y combinada de un hongo micorrizal (HM) Rhizoglomus fascicuiatum, un microorganismo solubilizador de minerales (MSM) Mortiereiia sp., y una bacteria promotora de crecimiento vegetal (PGPB) Azospiriiium brasiiense. Cada columna representa el promedio de 10 repeticiones. Las barras representan el error estándar. Las columnas con letras minúsculas diferentes indican diferencias significativas según la prueba de rangos múltiples de Duncan (P<0.05).
A diferencia de los resultados obtenidos para altura, se observó un efecto estadísticamente significativo sobre la MSA de las plantas (Figura 1B). Las plantas no inoculadas tuvieron una MSA promedio de 0.640 g/planta, mientras que, al inocular con HM, HM+ PGPB y MSM + PGPB se produjo un incremento significativo alcanzando valores de 1.120, 1.214 y 1.154 g/planta, respectivamente. En otros estudios se evidenció también un incremento en el peso seco del tallo y de las hojas a partir de los 15 días de la siembra con la inoculación dual de Leucaena leucocephala con el hongo micorrícico Rhizophagus intraradices y con A. brasilense (Aguirre- Medina et al., 2015); en otro estudio se inoculó con el hongo micorrícico Rhizophagus intraradices (Aguirre-Medina et al., 2018) junto con G. fasciculatum en una investigación para suelos de uso agropecuario (Martínez et al., 2019).
Los otros tratamientos, como se observa en la Figura 1B, no tuvieron efecto significativo sobre esta variable, hecho que contrasta con un incremento en la masa seca aérea observado al inocular de manera individual Leucaena leucocephala con A. brasilense.
Las combinaciones HM+PGPB y MSM+PGPB muestran que los efectos interactivos sobre el crecimiento de la planta fueron mayores en comparación con los efectos individuales de PGPB y MSM. En ambos casos coincide la presencia de PGPB, que puede mejorar la captación de N2 y su transformación a amonio y aminoácidos p2a,ra beneficio del vegetal (Sangoquiza-Caiza et al., 2019). Los hongos en estas combinaciones pueden estar ayudando a suplir P y otros nutrientes de baja movilidad, que son transportados a la parte aérea y en interacción con la radiación solar inducen la fotosíntesis, respiración, transpiración y transporte de productos fotoasimilados, que se traducen en una mayor producción de biomasa (Aguirre-Medina et al., 2015). Por otro lado, la fijación biológica de nitrógeno requiere de una alta cantidad de P (Ferrari y Wall, 2004) que puede ser obtenido a través de la asociación micorrizal (Aguirre-Medina et al., 2018) o de una disolución de compuestos de P insolubles por la acción de microorganismos edáficos como los solubilizadores de P (Beltrán-Pineda, 2014).
Como se ilustra en la Figura 1C, todos los tratamientos inoculados tuvieron un efecto significativo sobre la MSR de Leucaena. Las plantas control presentaron un valor medio de 1.311 g/ planta, lo que contrasta con los obtenidos en las inoculaciones individuales, con promedios entre 1.547 a 1.794 g. Las inoculaciones duales alcanzaron los mejores valores de MSR, MSM + PGPB y HM+ PGPB (2.233 y 2.122 g/plantas) y mostraron un incremento de 61.9 - 70.3 % respectivamente. La inoculación con los tres microrganismos no mejoró lo alcanzado con las inoculaciones duales. Este efecto es similar al encontrado en la inoculación en soya (Glycine max [L] Merr) con Azospirillum brasilense, que incrementó la biomasa radical en un 61.8 % con respecto al control (Alberto-Casas et al., 2019).
La mayor promoción de crecimiento radical se dio en dos de los tratamientos que incluían A. brasilense; esta es una de las bacterias más empleadas para promover el crecimiento de plantas de interés agrícola, forestal y ambiental (Steenhoudt y Vanderleyden, 2000). Sus mecanismos de acción están asociados a la fijación asimbiótica de nitrógeno atmosférico, a la solubilización de fosfatos (Pérez Pérez et al., 2019) y a la producción de fitohormonas (Aguirre-Medina et al., 2015) que modifican la morfología y generan un mejor desarrollo radicular, como el obtenido en este estudio. Normalmente, la promoción en el sistema radicular consiste en aumentar el número y longitud de pelos radicales responsables de la absorción de nutrientes, particularmente de aquellos de baja movilidad, como el P (Gupta et al., 2015).
En relación con la concentración de fósforo foliar (Figura 1D), las plantas control presentaron un porcentaje en las hojas de 0.152 %. Las inoculaciones con los microorganismos tuvieron un efecto significativo sobre esta variable: al inocular individualmente con HA se alcanzó un valor de 0.18 %, con PGPB 0.19 % sin diferencias significativa entre ellos; la inoculación con MSM, las duales y la inoculación triple presentaron los mejores valores de P foliar en la planta sin diferencia significativa entre ellos, con un valor promedio de 0.21 %, lo que equivale a un aumento del 38.2 % con respecto al control. Este resultado es similar al obtenido en un estudio en el cual la inoculación de L. leucocephala con G. fasciculatum incrementó significativamente el contenido de P foliar en comparación con los tratamiento no inoculados (Martínez et al., 2019). Otros estudios realizados en Acacia farnesiana y Prosopis glandulosa inoculadas con Glomus spp. Zac-19 evidenciaron también un incremento significativo, con relación al control no inoculado, en el contenido de P foliar de 0.52 % y 0.34 %, respectivamente(Hernández-Martínez et al., 2006).
Los resultados en relación con la concentración de fósforo foliar muestran que la inoculación de Leucaena permitió una mayor acumulación de este elemento en las hojas, posiblemente por la capacidad de estos microorganismos de solubilizar fósforo insoluble presente en el material de depósito utilizado (4.7 mg/kg), haciéndolo disponible para la plántula y absorbiéndolo en el caso de los HM.
Por otro lado, el hongo Mortierella sp. ha sido reportado como promotor de crecimiento de varias especies vegetales en diferentes suelos (Ozimek et al., 2017). El mecanismo está asociado a la producción de ácidos orgánicos que solubilizan minerales nativos del suelo o aplicados a este (Ramírez Gil et al., 2013; Osorno et al., 2018). En suelos con baja fijación de fósforo, como el estudiado (entisol) la actividad individual del MSM puede promover la absorción de P y el crecimiento de las plantas al estar combinado con otros microorganismos. En otros suelos con mayor fijación de P puede requerir la presencia de HM para que absorban el H2PO4 - producto de su disolución (Osorio y Habte, 2013; Osorio et al., 2017).
Los tratamientos tuvieron efectos significativos sobre el porcentaje de colonización micorrizal en las plántulas de Leucaena (Figura 1E). Las raíces de las plántulas control, MSM y PGPB no presentaron asociación micorrizal (0 %), mientras que con las inoculaciones HM, HM+PGPB, MSM+PGPB y HM+MSM+PGPB presentaron un incremento de 15.8 %, 18.4 %, 12.0 % y 17.0 %, respectivamente. Sin embargo, con la inoculación dual HM+MSM se incrementó a 27.4%, lo cual es superior significativamente con respecto a los otros tratamientos.
La presencia del hongo micorrícico fue detectada tanto en el tratamiento individual, como en los tratamientos combinados e inclusive en uno de los tratamientos no inoculados; esto posiblemente se debió a que el suelo, al no ser esterilizado, pudo contener esporas de HA de forma natural. El mayor porcentaje se observó en el tratamiento HM + MSM, lo que no sorprende debido a que varios estudios han demostrado que diferentes hongos solubilizadores pueden modificar, por medio de sus exudados, parámetros preinfectivos como la longitud hifal de esporas germinadas y el número de ramificaciones hifales. Este aumento en el crecimiento micelial pre- infectivo y/o en el número de ápices hifales permite una mayor infección radical, ya que incrementa la posibilidad de contacto entre una mayor cantidad de ápices de HMA y las raíces influyendo positivamente en el transporte de nutrientes (Mónica et al., 2018).
En el tratamiento HM+PGPB también se evidenció colonización micorrizal, aunque en menor porcentaje; estudios han demostrado que Azospirillum sp. es importante en la regulación y formación de la asociación simbiótica mutualista planta - HMA, y actualmente es considerada una bacteria que ayuda a la simbiosis; ello se puede corroborar con la investigación realizada en Gmelina arborea, en la que se evaluó el efecto de la inoculación de Azospirillum brasilense y Glomus sp. logrando una colonización superior al 50 % (Zambrano y Díaz, 2008). También se ha documentado que al inocular Azospirillum sp. se incrementan la actividad nitrogenasa y la captación de agua y nutrientes en las plantas (Alberto-Casas et al., 2019). Azospirillum brasilense incrementó la colonización micorrizal al ser inoculado junto con el hongo micorrícico Rhizoglomus irregularis en Tithonia diversifolia (Hemsl.) y en Brachiaria hybrid cv. Mulato II, debido al efecto positivo que ejercieron las fitohormonas producidas por esta bacteria, las cuales incrementaron los sitios de colonización y multiplicación de las estructuras micorrícicas (Méndez-Bonet et al., 2022; González-Cañizares et al., 2020). Zuleta-Rodríguez et al. (2019) en una investigación realizada en cultivo de maíz, también observaron que la inoculación dual de hongos micorrícicos arbusculares y A. brasilense favoreció la colonización radicular.
El desarrollo de colonización radical en el tratamiento MSM+PGPB se dio probablemente por la presencia de otros hongos micorrízicos nativos del suelo, que al estar bajo la influencia de Mortierella sp. y A. brasilenses se les facilitó la penetración y posterior colonización de la raíz. Este hecho explicaría por qué en el tratamiento control los hongos nativos no colonizaron la raíz de Leucaena (Zambrano y Díaz, 2008). La distribución de hongos arbusculares en ecosistemas estresados fue reportada en suelos de minas de carbón, calcita, lignita y suelos contaminados con metales pesados (Sadhana, 2014).
El uso de plantas asociadas con microorganismos benéficos es de interés biotecnológico para el crecimiento y adaptación de vegetación en suelos contaminados con metales pesados, como los suelos afectados por la minería aurífera aluvial (de Fátima Pedroso et al., 2018). Estos microorganismos cumplen funciones de adaptación, biorremediación y promoción vegetal. Por ejemplo, los hongos micorrícicos arbusculares forman asociaciones con las raíces de la mayoría de plantas, incluida Leucaena (Wang, 2017), y mejoran su capacidad para absorber agua y nutrientes, particularmente aquellos de baja movilidad, pueden promover la salud vegetal mediante la inducción de resistencia sistémica frente a patógenos (Aguirre-Medina et al., 2018) y son usados en procesos de biorremediación de suelos contaminados por metales pesados (Upadhyaya et al., 2010). En este último aspecto, existen controversias en la comunidad científica, ya que para algunos autores las micorrizas arbusculares no ejercen influencia en la captura de metales pesados por parte de las plantas, y para otros autores, estas incrementan la concentración de dichos metales en los tejidos de las plantas micorrizadas (Brunetti et al., 2018).
Muchos hongos exhiben capacidad solubilizadora y, aunque las bacterias han recibido mayor atención al respecto, los hongos son más efectivos solubilizando fósforo inorgánico (Kucey, 1983). Mortierella sp. ha sido citado en la literatura científica como solubilizador debido a que mejora la eficiencia de la fertilización fosfórica y aumenta la solubilización y la desorción de P (Ramírez-Gil et al., 2013; Osorno et al., 2017; Osorno et al., 2018).
Las bacterias promotoras del crecimiento vegetal pertenecen a un mismo grupo funcional, las cuales, al ser inoculadas directamente sobre las semillas, raíces y hojas, aportan efectos positivos en el crecimiento y desarrollo de una planta (Bashan, 1998). Estos microorganismos pueden estimular el crecimiento vegetal directa e indirectamente. Los mecanismos directos incluyen la fijación biológica de nitrógeno atmosférico, la producción de sideróforos, la secreción de fitohormonas y enzimas, la solubilización de minerales como el fósforo y la inducción de resistencia sistemática (Santoyo et al., 2016). Asimismo, A. brasilense es una bacteria promotora de crecimiento vegetal capaz de crecer de manera endófita en plantas de soya formando microcolonias entre los espacios intercelulares, por lo que se constituye en una buena candidata para la inoculación de plantas leguminosas (Alberto-Casas et al., 2019).
Conclusiones
En el suelo de minería de aluvión Leucaena leucocephala presentó una buena adaptación y una promoción en el crecimiento con las inoculaciones con hogos micorricico arbusculaes, solubilizadores de fósforo y bacterias promotoras decrecimiento vegetal debido a que estos microorganismos tienden a asociarse eficientemente, incrementando así la captación de nutrientes en las plántulas y generando un mayor crecimiento de la parte aérea y radical, lo cual conlleva una alta productividad en el cultivo.
Se observó que al inocular las plántulas de Leucaena con micorrizas arbusculares, hongos solubilizadores y bacterias promotoras de crecimiento en consorcio, estos microorganismos pueden actuar sinérgicamente mejorando la concentración de fósforo foliar y la cantidad de fósforo absorbido. Por lo tanto, el uso de estos consorcios microbianos representa una estrategia biotecnológica para la producción en invernadero de plántulas de Leucaena leucocephala que puedan ser utilizadas en programas de reforestación de suelos degradados de minería de aluvión.














