Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
versão impressa ISSN 0120-2952
Rev. Med. Vet. Zoot. v.58 n.3 Bogotá set./dez. 2011
CAMBIOS EN LA ACTIVIDAD ENZIMÁTICA EN DUODENO Y YEYUNO
DE CERDOS DURANTE VARIOS PERIODOS POSDESTETE
CHANGES IN THE ENZYMATIC ACTIVITY IN DUODENUM AND JEJUNUM
OF PIGS DURING SEVERAL POSTWEANING PERIODS
D. Ospina1, J. Ciro1, Y. Román2, C. Peláez2, A. López1, J. Parra1*
1 Grupo BIOGEM (Biodiversidad y Genética Molecular), Maestría en Ciencias Agrarias,
Universidad Nacional de Colombia, Medellín (Colombia).
2 Grupo GIEM (Grupo Interdisciplinario de Estudios Moleculares), Maestría en Química,
Universidad de Antioquia, Medellín (Colombia).
*Autor para correspondencia: jeparrasu@unalmed.edu.co
Artículo recibido: 14 de octubre de 2011; aprobado: 22 de noviembre de 2011
RESUMENObjetivos: evaluar los cambios en la actividad enzimática intestinal de algunos cerdos durante varios periodos posdestete. Materiales y métodos: el trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, sede Medellín. El estudio se realizó con 16 cerdos destetados a los 21 días de edad. Los animales experimentales fueron alimentados durante 10 días con una dieta basal (DB) que tuvo como componentes leche y algunos de sus derivados y que además cumplía con los requerimientos nutricionales. Luego, los cerdos fueron sacrificados escalonada-mente los días uno, cinco, siete y diez posdestete, y se realizó extracción completa del intestino delgado, el cual fue dividido en dos secciones (duodeno y yeyuno) de igual tamaño. El análisis de la actividad enzimática (APN, DPP-IV, LPH, MGA y SI) se realizó mediante el método de velocidades iniciales y el diseño estadístico que se empleó fue completamente al azar, no obstante, los datos se analizaron mediante la aplicación de los modelos lineales generales (GLM) y de la prueba de duncan. Resultados: se evidencia que las enzimas presentaron diferencias (P < 0,01) durante los periodos posdestete. En el día cinco se observaron cambios negativos en todas las enzimas en comparación con su estado durante el primer día posdestete; sin embargo, entre el día uno y diez posdestete se presentaron diferencias entre APN, DPP-IV y LPH (P < 0,01). Además, se encontró que la sección proximal (duodeno) presentó las mayores actividades enzimáticas (P < 0,01). Conclusiones: el destete temprano disminuye la actividad enzimática a nivel intestinal, provocando la subutilización de los nutrientes de la dieta y, por ende, alta incidencia de diarreas durante esta etapa.
Palabras clave: destete, digestión, intestino delgado.
ABSTRACTObjective: To evaluate changes in the enzymatic intestinal activity of pigs during several post-weaning periods. Materials and Methods: the experiment was conducted in San Pablo Production Center of the Universidad Nacional de Colombia (Medellín). Were used 16 weaned pigs at 21 days of age. Animals were fed for 10 days with a basal diet of milk and some of its derivatives, and that also fulfilled all the nutritionals minimums. Pigs were sequentially slaughtered on days one, five, seven, and 10 days after weaning and a complete extraction of small intestine was realized, and divided in two equal size sections (duodenum and jejunum). Enzymatical activity analysis (ApN, DpP-IV, LPH, MgA, SI) was performed using the initial rates method. The statistical design used was completely at random. Results: There were statistical differences for each of the enzymes under study (P<0.01). On day five negative changes were observed in all enzymes compared to their state during the first post-weaning day; however, between one and 10 post-weaning days there were significant differences in ApN, DpP-IV, LPH (P<0.01). The proximal section (duodenum) (P <0.01) showed the highest enzymatic activities. Conclusions: The early weaning causes the decrease of enzymatic activity at intestinal level, and the under-use of the nutrients, and therefore, high incidence of post-weaning diarrhea.
Key words: digestion, small intestine, weaning.
INTRODUCCIÓN
En los países de mayor producción de cerdos, los lechones son destetados entre los 14-28 días de edad (Marion et ál. 2002). Como resultado, al momento del destete los lechones son más livianos y su sistema digestivo está menos desarrollado, especialmente el intestino, lo que los hace más susceptibles a problemas digestivos en el periodo posdestete (Reis de Souza et ál. 2007).
El destete es el periodo más crítico durante la vida del cerdo, debido a que el sistema digestivo debe estar adaptado a una dieta sólida al momento del destete, y de esta forma evitar la aparición de desórdenes intestinales, infecciones y diarreas. Por tal motivo, el efecto inmediato del destete es la dramática reducción en el consumo de alimento y los procesos digestivos (Lallès et ál. 2004; Reis de Souza y Mariscal 2005) y el aumento de episodios diarreicos (Pluske et ál. 1997; Wang et ál. 2006).
Algunos autores han reportado que la nutrición enteral después del destete previene la atrofia de las vellosidades y las diarreas, debido a que se promueve la maduración digestiva del cerdo, representada por los cambios en la expresión y actividad de las enzimas secretadas por la membrana de borde en cepillo (Sangild et ál. 2002).
Cuando el lechón está en etapa de lactancia, las bacterias dominantes en estómago e intestino delgado suelen ser lactobacilos y estreptococos (Easter 1995) -ambas especies bien adaptadas al sustrato lácteo disponible-, mientras que la microbiota que se desarrolla en el intestino grueso está constituida por una extensa y variada selección de bacterias patógenas (Radecki y Yokohama 1991). Tras el destete, se produce un periodo breve de ayuno y de adaptación a una nueva ración sólida, induciendo la mortalidad de lactobacilos y estreptococos, por la disminución en la disponibilidad del sustrato específico (lactosa) en el tracto gastrointestinal. Al desaparecer estas bacterias, se produce la proliferación de la población de E. coli, la cual al ir aumentando y cumpliendo su ciclo vital, libera desde sus paredes productos proinflamatorios como el lipopolisacárido (LPS).
El LPS es un patrón molecular asociado a patógenos (PAMP) que es reconocido por cualquier hospedero mamífero como una entidad patogénica importante. Este LPS induce cambios importantes en la estructura intestinal, que conllevan a la interrupción en su capacidad funcional, cuya recuperación eficiente y apropiada puede llevar varias semanas (Amador et ál. 2007; Pluske et ál. 1997; Van Beers-Schreurs 1996). Aunado a esto, el cerdo recién destetado está sujeto a diferentes tipos de estrés causados por la separación abrupta de la madre, la reubicación en nuevos grupos sociales y el cambio a un alimento sólido (Kojima et ál. 2007).
Por lo anterior, el objetivo de este trabajo es evaluar los efectos del destete temprano sobre la actividad de las enzimas intestinales de la membrana de borde en cepillo (disacaridasas y aminopeptidasas) en cerdos durante varios periodos posdestete.
MATERIALES Y MÉTODOS
Consideraciones éticas
Todos los procedimientos experimentales se realizaron de acuerdo con la guía propuesta por el Cioms (Council for International Organizations of Medical Sciences) sobre la investigación biomédica con animales (1985). Además, el Comité de Ética en Investigación de la Universidad Nacional de Colombia, sede Medellín, avaló la investigación (CEMED 001 de 26 de enero de 2009).
LocalizaciónEl trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, sede Medellín, ubicado en el municipio de Rionegro, paraje "El Tablacito", localizado a 2100 msnm, con una temperatura entre 12 y 18ºC, correspondiendo a una zona de vida bosque muy húmedo montano bajo (bmh-MB).
AnimalesSe seleccionaron 16 cerdos resultado del cruce alterno Duroc x Landrace, destetados exactamente a los 21 días de edad, con un peso de 6,5 ± 0,5 kg. Estos lechones se alojaron en jaulas provistas de comedero de canoa, las cuales se ubicaron en un cuarto con temperatura controlada a 26 ± 3°C. Durante la lactancia no se suministró alimento sólido a los lechones, no obstante dispusieron de agua a voluntad durante todo el experimento.
DietasLa DB que se ofreció a los animales tuvo como componentes leche y algunos de sus derivados y además fue enriquecida con vitaminas, minerales y lisina HCl. Como muestra la tabla 1, la dieta se balanceó de tal manera que cumpliera con todos los mínimos nutricionales requeridos y propuestos por el NRC (National Research Council) (1998). La cantidad de alimento que se ofreció por jaula fue de 300 g/día; sin embargo, se suministró alimento adicional cuando los animales lo requirieron (si se observaba que tenía capacidad y necesidad de consumir más alimento). Las dietas experimentales se proporcionaron desde el día 1 al 10 pos-destete.
Toma de muestras de tejido intestinalDurante la fase experimental se sacrificaron 16 cerdos de la siguiente forma: el día inicial, o día 1 (día del destete), se sacrificaron cuatro animales, que representaron el grupo de referencia para verificar el estado general de salud y realizar la evaluación ron cuatro cerdos, respectivamente. Todos macroscópica del estado de los órganos los animales fueron sacrificados 2,5 horas de los animales experimentales. Los días después de su última comida; primero cinco, siete y diez posdestete se sacrifica-se sedaron por inhalación de dióxido de carbono durante 3 minutos, y luego se sacrificaron por exanguinación, mediante sección de la vena yugular. Después del sacrificio, los cerdos se colocaron en posición decúbito dorsal, se incidió la región abdominal y se extrajo completamente el intestino delgado desde la unión pilórica hasta la válvula ileocecal (Segalés y Domingo 2003). El intestino fue alineado y medido sin ningún tipo de tensión sobre una mesa. Posteriormente, este se dividió en dos regiones (duodeno y yeyuno) de igual tamaño, y se tomaron 20 cm del centro de cada segmento. Una vez cortadas las porciones, la digesta contenida en cada una de ellas se removió mediante lavado por infusión con solución salina fría. (Makkink y Berntsen 1994; Reis de Souza et ál. 2005). Luego, se obtuvieron varias submuestras (1 cm) de cada segmento y la mucosa de los segmentos intestinales se separó mediante raspado con un portaobjetos. Las muestras para análisis de actividad enzimática (mucosa intestinal) se congelaron inmediatamente con nitrógeno líquido y, posteriormente, se almacenaron en un congelador a -70oC hasta realizar las determinaciones de laboratorio.
TABLA 1. Composición y análisis proximal de la dieta basal.
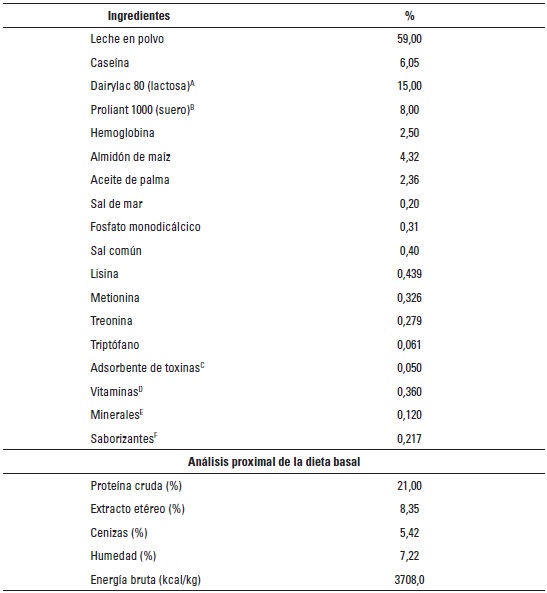
A Dairylac 80 (Pro-Ag Products Ltd, Winnipeg, Canadá).
B Proliant 1000 (Alitecno S.A.C., Lima, Perú).
C Toxibond (Biomix, Medellín, Colombia).
D Composición por kg de alimento: vitamina A 1020 UI, vitamina D 198 UI, vitamina E 6 UI, vitamina K 1,20 mg, riboflavina 7,20 mg, vitamina B12 0,04 mg, colina 968,58 mg, niacina 36 mg, ácido pantoténico 16,55 mg, tiamina 30 mg, piridoxina 31 mg, biotina 0,08 mg, ácido fólico 0,75 mg.
E Composición por kg de alimento: cobre 14,40 mg, hierro 120 mg, manganeso 36 mg, selenio 0,30 mg, yodo 0,96 mg, zinc 144 mg.
F Vainilla dulce, esencia de frutas (Prodia, Medellín, Colombia).
Procesamiento de muestras de mucosa intestinal para detección de actividad enzimática
Las muestras de mucosa intestinal que se obtuvieron de los diferentes segmentos de intestino delgado se procesaron y analizaron en el laboratorio del Grupo Interdisciplinario de Estudios Moleculares (GIEM) de la Universidad de Antioquia. Inicialmente, las muestras se liofilizaron por un día a una presión de 1,33 x 10-3 mBar y una temperatura de -40°C (Labconco Freeze Dry System/Freezone 4.5, KCK, USA). Después, estas muestras se guardaron en viales de 2 mL y se almacenaron a -20°C y luego se trituraron con una espátula metálica delgada hasta la obtención de un polvo homogéneo. Posteriormente de este procedimiento, se realizó una extracción con 6 mL de una solución buffer pH 6,5 (ácido cítrico 50 mM y NaCl 250 mM) y agitación a 30 rpm durante 10 min a 4°C. La solución resultante de la extracción se centrifugó a 12 000 rpm por 15 min a 4°C y el sobrenadante que resultó se almacenó a -20°C para posteriores análisis.
Determinación de actividad de sacarasa-isomaltasa (SI) (EC 3.2.1.48-10)
La actividad enzimática de sacarasa-isomaltasa (SI) se determinó según el método de Sangild et ál. (1995). Entonces, se tomaron 733 µL de sobrenadante a una concentración peso de muestra (g/6 mL), los cuales se agregaron a una solución de 1470 µL de sacarosa al 1% (29,21 mM) en una buffer pH 6,5 (ácido cítrico 50 mM y NaCl 250 mM) a 37°C. Luego, se tomaron alícuotas de 200 µL de muestra reaccionante en los tiempos de 0, 15, 30, 45 y 60 minutos y se hicieron reaccionar con 200 µL de reactivo DNS1 (42 mL) en tubos de ensayo. Por último, se calentó durante 10 min a 100°C, se completó con 600 µL de agua destilada y posteriormente se leyó la absorbancia a 540 nm (todo por duplicado). El análisis se realizó mediante el método de velocidades iniciales y los resultados se muestran como el promedio en µmol de glucosa liberado por minuto por gramo de muestra, producto de la hidrolisis de la sacarasa. Los resultados también se analizan por medio de la curva de calibración.
Determinación de actividad de lactasa-florizina hidrolasa (LPH) (EC 3.2.1.23-62), maltasa-glucoamilasa (MGA) (EC 3.2.1.20), aminopeptidasa N (APN) (EC 3.4.11.2) y dipeptidil peptidasa IV (DPP-IV) (EC 3.4.14.5)
La actividad enzimática de las cuatro enzimas intestinales lactasa-florizina hidrolaza (LPH), malatasa-glucoaminasa (MGA), aminopeptidasa N (APN) y dipeptidil peptidasa IV (DPP-IV) también se determinó según el método de Sangild et ál. (1995). El sobrenadan-te que se obtuvo después de realizar el tratamiento de muestra tenía una concentración de peso de muestra (g/6 mL). Luego, se realizó una dilución de la muestra de 1/10 con una solución buffer ácido cítrico pH 6,5; 50 mM y NaCl 250 mM. Después, se hicieron reaccionar 50 µL de muestra con 100 µL de sustrato Gly-Pro-p-nitroanilide-HCl para actividad de DPP-IV; L-alanine 4-nitroanilide-HCl para actividad APN; 4-Nitrophenyl-β-D-galactopyranoside para actividad LPH, y 4-Nitrophenylα-D-glucopyranoside para actividad MGA. Todos los sustratos que se utilizaron tenían una concentración de 250 µM y la reacción se realizó en pozos para ELISA. Luego, se leyó absorbancia (405 nm) cada dos minutos durante 16 min (todo por triplicado). Los análisis de las cuatro enzimas también se realizaron mediante el método de velocidades iniciales. Los resultados se muestran como el promedio en µmol de p-nitroanilina (producto de la hidrolisis de cada una de las aminopeptidasas) y el promedio en µmol de p-nitrofenol (producto de la hidrolisis de las disacarasidasas) liberados por minuto por gramo de muestra (µmol/min/g). Los resultados, de igual forma, se analizan por medio de la curva de calibración.
Diseño estadísticoEl experimento se realizó según un diseño completamente al azar, puesto que cada uno de los 16 animales experimentales se seleccionó de manera aleatoria a uno de cuatro tratamientos (1, 5, 7 y 10 días posdestete), en el que cada tratamiento tuvo un total de cuatro repeticiones, siendo un lechón la unidad experimental. El análisis estadístico de los datos que se obtuvieron se desarrolló utilizando el procedimiento de modelos lineales generales (GLM) del SAS (Statistical Analysis System) (2006). En cuanto a la comparación de los promedios entre tratamientos, se utilizó una prueba de Duncan (P < 0,05).
RESULTADOS
Durante todo el experimento, los cerdos presentaron un buen estado de salud, aunque algunos mostraron incrementos en la temperatura rectal por encima de 38ºC. No obstante, estos cerdos no presentaron síntoma alguno de enfermedad que causara su retiro y/o sacrificio inmediato. Además, al nivel en que se fijó el suministro diario de alimento, no hubo sobrantes.
De acuerdo con los resultados de actividad enzimática intestinal, en las tablas 2 y 3 se pueden observar los datos obtenidos con la DB durante cada uno de los días de experimentación y las secciones intestinales. Para las variables aminopeptidasas APN y DPP-IV se presentaron disminuciones (P < 0,01) a partir del día uno posdestete (tabla 2), luego los animales con cinco días de destetados presentaron los menores valores (1,51 y 2,17 µmol/min/g, respectivamente), y se presentó recuperación parcial de los valores a partir del día diez posdestete, donde se evidencia además, diferencia estadística (P < 0,01) con respecto al día uno posdestete.
Para las disacaridasas en estudio (tabla 2) se presentaron diferencias (P < 0,01) a partir del día uno posdestete, en el que MGA y SI presentaron en el día cinco posdestete su menor actividad (2,21 y 4,65, respectivamente), mientras que se aprecia una recuperación parcial con el transcurso de los días, específicamente en el día diez posdestete, donde se evidencia, además, diferencia estadística (P < 0,01) con respecto al día uno pos-destete. Para la variable LPH, también se presentó diferencia estadística (P < 0,01) entre cada uno de los periodos posdestete, observándose una disminución de la actividad de LPH con el transcurso de los días.
Para cada sección intestinal se presentaron diferencias (P < 0,01) entre las distintas variables en estudio (tabla 3), evidenciándose que la parte proximal (duodeno) presentó los mayores valores para actividad enzimática de las aminopeptidasas APN y DPP-IV (2,14 y 2,41 µmol/min/g, respectivamente) y para las disacaridasas LPH, MGA y SI (10,1; 2,74; y 4,58 µmol/min/g, respectivamente). Debido a que en trabajos anteriores no se observaron diferencias en la expresión molecular de enzimas entre yeyuno e íleon, no se consideró necesario realizar el estudio enzimático en íleon.
TABLA 2. Cambios en la actividad enzimática de las vellosidades (µmol/min/g) del intestino delgado de
lechones destetos que consumieron la dieta basal (DB) durante el periodo posdestete (efecto del destete).
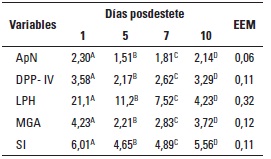
APN: aminopeptidasa N (EC 3.4.11.2); DPP-IV: dipeptidilpeptidasa IV (EC 3.4.14.5); LPH: lactasaflorizina hidrolasa (EC 3.2.1.23-62); MGA: maltasaglucoamilasa (EC 3.2.1.20); SI: sacarasa-isomaltasa (EC 3.2.1.48-10). ABCD En una misma fila, medias con distinto superíndice son estadísticamente diferentes (P < 0,01). EEM: Error estándar de la media.
TABLA 3. Cambios en la actividad enzimática de las vellosidades (µmol/min/g) de diferentes secciones
del intestino delgado de cerdos hasta el día 10 posdestete (efecto del destete).
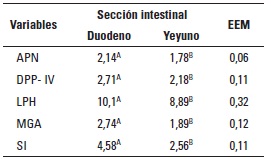
APN: aminopeptidasa N (EC 3.4.11.2); DPP-IV: dipeptidilpeptidasa IV (EC 3.4.14.5); LPH: lactasaflorizina hidrolasa (EC 3.2.1.23-62); MGA: maltasaglucoamilasa (EC 3.2.1.20); SI: sacarasa-isomaltasa (EC 3.2.1.48-10). AB En una misma fila, medias con distinto superíndice son estadísticamente diferentes (P < 0,01). EEM: Error estándar de la media.
DISCUSION
De manera general, son pocos los trabajos en los que se han evaluado tanto los efectos del destete como la metodología utilizada, como se expuso en este experimento, de allí que se haya presentado cierta dificultad para comparar y discutir los resultados obtenidos. Pese a lo anterior, se considera importante continuar generando resultados para establecer la validez de los resultados.
En cuanto a este experimento, al momento del destete, los valores de actividad enzimática (µmol/min/g) que se obtuvieron para cada una de las enzimas intestinales en estudio fueron similares a los reportados por otros autores (Kelly et ál. 1991; Pluske et ál. 1996; Bruininx et ál. 2002). Durante la fase temprana del destete del día 1-5, se produjo un proceso de deterioro agudo de la estructura y función intestinal, disminuyendo la actividad de las enzimas intestinales; esto también fue similar a lo reportado por Montagne et ál. (2007). Entre las primeras 24 horas posdestete, los cerdos manifiestan varios signos de estrés, entre los que se encuentran la disminución en la altura (atrofia) de las vellosidades (Hedemann et ál. 2006; Vente-Spreeuwemberg et ál. 2001), la reducción en la actividad específica de las enzimas digestivas (Kelly et ál. 1991) y una baja tasa de crecimiento (McCraken et ál. 1999).
El proceso del destete se asocia con una reducción temporal en las actividades de las disacaridasas y peptidasas, lo cual favorece la reducción en los procesos digestivos. En este estudio, la reducción en la actividad enzimática al momento del destete podría estar asociada con la reducción en el tamaño de las vellosidades (Hedemann et ál. 2006), debido a que las células desprendidas de las puntas de las vellosidades son enterocitos maduros; principal reservorio de disacaridasas y peptidasas (Hampson y Kidder 1986; Hedemann et ál. 2003).
La disminución lineal de la actividad de LPH que se observó en este estudio durante el periodo posdestete se ha descrito previamente como un proceso fisiológico natural relacionado con la edad del animal y con la madurez intestinal (Hampson y Kidder 1986; Marion et ál. 2005). En trabajos reportados por Radecki y Yokoyama (1991); Tang et ál. (1999), y Marion et ál. (2002, 2005), el destete a los 21 días de edad redujo las actividades de MGA y SI durante la primera semana posdestete, observándose una recuperación total al final de la segunda semana. El aumento en las actividades de MGA y SI y la reducción en actividad de LPH en el día 10 posdestete en este estudio reflejan la maduración de la función intestinal (Boudry et ál. 2002).
En cuanto a la distribución intestinal de las actividades de LPH, MGA, SI, APN y DPP-IV fue similar a las observadas en el trabajo publicado por Marion et ál. (2005), en el que las actividades máximas se obtuvieron en el segmento proximal. En este trabajo, la actividad de las disacaridasas LPH, MGA y SI disminuyó del segmento proximal al distal.
CONCLUSIONESEl destete temprano disminuye la actividad enzimática a nivel intestinal, provocando la subutilización de los nutrientes de la dieta y, por ende, alta incidencia de diarreas durante esta etapa.
La disminución en la actividad enzimática intestinal conlleva a una menor utilización de los nutrientes ingeridos y a la disminución de los parámetros de crecimiento de los animales, lo que se vería representado en pérdidas para el productor.
De los hallazgos obtenidos se desprende que es necesario realizar más investigaciones sobre la actividad de enzimas intestinales asociada a la fisiología digestiva, para que de esta forma se mejore la comprensión de los mecanismos causantes de problemas digestivos y sus posibles estrategias terapéuticas en el periodo posdestete.
1 Reactivo DNS (42 mL): Solución A: 0,25 g de ácido + 3,5 dinitrosalicílico + 5 mL de NaOH 2 M + 12 mL de agua destilada. Solución B: 7,5 g de tartrato de sodio y potasio en 25 mL de agua destilada. Solución A + Solución B = Reactivo DNS.
REFERENCIAS
1. Amador P, García-Herrera J, Marca MC, de la Osada J, Acín S, Navarro MA, et ál. 2007. Intestinal d-galactose transport in an endotoxemia model in the rabbit. J Membr Biol. 215(2-3): 125-133.
[ Links ]2. Boudry G, Lallès JP, Malbert CH, Bobillier E, Sève B. 2002. Diet-related adaptation of the small intestine at weaning in pigs is functional rather than structural. J Pediatr Gastroenterol Nutr. 34(2): 180-187.
[ Links ]3. Bruininx EM, Schellingerhout AB, Lensen EG, van der Peet-Schwering CMC, Schrama JW, Everts H, den Hartog LA, Beynen AC. 2002. Associations between individual food intake characteristics and indicators of gut physiology of group-housed weanling pigs differing in genotype. Anim Sci. 75: 103-113.
[ Links ]4. [CIOMS] Council for International Organizations of Medical Sciences. 1985. International guiding principles for biomedical research involving animals [Internet]. Geneva (Switzerland): World Health Organization. [Citado 2011 octubre 14] Disponible en: http://www.cioms.ch/publications/guidelines/1985_texts_of_guidelines.htm.
[ Links ]5. Easter RA. 1995. Growth, body composition and nutrition. En: Memorias Curso de Lance. San José, Costa Rica. 17 p.
[ Links ]6. Hampson DJ, Kidder DE. 1986. Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine. Res Vet Sci. 40(1): 24-31.
[ Links ]7. Hedemann MS, Eskildsen M, Laerke HN, Pedersen C, Lindberg JE, Laurinen P, Bach-Knudsen KE. 2006. Intestinal morphology and enzymatic activity in newly weaned pigs fed contrasting fiber concentrations and fiber properties. J Anim Sci. 84(6): 1375-1386.
[ Links ]8. Hedemann MS, Højsgaard S, Jensen BB. 2003. Small intestinal morphology and activity of intestinal peptidases in piglets around weaning. J Anim Physiol Anim Nutr. 87(12): 32-41.
[ Links ]9. Kelly D, Smyth JA, McCracken KJ. 1991. Digestive development of the early-weaned pig. 1. Effect of continuous nutrient supply on the development of the digestive tract and on changes in digestive enzyme activity during the first week post-weaning. Br J Nutr. 65(2): 169-180.
[ Links ]10.Kojima CJ, Carroll JA, Matteri RL, Touchette KJ, Allee GL. 2007. Effects of weaning and weaning weight on neuroendocrine regulators of feed intake in pigs. J Anim Sci. 85(9): 2133-2139.
[ Links ]11. Lallès JP, Boudry G, Favier C, Le Floc'h N, Luron I, Montagne L, Oswald IP, Pié S, Piel C, Sève B. 2004. Gut function and dysfunction in young pigs: physiology. Anim Res. 53(4): 301-316.
[ Links ]12. Makkink CA, Berntsen PJ, op den Kamp BM, Kemp B, Verstegen MW. 1994. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci. 72(11): 2843-2850.
[ Links ]13. Marion J, Biernat M, Thomas F, Savary G, Le Breton Y, Zabielski R, Le Huërou-Luron I, Le Dividich J. 2002. Small intestine growth and morphometry in piglets weaned at 7 days of age. Effects of level of energy intake. Reprod Nutr Dev. 42(4): 339-354.
[ Links ]14. Marion J, Petersen YM, Romé V, Thomas F, Sangild PT, Le Dividich J, Le Huërou-Luron I. 2005. Early weaning stimulates intestinal brush border enzyme activities in piglets, mainly at the posttranscriptional level. J Pediatric Gastroenterol Nutr. 41(4): 401-410.
[ Links ]15. McCracken BA, Spurlock ME, Roos MA, Zuckermann FA, Gaskins HR. 1999. Weaning anorexia may contribute to local inflammation in the piglet small intestine. J Nutr. 129(3): 613-619.
[ Links ]16. Montagne L, Boudry G, Favier C, Le Huërou-Luron I, Lallès JP, Sève B. 2007. Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning. Brit J Nutr. 97(1): 45-57.
[ Links ]17. [NRC] National Research Council. 1998. Nutrient requirements of swine. 10th rev. ed. Washington: The National Academies Press. 212 p.
[ Links ]18. Pluske JR, Hampson DJ, Williams IH. 1997. Factors influencing the structure and function of the small intestine in weaned pigs: a review. Livest Prod Sci. 51(1-3): 215-236.
[ Links ]19. Pluske JR, Williams IH, Aherne FX. 1996. Maintenance of villous height and crypt depth in piglets by providing continuous nutrition after weaning. Anim Sci. 62: 131-144.
[ Links ]20. Radecki SV, Yokoyama, MT. 1991. Intestinal bacteria and their influence on swine nutrition. En: Miller ER, Ullrey DE, Lewis AJ, editors. Swine Nutrition. Boston: Butterworth Heinemann. p. 439-447.
[ Links ]21. Reis de Souza TC, Guerrero MJ, Aguilera A, Mariscal G. 2005. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Méx. 43(3): 309-321.
[ Links ]22. Reis de Souza TC, Mariscal G. 2005. Preferencia alimenticia y comportamiento zoo-técnico de lechones alimentados con dietas formuladas con diferentes tipos de suero de leche deshidratado. Téc Pecu Méx. 42(2): 193-206.
[ Links ]23. Reis de Souza TC, Mariscal LG, Aguilera A, Cervantes JG. 2007. Digestibilidad de la proteína y energía en dietas para lechones, complementadas con tres diferentes tipos de suero de leche deshidratado. Vet Méx. 38(2): 141-151.
[ Links ]24. Sangild PT, Sjöstrom H, Norén O, Fowden AL, Silver M. 1995. The prenatal development and glucocorticoid control of bushborder hydrolases in the pig small intestine. Pediatr Res. 37(2): 207-212.
[ Links ]25. Sangild PT, Petersen YM, Schmidt M, Elnif J, Petersen TK, Buddington RK, Greisen G, Michaelsen KF, Burrin DG. 2002. Preterm birth affects the intestinal response to parenteral and enteral nutrition in newborn pigs. J Nutr. 132(9): 2673-2681.
[ Links ]26. [SAS] Statistical Analysis Systems Institute. SAS®/STAT User's Guide. 2006. Version 9.1th ed. Cary, NC, US: SAS Institute Inc.
[ Links ]27. Segalés J, Domingo M. 2003. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras. Madrid: Boehringer Ingelheim. p. 10-14.
[ Links ]28. Tang M, Laarveld B, Van Kessel AG, Hamilton DL, Estrada A, Patience JF. 1999. Effect of segregated early weaning on postweaning small intestinal development in pigs. J Anim Sci. 77(12): 3191-3200.
[ Links ]29. Van Beers-Schreurs HMG. 1996. The chan-ges in the function of the large intestine of weaned pigs. [PhD thesis]. [Utrecht, The Netherlands] University of Utrecht.
[ Links ]30. Vente-Spreeuwenberg MAM, Verdonk JMAJ, Gaskins HR, Verstegen MWA. 2001. Small intestine epithelial barrier function is compromised in pigs with low feed intake at weaning. J Nutr.; 131(5): 1520-1527.
[ Links ]31. Wang Y, Shan T, Xu Z, Liu J, Feng J. 2006. Effect of lactoferrin on the growth performance, intestinal morphology, and expression of PR-39 and protegrin-1 genes in weaned piglets. J. Anim Sci. 84(10): 2636-2641.
[ Links ]













