Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.59 no.1 Bogotá Jan./Apr. 2012
ESTUDIO DEL INTERVALO INTEROVULATORIO EN YEGUAS CRIOLLAS COLOMBIANAS
STUDY OF THE INTEROVULATORY INTERVAL IN COLOMBIAN CRIOLLO MARES
M. P. Paredes1*, C. Jiménez1, A. Hernández1
1 Departamento de Salud Animal, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, sede Bogotá.
Cr. 45 nro. 26-85, Bogotá (Colombia)
*Autor para correspondencia: mdparedesh@unal.edu.co
Artículo recibido: 13 de febrero de 2012; aprobado: 26 de marzo de 2012
RESUMEN
Con el objetivo de estimar parámetros reproductivos de referencia en yeguas criollas colombianas (CC), se emplearon 30 yeguas a las que se les realizó seguimiento de dos ciclos estrales (CE). La duración del CE fue 21,5 ± 1,8 días (promedio ± DE), la cual fue similar en el 40% de las yeguas en los dos CE, en el 60% restante la duración entre los dos CE tuvo una diferencia entre 1 a 7 días. La tasa de crecimiento diario del folículo dominante (FD) fue de 1,62 ± 0,4 mm y la del folículo subordinado (FS) de 0,65 ± 0,4 mm. La desviación folicular se presentó el día 17,2 ± 3,0 del CE. El tamaño máximo del FD fue 44,3 ± 4,8 mm. En el 63% de los CE el FD se ubicó en el ovario derecho y en el 37% en el izquierdo. En el 85% de los CE ocurrió primero el edema uterino y después los signos de celo. El grado de edema disminuyó antes de la ovulación en 86,6% de los CE. La duración del estro fue 5,9 ± 1,8 días. Hasta 48 horas posovulación se presentaron signos de celo en el 73,3% de los CE y en el 26,6% ningún signo de celo. Según los valores obtenidos, aunque los parámetros reproductivos son similares a los descritos para otras razas de equinos en países diferentes a Colombia, hay algunas diferencias que deben tenerse en cuenta en las prácticas clínicas de rutina en la reproducción de las yeguas CC.
Palabras clave: ciclo estral, crecimiento folicular, edema uterino, yeguas criollas colombianas.
ABSTRACT
This study aims to contribute in the generation of reference values in Colombian Criollo (CC) mares, 30 animals were used to characterize their estrous cycles (EC). EC duration was 21.5 ± 1.8 days (mean ± SD). 40% of mares had the same duration in days for the two cycles observed and in the remaining 60% the difference in EC duration ranged from 1 to 7 days. The daily growth rate of the dominant follicle (DF) was 1.62 ± 0.4 mm and for the subordinate follicle (SF) was 0.65 ± 0.4 mm. Follicular deviation occurred on day 17.2 ± 3.0. The maximum size of DF was 44.3 ± 4.8 mm. In 63% of the observed EC, the DF was located in the right ovary and 37% in the left. In 85% of the studied EC, uterine edema preceded heat signs. The degree of edema decreased before ovulation in 86.6% of the studied EC. The average estrus duration was 5.9 ± 1.8 days. Most mares (73.3%) maintained heat signs up to 48 hours after ovulation. The values obtained showed that the reproductive parameters in CC mares are somewhat different from those described for different genotypes in other countries; these differences should be taken into account on routine clinical practices in the reproduction of the CC mares.
Key words: estrous cycle, follicular growth, uterine edema, Colombian criollo mares.
INTRODUCCIÓN
El ciclo estral (CE) se define como el intervalo transcurrido entre una ovulación y la siguiente. Su duración en la especie equina es aproximadamente de 21 días y presenta dos fases, la folicular y la luteal (Daels y Hughes 1993; Pryor y Tibary 2005).
Los cambios fisiológicos a través del CE son controlados por hormonas producidas por el hipotálamo, la hipófisis, la glándula pineal, los ovarios y el útero. La fase folicular tiene una duración muy variable en la especie equina, el comportamiento de estro dura de 5 a 7 días (rango 2 - 12 días), lo cual depende de la yegua, de la raza y del fotoperiodo (Ginther 1992); no obstante, también puede ser más extenso en yeguas de mayor edad como resultado de una fase folicular prolongada, debido probablemente a la presencia de folículos de menor diámetro (Madill 2002). Por su parte, la fase luteal dura de 14 a 16 días y hay predominancia del cuerpo lúteo (Pryor y Tibary 2005). Durante el diestro se incrementa el tono uterino, el cérvix se cierra y no hay receptividad hacia el macho (Daels y Hughes 1993).
En las yeguas, la onda de crecimiento folicular en los ovarios se desarrolla durante la segunda mitad del CE y generalmente solo un folículo termina en ovulación (Donadeu y Ginther 2002; Ginther et al. 2001). La llamada onda emergente se refiere al primer grupo de folículos detectados por ultrasonografía, con un tamaño promedio de 6 mm (Bergfelt y Adams 2007; Gastal et al. 1997; Ginther 2000). Los folículos tienen una fase común de desarrollo folicular (2 - 3mm/día) y el futuro folículo dominante (FD) tiene en promedio un crecimiento mayor de 3 mm hasta el inicio de la desviación folicular (Donadeu y Ginther 2002; Ginther et al. 2001; Ginther 1995), momento en el cual la diferencia entre la frecuencia de crecimiento del FD y la del crecimiento de los folículos subordinados (FS) es notoria (Gastal et al. 1997). De esta manera ocurre la selección folicular. Así, un folículo se transforma en FD o preovulatorio (Donadeu y Ginther 2002; Ginther 2000) y disminuye el crecimiento de los FS. La selección folicular ocurre al final de la fase común de crecimiento; el FD crece a una tasa continua y el FS sufre regresión o crece temporalmente a una velocidad más lenta y posteriormente disminuye su crecimiento; este evento se conoce como desviación folicular (Ginther et al. 2001).
Al ganar ventaja en tamaño, el folículo más grande desarrolla la capacidad de suprimir las concentraciones circulantes de la hormona folículo estimulante (FSH) y de utilizar niveles basales de la misma para su desarrollo (Ginther et al. 2004). El folículo más grande tiene mayor área de superficie y por lo tanto, más receptores para la FSH, lo cual es importante para que pueda continuar su crecimiento con bajos niveles sanguíneos de FSH y ocurra la desviación folicular. La disminución en la liberación de FSH está asociada con la desviación y después de ésta, su concentración continúa disminuyendo durante varios días después (Ginther 2000). Las hormonas del fluido folicular son importantes en el control de la desviación folicular; en unas yeguas, se encontró que la concentración de estradiol (E2) aumenta en el folículo más grande antes del comienzo de la desviación folicular, lo cual se asoció con cambios en la textura de la pared folicular (Donadeu y Ginther 2002; Ginther 2000). Se cree que la inhibina puede causar un descenso en los niveles de FSH en la sangre, en efecto se halló un aumento de FSH en el plasma posterior a la administración de un antisuero contra la inhibina (Ginther 2000). El diámetro promedio en el momento de la desviación folicular es de 22 mm para el folículo de mayor tamaño y 19 mm para el segundo folículo más grande; así mismo, el comienzo de la desviación se presenta 6,2 días después de la emergencia folicular (Gastal et al. 1999; Ginther 2000). Generalmente la ovulación en la yegua puede darse a partir de los 35mm (Ginther 1992). El diámetro máximo del folículo ovulatorio está entre 40 a 45 mm en yeguas Pura Sangre Inglesa (PSI) y Cuarto de Milla; aunque esto puede tener grandes variaciones según las condiciones medioambientales, la raza de los animales y cuando se presentan ovulaciones múltiples (Bergfelt y Adams 2007).
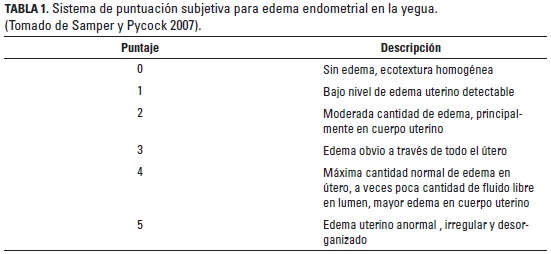
La principal característica observada en el endometrio durante el CE de la yegua, es la presencia de edema durante el estro (Samper 1997). El grado de edema endometrial puede ser cuantificado utilizando un sistema de clasificación subjetivo en donde se evalúa la cantidad de edema uterino y la visibilidad de los pliegues endometriales. La presencia de edema uterino es el indicador más confiable de celo en la yegua normal, aún si la yegua no se muestra receptiva al macho. La ausencia de edema uterino con un cérvix cerrado es característica del diestro (Samper y Pycock 2007).
Dada la amplia variación de las condiciones climáticas en el trópico colombiano, se hace necesario establecer los valores de referencia de importancia clínica, en yeguas CC ubicadas en los diversos pisos térmicos colombianos. Aunque se han realizado estudios sobre el CE en yeguas CC ubicadas en Bogotá, no hay reportes escritos acerca de las características del CE en yeguas CC ubicadas en el piso térmico templado o medio de Colombia, que comprende todas las áreas ubicadas entre los 1000 y 2000 msnm y temperaturas que oscilan entre los 17 y 24 °C (Ojeda et al. 2001). La comprensión de los eventos fisiológicos del ciclo reproductivo de la yegua permite conocer y definir las posibles limitantes de su capacidad reproductiva y aplicar correctivos en la práctica de rutina de la clínica de reproducción; de esta forma, se mejora y aumenta la eficiencia reproductiva de cada animal y por ende, de los criaderos equinos, fomentando a su vez la conservación y mejoramiento de las razas de caballos de importancia social o económica. Dado que la población de yeguas CC en el país es importante, es pertinente investigar las características del CE de esta población para facilitar la expresión de su máxima eficiencia reproductiva en los criaderos, así como para conocer parámetros de referencia para futuros estudios que contribuyan a la preservación de la raza de caballos CC. Así mismo, es necesario establecer los valores de referencia correspondientes bajo las condiciones del trópico colombiano en los diferentes pisos térmicos, en virtud de la variación climática inherente a ellos.
En la literatura disponible, no hay reportes acerca de la duración del estro, del CE, del crecimiento folicular o de las variaciones en el grado de edema uterino en yeguas CC residentes en las zonas geográficas correspondientes a los pisos térmicos templado y cálido del trópico colombiano. El presente trabajo tuvo como objetivo determinar la duración del CE y del estro, así como conocer el crecimiento de los folículos ováricos y las variaciones del grado de edema uterino en función del tiempo, durante dos CE, en yeguas CC ubicadas en el piso térmico templado del trópico colombiano (1000 y 2000 msnm).
MATERIALES Y MÉTODOS
Se analizaron dos CE consecutivos por medio de observaciones directas, palpación rectal y ultrasonografía en 30 yeguas de la raza CC ubicadas en diferentes zonas rurales del municipio de Pereira (Risaralda), a una altura de 1411 metros sobre el nivel del mar (msnm), 4o49' de latitud norte y 75o42' de longitud oeste. Las condiciones medioambientales, correspondientes al llamado piso térmico templado colombiano (Ojeda et al. 2001),fueron: temperatura promedio de 21.8 0C, humedad relativa 75%, precipitación media de 2210 mm/año y brillo solar diario promedio de 13 horas (Ideam 2005). El desarrollo del trabajo tuvo lugar desde finales del mes de mayo del 2008 hasta mayo del 2009 según la disponibilidad de animales.
La edad de las yeguas osciló entre los 4 y 14 años, distribuidos así: entre los 4 a 7 años (n=17), de 8 a 11 años (n=10) y de 12 a 14 años (n=3). El peso corporal estuvo entre 320 y 400 kg y con una buena condición (en promedio 6/9). Todos los animales permanecían estabulados, con una dieta de pasto de corte King grass (Pennisetum purpureum), el cual se suministró a voluntad y 4 kg de concentrado al día. Las yeguas incluidas en el estudio se hallaban en buenas condiciones sanitarias, con el plan de vacunaciones vigente (tétano, influenza y encefalitis equina venezolana) y sin ninguna anormalidad reproductiva, lo cual fue determinado por medio de la inspección visual de los órganos reproductivos externos, palpación rectal y ultrasonografía. En cada criadero se utilizó un macho entero como detector del estro.
Palpación rectal y ultrasonografía
La evaluación secuencial del tracto reproductivo por ultrasonido se realizó con un ecógrafo marca Honda electronics modelo HS 1500V (Aichi, Japón), equipado con un transductor rectal lineal multifrecuencia de 10, 7,5 y 5 MHz, modelo HLV-375M y con capacidad de almacenamiento de 60 imágenes. En este estudio el seguimiento folicular, la ovulación y el grado de edema uterino se llevó a cabo con 7,5 Mhz para obtener una mayor resolución de las imágenes estudiadas. Las mediciones ultrasonográficas se realizaron por un solo operario durante todo el estudio.
Para este estudio, el día cero del CE correspondió al de la ovulación. A partir de este día, se comenzó un seguimiento ecográfico diariamente de cada yegua para determinar la duración del intervalo entre ovulaciones, evaluar si había presencia de una o más ondas foliculares, identificar el número de folículos en cada ovario, calcular el diámetro folicular y su tasa de crecimiento, identificar FD y el FS más grande y establecer el momento de la desviación folicular. La medición del diámetro folicular se llevó a cabo calculando el promedio de dos medidas perpendiculares de cada folículo. El día de la desviación entre el FD y el FS se definió como el día en el cual se encontró la mayor diferencia entre sus tasas de crecimiento (Ginther 2000).
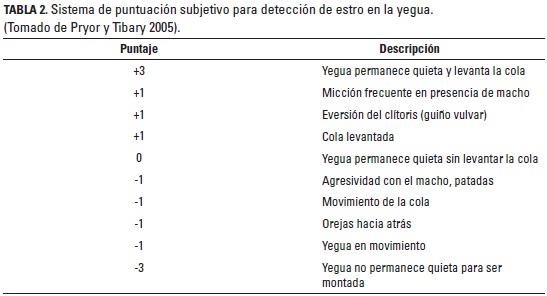
Así mismo, se evaluó por ultrasonido el tamaño y el grado de edema uterino durante la fase folicular y luteal del CE; para cuantificar estos datos se utilizó un sistema de puntuación subjetiva para edema endometrial (Samper y Pycock 2007) (tabla 1). El comportamiento característico del estro se observó una vez al día, en promedio durante dos minutos, durante la fase folicular hasta 48 horas después de haber ocurrido la ovulación por medio del recelaje (detección del estro) de cada hembra con un macho entero; posteriormente, estos datos se cuantificaron con un sistema de puntuación subjetivo para el comportamiento de estro (Pryor y Tibary 2005) (tabla 2); esta observación fue llevada a cabo por una sola persona y en cada criadero se utilizaron dos caballos receladores diferentes, los cuales se alternaban para no generar problemas en el comportamiento del reproductor; sin embargo, siempre se utilizó el mismo caballo para una misma yegua.
Análisis estadístico
El análisis de los datos se hizo mediante estadística descriptiva con valores de promedio y desviación estándar (DE) para todos los parámetros por evaluar. La tasa de crecimiento del FD y del FS se calculó mediante la formula: diámetro folicular máximo alcanzado por el folículo menos el diámetro folicular inicial el día de su detección dividido por el intervalo en días, desde el inicio del seguimiento del folículo hasta la ovulación del mismo (Henao y Trujillo 2003). Por último, se realizó el análisis de varianza de los datos encontrados en el primero y segundo CE para determinar posibles diferencias entre ellos.
En este estudio descriptivo del intervalo interovulatorio el objetivo era evaluar si las yeguas CC se comportaban de manera similar a las investigaciones descritas en la literatura.
RESULTADOS
Seguimiento del ciclo estral
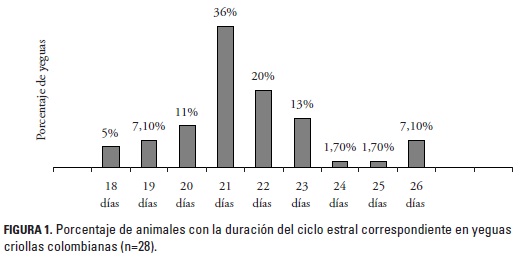
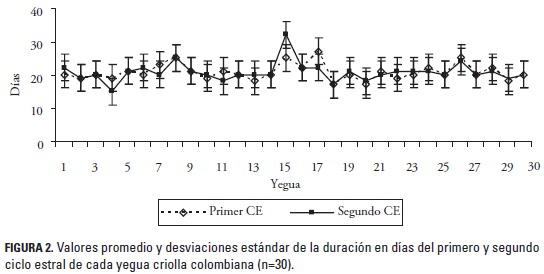
Dado que no se encontraron diferencias significativas (p > 0,05) entre el primero y segundo CE, los resultados se presentan unificados. La duración del CE fue de 21,5 ± 1,8 días (promedio ± DE) con un rango entre 18 (3/56 CE) a 26 días (3/56 CE). En el 36% (20/56) de los casos el CE presentó una duración de 21 días (figura 1). El 40% (12/30) de las yeguas analizadas tuvieron la misma duración en días durante los dos CE, en las yeguas restantes se encontró un rango de diferencia en la duración de los CE entre 1 a 5 días (figura 2). Entre tanto, se encontraron dos casos fuera de los parámetros normales, una yegua que presentó una duración de 20 y 16 días para el primero y segundo CE y otra con 26 y 33 días para el primero y segundo CE, respectivamente. Los datos de estos animales se excluyeron en el análisis del promedio de la duración del CE para no sesgar los valores reportados de los rangos; sin embargo, estos CE tuvieron un desarrollo y ovulación normales por lo tanto se incluyen dentro de los resultados.
Dinámica folicular
Se identificó la cantidad de folículos encontrados en cada ovario desde el día 0 del estudio hasta cuando ocurrió la siguiente ovulación. El día 0 del ciclo se encontraron 2,4 ± 1,7 folículos en el ovario derecho con un rango de 0 a 8 folículos y 2,3 ± 1,2 folículos en el izquierdo, con un rango de 0 a 5. El promedio de la cantidad de folículos hallados durante todo el CE fue de 3,17 ± 0,5 folículos (rango: 2,3 - 5) en el ovario derecho; 2,4 ± 0,7 folículos (rango: 1 - 3,3) en el ovario izquierdo y el promedio de la cantidad total de folículos encontrados en los dos ovarios fue de 5,6 ± 0,7 folículos (rango: 4 - 6,9).
La tasa de crecimiento diario del FD y del FS durante el CE de cada yegua se determinó con la fórmula descrita anteriormente en el apartado análisis estadístico, teniendo en cuenta el diámetro inicial del folículo, el diámetro final alcanzado y los días de seguimiento del folículo (Henao y Trujillo 2003). La tasa de crecimiento del FS osciló entre 0,01 y 1,97 mm/día, con un promedio de 0,65 ± 0,4 mm/día. El promedio del tamaño del FS alcanzado durante todo el ciclo fue de 16,6 ± 4,0 mm y su tamaño estuvo en un rango de 11,1 - 23,1 mm; el diámetro máximo del FS se encontró el día 17,3 ± 3,0 (rango 10 - 23 días) y fue de 25,5 ± 4,7 con un rango de 14,5 - 35,6 mm.
El promedio de la tasa de crecimiento diario del FD fue de 1,62 ± 0,4 mm, con un rango de 0,5 y 2,8 mm por día. En el 55% (33/60) de los CE analizados el FD y el FS se encontraban ubicados en el mismo ovario. El FS se ubicó en un 68,3% (41/60 CE) en el ovario derecho y 31,6% (19/60) en el izquierdo, mientras que el 63,3% (38/60) y el 36,6% (22/60) de FD se ubicaron en el ovario derecho y en el ovario izquierdo, respectivamente.
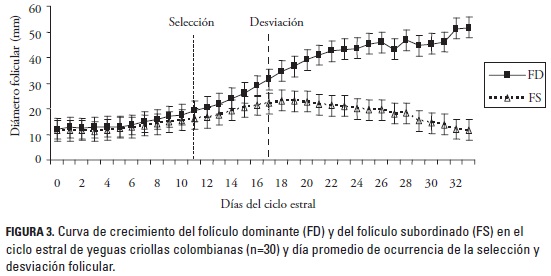
La selección folicular inició en promedio el día 11,1 ± 2,9 posovulación cuando se encontró una mayor diferencia en la tasa de crecimiento folicular, con una ventaja de crecimiento de 1,0 mm del FD comparado con el FS; en ese momento el diámetro promedio fue de 18,9 ± 7,4 mm para el folículo de mayor tamaño y 15,9 ± 5,3 mm para el segundo folículo más grande. A partir de ese momento, el FD tuvo una velocidad de crecimiento diaria mayor que el FS y en promedio hacia el día 17,2 ± 3,0 (rango 10 a 23 días) ocurrió la desviación folicular cuando el FD continuó creciendo (2,5 mm/día) y el FS comenzó a disminuir su tasa de crecimiento (0,7 mm/día). Se obtuvieron valores promedio ± DE de 31,3 ± 7,0 mm y 22,0 ± 5,3 mm para el FD y el FS, respectivamente. Después de la desviación folicular, el FD continuó aumentando su tasa de crecimiento hasta el momento de la ovulación (figura 3). La velocidad de crecimiento del FD disminuyó en promedio 3 días antes de la ovulación y de manera más notoria el día anterior de la ovulación (día -1) cuando la tasa de crecimiento fue de 1,84 ± 1,8 mm/día.
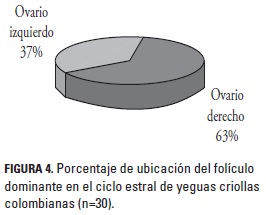
Todos los animales analizados presentaron ovulación durante los dos CE estudiados. El promedio del tamaño folicular a la ovulación fue de 44,3 ± 4,8 mm, con un rango de 34,9 mm y 53,0 mm. La ovulación tuvo lugar 3,5 ± 2,2 días después que el FD alcanzara los 35 mm de diámetro. El 63,3% (19/30) de FD o folículos ovulatorios se ubicaron en el ovario derecho y el 36,6% (11/30) en el izquierdo (figura 4); en el 60% (18/30) el FD se ubicó en el mismo ovario durante los dos CE.
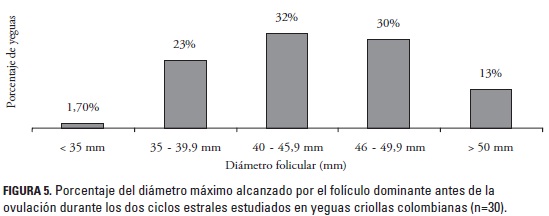
El tamaño promedio del folículo ovulatorio en el ovario derecho fue de 44,04 ± 4,9 mm (34,9 - 53 mm) y de 44,9 ± 4,6 mm (36,2 - 51,8) en el ovario izquierdo (p < 0,05). El mayor porcentaje de las yeguas (32%) ovularon con un tamaño del FD comprendido entre 40 y 45,9 mm, el 30% entre 46 y 49,9 mm, el 23% entre 35 a 39,9 mm y el 13% con un FD mayor de 50 mm; solamente una yegua ovuló con un folículo menor de 35 mm (figura 5). Se encontró un solo caso de ovulación doble durante un CE en una yegua, con la presencia de un FD en el ovario derecho de 38,5 mm de diámetro, el cual tuvo una tasa de crecimiento de 1,4 mm/día y un FD en el ovario izquierdo de 45,0 mm de diámetro con una tasa de crecimiento de 1,8 mm/día; estos folículos se ovularon con un día de diferencia; el FS se encontró en el ovario derecho y su tasa de crecimiento fue de 0,4 mm/día.
En el caso particular del segundo CE de una yegua con 16 días de duración, se encontró una tasa de crecimiento mayor del FD (2,38 mm/día) comparada con la del FD del primer CE (1,58 mm/día), el cual fue de 20 días de duración; y la velocidad de crecimiento del FS fue menor (0,73 mm/día) en el segundo CE que en el primer CE (1,0 mm/día). La divergencia ocurrió más temprano en el CE de corta duración (día 11 vs. día 17) y el tamaño folicular unas horas antes de la ovulación fue de 39,3 y 46,8 mm en el primero y segundo CE, respectivamente. En el otro animal que presentó una duración de 33 días en el segundo CE, se encontró una mayor tasa de crecimiento del FD (1,93 mm/día) comparada con la del FD del primer CE (1,64 mm/día) de 26 días de duración; en este caso la velocidad de crecimiento del FS fue menor (0,2 mm/día) en el segundo CE que en el primer CE (0,4 mm/día), la divergencia folicular fue más tardía en el segundo CE que en el primer CE (día 23 vs. día 20) y el tamaño folicular unas horas antes de la ovulación fue 46,0 y 51,7 mm en el primero y segundo CE respectivame.
Grado de edema uterino
El grado de edema uterino aumentó progresivamente durante el periodo final del CE; en el día 0 del CE se encontraron valores que variaron en un rango de 0 a 2 y el último día del ciclo de 0 a 3. Entre el día 0 y el día 13 del CE el grado de edema uterino fue menor de 1, a partir de ese momento aumentó hasta alcanzar un grado máximo de 3 y comenzó a disminuir gradualmente a medida que se aproximaba la ovulación. En el 83,3% (50/60) de los CE analizados se alcanzó un nivel máximo de edema uterino grado 3 y solamente en el 5% (3/60) un grado de edema 4. El edema uterino fue visualizado en promedio 6,9 ± 1,9 días antes de la ovulación. El grado máximo de edema fue detectado 3,7 ± 1,5 días antes de la ovulación y en promedio disminuyó a los 1,9 ± 1,0 días antes de la ovulación. La presencia de edema precedió el comportamiento de estro en promedio 2,6 ± 1,8 días. En el 85% (51/60) de los CE la detección de edema uterino antecedió a la existencia de los signos de celo.
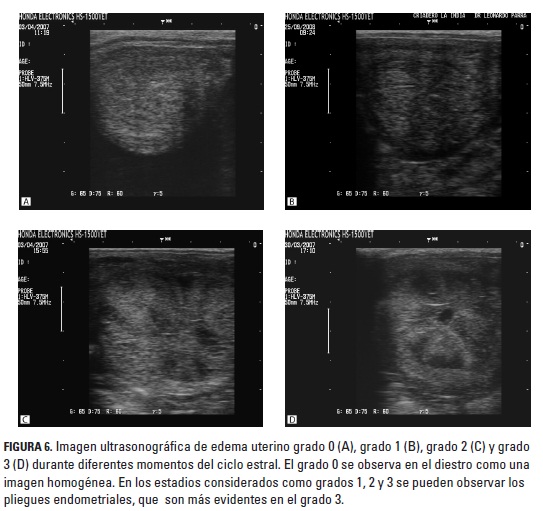
El grado de edema disminuyó antes de la ovulación en el 86,6% (56/60) de los CE. En el 70% (42/60) de los CE se presentó un edema con valores entre 0 a 2 con folículos > 40 mm en el momento de la ovulación; en 21,6% (13/60) de los CE la ovulación ocurrió con folículos < 40 mm y edema 0 a 2; en el 5% (3/60) con folículos > 40 mm y grado de edema 3, y en 3,3% (2/60) al momento de la ovulación se presentó grado de edema 3 con un folículo < de 40 mm. En el 50% (30/60) de los CE se encontró un edema uterino grado 1 el día previo a la ovulación y en el 35% (21/60) un edema uterino grado 2. Una yegua no presentó ningún grado de edema durante el primer CE, el cual fue de 18 días de duración, con evidencia de signos de celo solamente el día anterior y el día siguiente a la ovulación, que ocurrió con un folículo de 36,8 mm de diámetro; aunque el siguiente CE fue de la misma duración, sí se encontró edema, signos de celo más evidentes y un folículo de mayor diámetro (44,2 mm). En la figura 6 se observa la imagen ultrasonográfica de los diferentes grados de edema uterino encontrados durante el CE. En los CE analizados no se encontraron edemas patológicos.
Duración del estro
La duración del estro, determinada por la presencia de los signos de celo, fue de 5,9 ± 1,8 días con un rango de 1 a 11 días. Los signos de celo se evidenciaron 4,3 ± 1,9 días antes de la ovulación, cuando el FD alcanzó un tamaño de 36,5 ± 3,6 mm. En el 43,3% (26/60) de los CE los signos de estro se hicieron evidentes simultáneamente a la detección de un grado de edema 2 y en el 28,3% (17/60) cuando el edema era grado 1. En el 96,6% y el 73,3% de los CE se presentaron signos de celo hasta 24 y 48 horas posovulación, respectivamente.
Dentro de los signos característicos del celo, el observado con mayor frecuencia fue la eversión rítmica del clítoris (86,6%) y el levantamiento de la cola (86,6%), seguido por la micción frecuente (76,6%) y quietud de la yegua con levantamiento de la cola (70%); en un 30% de los CE se observó que la yegua permaneció quieta sin levantar la cola. En los casos cuando la detección del celo por parte del macho se consideró negativa, el comportamiento más repetido por los animales fue el del movimiento de la cola (8,3%), el corporal (8,3%) y la posición de las orejas hacia atrás (8,3%); en una ocasión se observó agresividad ante el macho.
DISCUSIÓN
La comprensión de los eventos fisiológicos del ciclo reproductivo de la yegua CC permite conocer y definir el comportamiento y las posibles limitantes de su capacidad reproductiva y aplicar prácticas de rutina con el fin de mejorar y aumentar la eficiencia reproductiva de cada animal, de los criaderos equinos, y así fomentar la conservación y mejoramiento de esta raza.
Se ha descrito que las yeguas presentan CE dentro de los rangos normales en períodos de menor duración del brillo solar, sin que esto afecte el intervalo inter estro o la ovulación (Boeta et al. 2006). En el presente estudio se encontró una duración del CE de 21,5 ± 1,8 días en promedio, (rango 18 a 26 días) lo cual coincide con lo reportado en la literatura (Daels y Hughes 1993; Ginther 1995; Pryor y Tibary 2005). En el altiplano de Bogotá (Colombia), ubicado a 2638 msnm (trópico alto) se encontró, en un grupo de yeguas CC, una duración promedio del CE de 20,5 ± 1,43 días (López y Rodríguez 2005). Lo anterior representa ciclos de menor duración comparados con los reportes de la literatura para otros genotipos y zonas geográficas. En casos de estrés nutricional, cuando la calidad y la cantidad de alimento es inadecuada, las yeguas tienden a disminuir la actividad ovárica y presentar cierto grado de estacionalidad en el trópico (Samper 1997).
Dado que la duración del CE puede estar afectada por la duración del brillo solar (Markovic et al. 2003), es importante en el futuro establecer con estudios más precisos si se presentan variaciones en diferentes épocas del año con cambios en la duración del brillo solar, en las condiciones propias del trópico, en los diferentes climas que corresponden a la variedad topográfica en Colombia. La variación en la duración del brillo solar en un día en Colombia en las diferentes épocas del año es de 30 minutos aproximadamente (Ideam 2005), lo cual podría influir en las características fisiológicas y por ende, en la capacidad reproductiva de los equinos y en este contexto, es deseable que se lleven a cabo estudios que cubran, en lo posible uno o varios años para abarcar periodos de invierno o verano donde la intensidad lumínica pueda variar.
A pesar de no haber encontrado diferencias significativas en la duración de los dos CE analizados (p < 0,05), se encontraron casos en que las yeguas presentaron una variación más amplia en la duración del primero y segundo CE, como en una yegua que presentó el primer CE de 26 días de duración y el segundo de 33 días. El 40% de los animales tuvieron la misma duración durante el primero y segundo CE y el FD se ubicó en el mismo ovario durante los dos CE en el 60% de los animales, con lo cual, se evidencia que conocer la dinámica folicular y la duración del CE en cada individuo puede mejorar la eficiencia reproductiva al disminuir la cantidad de inseminaciones durante el estro.
Aunque se presentaron dos casos fuera de los rangos normales reportados en la literatura, para la duración del intervalo interovulatorio, estos tuvieron un desarrollo y una ovulación posterior normal, lo cual indica que siempre existe un factor de individualidad, que puede hacer variar la duración y otros aspectos del CE de los rangos normales reportados. En estos casos es posible que la velocidad de crecimiento del FD afecte la duración del CE y también la disminución en la competencia ejercida por el FS, que permite un mayor crecimiento del FD (Ginther et al. 2004).
En el presente trabajo se halló que la tasa de crecimiento del FD en los dos CE evaluados fue 1,62 ± 0,4 mm/día y la del FS 0,65 ± 0,4 mm/día; la tasa de crecimiento del FD encontrada fue más baja comparada con la reportada en países estacionales donde se describe que los folículos tienen una fase de crecimiento paralela (2-3mm/día) (Donadeu y Ginther 2002). Estos resultados más bajos en la tasa de crecimiento del FD y del FS pueden deberse a diferencias entre las razas de animales; los reportes de la literatura son generalmente en yeguas de mayor tamaño que las CC que tienen un crecimiento folicular más acelerado (Gastal et al. 1999; Ginther 1995).
Entre tanto, la desviación es caracterizada por el crecimiento continuo y preferencial de un folículo, el cual se convertirá en el folículo dominante, continuará creciendo y ovulará. En este estudio se pudo observar lo descrito en la literatura, al encontrar un crecimiento continuo y paralelo de dos folículos al principio del ciclo hasta un momento determinado cuando se encontró una mayor diferencia en la tasa de crecimiento folicular en uno de los folículos y una disminución en el crecimiento del otro. En el presente estudio se encontró que hacia el día 17,2 ± 3,0 ocurrió la desviación folicular cuando el FD continuó creciendo (2,5 mm/día) y el FS comenzó a disminuir su tasa de crecimiento (0,7 mm/día). En la literatura existen reportes similares, donde se describe el inicio de la desviación folicular el día 15,7 ± 0,5 del CE (Ginther et al. 2007).
En yeguas CC ubicadas en Bogotá (Colombia) (2638 msnm, temperatura promedio de 13 °C y humedad relativa de 72%) se encontró un promedio de diámetro del folículo ovulatorio de 43,7 mm (rango de 39 - 52 mm), con una tasa de crecimiento de 2,52 mm/día, la cual disminuyó un día antes de la ovulación (2mm/día) (López y Rodríguez 2005). En otro estudio con yeguas CC en Bogotá, se encontró un tamaño máximo preovulatorio de 41,34 ± 2,14 (rango de 39 a 52 mm) y una tasa de crecimiento de 2,04 mm por día (Ramírez et al. 2010). En el presente estudio la tasa de crecimiento promedio en los dos CE fue más baja comparada con los estudios mencionados anteriormente (1,61 ± 0,4 mm/día) y el tamaño promedio del folículo preovulatorio fue mayor (44,3 ± 4,8 mm); estas diferencias en animales de la misma raza pueden deberse a factores extrínsecos como la ubicación geográfica, nutrición o edad. La velocidad de crecimiento del FD disminuyó el día antes de la ovulación (día -1) en los dos CE, lo que coincide con los reportes de Daels y Hughes (1993) y Ginther (1992).
El diámetro folicular es usado como una guía para predecir la ovulación en la yegua, pero el amplio rango en el diámetro de los folículos preovulatorios no permite hacer una predicción confiable del momento óptimo para realizar o permitir la inseminación. Sin embargo, en un estudio reciente se encontró que la mayoría de las yeguas (17/20) ovularon cuando los diámetros de los FD eran similares (0 a 3 mm de diferencia) en CE consecutivos (Cuervo-Arango y Newcombe 2008). En el presente estudio se reportó que la mayoría de las yeguas (n=21) ovularon con una diferencia en los folículos entre 0 y 4 mm y una menor cantidad de ellas, con una diferencia mayor de 5 mm (n=9) entre los CE analizados; esto coincide con el estudio mencionado anteriormente y puede sugerir que los diámetros foliculares registrados de ovulaciones previas pueden ser tenidos en cuenta para predecir el momento óptimo del servicio en CE consecutivos.
De otra parte, se encontró un mayor porcentaje de ovulaciones en el ovario derecho durante los dos CE, lo cual coincide con los hallazgos de Gastal (2009) quien reportó mayor presencia del FD en el ovario derecho (61%) comparado con el izquierdo (39%), si bien difiere de lo encontrado por Ginther (1995) quien estableció que un 56% de las yeguas ovularon por el ovario izquierdo y el 44% por el derecho; por su parte, Ramírez et al. (2010) reportaron 60% de ovulaciones en el ovario izquierdo y 40% en el derecho; Ginther (1992) encontró que el 47% de las yeguas ovularon del ovario izquierdo y 53% del derecho. Esta diferencia en el porcentaje puede ser un hallazgo incidental y requiere más estudios para determinar cuáles factores pueden influenciar la ubicación del folículo preovulatorio.
En este estudio se presentó un solo caso de ovulación doble en un CE de una yegua de 5 años de edad. Las variables que pueden afectar la presencia de ovulaciones dobles en yeguas son la raza, la edad, el estado reproductivo y el nutricional; aunque se ha reportado que la tasa de ovulaciones dobles es mayor en yeguas de la raza PSI y en yeguas mayores de 17 años (35,6%), también se ha encontrado una tasa de 20,7% en yeguas de 2 a 4 años (Davies Morel et al. 2005). Posiblemente la baja presentación de ovulaciones dobles en el presente estudio pueda deberse a la edad, ya que las yeguas analizadas tenían entre 4 y 14 años y a que la tasa de ovulaciones dobles es mayor en otras razas de equinos y puede ser baja en yeguas CC; además de lo encontrado en el presente estudio, solamente hay un reporte de un caso de ovulación doble en una yegua CC (López y Rodríguez 2005). Aunque se ha descrito que las ovulaciones dobles están asociadas a la presentación de dos folículos que continúan creciendo de forma paralela durante la desviación folicular, alcanzan la madurez y son ovulados, no se han establecido los factores que pueden llevar a la ocurrencia de ovulaciones múltiples en yeguas (Gastal 2009). Sin embargo, se ha encontrado que las diferencias en las concentraciones plasmáticas de hormonas entre las ovulaciones dobles y simples son más un efecto que una causa de las ovulaciones múltiples, debido a que en las yeguas que presentan ovulaciones dobles el FD tiene menor tamaño, el nivel de FSH plasmática es más bajo y los estrógenos más altos entre el día 2,5 y -0,5 antes de la ovulación, comparado con las yeguas que tienen ovulaciones simples (Ginther et al. 2008).
El comportamiento de estro en la yegua es evidente durante 5 a 7 días en promedio; la duración depende de la yegua y del período estacional (Pryor y Tibary 2005). La duración del estro en el presente estudio fue de 5,9 días con un rango de 1 a 11 días, lo cual está influenciado posiblemente por factores intrínsecos y extrínsecos de cada yegua (Daels y Hughes 1993). Esta amplia variación en el rango de duración del comportamiento de estro sugiere que la evidencia o ausencia de los signos de estro no son un factor seguro para determinar el momento óptimo para realizar la inseminación artificial o natural y deben ser observados en conjunto con otros aspectos como el diámetro folicular y el edema uterino (Samper y Pycock 2007).
El grado de edema y el tamaño folicular son marcadores importantes para decidir cuándo inseminar o aparear la yegua. La intensidad del edema uterino disminuye a medida que se acerca la ovulación (Cuervo-Arango y Newcombe 2008). Un edema uterino con valores entre 1 y 2, precedido por un grado de 3 y la presencia de un folículo grande es un buen indicador de ovulación inminente; por el contrario, un edema clasificado con bajo puntaje, con folículos de menor tamaño, puede indicar la presentación de estro temprano; además, la presencia de edema uterino es la mejor señal de la presentación de receptividad sexual en la yegua normal aún cuando no presente signos evidentes. Las yeguas que tienen un grado de edema uterino alto en el momento de la ovulación pueden ser propensas a acumular líquidos dentro del útero después de la inseminación o monta natural (Samper y Pycock 2007).
El comportamiento de estro es un buen indicador de la presencia de celo en la yegua, y en el presente estudio se pudieron observar los signos más comunes descritos en la literatura en la mayoría de las yeguas (Crowell-Davis 2007; McDonnell 2000); esto destaca la importancia de observar el comportamiento de las yeguas ante el macho para determinar la etapa del estro en que se encuentra la yegua. Los signos de comportamiento de estro descritos en la literatura coinciden con los encontrados en este estudio, donde los más frecuentes fueron la eversión rítmica del clítoris, levantamiento de la cola y micción frecuente; cuando una yegua presenta estos signos y además permanece quieta probablemente está en estro, si por el contrario es agresiva ante el macho lo más probable es que esté en diestro (Crowell-Davis 2007); lo cual se evidenció en este estudio. Sin embargo, el llamado 'recelaje' (detección de presencia de estro con el uso de un macho entero) no es 100% seguro para determinar el estado del estro y la intensidad y duración de los signos de estro, porque ellos pueden variar en cada yegua. En este estudio se observó un caso donde no se evidenció ningún signo de celo, al contrario la yegua se mostró agresiva ante el macho, a pesar de tener un desarrollo folicular normal. El celo no expresado, en donde la yegua tiene desarrollo folicular y ovula pero sin mostrar signos de celo, puede deberse a factores sociales de dominancia en grupos de yeguas o a factores particulares de preferencia por un macho en particular, por esto es recomendable hacer la detección de celo con machos diferentes y de manera individual (Crowell-Davis 2007).
Según Cuervo-Arango y Newcombe (2008), el grado de edema uterino se repite en ciclos consecutivos lo cual coincide con lo encontrado en este estudio, aunque se presentó el caso de una yegua que no presentó ningún grado de edema durante el primer CE, el cual fue de 18 días de duración, con evidencia de signos de celo solamente el día anterior y el día siguiente a la ovulación, que ocurrió cuando el FD tenía un diámetro de 36,8 mm de diámetro. Si bien el siguiente CE fue de la misma duración, sí se encontró edema, signos de celo más evidente y un folículo de mayor diámetro. Estas variaciones individuales en el patrón de edema uterino deben ser aclaradas y es deseable determinar si están correlacionadas con variaciones en los niveles plasmáticos de estrógenos que puedan estar alterando la presentación de edema y del comportamiento característico de estro.
CONCLUSIONES
Se determinó que la duración del CE de un grupo de yeguas CC en la zona rural de Pereira fue de 21,5 ± 1,8 días y del estro de 5,9 ± 1,8 días. El tamaño promedio al momento de la ovulación del folículo preovulatorio fue de 44,3 ± 4,8 mm, con una tasa de crecimiento promedio de 1,6 ± 0,4 mm/día para el FD y de 0,67 ± 0,4 mm/día para el FS. La tasa de crecimiento del FD disminuyó aproximadamente un día antes que ocurriera la ovulación.
Aunque durante todo el ciclo estral se evidenció actividad folicular, ésta fue menor durante la fase de diestro temprano. Se evidenció una sola onda de crecimiento folicular en todas las yeguas analizadas, con la presencia de un FD que terminó en ovulación. Así mismo, se encontró que hay más ovulaciones por el ovario derecho que por el ovario izquierdo en los dos CE analizados. Solamente hubo un caso de ovulación doble en una yegua de 5 años de edad, la cual se presentó en un solo CE de los dos estudiados; esto puede indicar que la yegua CC tiende a presentar ovulaciones simples comparada con otras razas.
Para aumentar la eficiencia reproductiva en un criadero o en cada animal se deben tener en cuenta diferentes variables en conjunto como son el tamaño folicular en la ovulación, el edema uterino, y la disposición de la yegua al caballo; en este sentido, el grado de edema uterino es esencial para determinar el estro, además, cuando se encuentra un folículo de gran tamaño y el edema alcanza un nivel máximo y disminuye días después puede indicar que ocurrirá la ovulación y es un momento óptimo para llevar a cabo la inseminación artificial o monta natural.
La variación de los resultados entre los animales es muy amplia, por esto siempre se debe recordar la individualidad en el comportamiento reproductivo de cada animal. Siempre se debe tener en cuenta que existen factores propios a cada individuo bien sean, genéticos, medioambientales y nutricionales que pueden influenciar y hacer variar la fisiología reproductiva. Por esto, es importante realizar seguimientos más detallados y continuos y llevar registros individuales que permiten conocer el comportamiento de cada animal y la duración del CE en cada individuo.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia por la financiación parcial de esta investigación. Al Laboratorio de Hormonas de la Universidad Nacional de Colombia por permitir el procesamiento y lectura de las muestras. A Fedequinas por la ayuda en la financiación de este trabajo. A los diferentes criaderos equinos que prestaron sus animales para este estudio.
REFERENCIAS
1. Bergfelt DR, Adams GP. 2007. The normal female reproductive system. Ovulation and corpus luteum development. En: Samper JC, Pycock JF, McKinnon AO, editors. Current Therapy in Equine Reproduction. Missouri: Saunders Elsevier. p. 1-13. [ Links ]
2. Boeta M, Porras A, Zarco LA, Aguirre-Hernández R. 2006. Ovarian activity of the mare during winter and spring at a latitude of 19o21' north. J Equine Vet Sci. 26(2): 55-58. [ Links ]
3. Crowell-Davis SL. 2007. Sexual behavior of mares. Hormones and Behavior. 52: 12-17. [ Links ]
4. Cuervo-Arango J, Newcombe JR. 2008. Repeatability of preovulatory follicular diameter and uterine edema pattern in two consecutive cycles in the mare and how they are influenced by ovulation inductors. Theriogenology. 69(6): 681-687. [ Links ]
5. Daels PF, Hughes JP. 1993. The normal estrous cycle. En: McKinnon AO, Voss JL, editors. Equine Reproduction. Philadelphia: Lea & Febiger. p. 121-132. [ Links ]
6. Davies Morel MCG, Newcombe JR, Swindlehurst JC. 2005. The effect of age on multiple ovulation rates, multiple pregnancy rates and embryonic vesicle diameter in the mare. Theriogenology. 63: 2482-2493. [ Links ]
7. Donadeu FX, Ginther OJ. 2002. Changes in concentrations of follicular fluid factors during follicle selection in mares. Biol Reprod. 66: 1111-1118. [ Links ]
8. Gastal EL, Gastal MO, Bergfelt DR, Ginther OJ. 1997. Role of diameter differences among follicles in selection of a future dominant follicle in mares. Biol Reprod. 57: 1320-1327. [ Links ]
9. Gastal EL, Gastal MO, Wiltbank MC, Ginther OJ. 1999. Follicle deviation and intrafollicular and systemic estradiol concentrations in mares. Biol Reprod. 61: 31-39. [ Links ]
10. Gastal EL. 2009. Recent advances and new concepts on follicle and endocrine dynamics during the equine periovulatory period. Anim Reprod. 6(1): 144-158. [ Links ]
11. Ginther OJ. 1992. Reproductive Biology of the Mare: Basic and Applied Aspects. 2nd ed. Madison (WI): Equiservices Publishing. 642 p. [ Links ]
12. Ginther OJ. 1995. Ultrasonic Imaging and Animal Reproduction: Horses. Book 2. Madison (WI): Equiservices Publishing. 394 p. [ Links ]
13. Ginther OJ. 2000. Selection of the dominant follicle in cattle and horses. Anim Reprod Sci. 60-61: 61-79. [ Links ]
14. Ginther OJ, Beg MA, Bergfelt DR, Donadeu FX, Kot K. 2001. Follicle selection in monovular species. Biol Reprod. 65: 638-647. [ Links ]
15. Ginther OJ, Beg MA, Gastal MO, Gastal EL. 2004. Follicle dynamics and selection in mares. Anim Reprod. 1(1): 45-63. [ Links ]
16. Ginther OJ, Utt MD, Beg MA. 2007. Follicle deviation and diurnal variation in circulating hormone concentrations in mares. Anim Reprod Sci. 100: 197-203. [ Links ]
17. Ginther OJ, Gastal EL, Rodrigues BL, Gastal MO, Beg MA. 2008. Follicle diameters and hormone concentrations in the development of single versus double ovulations in mares. Theriogenology. 69(5): 583-590. [ Links ]
18. Henao G, Trujillo LE. 2003. Dinámica folicular y función lútea durante la gestación temprana. Estudio de un caso en Bos indicus. Rev Fac Nal Agr. 56(1): 1779-1788. [ Links ]
19. Ideam. 2005. Atlas Climatológico de Colombia. Parte III - Aspectos Departamentales [Internet]. Bogotá: Centro de documentación e Información científico técnica - Instituto de Hidrología, Meteorología y estudios ambientales de Colombia [Ideam]; [citado 2007 jun 01]. Disponible en: http://documentacion.ideam.gov.co/openbiblio/Bvirtual/019711/AtlasClimatico3.pdf. [ Links ]
20. López JJ y Rodríguez CA. 2005. Dinámica ovárica y niveles de progesterona durante el ciclo estral de yeguas criollas colombianas en la Sabana de Bogotá-Colombia. [Tesis de Pregrado]. [Bogotá, Colombia] Universidad Nacional de Colombia. [ Links ]
21. Madill S. 2002. Reproductive considerations: mare and stallion. Vet Clin Equine. 18: 591-619. [ Links ]
22. Markovic D, Pavlovic M, Pavlovic V. 2003. Seasonality, folliculogenesis and luteogenesis in mare ovaries. Facta universitatis - Series: Medicine and Biology. 10(3): 120-126. [ Links ]
23. Ojeda D, Barbosa C, Pinto J, Cardona MC, Cuéllar M, Cruz S, De la Torre LS, Castañeda J, Barrera CR, González Y, Alarcón JC. 2001. Ecosistemas. En: El medio ambiente en Colombia. [Internet]. Bogotá: Centro de documentación e Información científico técnica - Instituto de Hidrología, Meteorología y estudios ambientales de Colombia [Ideam]; [citado 2008 feb 01]. Disponible en: https://documentacion.ideam.gov.co/openbiblio/Bvirtual/000001/cap7.pdf. [ Links ]
24. Pryor P, Tibary A. 2005. Management of Estrus in the Performance Mare. Clin Tech Equine Pract. 4: 197-209. [ Links ]
25. Ramírez G, Gutiérrez C, Ramos M. 2010. Dinámica folicular en yeguas Paso Fino colombiano medido por ultrasonografía en la Sabana de Bogotá. Rev Med Vet. 19: 21-35. [ Links ]
26. Samper JC. 1997. Ultrasonographic appearance and the pattern of uterine edema to timed ovulation in mares. En: Proceedings of the 43rd Annual Convention of the American Association of Equine Practitioners; 1997 december 7-10, Phoenix, Arizona, USA, p.189-191. [ Links ]
27. Samper JC, Pycock JF. 2007. The normal female reproductive system. The normal uterus in estrus. En: Samper JC, Pycock JF, McKinnon AO, editors. Current Therapy in Equine Reproduction. Missouri: Saunders Elsevier. p. 32-35. [ Links ]