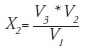Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.61 no.3 Bogotá Sep./Dec. 2014
https://doi.org/10.15446/rfmvz.v61n3.46872
http://dx.doi.org/10.15446/rfmvz.v61n3.46872
DETERMINACIÓN IN VITRO DE LA ACCIÓN PROBIÓTICA DE Lactobacillus plantarum SOBRE Yersinia pseudotuberculosis AISLADA DE Cavia porcellus
IN VITRO DETERMINATION OF THE PROBIOTIC Lactobacillus plantarum ACTION ON Yersinia pseudotuberculosis ISOLATED FROM Cavia porcellus
H. Jurado-Gámez1,2,*, F. Calpa-Yama2, A. Chaspuengal-Tulcán2
1 Programa de Zootecnia, Departamento de Producción y Procesamiento Animal, Facultad de Ciencias Pecuarias, Universidad de Nariño.
Ciudad Universitaria Torobajo, Cll. 18 Cr. 50, Pasto (Colombia).
2 Grupo de Investigación en Procesos Biotecnológicos Aplicados a la Producción Animal - Fisiología y Etología Animal (FISE- PROBIOTEC), Universidad de Nariño.
Ciudad Universitaria Torobajo, Cll. 18 Cr. 50, Pasto (Colombia).
* Autor para correspondencia: henryjugam@gmail.com
Artículo recibido: 10 de julio de 2014 • Aprobado: 15 de septiembre de 2014
RESUMEN
Se evaluó el efecto in vitro de Lactobacillus plantarum sobre Yersinia pseudotuberculosis aislada de cuyes (Cavia porcellus) e identificada bioquímica y molecularmente. Se determinó la viabilidad de L. plantarum a diferentes pH (3.25, 4.5, 7.6 y 8.2), sales biliares bovinas (3, 4 y 5%), bilis bovina (0.5, 1 y 2%) y temperatura (38 y 45°C). Se realizó antibiograma a ambas bacterias con Cefalotina, Cefepima, Ciprofloxacina, Dicloxacilina, Enrofloxacina, Gentamicina, Penicilina y Trimetropim-Sulfametoxasol. Se determinaron los péptidos de L. plantarum mediante HPLC y la cinética de crecimiento en dos sustratos (MRS y Pro), midiéndose: biomasa, pH, consumo de azúcar total y ácido láctico. Se observó un mejor crecimiento bajo pH 3.25, sales biliares 5%, bilis bovina 2% y temperatura de 45°C con valores de 3.0·1012, 2.3·1012, 8.6·1011 y 3.0·1012 UFC/ml, respectivamente. L. plantarum y el sobrenadante inhibieron a Y. pseudotuberculosis, con halos de 3 y 5 mm. Se observó resistencia de L. plantarum y Y. pseudotuberculosis a Penicilina y Dicloxacilina, respectivamente, con sensibilidad de ambas cepas a los demás antibióticos. Se evidenciaron los péptidos VAL-TIR-VAL y TIR-GLI-GLI-FA-MET en el sobrenadante de L. plantarum. Durante la fase logarítmica para los medios MRS y Pro se alcanzaron valores de 6.75·1012 y 1.20·1012 UFC/ml (biomasa), 6.96 y 5.49 (pH), y 0.65 y 0.76%, (ácido láctico), respectivamente. La comparación de los medios mediante un diseño de bloques al azar (P > 0.05), mostró similar comportamiento. L. plantarum demostró su potencial probiótico en condiciones in vitro.
Palabras clave: antibióticos, biomasa, inóculo, funcional.
ABSTRACTThe in vitro effect of Lactobacillus plantarum on Yersinia pseudotuberculosis isolated from guinea pig identified and evaluated biochemical and molecular. L. plantarum viability was determined at different pH (3.25, 4.5, 7.6 y 8.2), bovine bile salts (3, 4 y 5%), bovine bile (0.5, 1 y 2%) and temperature (38 y 45°C). Both bacteria susceptibility was performed with Cephalothin, Cefepime, Ciprofloxacin, Dicloxacillin, Enrofloxacin, Gentamicin, Trimethoprim-Sulfamethoxazole and Penicillin. L. plantarum peptides were determined by HPLC and growth kinetics on two substrates (MRS and Pro), measuring biomass, pH, total sugar consumption and lactic acid. Better growth was observed at 3.25 pH, 5% bile salts, 2% bovine bile and temperature 45 °C. with values 3,0·1012, 2.3·1012, 8.6·1011 y 3.0·1012 UFC/ml, respectively. L. plantarum and the supernatant inhibited Y. pseudotuberculosis, with halos of 3 to 5 mm. L. plantarum and resistance to penicillin and Y. pseudotuberculosis Dicloxacillin was observed, respectively, with sensitivity of both strains to other antibiotics. Peptides were evidenced VAL-TIR-VAL y TIR-GLI-GLI-FA-MET in the supernatant of L. plantarum. During the logarithmic phase for MRS and Pro 1012 values were reached 6.75·1012 y 1.20·1012 CFU / ml (biomass), 6.96 and 5.49 (pH) and 0.65 and 0.76 % (lactic acid) respectively. The comparison of means using a randomized block design (P > 0.05) showed similar behavior. L. plantarum demonstrated their probiotic potential in vitro conditions.
Keywords: Antibiotics, biomass, inoculum, functional.
INTRODUCCIÓN
Los sistemas de producción se ven afectados por diversas enfermedades de carácter microbiano que resultan en pérdidas significativas para el productor. En los sistemas de producción del cuy (Cavia porcellus) tipo carne, se observa que las enfermedades bacterianas más importantes son la yersiniosis (Yersinia pseudotuberculosis), la salmonellosis (S. typhimurium y S. enteriditis) y la colibacilosis (E. coli) (Correa 2000). Dentro de este marco sanitario se encuentran grandes obstáculos que impiden el restablecimiento de la sanidad en el cuy, ya que en la actualidad no se han determinado tratamientos específicos para este tipo de enfermedades; por esta causa se usan medicamentos inadecuados para la especie, con efectos desconocidos y la generación de efectos residuales (Calpa y Chaspuengal 2013).
Actualmente parte de la investigación se encuentra encaminada a controlar ciertas bacterias patógenas e infecciones con organismos aislados del huésped. Este tipo de microorganismos vivos tienen un efecto benéfico en el tracto intestinal, manteniendo y fortaleciendo los mecanismos de defensa contra patógenos sin alterar las funciones fisiológicas y bioquímicas. Estos microorganismos se denominan probióticos (Guevara 2011). Los principales géneros utilizados como probióticos en cultivos puros o mezclas son Aspergillus, Saccharomyces, Bacillus, Bacteroides y Lactobacillus (Sumano y Ocampo 2006).
A menudo Lactobacillus ha sido asociado con varios efectos benéficos en la salud humana y animal (Iñiguez et al. 2007). Este tipo de microorganismos son una alternativa al uso de los antibióticos con el fin de equilibrar la microbiota intestinal (Oyetayo y Oyetayo 2005).
MATERIALES Y MÉTODOS
La presente investigación se realizó en el laboratorio de Microbiología perteneciente al programa de Zootecnia, Universidad de Nariño (Colombia). Se utilizaron cepas comerciales de Lactobacillus plantarum (ATCC 8014TM®) y cepas patógenas de Yersinia pseudotuberculosis aisladas de lesiones de bazo, hígado, pulmón, riñón, páncreas y ganglios linfáticos mesentéricos, cervicales e inguinales de Cavia porcellus (cuy) del departamento de Nariño. La cepa de Yersinia pseudotuberculosis se identificó en forma bioquímica y molecular, la primera mediante kit comercial para enterobacterias no fermentadoras (BBL Crystal®) (Jaramillo-Torres et al. 2008) y la segunda por PCR simple realizado en el laboratorio de Biología Molecular de la Universidad de Nariño, mediante los procedimientos indicados por Jaramillo-Torres et al. (2008).
Para mantener activa la cepa de Yersinia, se realizó repique en medios sólido y líquido: como medio solido se utilizó agar McConkey y como medio líquido caldo BHI. Estos preservados se incubaron por 24 h a 37°C y se almacenaron a una temperatura de 4°C. En cada repique o siembra se confirmó su pureza mediante tinción de Gram.
La cepa de L. plantarum se reactivó por rehidratación en caldo MRS y se incubó a 37°C por 24 h de acuerdo con las instrucciones del fabricante. Después de la hidratación se mantuvo en caldo y agar MRS para incubarse a 32°C por 24 h; finalmente fue refrigerada y almacenada a 4°C.
Se inoculó una alícuota de L. plantarum en un Erlenmeyer con 40 ml de caldo MRS estéril comercial que se incubó durante 24 h a 37°C. Luego se realizó un repique de 4 ml y se transfirió a otros 40 ml de caldo MRS para incubar en las condiciones antes mencionadas. Se ajustó el inóculo de acuerdo con Crueger y Crueger (1993). Para ello, se prepararon 90 ml de caldo MRS estéril y se añadieron 10 ml de inóculo probiótico con la aplicación de la regla. Después de este tiempo, se estimó el número de bacterias por ml de caldo MRS, se tomó 1 ml y se realizó lectura directa en el espectrofotómetro a 625 nm. Cuando se presentó una mayor población de caldo estéril establecida se añadió teniendo en cuenta el cálculo matemático de proporcionalidad de acuerdo con Guerrero citado por Montes et al. (2003):
Es el valor de X1:
M1 ------ V1
M2 ------ X1
Entonces V2 será:
V2 = V1-X1
Finalmente se obtiene el valor de X2:
V1 ------ V2
V3 ------ X2
El valor de X2 es la cantidad que debe ser añadida a 100 ml para ajustar la población de 1.50·108 UFC/ml.
M1 = Población o densidad de las células que se deben ajustar.
M2 = 0.125 densidad óptica equivalente al estándar de Mac Farland 1.50·108 UFC/ml. Densidad utilizada para la primera fermentación.
V1 = 1 ml del volumen total de inóculo (10/90).
X1 = la cantidad que contiene M2.
V2 = lo que se añadió a 1 ml para ajustar a 1.50·108 UFC/ml.
V3 = 100 cantidad total ml de inóculo.
X2 = cantidad de caldo MRS estéril comercial que se añade a V3 para la población con el fin de ajustar el valor de M2.
Se estudió la viabilidad de L. plantarum a diferentes niveles de pH (3.25 control, 4.5, 7.6 y 8.2), tres porcentajes de sales biliares bovinas (3, 4 y 5%) y dos concentraciones de bilis bovina Sigma (0.5, 1 y 2%), fue determinada actividad de catalasa y producción de gas. Se realizó pruebas de crecimiento de la bacteria láctica a diferentes temperaturas (38 y 45°C), sembrada en medio Pro formulado a partir de azúcar blanco (10 g/l), leche de soya (15 g/l), leche en polvo (150 g/l) y salvado de trigo (15 g/l) (Jurado-Gámez 2010) por 14:24 h (fase logarítmica). Posteriormente, se efectuaron pruebas de viabilidad en agar MRS por 48 h a 32°C. Fueron seleccionadas las cajas de Petri con viabilidades de 30 y 300 UFC/ml y valores de dilución iguales o superiores a 107 UFC/ml. Para las metodologías se utilizaron los procedimientos de Dahl et al. (1989), Cai et al. (1998) y Cai et al. (1999).
La prueba de inhibición in vitro de Y. pseudotuberculosis se llevó a cabo mediante una adaptación del método de Tagg y McGiven (1971). Los discos se impregnaron con L. plantarum en cantidades de 25, 50 y 100 µl y se colocaron en cajas de Petri con agar Mueller Hinton previamente cultivadas con las bacterias patógenas; se incubaron a 32°C durante 18 h, al cabo de las cuales se realizó la lectura de los halos formados, teniendo en cuenta la distancia desde el borde del disco de agar con la bacteria láctica hasta el final del halo de inhibición de las bacterias patógenas. El tamaño crítico de halo para determinar si hay inhibición se consideró igual o superior a 2 mm (Estrada et al. 2005).
Para el ensayo de inhibición en sobrenadantes, se centrifugó 1.5 ml de muestra de las bacterias lácticas a 4°C a 1000 rpm por 15 min; el sobrenadante se filtró en membrana de 0.20 micras. La actividad bactericida se evaluó mediante dos métodos de difusión modificados: discos y cilindros de plástico, en agar Mueller Hinton inoculado con la cepa patógena. Para el método de discos, se añadieron 50, 75 y 100 µl de la bacteriocina en discos de papel de filtro de 8 mm de diámetro pre-esterilizado (15 min a 121°C y 15 PSI). Más tarde se colocaron en la superficie del agar los discos con la bacteriocina, y las placas de Petri se incubaron a 35°C por 18 h. Para el método con cilindros se utilizaron puntas de pipetas estériles cortadas a partir de 8 mm de diámetro, colocadas en placas de Petri y en las que se añadieron las diferentes cantidades de sobrenadante. Finalmente se llevaron a tiempo de incubación en las condiciones anteriormente descritas. La inhibición se determinó por el halo producido alrededor del sensidisco y el cilindro, finalmente se midió la distancia de los discos finales y el borde de halo.
Para determinar la susceptibilidad de Y. pseudotuberculosis y L. plantarum a los antibióticos se usó el método de Kirby Bauer (Bauer et al. 1966); se compararon ocho antibióticos comerciales (Cefalotina Kf 30 µg, Cefepima Fep 30 µg, Ciprofloxacina Cip 5 µg, Dicloxacilina Dcx 1 µg, Enrofloxacina Enr 5 µg, Gentamicina Cn 10 µg, Penicilina GP 10 IU y Trimetoprim-sulfametoxasol COT 25 µg). El efecto del antibiótico fue determinado por el diámetro del halo que se produjo alrededor de los sensidiscos, después de 18 h de crecimiento en el medio, donde crecían las bacterias patógenas (Tagg y Mcgiven 1971).
Se midió el contenido de péptidos del sobrenadante de L. plantarum a través del método HPLC-DAD (Cromatógrafo líquido HPLC Waters con bomba binaria 1525; columna C18 300ª). Para ello la cepa se cultivó en caldo MRS durante 24 h a 32°C, se ajustó posteriormente mediante espectrofotometría a una densidad óptica de 0.125 en escala equivalente 0.5 estándar de McFarland a una concentración de 1.5·108 UFC/ml. Las muestras se transfirieron a tubos Eppendorf y se centrifugaron a 18000 rpm durante 30 min a 4°C. El sobrenadante se filtró utilizando membranas de PVDF de 0.20 micrómetros y se obtuvo la lectura (Higuera, 2000). Se usó un cromatógrafo líquido HPLX aguas con bomba binaria 1525, con columna C18 300A (Júpiter, Phenomeme · 150 mm · 4.6 mm), detector PDA 2998-214 y 280 nm Scan e inyector Rheodyne Loop 20 µl.
La cinética de la fermentación se llevó a cabo en dos sustratos diferentes, el medio comercial MRS y el medio Pro. La cinética se realizó en un Erlenmeyer con 600 ml del medio y las bacterias probióticas fueron fijadas a una concentración inicial de 1.50·108 UFC/ml (540 ml del medio y 60 ml de inóculo), se continuó en agitador a 100 rpm y se incubó a 32°C. Las variables evaluadas durante la cinética fueron: producción de biomasa por recuento de microorganismos viables en placa (UFC/ml), consumo total de azúcar por el método de antrona (Dubois et al. 1956) a 625 nm, determinación de pH medido con pHmetro digital (pH Jenco® Vision Plus) y la producción de ácido láctico mediante titulación con 0.1 N de hidróxido de sodio. El muestreo se llevó a cabo por duplicado desde el tiempo cero y posteriormente cada 02:24 h durante 24 h para un total de 11 periodos con el fin de determinar los parámetros de fermentación.
La técnica de recuento en placa proporciona información sobre el número de células viables durante el proceso en términos de UFC/ml; de este modo se determinó la evolución que presenta la producción de biomasa. Dado que la cantidad de sólidos en suspensión fue alta, no se hizo medición en peso seco ni turbidimétricamente. Para los recuentos se diluyó 1 ml de muestra en 9 ml de agua peptonada 0.1% y se hicieron diluciones decimales; cada dilución de 100 µl se sembró en placas de Petri con MRS más azul de anilina. Las cajas se incubaron a 32°C y se observaron entre 24 y 48 h. Se consideraron las placas de Petri con un recuento de UFC/ml entre 30 y 300 colonias. El número de colonias se multiplica por el inverso de la dilución y por 10 para la UFC/ml formada (Lanara 1981) y estadísticamente se trabajó bajo transformación logarítmica natural.
Para determinar los azúcares con el método de Antrona (Dubois et al. 1956), se preparó previamente una curva estándar con diversas concentraciones de solución patrón de glucosa (Figura 1), los valores obtenidos mediante la lectura de densidad óptica (DO) a 625 nm, se presentan frente a la concentración en mg/l y se obtuvo los valores de la ecuación de la línea. Para las muestras obtenidas a partir de diferentes cinéticas de tiempo se realizaron lecturas de absorbancia en espectrofotómetro a 625 nm, y se procedió a aplicar la fórmula para valores de X para cada tiempo, teniendo en cuenta que se ha trabajado en la base de una dilución de 1/100 y 1/1000 para MRS y Pro, respectivamente.
Los resultados indicarán si la cepa parece ser la más adecuada en términos de tiempo y la tasa de crecimiento durante el proceso de fermentación para establecer el tiempo de duración en la producción de biomasa. Los cálculos de la cinética de fermentación fueron los definidos por Crueger y Crueger (1993) y Rodríguez-León et al. (2003).
Dado que la tasa de crecimiento específico fue definida por la ecuación:
![]()
Para el tiempo de duplicación celular se tiene:
![]()
El conteo de microorganismos viables en placa UFC/ml obtenida durante la cinética de fermentación, adoptó un diseño de bloques al azar (DBA), los medios fueron considerados como los tratamientos y las horas de evaluación correspondió a los bloques (11 h), el comportamiento fue evaluado desde el tiempo 0 (cero h), hasta el tiempo 11 (24 h), se analizaron dos réplicas para cada medio y tiempo. El modelo matemático fue el siguiente:
![]()
Donde,
Yij = Observación de la i-ésima unidad en el j-ésimo bloque.
μ = Media general del experimento.
αj = efecto del tratamiento en el j-ésimo nivel.
βj = Efecto del bloque.
εij = Error asociado a la i-ésima unidad y el j-ésimo bloque.
Los datos se analizaron mediante el procedimiento PROC GLM del paquete estadístico S.A.S. Versión 9.1 (SAS Institute 2004).
RESULTADOS
Los resultados de identificación de Y. pseudotuberculosis, mediante el kit comercial para enterobacterias no fermentadoras, indicó la presencia del microorganismo. Igualmente, la prueba molecular por PCR, confirmó que la cepa aislada correspondía a Y. pseudoturberculosis.
El crecimiento microbiano (UFC/ml) para la cepa probiótica, evaluada bajo diferentes concentraciones de pH, demostró valores satisfactorios con índices altos de 2.9·1012, 3.2·1011 y 3.3·1012 UFC/ml, para los tiempos 0, 1 y 2 respectivamente (Tabla 1); incluso el pH más bajo (3.25), tomado como punto control, reflejó valores entre 2.7·108 y 3.1·1012 UFC/ml, señalando valores de viabilidad altos.
Los resultados de la prueba de viabilidad a concentraciones de 3, 4 y 5% de sales biliares muestran un buen promedio de crecimiento de L. plantarum, con valores de 4.5·1011, 9.6·1011 y 2.2·1012 UFC/ml respectivamente. Igual comportamiento se observa con bilis bovina (Sigma®) 0.5, 1 y 2% con valores de 5.6·1011, 3.8·1011 y 8.4·1011 UFC/ml, respectivamente (Tabla 2).
Las pruebas de producción de gas y catalasa para L. plantarum fueron negativas. Por otra parte, los resultados obtenidos en la Tabla 3 muestran termotolerancia de la cepa a temperaturas de 38 y 45°C, sin afectar su crecimiento. Por su parte, los resultados de la acción inhibitoria de L. plantarum sobre Y. pseudotuberculosis, se presentan en la Tabla 4 y la Figura 2.
La prueba del sobrenadante de L. plantarum llevado a los 80°C sobre Y. pseudotuberculosis mostró resistencia de la bacteria patógena con valores entre 0 y 2 mm; sin embargo, se encontró mayor variabilidad en los resultados con halos de inhibición a pH 6 con valores entre 0 y 8 mm (Tabla 5 y Figura 3).
En la Tabla 6 se muestran los datos obtenidos de la prueba de susceptibilidad antimicrobiana de los antibióticos contra L. plantarum y Y. pseudotuberculosis. Por su parte, la Figura 4 muestra los halos de inhibición formados por los antibió- ticos.
El sobrenadante analizado por HPLC encontró dos péptidos. En el pico N°.9 (tr = 12.1 min), presentó un tiempo de retención similar al del pico No. 2 del estándar de calibración (Figura 6 y Tabla 7), por lo que, el péptido de esta muestra presente una cadena de aminoácidos compuesta por VAL-TIR-VAL (PM = 379.5). Los espectros UV presentan longitudes de máxima absorción similares (Tabla 8 y Figura 5).
El pico N°.3 del estándar, que corresponde al péptido metionina enkefalina acetato, de composición (TIR-GLI-GLI-FA-MET)M6638 (PM = 573.7 para la base libre), presenta un tiempo de retención similar al del pico N°.12 de la muestra. Los máximos de absorbancia de los espectros presentaron longitudes de máxima absorción muy cercanas.
En la Figura 7 se muestra el comportamiento de L. plantarum en los medios MRS y Pro durante las 24 horas de la cinética; las cepas tuvieron un comportamiento similar durante las primeras 09:36 h, pero el crecimiento máximo (fase exponencial) se presentó primero en el medio MRS a 12 h (tiempo 5) con un valor de 6.75·1012 UFC/ml; por otro lado, en el medio Pro el crecimiento máximo se logró 2:24 horas más tarde (tiempo 6) con un valor de 1.20·1012 UFC/ml, respectivamente, de esta manera se demostró una pequeña ventaja para el medio MRS.
En la Figura 8 los valores del azúcar total en los medios MRS y Pro fueron de10,64 mg/l y 27,83 mg/l respectivamente, a las 12:00 y 14:24 h de efectuada la cinética. Por tanto, como lo demuestra L. Plantarum esta vez usará más eficientemente este sustrato para el crecimiento en el medio Pro y MRS (30 y 27 Ln UFC/ml, respectivamente).
En la Figura 9 se presenta el pH reportado durante las 24 horas del proceso de fermentación, se observa que en la fase logarítmica (21,51 ln UFC/ml, tiempo 5) para el medio MRS el pH fue de 6,96, mientras que para el medio Pro en la misma fase ( 27,42 ln UFC/ml, tiempo 6), el pH fue de 5,49, después de estas horas sigue la disminución del pH con una acidez más alta como respuesta a la producción de ácido láctico por las bacterias lácticas.
En la Figura 10 se observa la producción de ácido láctico en los medios MRS y Pro para L. plantarum que presenta porcentajes de 0.63 y 0.76%, respectivamente, para llegar a la fase logarítmica, los datos correspondientes para el tiempo 5 y 6, que muestra una mayor producción de ácido a favor del medio Pro.
Los resultados de la producción de biomasa, en relación con la tasa de crecimiento específico (μh-1), fase de latencia (fase de retardo), la fase logarítmica tardía, tiempo de duplicación celular (minutos), crecimiento celular total y la fase de consumo total de azúcar logarítmica y la fase logarítmica, y el coeficiente de determinación (R2) se muestran en la Tabla 9.
La estadística mostró que los tiempos de evaluación presentaron diferencias estadísticas entre las horas de evaluación (P< 0.05). Se encontró un R2 alto (90%) por lo cual no se consideró el error estándar. El análisis de ANOVA indicó que los dos tipos de medios no muestran diferencias estadísticas significativas, por tanto, ambos pueden ser utilizados como medio de cultivo en el laboratorio.
DISCUSIÓN
El crecimiento bacteriano no se vió afectado por los niveles de pH, dado que las bacterias ácido lácticas (BAL) del género Lactobacillus siguen desarrollándose a pH relativamente bajo; esto favorece el proceso de fermentación debido a su capacidad de resistir la acidez que se produce en el estómago, que es uno de los principales obstáculos para el paso del probiótico a través del tracto gastrointestinal.
Los resultados obtenidos para sales biliares y bilis bovina, indican una característica importante de L. plantarum, por cuanto presenta altos recuentos bacterianos incluso en diluciones de 10-10. Las cepas destinadas a servir como probióticas deben ser capaces de pasar a través del tracto gastrointestinal sin sufrir alteraciones en su comportamiento fisiológico. Así, una cepa no sólo debe sobrevivir a las condiciones ácidas del estómago sino además, a sales biliares, con el fin de ejercer efectos benéficos en el intestino; por lo tanto, la tolerancia a la bilis se considera como una de las propiedades más importantes de los microorganismos (Iñiguez et al. 2007).
Jay 1982 citado por Mora y García (2007), menciona que los lactobacilos pueden desarrollarse con límites de temperatura que oscilan entre 2 y 52°C, siendo su rango óptimo de crecimiento entre 30 a 40°C. Por tanto, esta es una característica importante de la bacteria puesto que le permite crecer en diferentes temperaturas, observándose en este caso que a una temperatura de 45°C en algunas diluciones presenta un mayor número de UFC (3.0·1012 UFC/ml) y no afecta su crecimiento. A un rango de temperatura de 38°C, la cepa probiótica se podría usar para otras aplicaciones como incorporar esta bacteria a concentrados para la alimentación animal mediante métodos de secado. Además, con el uso de esta bacteria como probiótico en animales, como por ejemplo el cuy, debe resistir su temperatura corporal (38°C), lo que permitiría colonizar el tracto gastrointestinal del animal.
Al respecto de la importancia de la temperatura en el crecimiento y producción de sustancias antimicrobianas, Dalié et al. (2010) mencionan que la temperatura y el período de incubación, son factores esenciales que modulan el crecimiento de las BAL y pueden llegar a afectar considerablemente las cantidades producidas de metabolitos antimicrobianos.
El ensayo de inhibición in vitro mostró que L. plantarum es capaz de ejercer un efecto inhibidor contra Y. pseudotuberculosis con halos entre 2 y 3 mm de distancia, que son independientes de la cantidad de discos manejados en agar. Este proceso probablemente se deba a la producción de sustancias como resultado de la fermentación, principalmente la generación de compuestos antimicrobianos, tales como los ácidos láctico, acético y propiónico, el peróxido de hidrógeno (H2O2), la reuterina, el dióxido de carbono (CO2), el diacetilo (2,3-butanodiona), el acetaldehído y compuestos de alto peso molecular como las bacteriocinas (Ramírez 2005).
El sobrenadante llevado a altas temperaturas (80°C) no presenta inhibición de la bacteria patógena, por lo cual se observa efecto adverso de ésta sobre la capacidad inhibitoria del sobrenadante. Al respecto, Zapata et al. (2009) indican que la estabilidad térmica de las bacteriocinas derivadas de bacterias lácticas de bajo peso molecular es muy importante por cuanto estos compuestos son utilizados en muchos procesos de las industrias alimentarias en donde tienen que pasar por diferentes procesos con altas y bajas temperaturas. Los métodos empleados (disco, cilindros y pozos), no presentaron una variación notable, por lo que se consideran adecuados para la evaluación de la inhibición de las bacterias patógenas.
La prueba antimicrobiana sobre Y. pseudotuberculosis indicó resistencia a la dicloxacilina, siendo sensible a los demás antibióticos. La sensibilidad presentada en este estudio es de gran importancia, ya que el mecanismo de acción de los antibióticos sobre las bacterias patógenas utilizadas se confirma, ya que varias especies de la familia Enterobacteriaceae tienen patrones de resistencia para ciertos aminoglucósidos, fluoroquinolonas y cephalosporina (Navarro et al. 2010). Por su parte, L. plantarum mostró resistencia a la penicilina y sensibilidad a los otros antibióticos, lo que sugiere que las bacterias ácido lácticas no pueden administrarse en dietas o alimentos que contengan antibióticos a los que son sensibles, dado que inhiben su efecto.
Los espectros UV de péptidos estándar mostraron gran similitud para preparados en longitudes de absorción máxima de la muestra, con lo que se estableció la presencia de los dos péptidos. Por lo tanto, la presencia de estas sustancias, sugiere que la concentración y la diversidad de péptidos depende del microorganismo que fermenta el sustrato donde se desarrolló (Gonzáles-Olivares et al. 2010).
De acuerdo con los resultados de la cinética, el medio MRS sería el medio más adecuado para la preparación de los inóculos debido a que presenta el mayor aumento de células en la fase final (en términos de UFC/ml) con mejores resultados que el medio Pro; sin embargo, debe tenerse en cuenta la tasa de crecimiento específico (μh-1), ya que se observan diferencias, con la obtención de valores de 2.971 a 2.597 para los medios Pro y MRS, respectivamente, y tiempos de 14 y 16 min.
Los valores de biomasa (UFC/ml) durante la cinética del proceso indican ser los adecuados para su uso en la preparación de inóculos probióticos, puesto que -incluso en el caso de productos alimenticios- el nivel de bacterias viables es generalmente insignificante en productos de suplementos dietéticos, donde se requieren niveles de 0.1-10000000000, y en productos lácteos que requieren entre 200 y 300 millones por taza (California Dairy Research Foundation 2011).
Los valores del consumo total de azúcar (33.04 y 51.06% para los medios MRS y Pro, respectivamente), indican que ambos presentan velocidades específicas de crecimiento bastante similares (2.971 y 2.597 μh-1), que permiten lograr incrementos celulares al final de la fase logarítmica de 6.75·1012 y 1.20·1012 UFC/ml para MRS y Pro, respectivamente. Por consiguiente estos medios son óptimos para su uso en la preparación de inóculos, principalmente el medio Pro, en comparación con el medio MRS. Para mantener la fase logarítmica durante la cinética se debe garantizar una cierta cantidad de nutrientes, incluyendo azúcar, con el fin de promover el crecimiento y una cantidad dada de biomasa.
El ácido láctico producido por L. plantarum refleja su pertenencia al grupo de bacterias ácido lácticas (BAL); para el caso, se ha clasificado en el grupo de los microorganismos heterofermentativos dado que sólo puede producir ácido láctico al 50%, la otra mitad corresponden a cantidades considerables de etanol, ácido acético y dióxido de carbono (Ramírez 2005). De acuerdo con Samaniego y Sosa (2012), la producción de ácido láctico se produce a partir de la fermentación de hexosas a ácido láctico por la vía Embden-Meyerhoff.
Aunque los cálculos estadísticos no muestran ventajas para el medio de cultivo Pro, si se tiene en cuenta el punto de vista económico, su importancia destacaría como medio de cultivo para la producción de UFC/ml, dado que resulta más barato; además, proporciona los nutrientes necesarios para el crecimiento de bacterias lácticas y permite la producción de inóculo probiótico para futuros estudios en animales in vivo.
CONCLUSIONES
Se concluye que el probiótico L. plantarum demostró su potencial para actuar en contra de Y. pseudotuberculosis en condiciones in vitro, con una adecuada formación de biomasa para la producción de inóculo. Se debe investigar su utilización in vivo, mediante la administración a cuyes en diferentes etapas de producción.
REFERENCIAS
Bauer A, Kirby J, Sherris T. 1966. Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. [Internet]. [Citado 2013 julio 18]; 36:493-496. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/5325707 [ Links ]
Cai Y, Benno Y, Nakase T, Oh T. 1998. Specific probiotic characterization of Weissella hellenica DS-12 isolated from flounder intestine. J Gen Appl Microbiol. [Internet]. [Citado 2013 noviembre 24]; 44(5):311-316. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12501410 [ Links ]
Cai Y, Suyanandana P, Saman P, Benno Y. 1999. Classification and characterization of lactic acid bacteria isolated from the intestines of common carp and freshwater prawns. J Gen Appl Microbiol. [Internet]. [Citado 2013 noviembre 24]; 45(4):177-184. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12501375 [ Links ]
California Dairy Research Foundation (CDRF). Probiotics Basics. 2011. [Internet] [Citado 2013 octubre 9]. Disponible en: http://cdrf.org/home/checkoff-investments/usprobiotics/probiotics-basics/ [ Links ]
Calpa F, Chaspuengal A. 2013. Evaluación in vitro de Lactobacillus casei con características probióticas sobre Yersinia pseudotuberculosis. [Trabajo de grado]. [Pasto, Colombia] Universidad de Nariño. [ Links ]
Clinical and Laboratory Standards Institute. 2011. Performance Standards for Antimicrobial Susceptibility Testing. Twenty-First Informational. CLSI. 31(Supplement 1):1-172. [ Links ]
Correa R. 2000. Sanidad en cuyes. En: V Curso y V congreso Latinoamericano de Cuyicultura y Mesa Redonda sobre Cuyicultura Periurbana; 1999 octubre 11-14. Puerto Ayacucho, Estado de Amazonas, Venezuela, p. 92. [ Links ]
Crueger W, Crueger A. 1993. Biotecnología: manual de microbiología industrial. 3 ed. España: Ed. Acribia. 413 p. [ Links ]
Dahl T, Midden W, Hartman P. 1989. Killing of Gram-negative and Gram-positive Bacteria by Pure Singlet Oxygen. J Bacteriol. [Internet]. [Citado 2014 enero 20]; 171(4):2188-2194. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC209876/ [ Links ]
Dalié D, Deschamps A, Richar-Forget F. 2010. Lactic acid bacteria-Potential for control of mould growth and mycotoxins: A review. Food Control. [Internet]. [Citado 2014 enero 20]; 21:370-380. Disponible en: http://ciptaindomedica.files.wordpress.com/2011/01/lactic-acid-bacteria-e28093-potential-for-control-of-mould-growth-and-mycotoxins.pdf [ Links ]
Dubois M, Gilles K, Hamilton J, Rebers P, Smith F. 1956. Colorimetric method for determination of sugar and related substances. Anal Chem. [Internet]. [Citado 2014 enero 20]; 28: 350-356. [ Links ]
Estrada A, Gutiérrez L, Montoya O. 2005. Evaluación in vitro del efecto bactericida de cepas nativas de Lactobacillus sp.contra Salmonella sp. y Escherichia coli. Rev. Fac. Nal. Agr. Medellín. [Internet]. [Citado 2013 julio 18]; 58(1): 2601-2609. Disponible en: http://www.redalyc.org/articulo.oa?id=179914238002 [ Links ]
European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Versión 2.0, valid from 2012-01-01. [Internet] 2012 [Citado 2013 octubre 9]. Disponible en: http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/Breakpoint_table_v_2.0_120221.pdf [ Links ]
González-Olivares L, Jiménez-Guzmán J, Cruz-Guerrero A. Rodríguez-Serrano G, Gómez-Ruiz L, García-Gariba M. 2010. Liberación de péptidos bioactivos por bacterias lácticas en leches fermentadas comerciales. Rev. Mex. Ing. Quím. [Internet]. [Citado 2014 marzo 25]; 10(2):179-188. Disponible en: http://www.scielo.org.mx/pdf/rmiq/v10n2/v10n2a4.pdf [ Links ]
Guevara J. 2011. Probióticos en nutrición animal. Revisión bibliográfica. Sistema de Revisiones en Investigación Veterinaria de San Marcos (Sirivs). Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos. [Internet]. [Citado 2013 mayo 20]. Disponible en: http://www.unmsm.edu.pe/veterinaria/files/Articulo_guevara_probioticos.pdf [ Links ]
Higuera B. 2000. Estudio por HPLC de la acción de dos elicitores bióticos sobre la producción in vitro de metabolitos secundarios en células de clavel (Dianthuscaryophyllus L.). Rev. Colombiana de Química. [Internet]. [Citado 2014 enero 12]; 29(1):9-17. Disponible en: http://www.bdigital.unal.edu.co/21497/1/17944-57795-1-PB.pdf [ Links ]
Iñiguez P, Pérez R, Acedo F. 2007. Evaluation of probiotic properties in Lactobacillus isolated from small intestine of piglets. Rev Lat Am Microbiol. [Internet]. [Citado 2013 abril 10]; 49(3-4):46-54. Disponible en: http://www.medigraphic.com/pdfs/lamicro/mi-2007/mi07-3_4b.pdf [ Links ]
Jaramillo-Torres H, Patiño-Burbano R, Rodríguez-Bautista J. 2008. Detección de Yersinia pseudotuberculosis en heces de cuyes (Cavia porcellus) utilizando una metodología microbiológica y una molecular. Revista Corpoica. [Internet]. [Citado 2013 noviembre 24]; 9(2):62-71. Disponible en: http://www.corpoica.org.co/sitioweb/Archivos/Revista/DeteccindeYersiniaPseudotuberculosisenhecesdecuyes.pdf [ Links ]
Jurado-Gámez H. 2010. Evaluación de bacterias ácido-lácticas con características probióticas en la alimentación de lechones en fase de precebo como alternativa al uso de antibióticos. [Tesis Doctoral]. [Cali, Valle del Cauca] Universidad del Valle. [ Links ]
Lanara. Laboratorio de Referencia Animal. 1981. Métodos analíticos oficiáis para controle de produtos de origem animal e seus ingredients. Ii- Métodos físico e químicos. Mel. Ministério da Agricultura. Brasilia. 2 (25):1-15. [ Links ]
Montes A, Santacruz A, Sañudo J. 2003. Efecto in vitro de Lactobacillus casei subsp. rhamnosus sobre el crecimiento de un aislado de Helicobacter pylori. [Trabajo de grado]. [Pasto, Colombia] Universidad de Nariño. [ Links ]
Mora N, García A. 2007. Susceptibilidad de bacterias ácido lácticas (BAL) frente a diversos antibióticos. [Tesis Licenciado Química en Alimentos]. [Hidalgo, México] Universidad Autónoma del Estado de Hidalgo. [ Links ]
Navarro F, Cardona E, Mirelis B. 2010. Lectura interpretada del antibiograma de enterobacterias. [Internet]. [ Citado 2013 octubre 9]. Disponible en: http://www.sld.cu/galerias/pdf/sitios/apua-cuba/lectura_interpretada_del_antibiograma_de_enterobacterias.pdf [ Links ]
Oyetayo V, Oyetayo F. 2005. Potential of probiotics as biotherapeutic agents targeting the innate immune system. Afr J Biotechnol. [Internet].[Citado 2013 abril 10]; 4:123-127. Disponible en: http://www.ajol.info/index.php/ajb/article/view/15065/90984. [ Links ]
Ramírez M. 2005. Actividad inhibitoria de cepas de bacterias acido lácticas frente a bacterias patógenas y deterioradoras de alimentos. [Tesis Licenciado Químico en Alimentos]. [Pachuca de Soto, México] Universidad Autónoma del Estado de Hidalgo. [ Links ]
Rodríguez-León JA, Bueno G, Rodríguez D, Delgado G, Serrano P, Brizuela M. 2003. True and apparent yields and maintenance coefficient and their significance on fermentation kinetics. In: Roussos S, Soccol CR, Pandey A, Augur C (editors). New Horizons in Biotechnology. [Internet]. [citado 2014 enero 20]; pp. 163-172. Disponible en: http://link.springer.com/chapter/10.1007/978-94-017-0203-4_15 [ Links ]
Samaniego L, Sosa M. 2012. Lactobacillus spp.: Importantes promotores de actividad probiótica, antimicrobiana y bioconservadora, Reseña. [Internet]. [citado 2013 octubre 9]. Disponible en: http://www.bibliociencias.cu/gsdl/collect/libros/index/assoc/HASH011d/e18c5081.dir/doc.pdf [ Links ]
SAS Institute Inc. 2004. SAS/STAT® 9.1 User's Guide. Cary, NC: SAS Institute Inc. 5136. [ Links ]
Sumano H, Ocampo L. 2006. Farmacología veterinaria. 3a ed. Madrid: McGraw-Hill. 1082 p. [ Links ]
Tagg J, Mcgiven A. 1971. Assay system for bacteriocins. Appl. Environ. Microb. [Internet]. [Citado 2013 febrero 10]; 21(5):943. Disponible en: http://aem.asm.org/content/21/5/943.full.pdf. [ Links ]
Zapata S, Muñoz J, Ruíz O, Montoya O, Gutiérrez P. 2009. Aislamiento de Lactobacillus plantarum LPBM10 y caracterización parcial de su bacteriocina. VITAE. [Internet]. [citado 2013 noviembre 24]; 9(2):62-71. Disponible en: http://www.scielo.org.co/pdf/vitae/v16n1/v16n1a09. [ Links ]
Article citation:
Jurado-Gámez H, Calpa-Yama F, Chaspuengal-Tulcán A. 2014. Determinación in vitro de la acción probiótica de Lactobacillus plantarum sobre Yersinia pseudotuberculosis aislada de Cavia porcellus [In vitro determination of the probiotic Lactobacillus plantarum action on Yersinia pseudotuberculosis isolated from Cavia porcellus]. Rev Fac Med Vet Zoot. 61(3): 241-257. http://dx.doi.org/10.15446/rfmvz.v61n3.46872