Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
versión impresa ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.63 no.2 Bogotá mayo/ago. 2016
https://doi.org/10.15446/rfmvz.v63n2.59357
Doi: 10.15446/rfmvz.v63n2.59357
INHIBICIÓN DE Lactobacillus gasseri SOBRE Yersinia pseudotuberculosis BAJO CONDICIONES IN VITRO
INHIBITION OF Lactobacillus gasseri ON Yersinia pseudotuberculosis UNDER IN VITRO CONDITIONS
H. A. Jurado-Gámez1*, D. A. Romero-Benavides1, J. A. Morillo-Garcés1
1 Grupo de investigación Fise-Probiotec, Programa de Zootecnia, Departamento de Producción y Procesamiento Animal, Facultad de Ciencias Pecuarias, Universidad de Nariño, Pasto, Colombia.
* Autor para correspondencia: henryjugam@gmail.com
Artículo recibido: 15 de abril de 2015 Aprobado: 7 de julio de 2016
RESUMEN
Se evaluaron la cinética de fermentación, pruebas de crecimiento y efecto de inhibición de Lactobacillus gasseri sobre Yersinia pseudotuberculosis. Se determinó susceptibilidad de L. gasseri y Y. pseudotuberculosis a los antibióticos gentamicina, penicilina, ciprofloxacina, dicloxacilina y cefalotina; además, el efecto de inhibición de L. gasseri y su sobrenadante en Y. pseudotuberculosis y el crecimiento de L. gasseri a diferentes concentraciones de sales biliares, bilis bovina y temperatura. Se evaluó la cinética de crecimiento de la cepa láctica (UFC/ml, pH, azúcar, acidez y proteína) y se determinaron péptidos en el sobrenadante mediante HPLC. Las variables pH y UFC/ml se evaluaron mediante un diseño de medidas repetidas en el tiempo. Se encontró resistencia de L. gasseri y Y. pseudotuberculosis a la dicloxacilina, además de cefalotina para la primera. La cepa láctica y su sobrenadante inhibieron a la cepa patógena. Se obtuvieron crecimientos entre 3 x 108 y 1,7 x 1013 UFC/150 pl en sales biliares, entre 3 x 108 y 3 x 1012 UFC/150 pl en bilis bovina y entre 4,3 x 108 y 3 x 1013 UFC/150 pl a diferentes temperaturas. La fase exponencial se observó a las 16 h con un valor de 3 x 1012 UFC/150 pl, pH de 4,56, azúcar de 1,79 mg/l, acidez de 0,925 y proteína de 0,16 mg/l. Se encontró el péptido VAL-TIR-VAL en el sobrenadante de L. gasseri. Los resultados indican que L. gasseri puede ser importante como cepa probiótica en condiciones in vitro.
Palabras clave: crecimiento bacteriano, probiótico, patógeno, antibióticos.
ABSTRACT
Fermentation kinetics, growth tests and inhibition effect of Lactobacillus gasseri on Yersinia pseudotuberculosis was evaluated. Susceptibility to gentamicin, penicillin, ciprofloxacin, and cephalothin, dicloxacillin antibiotics, and the inhibition effect of L. gasseri and supernatant on Y. pseudotuberculosis was determined. Additionally, the growth of L. gasseri to different concentrations of bile salts, bovine bile and temperature. Growth kinetics of lactic strain (CFU/ml, pH, sugar, acidity and protein) was evaluated and peptide in the supernatant was determined by HPLC. The pH and CFU/ml variables were evaluated using a repeated measures time design. L. gasseri and Y. pseudotuberculosis resistance to dicloxacillin was found in addition to the first cephalothin. Lactic strain and its supernatant inhibited the pathogenic strain, 3 x 108 at 1.7 x 1013 CFU/150 pl in bile salts, 3 x 108 at 3 x 1012 CFU/150 pl in bovine bile and 4.3 x 108 to 3 x 1013 CFU/150 pl to different temperatures. Exponential phase was observed at 16 h with a value of 3 x 1012 CFU/150 pl , pH 4.56, sugar 1.79 mg/l, acidity 0.925 and protein 0.16 mg/l, the TIR-VAL VAL-peptide was found in the supernatant of L. gasseri. The results indicate that L. gasseri can be important as probiotic strain in vitro conditions.
Keywords: Bacterial growth, probiotic, pathogen, antibiotics.
INTRODUCCIÓN
El género Lactobacillus es un grupo de bacterias Gram-positivas que tienen como característica la producción de ácido láctico a partir de la fermentación de carbohidratos (Cueto-Vigil et al. 2010). Este grupo se encuentra constituido por cocos y bacilos, mostrando una gran variedad de especies distribuidas en la naturaleza. Su abundancia responde a su capacidad de crecer en diferentes sustratos y bajo diferentes condiciones biológicas y medioambientales (Ramírez-Ramírez et al. 2011).
La importancia del género Lactobacillus se debe a su capacidad de inhibir el crecimiento de diferentes microorganismos patógenos en especies de interés zootécnico (Reis et al. 2012). Esto lo realiza a través de varios mecanismos: la producción de ácido láctico y otros ácidos orgánicos que reducen el pH del medio; la producción de biocinas que atacan diferentes zonas de la pared celular de otros microorganismos; la producción de sustancias antagónicas como diacetilo, peróxido de hidrógeno, acetaldehído y compuestos no proteicos de bajo peso molecular; además, compiten por espacio en la mucosa intestinal como consecuencia de una buena implantación del microorganismo en el tracto gastrointestinal (Alfaro-Sanabria 2007; Vásquez et al. 2009).
Lactobacillus gasseri es una bacteria Gram-positiva, baja en guanina y citosina (GC), conocida como uno de los principales Lactobacillus homofermentativos del intestino humano. Se especula que esta cepa láctica es un microorganismo autóctono del tracto gastrointestinal y se asocia con una gran variedad de funciones probióticas, incluyendo la reducción de la actividad de las enzimas fecales mutagé-nicas, adhesión a los tejidos intestinales, estimulación de macrófagos y producción de bacteriocinas (Selle y Klaenhammer 2013).
Por otra parte, Yersinia _pseudotuberculosis es una bacteria de la familia Enterobacte-riaceae que causa importantes problemas sanitarios a nivel productivo. Su transmisión principal es por alimentos contaminados con materia fecal y sus vectores principales son los roedores (Magistrali et al. 2015). En la región de Nariño (Colombia), se observa prevalencia de la enfermedad en sistemas de producción cuyícola, como consecuencia del tipo de sistema productivo, que en su mayoría es tradicional; de ahí la importancia de su investigación a nivel regional, ya que el cuy es un animal de interés zootécnico.
En esta investigación se evaluó la cinética de fermentación, se llevaron a cabo pruebas de crecimiento y se estimó el efecto de inhibición de L. gasseri sobre Y. pseudotuberculosis.
MATERIALES Y MÉTODOS
La presente investigación se realizó en el laboratorio de microbiología de la Facultad de Ciencias Pecuarias y los laboratorios especializados pertenecientes a la Universidad de Nariño (Colombia), ubicados en la ciudad de Pasto, con una temperatura promedio de 14°C, a una altura de 2.540 msnm, precipitación anual promedio de 1.084 mm y humedad relativa del 76%.
Se usó la cepa comercial Lactobacillus gasseri ATCC 19992 y la cepa patógena Yersiniapseudotuberculosis NCTC 8580. Éstas fueron reconstituidas de acuerdo con las instrucciones de la casa comercial. La bacteria láctica se conservó mediante repique en medio sólido (cajas con agar MRS) cada 5 días y en medio líquido (tubos con caldo MRS) cada 8 días. Para la bacteria patógena se usó caldo BHI como medio líquido y agar manitol como medio sólido. Las condiciones de incubación fueron de 37°C por 24 horas, para luego ser refrigeradas (4°C) hasta su utilización.
L. gasseri fue cultivada de la siguiente manera: en un Erlenmeyer se tomaron 40 ml de caldo MRS estéril, en este se depositó una alícuota de la bacteria conservada y se incubó por 24 h a 37 °C; terminada la incubación, se tomaron 4 ml del incubado, se depositaron en otros 40 ml de caldo MRS, y se incubó en iguales condiciones. El inóculo fue ajustado mediante la metodología de Crueger y Crueger (1993): se tomaron 90 ml de caldo MRS estéril y se añadieron 10 ml de inóculo de acuerdo con la regla. Al terminar la incubación se hizo lectura directa de 1 ml mediante espectofotómetro (625 nm); cuando la población fue superior a la establecida, se agregó caldo estéril teniendo en cuenta la propuesta de Guerrero ajustada por Jurado-Gámez et al. (2014).
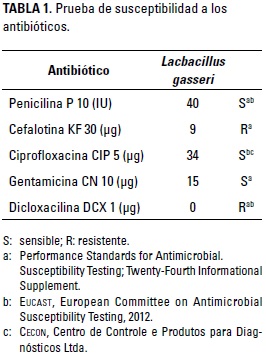
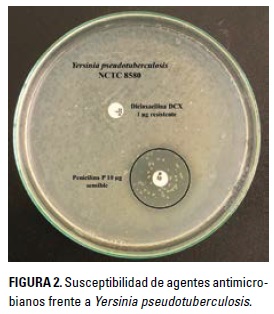
Se realizaron pruebas de susceptibilidad a antibióticos en L. gasseri y Y. pseudotuberculosis; los antibióticos evaluados fueron gentamicina (CN 10 pg), penicilina (P10 IU), ciprofloxacina (CIP 5 pg), dicloxa-cilina (DCX 1 pg) y cefalotina (KF 30 pg). Se utilizó la técnica de Kirby Bauer (Bauer et al. 1966); para ello, las bacterias se depositaron en un tubo con 1 ml de agua destilada, cada cepa por separado, y los tubos fueron incubados a 37°C hasta obtener la turbidez comparable con el estándar 0,5 de MacFarland; enseguida, el contenido se transfirió a cajas de Petri con agar Müller Hilton y se distribuyó con un hisopo de algodón. Por otra parte, con pinza estéril se tomaron los discos impregnados con cada uno de los antibióticos citados y se colocaron sobre el agar con algo de presión para que se adhieran al medio; luego, se invirtieron las cajas de Petri y se incubaron a 37°C por 18 h. Al terminar el tiempo de incubación se midió el halo formado entre el borde del disco y el borde máximo de inhibición.
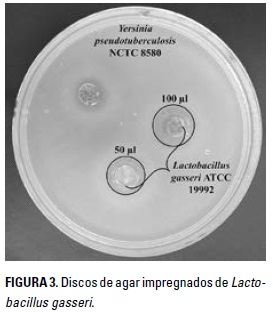
De igual manera, se evaluó el efecto de inhibición producido por L. gasseri sobre Y. pseudotuberculosis mediante la metodología de Tagg y McGiven (1971). Se tomó una alícuota de L. gasseri y se ajustó a escala McFarland 0,5 para luego cultivar en cajas de Petri con agar MRS y azul de anilina a concentraciones de 50, 75, 100 y 150 pl; finalmente se incubaron a 37°C por 24 h. La bacteria patógena fue ajustada a escala MacFarland 0,5 y fue cultivada en cajas de Petri con agar Müeller Hilton y agar TSA (triptona soya agar). Del agar MRS incubado con la bacteria láctica, se tomaron discos y se colocaron en las cajas incubadas con la bacteria patógena, luego se incubó a 32°C por 12 horas. Al finalizar el periodo de incubación se midieron los halos de inhibición. Se determinó susceptibilidad de la cepa patógena cuando el halo fue igual o superior a 2 mm (Ramírez 2005).
Se extrajo el sobrenadante de L. gasseri; para ello, se ajustó la concentración de la bacteria a 4 en la escala McFarland (725 nm). De ésta, se tomaron varias muestras de 1,5 ml y se depositaron en tubo Eppendorf para centrifugar a una temperatura de 4°C con 15.000 rpm durante 15 min. se tomó el sobrenadante de dos formas, la primera sin filtrar y la segunda con filtrado; para esta última, se usó papel filtro de 0,25 pm. Cada muestra se refrigeró a 4°C para posterior análisis.
Los anteriores sobrenadantes se evaluaron mediante la metodología de Kirby Bauer modificada (Bauer et al. 1966); el sobrenadante se colocó de dos formas: la primera mediante papel pads, sobre el cual se depositaron concentraciones de 50, 75, 100 y 150 pl; y la segunda, mediante cilindros estériles de 6 mm de diámetro, sobre los cuales se depositaron las mismas concentraciones (los cilindros se obtuvieron de puntas de pipeta estériles). Los discos y cilindros fueron colocados en cajas de Petri con las bacterias patógenas y se incubaron a 37°C por 24 h.
Se determinó el crecimiento de la cepa láctica a concentraciones de 3, 4 y 5% de sales biliares bovinas y concentraciones de 0,5, 1 y 1,2% de bilis bovina. La cepa se cultivó en caldo MRS durante 24 horas; de este cultivo se realizó una nueva inoculación en caldo MRS con las diferentes concentraciones de sales biliares y bilis bovina de manera separada. Luego se tomaron muestras y se cultivaron en agar MRS con azul de anilina, permaneciendo 48 horas a 32°C. Se realizaron pruebas de producción de gas y catalasa a la bacteria láctica (Cai et al. 1999).
Se evaluó el crecimiento de la cepa láctica a pH 2,5, 3,5, 4,5 y 6, el registro se realizó durante tres horas, con toma de muestras cada hora. La cepa fue incubada en medio MRS comercial y el pH se ajustó con la adición de ácido tartárico, para inhibir el efecto de la producción de ácido láctico, Las condiciones de incubación fueron de 32°C por 48 h.
Se evaluó la cinética de fermentación de L. gasseri en dos medios de cultivo (MRS y PRO) (Ramírez 2005). Para cada medio se tomó un Erlenmeyer al cual se adicionaron 540 ml de medio y 60 ml de inóculo, luego se llevó a incubación (incubadora shaker) en agitación constante a 32°C y 100 rpm, el pH no fue controlado dada la resistencia de la cepa. Durante la cinética se evaluó: conteo de microorganismos viables en placa (UFC/ml), de pH, consumo de azúcar total y proteína, determinación de acidez y de producción de ácido láctico. Las mediciones se realizaron cada 4 h durante 24 h.
El conteo de microorganismos viables en placa se realizó mediante la disolución de 1 ml de muestra en 9 ml de agua pep-tonada al 0,1%; se hicieron diluciones decimales que fueron transferidas a cajas de Petri que contenían medio MRS con azul de anilina (0,1 ml) para siembra en superficie. Las cajas fueron incubadas a 37°C y se observaron entre 24 y 48 horas. Se tuvo en cuenta únicamente las cajas de Petri con conteos entre 30 y 300 colonias. El número de colonias fue multiplicado por el inverso de la dilución y por 10 para obtener UFC/150 pl (Jurado-Gámez et al. 2014).
Para determinar el pH se tomó una muestra del medio y se midió con pHmetro digital (JENCO® VisionPlus).
El método de DuBois (1956) se seleccionó para determinar el azúcar total; así, se prepararon diferentes concentraciones de glucosa para crear una curva patrón mediante los valores obtenidos de las muestras observadas a una densidad óptica de 625 nm. Los valores se graficaron contra la concentración en mg/l y finalmente se obtuvieron los valores de la línea recta.
El ácido láctico se determinó mediante titulación con hidróxido de sodio (1N). La biomasa se estimó mediante los métodos de Crueger y Crueger (1993) y Rodríguez-León et al. (2003); para ello se estableció la velocidad máxima de crecimiento mediante la siguiente ecuación:
v max = dLnX/dt
Por su parte, el tiempo de duplicación celular (td) se determinó teniendo en cuenta la siguiente ecuación:
td = Ln2/v max
Se cuantificó el consumo de proteína por el método de Lowry y Col (1957), con modificación de Malara y Charra (1972); a tal fin, se realizó una curva de calibración mediante seroalbúmina bovina y se determinó la absorbancia en espectro-fotómetro a 625 nm. Los valores obtenidos se graficaron contra la concentración para obtener la ecuación de la línea recta.
Se evaluó la viabilidad de L. gasseri a dos temperaturas, 38 y 45°C, tomando como referencia la fase exponencial de crecimiento encontrada en la cinética de fermentación, el procedimiento se basó en lo propuesto por Crueger y Crueger (1993); para ello se ajustó el inóculo de acuerdo con la escala de MacFarland 0,125. La incubación duró 12 h desde el inicio de la prueba y a continuación se realizaron diluciones de 10-1 hasta 10-12 en agua peptonada y se sembraron en cajas de Petri con azul de anilina, comenzando en la disolución de 10-6 hasta la máxima disolución; las cajas se incubaron por 48 horas a 37°C para determinar el recuento de colonias en UFC/150 pl.
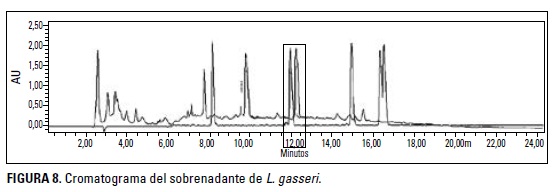
Se identificó el contenido de pépti-dos en el sobrenadante mediante HPLC (high performance liquid chromatography o cromatografía líquida de alta eficacia). Se tomó 1 ml de sobrenadante y se filtró con jeringa PVDF Pall de 0,25pm. La muestra se sometió a congelación (-20°C) y se protegió de la luz hasta su análisis. Se identificaron los espectros UV de los picos integrados, mediante el sistema de detección PDA y se compararon con el patrón de péptidos Sigma H2016, llevando a cabo cuatro réplicas.
Los datos fueron evaluados mediante el paquete estadístico SAS 9.1 (2004). Para comparar los medios y la prueba de pH, se usó un diseño estadístico de medidas repetidas en el tiempo, con el procedimiento Proc Mixed de SAS.
RESULTADOS
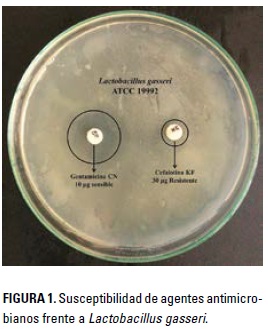
Los resultados del antibiograma se pueden observar en la Tabla 1 y la Figura 1. Los resultados manifiestan que L. gasseri presentó resistencia a la cefalotina y la dicloxacilina, y fue sensible a la penicilina, la ciprofloxacina y la gentamicina. Cunha et al. 2013 consideran que las especies bacterianas probióticas deben presentar ausencia de resistencia a antimicrobianos, porque el riesgo de transferencia de genes de resistencia a bacterias patógenas o potencialmente patógenas del tracto gastrointestinal del hospedero es importante. De igual manera, Dhamale et al. 2015 mencionan que la selección de especies con potencialidades probióticas debe incluir un perfil de susceptibilidad a los antibióticos. Además, se deben realizar pruebas para determinar si el efecto de resistencia es transferible a otras microorganismos, para lo cual se deben identificar genes de resistencias transmisibles como plásmidos o trasposones (Sharma et al. 2014).
Rodríguez da Cunha et al. (2012) encontraron que las cepas de L. gasseri aisladas de heces de infantes fueron resistentes a la gentamicina y la ciprofloxacina; y resultaron susceptibles a la penicilina y con efecto variable sobre la cefalotina. Estos resultados difieren en algunos aspectos frente a los encontrados en esta investigación; sin embargo, la resistencia hallada puede corresponder a resistencia intrínseca de la cepa evaluada (Casado et al. 2014). Por su parte, Selle y Klaenhammer (2013) mencionan que no es válido suponer que todas las cepas de L. gasseri tengan ausencia de genes de resistencia a antibióticos transmisibles, por lo cual es necesaria la evaluación de resistencia a antibióticos y la secuenciación del genoma de cepas con potencial probiótico antes de su comercialización.
De acuerdo con Gueimonde et al. (2013), la resistencia intrínseca es importante en un organismo probiótico, ya que ayuda a restaurar la microflora intestinal del huésped durante la administración de antibióticos; no obstante, se debe tener cuidado, ya que la resistencia puede ser un evento de transferencia genética y existe la probabilidad de transferir la resistencia a otras cepas, incluyendo las patógenas (Wong et al. 2015).
Por su parte, Y. pseudotuberculosis fue sensible a la penicilina, la cefalotina, la ciprofloxacina y la gentamicina, y mostró resistencia únicamente a la dicloxacilina (Tabla 2 y Figura 2). Al respecto Jurado-Gámez et al. (2014) observaron resultados similares a los de la presente investigación con resistencia a la dicloxacilina. Sin embargo, en la investigación de García-Cuestas et al. (2015), además de encontrar resistencia a la dicloxacilina, también hallaron resistencia a la penicilina y la cefalotina. Estas diferencias podrían ser un resultado adaptativo de la bacteria patógena (Birri et al. 2013). De acuerdo con Feuerriegel et al. (2014), la presencia de resistencia a los antibióticos es un fenómeno natural que puede ocurrir por la propagación de los sistemas de defensa que presentan las bacterias o también debido a cambios en genes, en donde proteínas codificadas pueden modificar su actividad hasta que son capaces de proteger o modificar el blanco de acción. La bacteria patógena estudiada fue sensible a la acción inhibitoria de L. gasseri en las concentraciones de 50, 75, 100 y 150 pl, produciendo halos de 3 y 4 mm (Tabla 3 y Figura 3).
El resultado de la acción inhibitoria que presentó L. gasseri podría deberse a la producción de sustancias antimicrobianas como ácido láctico, peróxido, enzimas y bacteriocinas, las cuales son características del metabolismo de las bacterias lácticas (Aguirre et al. 2009). De modo similar De Baere et al. (2013), consideran que las Bacterias Ácido Lácticas (BAL) producen varias sustancias como ácidos orgánicos, ácidos grasos, peróxido de hidrógeno, bacteriocinas y sustancias relacionadas, que pueden tener efectos antimicrobianos.
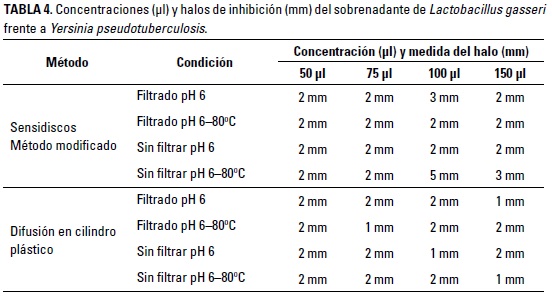
Los resultados de la inhibición del sobrenadante se registraron en la Tabla 4. Se observan halos de inhibición de 1 a 5 mm, con mayor prevalencia de los de 2 mm.
La acción de inhibición del sobrenadante puede explicarse por la presencia de compuesto antimicrobianos, aunque en este caso no es posible afirmar cual tuvo mayor incidencia en la inhibición de la bacteria patógena. Las sustancias antimicrobianas que pueden encontrarse son etanol, CO2, diacetilo, H O , ácido benzoico, isómeros D de aminoácidos, reuterina y bacteriocinas (Patel et al. 2013).
Con respecto a las bacteriocinas, Zárate (2012) las define como péptidos activos con actividad antimicrobiana frente a otras bacterias; en efecto, existen numerosas bacteriocinas producidas por BAL y cada una puede presentar un espectro de inhibición particular. El mismo autor señala que la producción de bacteriocinas es un rasgo ventajoso, ya que permite adquirir una posición dominante en un determinado nicho al eliminar a otras bacterias competidoras.
Los resultados para sales biliares y bilis indicaron adecuados crecimientos de L. gasseri. Se encontraron valores entre 3 x 108 y 1,7 x 1013 UFC/150 pL para 3% de sales biliares; entre 3 x 108 y 1 x 1012 UFC/150 pL para 4%, y entre 1,7 x 108 y 2 x 1012 UFC/150 pL para 5%. Mientras que para bilis bovinas se observaron crecimientos de 3 x 108 a 5 x 1011 UFC/150 pL para 0,5%; 4,7 x 108 a 2 x 1012 UFC/150 pL para 1,0%, y 3 x 108 a 3 x 1012 UFC/150 pL para 2%.
De acuerdo con los resultados obtenidos, L. gasseri tiene la capacidad de resistir concentraciones de hasta 5% de sales biliares y 2% de bilis bovina. Esta es una característica importante de la cepa, ya que puede ejercer su acción probiótica en las condiciones fisiológicas del tracto digestivo.
Antes de llegar al tracto intestinal, las bacterias probióticas tiene que ser capaces de resistir, en primer lugar, la acidez gástrica, y posteriormente se enfrentarán a las sales biliares (Argyri et al. 2013). Caballero-Cervantes (2014) sostiene que las sales biliares representan una importante barrera antibacteriana que afecta el establecimiento de bacterias probióticas en el tracto gastrointestinal (TGI), por lo cual, la resistencia al contacto con sales biliares es un requisito para la selección de bacterias probióticas.
Con relación a la producción de gas y la actividad de catalasa de Lactobacillus gasseri, las pruebas de gas y catalasa fueron negativas. La primera permite determinar la capacidad de la cepa de producir timpanismo cuando se administra en forma oral. La segunda se utiliza para identificar que son cepas lácticas, lo que indica características adecuadas como candidatas para probiótico.
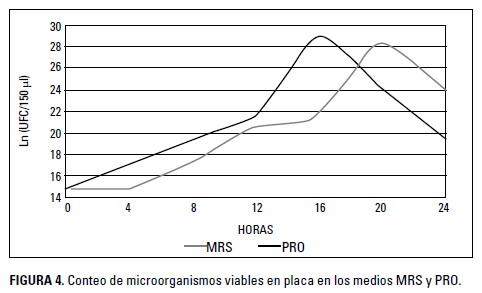
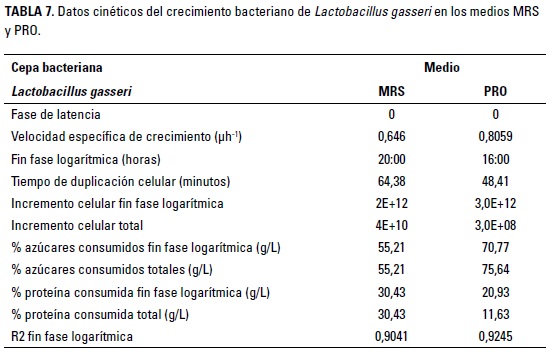
En la Figura 4 se observa el crecimiento de L. gasseri en los medios MRS y PRO durante 24 horas. La fase exponencial se encontró al tiempo 6 (20 h) en el medio MRS y en el tiempo 5 (16 h) en el medio PRO, con valores de 3 x 1012 y 1,75 x 1012 UFC/150 pl. De acuerdo con Ramírez et al. (2003), un crecimiento adecuado de una cepa probiótica debe ser igual o superior a 109 UFC/pl, pues este valor garantiza una adecuada colonización del tracto digestivo y cataloga a la cepa como cultivo iniciador en proceso industriales.
Los resultados muestran que el medio PRO mostró una fase exponencial más temprana; sin embargo, ambos medios mostraron crecimientos adecuados, Los resultados estadísticos para el crecimiento de L. gasseri indicaron diferencias entre tiempos (p < 0,05) e interacción entre el tiempo y los medios (p < 0,05). Para identificar los efectos de la interacción se realizó comparación por pares, teniendo en cuenta ambos medios en cada hora. Se observó un mayor crecimiento de la cepa en el medio PRO durante la segunda y tercer hora, existiendo igual crecimiento en las demás. Estos resultados muestran que el crecimiento puede ser favorecido por el medio PRO durante las horas 2 y 3, lo que indica que el contenido de nutrientes del medio posee características adecuadas para acelerar el crecimiento durante este tiempo; sin embargo, no se encontraron diferencias significativas de la cepas en el tiempo de la fase exponencial, lo que indica que, a pesar de observarse un mayor crecimiento en el tiempo 5 del medio PRO, éste no fue diferente estadísticamente con el medio MRS. En la investigación realizada por Yoda et al. (2014) se encontró un crecimiento de 6,2 x 1012 UFC/g para L. gasseri en medio MRS; lo anterior demuestra un crecimiento adecuado de la bacteria en diferentes condiciones de evaluación, lo que permite determinar una característica adecuada para el crecimiento.
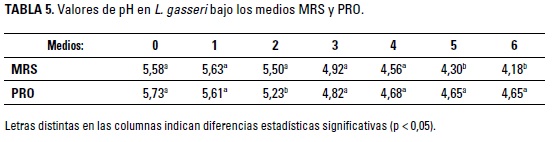
Los valores de pH se pueden observar en la Tabla 5. El análisis de medidas repetidas en el tiempo mostró efecto de interacción entre los métodos y el tiempo, por lo que se realizó la comparación de cada cepa por tiempo. se observa un mayor pH en la hora dos para MRS, con valores más bajos en los tiempos 5 y 6. Los valores encontrados indican que hay variación sin una tendencia evidente; por lo cual no se puede realizar una inferencia sobre el comportamiento de la variable en el tiempo. A pesar de ello, los valores de pH encontrados demuestran la capacidad de la cepa para disminuir el pH del medio, factor importante en la inhibición de microorganismos patógenos (Gregorio et al. 2014, Tejero-Sariñena et al. 2012)
Una cepa que disminuya el pH es útil como probiótico, ya que muchos microorganismos patógenos necesitan un ambiente cercano a la neutralidad; tal es el caso de Yersiniapseudotuberculosis, para la cual De Montijo-Prieto et al. (2015) reportan crecimiento entre pH 6 y 8, mostrando problemas para crecer fuera de este rango. Teniendo en cuenta lo anterior, los valores de pH encontrados durante la cinética de fermentación evidencian condiciones ambientales inadecuadas para la bacteria patógena, factor que inhibe su proliferación.
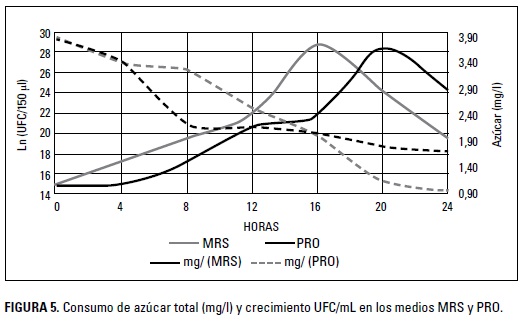
En las Figura 5 se puede observar el consumo de azúcar de L. gasseri en todos los tiempos de la cinética de fermentación de los medios analizados. El consumo de azúcar en los medios MRS y PRO presentó valores en la fase logarítmica de 1,79 mg/l y 2,043 mg/l, respectivamente.
Los resultados demuestran que la cepa hace un uso correcto de los carbohidratos. El consumo de azúcar mide de forma indirecta la producción de ácido láctico, ya que como consecuencia de la fermentación de los azúcares, se obtiene dicho ácido (Patel et al. 2012). Un consumo adecuado garantiza un aporte energético suficiente para el crecimiento de las bacterias, lo que permite reducir el tiempo necesario para que la cepa llegue a la fase exponencial de crecimiento (Rastogi et al. 2013).
El uso de medios de cultivo no comerciales como el medio PRO, el cual está constituido por diferentes materias primas con diferentes contenidos nutricionales, puede ser de importancia en la industria. Uno de los nutrimentos que ha sido estudiado con relación del crecimiento de las BAL son los carbohidratos, ya que son la fuente principal que utilizan las Bal como sustrato energético.
Cardelle et al. 2011 mencionan que algunas cepas de lactobacilos son utilizadas como probióticos en combinación con prebióticos; en la mayor parte de los estudios de fermentación in vitro con diferentes sustratos, es difícil determinar cuál de todos se fermentan selectivamente por los microorganismos de interés, y también se dificulta establecer la velocidad a la que un solo oligosacárido es fermentado.
Díaz-Vela et al. 2012 sugieren que la adaptación a un medio pobre en monosa-cáridos confiere un metabolismo altamente adaptable a consumir oligo o polisacáridos, dando una ventaja competitiva a cierto tipo de bacterias, además de afectar fuertemente los productos de la fermentación, sobre todo en la producción de ácidos grasos de cadena corta.
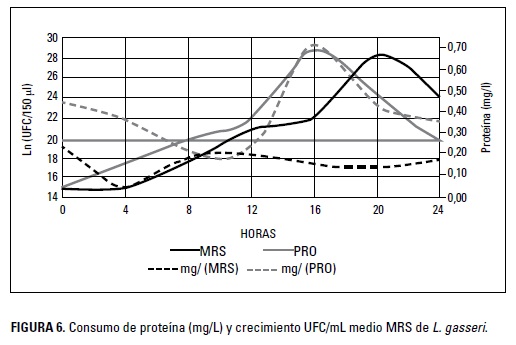
El consumo de proteínas en la fase exponencial para L. gasseri en los medios MRS y PRO fue de 0,13 y 0,70 mg/L (Figura 6). Como se puede observar, el consumo de proteínas de la BAL utilizada en esta investigación, no muestra una tendencia definida en comparación con la tendencia que marca el consumo de azúcar. En anteriores investigaciones, Guzmán-Insuasty (2014) encontraron un valor de 0,68 mg/L durante la fase exponencial en estudios con Lactobacillus casei; este valor es diferente del reportado para L. gasseri en el medio MRs, pero es muy similar al encontrado en el medio PRO.
Las fluctuaciones en el consumo de proteína pueden ser el resultado de la producción de compuestos peptídicos por parte de la bacteria láctica. Este tipo de sustancias pueden ser bacteriocinas o péptidos libres que la bacteria sintetiza y reincorpora en el medio, ocasionando un incremento en determinados momentos de la cinética de fermentación (Zacharof y Lovitt 2012).
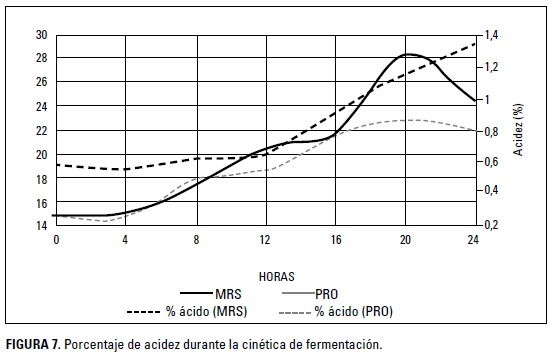
El estadístico de medidas repetidas en el tiempo mostró efecto de interacción entre las horas y los medios para L. gasseri; la comparación por pares entre ambos medios, teniendo en cuenta las horas, mostraron que la acidez fue mayor en el medio MRs durante toda la cinética de fermentación (Figura 7).
El ácido láctico es un factor importante en la inhibición de organismos patógenos, los mecanismos de acción son variados, desde la desintegración de la pared celular de algunas bacterias gran negativas hasta la inhibición de procesos fisiológicos como el transporte de algunas proteínas al interior de la célula (Singh et al. 2016). el ácido láctico ha sido utilizado a nivel industrial en la conservación de productos alimenticios con buenos resultados (Mahmoud 2014, Wang et al. 2013, Singh et al. 2015); sin embargo, la utilización de ácido láctico industrial deteriora algunas características organolépticas de los productos alimenticios, como el olor (Riboulet-Bisson et al. 2012).
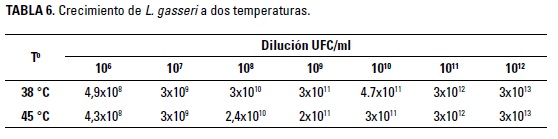
Por otra parte, las cepas lácticas tienen la capacidad de producir otro tipo de compuestos químicos, como compuestos aromáticos, que permiten mejorar la calidad organoléptica de los productos, ya sea en la textura o el olor (Rizzello et al. 2013). La evaluación de L. gasseri a 38 y 45°C se puede observar en la Tabla 6.
Se observa un crecimiento adecuado de la cepa en ambas temperaturas; esto muestra termoresistencia de la bacteria a las condiciones corporales, ya que se ha observa que muchas de las especies presentan un rango de temperatura corporal entre los 37 y 42 °C (Reese et al. 2009). este parámetro es interesante debido a que las cepas deben ser seleccionadas de acuerdo con su capacidad de crecer bajo la temperatura interna de los animales. Al respecto, Dijkstra et al. (2013) encontraron que las cepas de lactobacillus muestran crecimientos adecuados hasta los 45°C, mientras que en temperaturas superiores, el crecimiento tiene mayor variabilidad.
Por otra parte, en la industrialización de productos alimenticios, se realizan procesos de exposición al calor que ocasionan estrés calórico, e inactivan la cepa probiótica, disminuyendo su efecto benéfico sobre el hospedero (Russo et al. 2012). entre estos factores se encuentra la peletización de los alimentos balanceados y el procesado de algunos productos precocidos, procesos que requieren la utilización de temperatura para mejorar la contextura y palatabilidad de los productos (Sidira et al. 2015, Na-Kyoung et al. 2001).
Se observa una velocidad específica de crecimiento en el medio Pro, con un menor tiempo para llegar a la fase exponencial. estos factores son importantes, porque en la producción de inóculos a nivel industrial, el tiempo requerido para obtener una población adecuada de crecimiento influye sobre los costos de producción.
En la Tabla 8 se puede observar que L. gasseri registró la presencia de ácido láctico en el sobrenadante con valores de 5,70 y 5,30 g/L.
Waldir et al. (2007) afirman que actualmente el ácido láctico se obtiene por síntesis química y por vía fermentativa, siendo esta última la vía de preferencia, debido a que se obtiene ácido láctico ópticamente puro. Según Waldir et al. (2007), los aportes de sales minerales y la concentración de la fuente de carbono, tienen un papel significativo en la conversión de glucosa y en los parámetros de producción de ácido láctico. Por lo anterior, las diferencias entre los resultados encontrados en esta investigación y los resultados mencionados anteriormente pueden explicarse por la acción del medio.
Los resultados de la evaluación de pép-tidos en el sobrenadante mediante HPLC indicaron un pico similar al patrón (curva superior) en el tiempo 11,95, pico 7 de la muestra (curva inferior). Esto demuestra la presencia del péptido VAL-TIR-YAL con una concentración de 0,69 mg/mL. Sin embargo, el péptido encontrado no se encuentra relacionado con compuestos antimicrobianos.
CONCLUSIONESLactobacillus gasseri demostró poseer características importantes para una cepa probiótica en condiciones in vitro, ya que permite la inhibición de Yersinia pseudotuberculosis, además de sobrevivir en condiciones in vitro que simulan las condiciones gastrointestinales de animales de interés zootécnico. El crecimiento fue adecuado para la producción de inóculos a nivel industrial, por lo que puede ser evaluada en condiciones in vivo.
REFERENCIAS
Aguirre L, Hebert E, Garro M. 2009. Proteolytic activity of Lactobacillus strain on soybean proteins. LWT-Food Sci. and Tec. 59(2): 780-785. Doi: 10.1016/j.lwt.20l4.06.061. [ Links ]
Alfaro-Sanabria L. 2007. Efecto de Penicilinas y Tetraciclinas en Leche sobre el Crecimiento de Lactococcus lactis, Lactococcus cremoris y Streptococcus thermophilus [Tesis de maestría]. [Zamorano (México)]: Universidad de Zamorano. [ Links ]
Argyri AA, Zoumpopoulou G, Karatzas AG, Tsakalidou E, Nychas JE, Panagou EZ, Tassou C. 2013. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests. Food Microbiol. 33(2): 282-291. Doi: 10.1016/j.fm.2012.10.005. [ Links ]
Bauer AW, Kirby WM, Sherris JC, Turck M. 1966. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol. 45(4): 493-496. [ Links ]
Birri DJ, Brede DA, Tessema GT, Nes IF. 2013. Bacteriocin production, antibiotic susceptibility and prevalence of haemolytic and gelatinase activity in faecal lactic acid bacteria isolated from healthy Ethiopian infants. Microbial Ecology. 65(2): 504-516. Doi: 10.1007/s00248-012-0134-7. [ Links ]
Caballero-Cervantes Y. 2014. Aislamiento e identificación de bacterias ácido lácticas con potencial probiótico en bovinos Holstein [tesis de Maestría en Ciencias]. [Montecillo (MX)]: Colegio de Posgraduados. [ Links ]
Cai Y, Suyanandana P, Saman P, Benno Y. 1999. Classification and characterization of lactic acid bacteria isolated from the intestines of common carp and freshwater prawns. J Gen Appl Microbiol. 45(4): 177-184. [ Links ]
Cardelle-Cobas A, Corzo N, Olano A, Peláez C, Requena T, Ávila M. 2011. Galactooligosac-charides derived from lactose and lactulose: influence of structure on Lactobacillus, Streptococcus and Bifidobacterium growth. Int J Food Microbiol. 149(1): 12-34. Doi: 10.1016/j.ijfoodmicro.2011.05.026. [ Links ]
Casado MDC, Benomar N, Lerma LL, Gálvez A, Abriouel H. 2014. Antibiotic resistance of Lactobacillus pentosus and Leuconostoc pseudo-mesenteroides isolated from naturally-fermented Aloreña table olives throughout fermentation process. Int J Food Microbiol. 172: 110-118. Doi: 10.1016/j.ijfoodmicro.2013.11.025. [ Links ]
Chaspuengal A, Calpa F. 2014. Evaluación in vitro de Lactobacillus casei con características probióticas sobre Yersinia pseudotuberculosis. [Trabajo de grado]. [Pasto, Colombia] Universidad de Nariño. [ Links ]
Crueger W, Crueger A. 1993. Biotecnología: manual de microbiología industrial. 3.a ed. España: Ed. Acribia. [ Links ]
Cueto-Vigil MC, Acuña-Monslave Y, Yalenzuela-Riaño J. 2010. Evaluación in vitro del potencial probiótico de bacterias ácido lácticas aisladas de suero costeño. Actual Biol. 32: 129-138. [ Links ]
Cunha AF, Acurcio LB, Assis BS, Oliveira DLS, Leite MO, Cerqueira MM, Souza MR. 2013. In vitro probiotic potential of Lactobacillus spp. isolated from fermented milks. Arq Bras Med Vet Zootec. 65(6): 1876-1882. Doi: 10.1590/S0102-09352013000600040. [ Links ]
De Baere S, Eeckhaut V, Steppe M, De Maesschalck C, De Backer P, Van Immerseel F, Croubels S. 2013. Development of a HPLC-UV method for the quantitative determination of four short-chain fatty acids and lactic acid produced by intestinal bacteria during in vitro fermentation. J Pharm Biomed Anal. 80: 107-115. Doi: 10.1016/j.jpba.2013.02.032. [ Links ]
De Gregorio PR, Juárez-Tomás MS, Leccese-Terraf MC, Nader-Macías ME. 2014. In vitro and in vivo effects of beneficial vaginal lactobacilli on pathogens responsible for urogenital tract infections. J Med Microbiol. 63: 685-696. Doi: 10.1099/jmm.0.069401-0. [ Links ]
De Montijo-Prieto S, Moreno E, Bergillos-Meca T, Lasserrot A, Ruiz-López M, Ruiz-Bravo A, Jiménez-Valera M. 2015. A Lactobacillus plantarum strain isolated from kefir protects against intestinal infection with Yersinia enterocolitica O9 and modulates immunity in mice. Research in Microbiology. 166(8): 626-632. Doi: 10.1016/j.resmic.2015.07.010. [ Links ]
Dhamale KS, Sonawane PD, Jaybhaye AS, Chand P. 2015. Lactic Acid Bacteria: Antimicrobial activity and in vitro, in vivo studies of LAB activity on Fusarium oxysporum infected tomato seeds. Int J of Advanc Resear. 3(5): 954-963. [ Links ]
Díaz-Vela J, Mayorga-Reyes L, Totosaus A, Pérez-Chabela ML. 2012. Parámetros cinéticos y perfil de ácidos grasos de cadena corta de bacterias ácido lácticas termotolerantes con diferentes fuentes de carbono. Vitae. 19(3): 253-260. [ Links ]
Dijkstra F, Carrillo Y, Pendall E, Morgan J. 2014. Rhizosphere priming: a nutrient perspective. Front. Microbiol. 4: 216. Doi: 10.3389/fmicb.2013.00216. [ Links ]
DuBois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugar and related substances. Anal Chem. 28(3): 350-356. Doi: 10.1021/ac60111a017. [ Links ]
Feuerriegel S, Köser CU, Niemann S. 2014. Phylogenetic polymorphisms in antibiotic resistance genes of the Mycobacterium tuberculosis complex. J Antimicrob Chemother. 69(5): 1205-1210. Doi: 10.1093/jac/dkt535. [ Links ]
García-Cuestas E, López-Cobo S, Álvarez-Maestro M, Esteso G, Romera-Cárdenas G, Rey M, Cassady-Cain RL, Linares A, Valés-Gómez A, Thomson H. et al. 2015. NKG2D is a key receptor for recognition of bladder cancer cells by IL-2-activated NK cell and GCG promotes NK cell activation. Front Immunol. 6: 284. Doi: 10.3389/fimmu.2015.00284. [ Links ]
Gueimonde M, Sánchez B, De Los Reyes-Gavilán CG, Margolles A. 2013. Antibiotic resistance in probiotic bacteria. Front Microbiol. 4: 1-6. Doi: 10.3389/fmicb.2013.00202. [ Links ]
Guzmán-Insuasty M. 2014. Evaluación in vitro de Lactobacillus lactis y Lactobacillus casei sobre el control de Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus agalatiae y Escherichia coli, como principales agentes causantes de mastitis subclínica en vacas Holstein [tesis de Maestría en Ciencias Agrarias]. [Pasto (Col)]: Universidad de Nariño. [ Links ]
Jurado-Gámez H, Calpa-Yama F, Chaspuengal-Tulcán A. 2014. Determinación in vitro de la acción probiótica de Lactobacillus plantarum sobre Yersinia pseudotuberculosis aislada de Cavia porcellus. Rev Fac Med Vet Zoot [Internet]. [Citado 2015 dic. 08]; 61(3): 241-257. Disponible en: http://www.revistas.unal.edu.co/index.php/remevez/article/view/46872/49462 Doi: 10.15446/rfmvz.v61n3.46872. [ Links ]
Magistrali CF, Cucco L, Pezzotti G, Farneti S, Cambiotti V, Catania S, Parti P, Fabbi M, Lollai S, Mangili P, et al. 2015. Characterisation of Yersinia pseudotuberculosis isolated from animals with yersiniosis during 1996-2013 indicates the presence of pathogenic and Far Eastern strains in Italy. Vet Microbiol. 180(1-2): 161-166. Doi: 10.1016/j.vetmic.2015.08.020. [ Links ]
Mahmoud BSM. 2014. The efficacy of grape seed extract, citric acid and lactic acid on the inactivation of Vibrio parahaemolyticus in shucked oysters. Food Control, 41: 13-16. Doi: 10.1016/j.foodcont.2013.12.027. [ Links ]
Malara G, Charra R. 1972. Dosage des proteines particulaires selon la methode the Lowry. Note interne de travail. N° 5. Station Zoologique de Vellafranche-Sur-Mer. France. [ Links ]
Na-Kyoung L, Jin-Ok C, Jung-Uk H, Hyun-Dong P. 2001. Control of Listeria monocitogenes in groun beef by Lactococcal bacteriocina. Food Science and Biotechnology. 10(2): 199-203. [ Links ]
Patel A, Shah N, Ambalam P, Prajapati JB, Holst O, Ljungh A. 2013. Antimicrobial profile of lactic acid bacteria isolated from vegetables and indigenous fermented foods of India against clinical pathogens using microdilution method. Biomed Environ Sci. 26(9): 759-764. Doi: 10.3967/0895-3988.2013.09.007. [ Links ]
Patel S, Majumder A, Goyal A. 2012. Potentials of exopolysaccharides from lactic acid bacteria. Indian J Microbiol. 52(1): 3-12. Doi: 10.1007/s12088-011-0148-8. [ Links ]
Ramírez J, Barboza Y, Román R, Ferrer K, Briñez W, Márquez E. 2003. Utilización de carnes empacadas al vacío en la elaboración de productos fermentados. Rev Cien Fac Cien Vet. 13(2): 75-82. [ Links ]
Ramírez M. 2005. Actividad inhibitoria de cepas de bacterias acido lácticas frente a bacterias patógenas y deterioradoras de alimentos [tesis Licenciado Químico en Alimentos]. [Pachuca de Soto, (MX)]: Universidad Autónoma del Estado de Hidalgo. [ Links ]
Ramírez-Ramírez J, Rosas-Ulloa P, Velásquez-González M, Ulloa JA, Arce-Romero F. 2011. Bacterias lácticas: importancia en alimentos y sus efectos en la salud. Rev Fuente. 2(7): 1-16. [ Links ]
Rastogi G, Gurram RN, Bhalla A, Gonzalez R, Bischoff KM, Hughes SR, Kumar S, Sani RK. 2013. Presence of glucose, xylose, and glycerol fermenting bacteria in the deep biosphere of the former Homestake gold mine, South Dakota. Front Microbiol. 4(Article 18): 1-8. Doi: 10.3389/fmicb.2013.00018. [ Links ]
Reis JA, Paula AT, Casarotti SN, Penna ALB. 2012. Lactic acid bacteria antimicrobial compounds: characteristics and applications. Food Engin Rev. 4(2): 124-140. Doi: 10.1007/s12393-012-9051-2. [ Links ]
Riboulet-Bisson E, Sturme M, Jeffery IB, O'Donnell M, Neville BA, Forde BM, Claesson MJ, Harris H, Gardiner GE, Casey PG, et al. 2012. Effect of Lactobacillus salivarius bacteriocin Abp118 on the mouse and pig intestinal microbiota. PloS One. 7(2): e31113. Doi: 10.1371/journal.pone.0031113. [ Links ]
Rizzello CG, Coda R, Macías DS, Pinto D, Marzani B, Filannino P, Giuliani G, Paradiso VM, Di Cagno R, Gobbetti M. 2013. Lactic acid fermentation as a tool to enhance the functional features of Echinacea spp. Microb Cell Fact. 12(44): 1-12. Doi: 10.1186/1475-2859-12-44. [ Links ]
Rodrigues da Cunha L, Fortes Ferreira CL, Durmaz E, Goh YJ, Sanozky-Dawes R, Klaenhammer T. 2012. Characterization of Lactobacillus gasseri isolates from a breast-fed infant. Gut Microbes. 3(1): 15-24. Doi: 10.4161/gmic.19489. [ Links ]
Rodríguez-León JA, Bueno G, Rodríguez DE, Delgado G, Serrano P, Brizuela M. 2003. True and apparent yields and maintenance coefficient and their significance on fermentation kinetics. En: Roussos S, Soccol CR, Pandey A, Augur C. editores. New Horizons Biotechnology. Springer Netherlands. p. 163-172. [ Links ]
Russo P, de la Luz Mohedano M, Capozzi V, de Palencia PF, López P, Spano G, Fiocco D. 2012. Comparative proteomic analysis of Lactobacillus plantarum WCF S1 and ActsR mutant strains under physiological and heat stress conditions. Int J Mol Sci. 13(9): 10680-10696. Doi: 10.3390/ijms130910680. [ Links ]
SAS Institute Inc. 2004. SAS/STAT® 9.1 User's Guide [Internet]. Cary (NC): SAS Institute Inc; [citado 2015 abr. 4]. Disponible en: https://sup-port.sas.com/documentation/onlinedoc/91pdf/sasdoc_9Ustat_ug_7313.pdf. [ Links ]
Selle K, Klaenhammer TR. 2013. Genomic and phenotypic evidence for probiotic influences of Lactobacillus gasseri on human health. FEMS Microbiol Rev. 37(6): 915-935. Doi: 10.1111/1574-6976.12021. [ Links ]
Sharma P, Tomar SK, Goswami P, Sangwan V, Singh R. 2014. Antibiotic resistance among commercially available probiotics. Food Res Int. 57: 176-195. Doi: 10.1016/j.foodres.2014.01.025. [ Links ]
Sidira M, Kandylis P, Kanellaki M, Kourkoutas Y. 2015. Effect of immobilized Lactobacillus casei on volatile compounds of heat treated probiotic dry-fermented sausages. Food Chem. 178: 201-207. Doi: 10.1016/j.foodchem.2015.01.068. [ Links ]
Singh S, Yadav AS, Bharti P. 2015. Antimicrobial Activity of Acidified Sodium Chlorite and Cell Free Culture Supernatent of Lactic Acid Bacteria against Salmonella typhimurium. Journal of Biosciences and Medicines. 3(11): 128-135. Doi: 10.4236/jbm.2015.311017. [ Links ]
Singh V, Rakshit K, Rathee S, Angmo S, Kaushal S, Garg P, Cung JH, Sandhir R, Sangwan RS, Singhal N. 2016. Metallic/bimetallic magnetic nanoparticle functionalization for immobilization of a-amylase for enhanced reusability in bio-catalytic processes. Bioresource Technology. 214: 528-533. Doi: 10.1016/j.biortech.2016.05.002. [ Links ]
Tagg JR, McGiven AR. 1971. Assay system for Bacteriocins. Appl Environ Microb. [Internet]. [Citado 2013 feb. 10]; 21 (5): 943. Disponible en: http://aem.asm.org/content/21/5/943.fUll.pdf. [ Links ]
Tejero-Sariñena S, Barlow J, Costabile A, Gibson GR, Rowland I. 2012. In vitro evaluation of the antimicrobial activity of a range of probiotics against pathogens: Evidence for the effects of organic acids. Anaerobe. 18(5): 530-538. Doi: 10.1016/j.anaerobe.2012.08.004. [ Links ]
Vásquez SM, Suárez H, Zapata S. 2009. Utilización de sustancias antimicrobianas producidas por bacterias acido lácticas en la conservación de la carne. Rev Chil Nutr. 36(1): 64-71. Doi: 10.4067/S0717-75182009000100007. [ Links ]
Waldir E, Rychtera M, Melzoch K, Quillama E, Egoavil E. 2007. Producción de ácido láctico por Lactobacillusplantarum L10 en cultivos batch y continuo. Rev Peruana Biolog. 14(2): 271-276. [ Links ]
Wang C, Wang S, Chang T, Shi L, Yang H, Shao Y, Feng W, Cui M. 2013. Efficacy of lactic acid in reducing foodborne pathogens in minimally processed lotus sprouts. Food Control. 30(2): 721-726. Doi: 10.1016/j.foodcont.2012.08.024. [ Links ]
Wong A, Saint-Ngu DY, Dan LA, Ooi A, Hong Lim RL. 2015. Detection ofantibiotic resistance in probiotics of dietary supplements. Nutrition J. 14: 1-10. Doi: 10.1186/s12937-015-0084-2. [ Links ]
Yoda K, He F, Kawase M, Miyazawa K, Hiramatsu M. 2014. Oral administration of Lactobacillus gasseri TMC0356 stimulates peritoneal macrophages and attenuates general symptoms caused by enteropathogenic Escherichia coli infection. J Microbiol Immunol Infect. 47(2): 81-86. Doi: 10.1016/j.jmii.2012.08.013. [ Links ]
Zacharof MP, Lovitt RW. 2012. Bacteriocins produced by lactic acid bacteria a review article. APCBEE Procedia. 2: 50-56. Doi: 10.1016/j.apcbee.2012.06.010. [ Links ]
Zárate G. 2012. Dairy Propionibacteria: Less Conventional Probiotics to Improve the Human and Animal Health. En: Rigobelo EC, editor. Probiotic in Animals. Intech Open Access Publisher. [ Links ]
Article citation:
Jurado-Gámez HA, Romero-Benavidez DA, Morillo-Garcés JA. 2016. Inhibición de Lactobacillus gasseri sobre Yersinia pseudotuberculosis bajo condiciones in vitro. [Inhibition of Lactobacillus gasseri on Yersinia pseudotuberculosis under in vitro conditions]. Rev Med Vet Zoot. 63(2): 95-112. Doi: 10.15446/rfmvz.v63n2.59357.