Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.64 no.1 Bogotá Jan./Apr. 2017
https://doi.org/10.15446/rfmvz.v64n1.65811
Doi: 10.15446/rfmvz.v64n1.65811
PREVALENCIA DE Cystoisospora suis EN GRANJAS PORCINAS INTENSIVAS DE LA REGIÓN CENTRAL DE VENEZUELA
PREVALENCE OF Cystoisospora suis IN SWINE INTENSIVE HERDS AT THE CENTRAL REGION OF VENEZUELA
J. C. Pinilla1*, N. Da Silva Borges2
1 Facultad de Ciencias Agropecuarias, Programa de Medicina Veterinaria, Universidad de Santander. Lagos de Cacique, Bucaramanga (Colombia).
Departamento de Producción Animal, Facultad de Agronomía, Universidad Rómulo Gallegos, Venezuela.
* Autor para correspondencia: jcpinilla@hotmail.com
2 Laboratorio de Parasitología Animal, Facultad de Agronomía, Universidad Rómulo Gallegos, San Juan de Los Morros, Venezuela.
Artículo recibido: 30 de junio de 2016 • Aprobado: 18 de febrero de 2017
RESUMEN
Entre enero y junio de 2014 se condujo una investigación en la región central de Venezuela con la finalidad de determinar la prevalencia del enterococcidio Cystoisospora suis en granjas porcinas intensivas. Para la determinación parasitaria se seleccionaron 572 camadas con signos de diarrea, así como 1.712 muestras fecales de cerdos adultos. Todas las muestras se cultivaron en dicromato de potasio al 2,5% y posteriormente se procesaron mediante una técnica coproparasitológica. Los resultados señalan que C. suis se encontró en 55 granjas (82,1%) y 210 camadas (36,7%), con los mayores valores de prevalencia en las dos primeras semanas de vida (P < 0,05). Al referir los resultados en cerdos adultos se encontró correlación significativa (rho = 0,35; P < 0,05) entre excreción de ooquistes en lechones y madres, lo que sugiere que cerdas madres podrían actuar como fuentes de infección. Se encontró correlación entre el número de partos de la cerda y los valores de prevalencia en camadas y cerdas lactantes (P < 0,05) lo que indica que, a mayor número de partos, disminuye la prevalencia. Probablemente estos hallazgos se asocian con mecanismos inmunológicos desconocidos. Se concluye que C. suis se encuentra ampliamente distribuido en Venezuela y que el enterococcidio puede ser controlado mejorando las condiciones higiénicas de las granjas; sin embargo, hay mecanismos inmunológicos aún sin dilucidar que podrían incidir en la cadena de transmisión del protozoario.
Palabras clave: Cystoisospora suis, epidemiología, granjas, porcinos, Venezuela.
ABSTRACT
It was carried out an investigation at the central region of Venezuela from January to June 2014 with the aim to determine the prevalence of coccidian Cystoisospora suis in intensive swine herds. For parasitic determination 572 litters were selected with signs of diarrhea. Likewise, 1.712 fecal samples were also collected in mature pigs. Stool samples were cultured in a 2.5% potassium dichromate solution and later processed by coprological technique. The results of this investigation indicated that C. suis was observed in 55 herds (82.1%) and 210 litters (36.7%) with the highest prevalence values in first two weeks of age (P < 0.05). Regarding to mature pigs, there was a significant correlation (rho = 0.35; P < 0.05) among oocysts excretion in piglets and sows, suggesting that sows may act as infection sources. Sows parity was statistically correlated with the prevalence values in litters as in lactating sows (P < 0.05). This might indicate that as parity increase, prevalence decreases in these groups. Probably these findings are associated with unknown immunologic mechanisms. It is concluding that C. suis is broadly distributed in Venezuela and it could be controlled by improving conditions sanitary herd, however, non elucidated immunologic mechanisms might be involved in the protozoa transmission cycle.
Key words: Cystoisospora suis, epidemiology, herds, swine, Venezuela.
INTRODUCCIÓN
La coccidiosis neonatal porcina (cystoisosporosis) es una enfermedad intestinal causada por Cystoisospora suis (conocido también como Isospora suis), el cual es un protozoario del Phylum Apicomplexa, clase de los coccidios, con distribución cosmopolita y que se encuentra con mayor frecuencia en cerdos en confinamiento (Lindsay et al. 1999). Los animales que se infectan por C. suis desarrollan una diarrea de color amarillento a partir de la segunda semana de edad, que inicialmente es pastosa para hacerse fluida a los dos o tres días (Lindsay et al. 1999).
Cordero del Campillo et al. (1999) señalaron índices de prevalencia en granjas hasta de 92%, mientras que Karamon et al. (2007) demostraron 27,8% de prevalencia en camadas y 66,7% en granjas. Por su parte, Niestrath et al. (2002), además de Hamadejova y Vitovec (2005), señalaron 42,5 y 21,8% de prevalencia en camadas, respectivamente. En Venezuela, se determinó que la prevalencia de C. suis en lechones y cerdos de 0 a 13 semanas de edad es 21,8% y 26%, respectivamente (González de Wilinski 1993; Surumay et al. 1994). Así mismo, estudios realizados en granjas ubicadas en el municipio Mariño del estado Aragua mostraron prevalencias de 19,8% en camadas y 60% en granjas (Da Silva y Pinilla 2007), mientras que en el estado Carabobo se determinó una prevalencia de 75% (González de Wilinski et al. 2000). Por su parte, Pinilla y Coronado (2008) determinaron una prevalencia de 93,3% en granjas ubicadas en la región centro-occidental de Venezuela, y de 31,6% en lechones lactantes. Posteriormente, Pinilla (2009) determinó la presencia del enterococcidio en cuatro de cinco municipios examinados en el estado Aragua, con 75% de prevalencia en granjas y 31,9% en camadas. Con respecto a la edad, Sayd y Kawazoe (1996), además de Hamadejova y Vitovec (2005), señalaron mayores valores de prevalencia en camadas con dos semanas de vida, mientras que Niestrath et al. (2002) encontraron mayores valores en camadas de tres y cuatro semanas de edad.
La epidemiología de C. suis aún no se encuentra dilucidada del todo y es confusa en muchos de sus aspectos; se piensa que las cerdas madres pueden jugar un papel importante en la transmisión; sin embargo, no se encontraron ooquistes en muestras fecales de 77 madres en granjas ubicadas en el estado de Iowa (EE.UU.) con historia de coccidiosis neonatal (Lindsay et al. 1984; Lindsay et al. 1999). De igual forma, ni Stuart y Lindsay (1986) ni Farkas et al. (2004) encontraron cerdas excretando ooquistes, por lo cual concluyeron que las madres no juegan ningún papel en la transmisión del parásito. Sin embargo, Meyer et al. (1999) señalaron 2,3% de prevalencia de C. suis en cerdas madres; y Karamon y Ziomko (2004) determinaron 15 % de madres excretando ooquistes de C. suis. Por su parte, González de Wilinski (1993) señaló 13,6% de prevalencia de C. suis en madres lactantes y 43,4% en lechones destetados, mientras que Da Silva y Pinilla (2007) encontraron 24% de prevalencia en cerdos destetados, y Pinilla y Coronado (2008) encontraron 9 de 68 madres lactantes excretando ooquistes (13,2%), 43,7% en cerdos de iniciación y ningún verraco resultó positivo.
Según Cardona et al. (2004), así como Holyoake (2006), el número de partos de la cerda juega un papel importante sobre su sistema inmune, ya que se demostró disminución de títulos de anticuerpos contra infecciones bacterianas en animales viejos. En este mismo sentido, recientemente Schwarz et al. (2014) señalaron que el calostro y la leche maternal contienen anticuerpos útiles durante las primeras dos semanas de vida del lechón. Klopfenstein et al. (1999) y Lanfranchi et al. (2008), indicaron que el parto ocasiona estrés, sobre todo en cerdas primíparas, las cuales también se pueden verse inmunocompro-metidas por efecto del parto y la lactancia. Por su parte, Shrestha et al. (2015) señalaron que probablemente las cerdas durante su crecimiento esconden formas evolutivas intra y extraintestinales del enterococci-dio, las cuales, cuando llega el primer parto, excretan cantidades suficientes de ooquistes que son detectados por medio de técnicas de concentración-flotación; sin embargo, en la medida que avanzan en edad, sus sistemas inmunológicos se desarrollan hasta el punto de contrarrestar la infección y por tal motivo disminuye la cantidad de ooquistes, los cuales no son detectables por técnicas parasitológicas convencionales. Por otro lado, Nilsson (1988) y Roth (1999) señalaron que el destete representa el momento de mayor estrés, por lo que puede ocurrir diarrea asociada a C. suis en los lechones.
En los estados Aragua y Carabobo (región central) se encuentran más del 70% del total de las granjas intensivas del país, y aproximadamente 50% del total de vientres, lo cual las hace regiones importante en la producción porcícola venezolana (Feporcina 2010). Por ello, en el presente trabajo se planteó como objetivo determinar la prevalencia de C. suis en varias granjas porcinas intensivas ubicadas en dos entidades federales de la región central de Venezuela.
MATERIALES Y MÉTODOS
Ubicación geográfica del estudio
El estudio se realizó en la región central de Venezuela, específicamente en los estados Aragua (10°15,N - 67°36'O) y Carabobo (10011'35"N - 67°58,48"O). Las características climatológicas de la región son consideradas como bioclimáticas, con registros pluviométricos anuales entre 500 y 1.450 mm, temperaturas medias anuales entre 24,5 y 27°C con 70% de humedad relativa. Los estados están situados en altitudes entre 600 y 2.400 m.s.n.m (MARNR 2007).
Tipo de granja seleccionada
Se incluyeron únicamente explotaciones porcinas intensivas y organizadas, en flujo continuo, con tamaño igual o mayor a 100 madres en producción, lo que supone una sólida gestión económica de las mismas (Rodríguez 1995).
Diseño del muestreo
Se diseñó un muestreo aleatorio bietápico por conglomerados (Lohr 2000) empleando los registros de censos porcinos existentes en el Departamento de Epidemiología del Servicio Autónomo de Sanidad Agropecuaria (SASA 2006).
En la primera etapa del muestreo, se seleccionaron 40% de los municipios de cada estado, los cuales fueron escogidos al azar utilizando una tabla de números aleatorios: en Aragua se seleccionaron 5 de 13 municipios, mientras que en Carabobo se seleccionaron 5 de 11. En los municipios seleccionados se visitaron todas las granjas organizadas. Así, en Aragua de visitaron 43 granjas que representan el 59,7% del total de explotaciones organizadas del estado; sin embargo, solamente se pudieron examinar 32 granjas (73,6%) ya que al momento de la visita no permitieron el ingreso en 11 explotaciones por motivos sanitarios. En el caso de Carabobo se visitaron 45 granjas (58,9%); sin embargo, 10 granjas no se examinaron, pues en el momento de la visita cuatro no contaban con inventario de animales, cuatro tenían modalidades de sitio II, y en dos de ellas no se ingresó por razones de bioseguridad, para una proporción de 77,77% (35 de 45) de explotaciones examinadas.
En la segunda etapa, se tomaron las muestras en cada granja de forma proporcional al total de animales existentes en cada una y según los diferentes grupos de edad (Lohr 2000). Para el cálculo del tamaño de la muestra (n) se tomó como referencia una prevalencia conocida de 38,9% (Pinilla 2010) y un nivel de confianza de 95%. Empleando el procedimiento descrito por Morales y Pino (1987) se determinó un total de 370 muestras; sin embargo, se decidió fijar el tamaño total en 2.400 ya que se contaba con suficientes recursos y logística para la colección, envío y procesamiento de las mismas.
Toma de la muestra fecal
El muestreo se realizó entre enero y junio de 2014. En primer lugar, se seleccionaron de manera aleatoria 572 camadas de diferentes edades con signos de diarrea: en Aragua (n = 283) y en Carabobo (n = 289), y de cada una fueron tomados 4 o 5 lechones con la finalidad de hacer un pool de la muestra. A cada lechón se le introdujo un hisopo por vía rectal con el propósito de estimular la defecación y colectar las heces en tubos de ensayo previamente identificados. Se registró la edad de la camada y el número de partos de la madre en una planilla de campo. En segundo lugar, se colectaron 1.712 muestras fecales en otros grupos etarios, siguiendo un orden de menor a mayor: lechones de iniciación (n = 268), lechones de crecimiento (n = 172), lechones de engorde (n = 137), cerdas de reemplazo (n = 48), madres gestantes en edad de gestación avanzada (n = 252), madres lactantes de las camadas examinadas (n = 572) y verracos (n = 263). A las cerdas lactantes, gestantes, de reemplazo y a los verracos se les tomó la muestra de heces directamente de la ampolla rectal y en algunas ocasiones se recurrió al uso del axial para el muestreo de verracos indóciles. La muestra de heces en lechones de iniciación, crecimiento y engorde fue tomada directamente del piso o recién depuesta, tomando una pequeña porción de heces en cinco puntos dentro del corral.
Las muestras se colectaron en bolsas plásticas previamente identificadas y se introdujeron en una cava refrigerada para ser trasladadas a la unidad de investigación en parasitología de la Universidad Rómulo Gallegos, estado Guárico, Venezuela, donde fueron conservadas en refrigeración hasta su procesamiento.
Análisis coproparasitológico
Todas las muestras se cultivaron a temperatura ambiente en cápsulas de Petri utilizando 20 ml de una solución de dicromato de potasio al 2,5% durante 24 a 48 h (pool de cada camada) y de dos semanas para el resto de grupos, de manera que existiera suficiente tiempo para la esporulación de los ooquistes (Hendrix 1999). Transcurrido ese tiempo, se empleó una técnica de centrifugación-flotación empleando una solución de azúcar-sal (Henriksen y Christensen 1992) para realizar el diagnóstico parasitológico. En aquellas muestras donde la cantidad de grasa dificultaba observar los ooquistes de C. suis se empleó una técnica de sedimentación con PBS-éter descrita por Ortega-Mora et al. (1992). La visualización e identificación de los ooquistes se hizo con un microscopio binocular, usando magnificación de 10 y 40x.
Análisis estadísticos
Los resultados obtenidos se analizaron mediante estadísticos descriptivos y test de Ji-cuadrado para determinar asociaciones estadísticas. se utilizó el coeficiente con rangos de spearman (rho) para determinar asociaciones entre prevalencia y grupo etarios, y la Prueba exacta de Fisher cuando se quiso establecer comparaciones estadísticas entre pares de datos. Para los cálculos se utilizó el programa estadístico Statistix 8 (Statistix 2008).
RESULTADOS Y DISCUSIÓN
Prevalencia en granjas, municipios y estados
Se encontró C. suis en 55 de 67 granjas examinadas (82,1%), con diferentes niveles de prevalencia entre los 10 municipios evaluados en los estados Aragua y Carabobo; sin embargo, no se encontró asociación estadística (X2 = 4,55; P > 0,05) entre los valores de prevalencia del parásito con respecto a los dos estados: 81,3% (26 de 32) en el estado Aragua y 82,9% (29 de 35) en Carabobo. Al referirlo a los municipios, se determinó la presencia del parásito en cuatro de cinco municipios del estado Aragua, mientras que todos los municipios de Carabobo resultaron prevalentes a la infección. según estos resultados el parásito se encuentra presente en proporciones similares en los estados Aragua y Carabobo, así como en los diferentes municipios que han sido seleccionados. sin embargo, en el municipio Bolívar del estado Aragua no se determinó positividad, ya que, de 2 granjas existentes, solamente se examinó una, la cual resultó negativa. Estos resultados no dejan de tener importancia por cuanto la selección de los municipios fue aleatoria y el error originado fue corregido con el aumento del tamaño de la muestra. Al comparar estos resultados, coincidimos con lo señalado por González de Wilinski et al. (2000) quienes encontraron positividad en 5 de 5 (4 en Aragua y 1 en Carabobo) de los municipios examinados, así como con los resultados reportados por Pinilla (2009) quién señaló infección en 4 de 5 municipios evaluados en el estado Aragua.
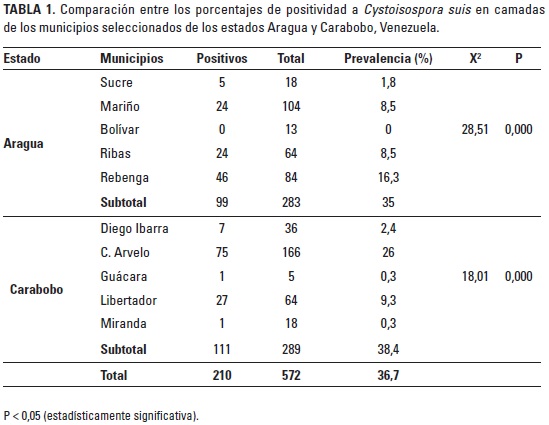
En la Tabla 1 se muestra la comparación entre los porcentajes de positividad a C. suis entre camadas provenientes de los dos estados. En Aragua se determinó 35% de prevalencia en camadas (99 de 283), observando diferentes grados de positividad, lo que refleja que hubo asociación estadística (X2 = 28,51; P < 0,05) con respecto al municipio. En este caso se observaron mayores valores de prevalencia en camadas criadas en los municipios Mariño, Ribas y Rebenga, lo que refleja que hubo asociación estadística con respecto a estos municipios. Por su parte, en el estado Carabobo se determinó 38,4% de prevalencia (111 de 289), observando diferentes grados de positividad, lo que también refleja asociación estadística (X2 = 18,01; P < 0,05) con respecto a los municipios Carlos Arvelo y Libertador, los cuales mostraron los mayores valores: 26% (75 de 289) y 9,3% (27 de 289), respectivamente. En el resto de municipios se encontraron camadas con valores más bajos de prevalencia.
Estos resultados demuestran que en los municipios Mariño, Rebenga y Ribas del estado Aragua, así como en Carlos Arvelo y Libertador del estado Carabobo, se observó una gran cantidad de granjas con pobres condiciones de manejo sanitario, lo cual incide favorablemente en la supervivencia y proliferación del protozoario. De acuerdo con la literatura consultada existe alta variabilidad entre los valores de prevalencia encontrados en camadas (entre 10 y 68,2%) en estudios llevados a cabo en Venezuela y otras regiones del mundo. Por tanto, estos resultados se encuentran en la media de estos valores; sin embargo, sería un poco difícil establecer comparaciones, ya que cada estudio fue diseñado con metodologías de trabajo diferentes.
Con respecto a la prevalencia en granjas (82,1%) coincidimos con González de Wilinski et al. (2000), quienes determinaron 75,5% de prevalencia en granjas de los estados Aragua y Carabobo (25 de 34), distribuidas en 87,5% en granjas del municipio Mariño, 66,6% en los municipios Girardot, Zamora y Ribas del estado Aragua, así como 75% de prevalencia en granjas del municipio Diego Ibarra del estado Carabobo. Igualmente, estos resultados coinciden con lo señalado por Pinilla (2009), quién determinó 75% de prevalencia en granjas del estado Aragua. Con relación a los municipios Mariño y Ribas, no coincidimos con González de Wilinski et al. (2000); sin embargo, los hallazgos obtenidos son similares a los señalados por DaSilva y Pinilla (2007) quienes demostraron 60% de positividad a C. suis en granjas ubicadas en el municipio Mariño del estado Aragua. Al comparar los hallazgos obtenidos con otras regiones de Venezuela, coincidimos con Pinilla y Coronado (2008), quienes señalaron 93,3% de prevalencia en granjas ubicadas en la región centro-occidental del país.
Al comparar los resultados obtenidos con respecto a otros países de nuestro continente, coincidimos con Sayd y Kawazoe (1996), quienes encontraron excreción de ooquistes de C. suis en 90% de las localidades (provincias) del Sudeste del estado de Sao Paulo, Brasil; así como 82% de prevalencia en las granjas examinadas. De acuerdo con lo anteriormente señalado, se infiere que C. suis se encuentra ampliamente distribuido en los municipios y granjas seleccionadas de la región central de Venezuela, existiendo alta variabilidad en los valores de prevalencia obtenidos y que pudiera ser controlada al mejorarse las condiciones higiénico-sanitarias. Probablemente, el microclima existente en las unidades paritorias proporciona las condiciones óptimas de temperatura y humedad para el desarrollo de ooquistes de C. suis, en virtud de la resistencia de estos a los agentes físicos y químicos empleados en la preparación de los paritorios.
Prevalencia en cerdos adultos
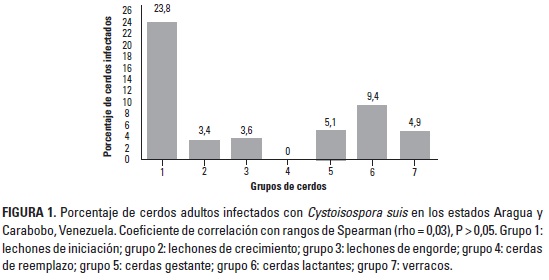
En la Figura 1 se muestra el porcentaje de cerdos adultos infectados con C. suis en las granjas examinadas. Estos resultados se analizaron mediante correlación con rangos de Spearman, y se determinó correlación positiva sin significancia estadística (rho = 0,03; P > 0,05), lo que refleja que la edad y la prevalencia a C. suis en cerdos adultos actúa de manera independiente. Se observa que todos los grupos evaluados presentaron excreción de ooquistes, con excepción de las cerdas de reemplazo. En el caso de cerdas madres (lactantes y gestantes) presentaron excreción de ooquistes (14,5%), con valores muy similares entre los 2 estados. También se determinó infección en machos reproductores (4,9%), con valores similares en los dos estados.
Los hallazgos obtenidos en cerdas difieren de lo señalado por Lindsay et al. (1984; 1999), Stuart y Lindsay (1986) y Farkas et al. (2004), quienes no encontraron cerdas madres excretando ooquistes del enterococcidio y, por tanto, concluyen que las cerdas no juegan ningún rol en la cadena de transmisión del parásito. Sin embargo, coincidimos con González de Wilinski (1993), Meyer et al. (1999), Karamon y Ziomko (2004), DaSilva y Pinilla (2007) y Pinilla y Coronado (2008), quienes señalaron diferentes proporciones del parásito en cerdas lactantes. La baja presencia de ooquistes de C. suis en heces de madres y verracos, demuestra que estos grupos pueden excretar cantidades de ooquistes que no son detectables con pruebas convencionales. Sin embargo, esas cantidades bajas de ooquistes pueden tornarse infectivas y diseminarse por toda la paridera, sobre todo cuando existen problemas higiénico-sanitarios y de manejo. Por tal motivo, las cerdas parecen jugar un papel importante en la cadena de transmisión, bien sea por un parasitismo activo no determinado, o por transporte pasivo de ooquistes a sus lechones.
Con relación a los cerdos destetados, se determinó excreción de ooquistes en las tres etapas postdestete, con especial significancia en la iniciación (23,8%). Los resultados obtenidos en lechones destetados coinciden con González de Wilinski (1993) y Pinilla y Coronado (2008), quienes señalaron la presencia del enterococcidio en este grupo; por tanto, se piensa que lechones destetados, así como los cerdos en crecimiento y engorde, criados y mantenidos en corrales próximos al área de maternidad, actúan como agentes diseminadores del parásito, sobre todo en aquellas granjas de flujo continuo donde no aplican buenas medidas de bioseguridad.
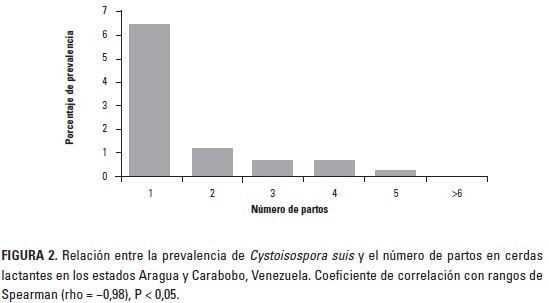
Los hallazgos obtenidos en cerdas lactantes se distribuyeron de acuerdo al número de partos y se analizaron mediante una prueba de correlación con rangos de Spearman, el cual arrojó una correlación negativa y estadísticamente significativa (rho = -0,98; P < 0,05), lo que indica que existe una disminución de la prevalencia en madres en la medida que aumenta el número de partos (Figura 2). Con estos resultados se evidencia asociación estadística entre las dos variables y se observa mayor excreción de ooquistes en cerdas de primer parto, lo que probablemente se deba a la influencia de factores de tipo inmunológico. Aunque se ha reportado que cerdas madres excretan poca cantidad de ooquistes, este hallazgo no ha sido señalado por ningún autor de la bibliografía consultada y tiene un significado importante para entender el comportamiento epidemiológico de C. suis. De acuerdo con este hallazgo se confirma que las cerdas madres excretan ooquistes del parásito a través de las heces; sin embargo, del total de cerdas lactantes excretando ooquistes de C. suis (9,4%), se observó que 6,5% eran de primer parto, lo que reflejó la asociación estadística existente.
El número de partos de la cerda parece ser un factor de riesgo que afecta el desempeño productivo en las salas de parto y por eso en muchas empresas porcinas se busca mantener cierta uniformidad en esta variable. Cardona et al. (2004), así como Holyoake (2006), comprobaron que las cerdas adquieren mejor estatus inmunitario en la medida que se hacen viejas, y esto fue señalado para Mycoplasma hyopneumoniae y Haemophilusparasuis, bacterias para las que se demostró disminución en los títulos de anticuerpos en la medida que las cerdas se hacían maduras. Probablemente, las cerdas durante su crecimiento mantienen y esconden formas evolutivas intra y extraintestinales del parásito y cuando llega el momento del primer parto comienzan a excretar cantidades suficientes de ooquistes que son detectados por medio de técnicas de concentración-flotación; sin embargo, en la medida que avanzan en edad, sus sistemas inmunológicos se desarrollan hasta el punto de contrarrestar la infección y por tal motivo disminuye la cantidad de ooquistes, los cuales no son detectables mediamte técnicas parasitológicas convencionales de flotación. También se podría pensar que cerdas primerizas se tornan más vulnerables que cerdas viejas a los cambios ocurridos durante el traslado a la sala de partos, los ruidos, el personal y los eventos asociados con el primer parto, los cuales ocasionan un gran estrés a estos animales, alterar su sistema inmunológico y de esta manera iniciar la excreción de ooquistes del parásito. Klopfenstein et al. (1999) y Lanfranchi et al. (2008) señalaron que los nuevos eventos y cambios que ocurren en el parto de las cerdas (dolor, nerviosismo) son fuente principal de estrés, sobre todo en cerdas primíparas, las cuales también se pueden ver inmunocomprometidas por efecto de la lactancia.
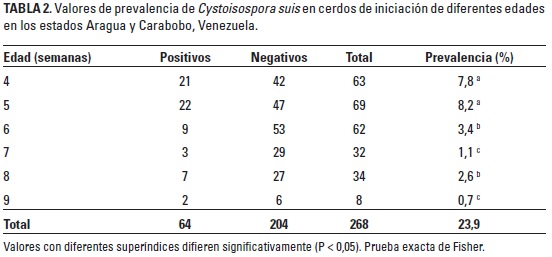
En la Tabla 2 se muestra la comparación entre valores de prevalencia a C. suis en lechones de iniciación en diferentes semanas de producción. Según estos resultados existen diferencias estadísticas (P < 0,05) en los seis grupos examinados, donde se muestra que los animales con cuatro y cinco semanas de edad presentaron los mayores valores de prevalencia. El destete de los cerdos se ha señalado como el momento de mayor estrés en la etapa productiva del animal. Nilsson (1988) asoció el estrés ocasionado por el destete con la excreción de ooquistes de C. suis en cerdos de cinco y seis semanas de edad. Indudablemente, la respuesta inmune del lechón ante cualquier agente patógeno puede verse comprometida por situaciones de manejo que desencadenen estrés. Existen suficientes evidencias que señalan que el estrés tiene efectos sobre el sistema inmune del cerdo. En tal sentido, se ha comprobado que el estrés aumenta los niveles sanguíneos de corticoesteroides, especialmente cortisol, pudiendo reducir la proliferación de linfocitos, así como el tamaño de los linfonódulos y, por consiguiente, disminución del número de anticuerpos producidos (Roth 1999). Esta alteración en los mecanismos inmunes del lechón podría jugar un papel importante en la aparición de ooquistes en animales jóvenes; sin embargo, se desconoce el papel que juegan las cerdas madres en la respuesta inmune del lechón, aunque Schwarz et al. (2014) demostraron la presencia de anticuerpos en el calostro y la leche de madres súperinfectadas experimentalmente, las cuales podrían actuar favoreciendo la respuesta inmune del lechón. Con los hallazgos anteriormente señalados se infiere que cerdos de iniciación y madres lactantes podrían interactuar en la cadena de transmisión del parásito y actuar como posibles fuentes de infección para los lechones en etapa de lactancia.
Prevalencia en camadas
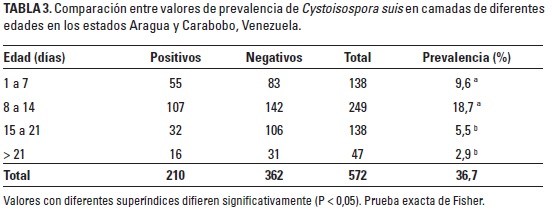
Se determinó una prevalencia total de 36,7% en lechones lactantes de diferentes edades (210 de 572). En la Tabla 3 se muestra la comparación entre los valores de prevalencia en camadas de diferentes edades, resultados que indican que hubo diferencias estadísticas entre los cuatro grupos examinados, en los que se observó que las camadas con 1 a 7 y 8 a 14 días mostraron los mayores valores de prevalencia (P < 0,05) con respecto de aquellas con edades mayores (15 a 21 y > 21 días). Al comparar estos resultados con algunos antecedentes en el país, coincidimos con DaSilva y Pinilla (2007), Pinilla y Coronado (2008) y Pinilla (2009), quienes señalaron valores de prevalencia similares en camadas, mientras que diferimos con González de Wilinski (1993) y González de Wilinski et al. (2000), quienes determinaron valores inferiores (21,8%), probablemente debido al empleo de la técnica de Wisconsin en el diagnóstico de C. suis, el cual pudo haber influido en sus resultados. De igual forma diferimos con Surumay et al. (1994), quienes indicaron una alta variabilidad en la prevalencia de C. suis en lechones desde un día hasta 13 semanas de nacidos.
Con respecto a resultados obtenidos en regiones porcícolas de Brasil, diferimos de Sayd y Kawazoe (1996), quienes reportaron valores inferiores de prevalencia en animales con edades entre 10 a 50 días, sin distinción de casos con diarrea y empleando una técnica de flotación con solución de azúcar. Con lo anteriormente señalado, se infiere que actualmente existe una alta variabilidad entre los valores de prevalencia observados en la región central de Venezuela. No obstante,, con el empleo de una técnica coprológica por concentración-flotación e incluyendo en el protocolo de diagnóstico la sedimentación con PBS-éter y utilizando soluciones hiperdensas (azúcar-sal; d= 1,30) para la flotación de ooquistes de C. suis en camadas de diferentes edades y signos de diarrea, es suficiente para estimar el comportamiento del parásito en camadas y de esta manera establecer programas de control en las granjas o la región.
CONCLUSIONES
Existe una amplia distribución del proto-zoario C. suis y alta variabilidad en su prevalencia en la región central de Venezuela, la cual puede ser controlada si se mejoran las condiciones higiénico-sanitarias de las explotaciones.
Se demostró la presencia de ooquistes no esporulados de C. suis en cerdos con menos de 72 h de nacidos.
Se determinó excreción de ooquistes en cerdas madres y lechones en iniciación, lo que supone que estos grupos podrían actuar como fuentes de infección y diseminación del parásito.
El número de partos de la cerda tuvo impacto sobre la prevalencia obtenida en camadas y madres examinadas.
REFERENCIAS
Cardona AC, Pijoan C, Utrera V, Deen J. 2004. Prevalence of Mycoplasma hyopneumoniae in different parity cull sows. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th International Pig Veterinary Society Congress; 2004 jun. 17-1 jul; Hamburg (DE): International Pig Veterinary Society. p. 402. [ Links ]
Cordero del Campillo M, Rojo FA, Martínez AR, Sánchez MC, Hernandez S, Navarrete I, Diez P, Quiroz H, Carvalho M. 1999. Parasitología Veterinaria. 1° ed. Madrid (ES): McGraw-Hill / Interamericana. [ Links ]
Da Silva N, Pinilla J. 2007. Evaluación parasitológica y caracterización de granjas porcinas ubicadas en el municipio Santiago Mariño del estado Aragua. [Trabajo de pasantías académicas]. [San Juan de Los Morros (VZ)]: Universidad Rómulo Gallegos. [ Links ]
Farkas R, Szeidemann Z, Majoros G. 2004. Prevalence and Geographical distribution of Isosporosis in swine farms of Hungary. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th International Pig Veterinary Society Congress; 2004 jun. 17-1 jul; Hamburg (DE): International Pig Veterinary Society. p. 314. [ Links ]
Feporcina. 2010. Comportamiento del sector porcino venezolano en el año 2005. Rev. Inf. Divulg. 1: 10-12. [ Links ]
González de Wilinski Y. 1993. Prevalencia de coccidias en suinos del estado Aragua y Municipio Diego Ibarra del estado Carabobo. Vet Trop. 18: 45-57. [ Links ]
González de Wilinski Y, De Moreno L, García G. 2000. Isospora suis en granjas con diferentes condiciones de instalaciones y manejo. Vet Trop. 25(2): 257-265. [ Links ]
Hamadejova K, Vitovec J. 2005. Ocurrence of the coccidium Isospora suis in piglets. Vet Med Czech. 50(4): 159-163. [ Links ]
Hendrix CM. 1999. Diagnóstico Parasitológico Veterinario. 2° ed. Madrid (ES): Editorial Harcourt Brace. [ Links ]
Henriksen SA, Christensen JP. 1992. Demonstration of Isospora suis oocysts in faecal samples. Vet Rec. 131(19): 443-444. [ Links ]
Holyoake PK. 2006. Dam parity affects the performance of nursery pigs. En: Nielsen JP, Jorsal SE, editores. Proceedings of the 19th International Pig Veterinary Society Congress; 2006 jul. 16-19; Copenhagen (DN). p. 149. [ Links ]
Karamon J, Ziomko I. 2004. Prevalence of coccidia invasions in sows and suckling piglets in Poland. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th International Pig Veterinary Society Congress; 2004 jun. 17-1 jul; Hamburg (DE): International Pig Veterinary Society. p. 21. [ Links ]
Karamon J, Ziomko I, Cencek T. 2007. Prevalence of Isospora suis and Eimeria spp. in suckling piglets and sows in Poland. Vet Parasitol. 147(1-2): 171-175. Doi: 10.1016/j.vetpar.2007.03.029. [ Links ]
Klopfenstein C, Farmer C, Martineau G. 1999. Diseases of the mammary glands and lactation problems. En: Straw BE, D'Allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (IW): Iowa State University Press. p. 833-860. [ Links ]
Lanfranchi E, Gonxález J, Filios S. 2008. The efficacy of butafosfan in the periparturient sow - Field trial Mexico. En: Proceedings of the 20th IPVS Congress; 2008 jun. 22-26; Durban (SA): International Pig Veterinary Society. p. 479. [ Links ]
Lindsay D, Ernst J, Current W, Stuart B, Stewart T. 1984. Prevalence of oocysts of Isospora suis and Eimeria spp. from sows on farms with and without a history of neonatal coccidiosis. J Am Vet Med Assoc. 185: 419-421. [ Links ]
Lindsay D, Blagburn B, Dubey J. 1999. Coccidia and Other Protozoa. En: Straw BE, D'Allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (IW): Iowa State University Press. p. 655-660. [ Links ]
Lohr S. 2000. Muestreo: Diseño y análisis. International Thomson Editores. México. 480 p. [ Links ]
Meyer C, Joachim A, Daugschies A. 1999. Ocurrence of Isospora suis in larger piglet production units and on specialized piglet rearing farms. Vet Parasitol. 82(4): 277-284. [ Links ]
[MARNR] Ministerio del Ambiente y de los Recursos Naturales Renovables. 2007. Anuario Climatológico. Estados Aragua y Carabobo. 170 p. [ Links ]
Morales G, Pino A. 1987. Parasitología cuantitativa. Caracas (VZ): Fondo Editorial Acta Científica Venezolana. 132 p. [ Links ]
Niestrath M, Takla M, Joachim A, Daugschies A. 2002. The role of Isospora suis as a pathogen in conventional piglet production in Germany. J Vet Med B Infect Dis Vet Public Health. 49(4): 176-180. Doi: 10.1046/j.1439-0450.2002.00459.x. [ Links ]
Nilsson O. 1988. Isospora suis in pigs with post weaning diarrhea. Vet Rec. 122(13): 310-311. [ Links ]
Ortega-Mora L, Troncoso J, Rojo-Vázquez F, Gómez-Bautista M. 1992. Evaluation of an improved method to purify Cryptosporidium parvum oocysts. Res Rev Parasitol. 52(3-4): 127-130. [ Links ]
Pinilla JC. 2009. Prevalencia de Isospora suis en granjas porcinas intensivas ubicadas en el estado Aragua (Venezuela). Zoot Trop. 27(2): 1-9. [ Links ]
Pinilla JC. 2010. Estudio epidemiológico de Isospora suis en granjas porcinas intensivas ubicadas en la región central de Venezuela. [Tesis Doctoral]. [Maracay (VZ)]: Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. [ Links ]
Pinilla JC, Coronado A. 2008. Prevalencia de Isospora suis en lechones criados en granjas de la región Centro-Occidental de Venezuela. Zoot Trop. 26(1): 47-53. [ Links ]
Rodríguez D. 1995. Estudio Seroepidemiológico de la enfermedad de Aujeszky en granjas porcinas del estado Carabobo. [Tesis de Maestría]. [Maracay (VZ)]: Universidad Central de Venezuela. [ Links ]
Roth JA. 1999. The System Inmune. En: Straw BE, D'allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (US): Iowa State University Press. p. 799-820. [ Links ]
[SASA] Servicio Autónomo de Seguridad Agropecuaria. 2006. Censo de granjas porcinas de los estados Aragua y Carabobo. En: Reportes de programa vacunación contra Fiebre Aftosa. Departamento de epidemiología. [ Links ]
Sayd S, Kawazoe U. 1996. Experimental infection of swine by Isospora suis Biester 1934 for species confirmation. Mem Inst Oswaldo Cruz. 93(6): 851-854. [ Links ]
Schwarz L, Worliczek H, Winkler M, Joachim A. 2014. Superinfection of sows with Cystoisospora suis ante partum leads to a milder course of cystoisosporosis in suckling piglets. Vet Parasitol. 204(3-4): 158-168. [ Links ]
Shrestha A, Abd-Elfattah A, Freudenschuss B, Hinney B, Palmieri N, Ruttkowski B, Joachim A. 2015. Cystoisospora suis - A Model of Mammalian Cystoisosporosis. Front Vet Sci. 2: 68. Doi: 10.3389/fvets.2015.00068. [ Links ]
Statistix. 2003. Statistix 8. Analytical Software for Windows. USA. [ Links ]
Stuart BP, Lindsay DS. 1986. Coccidiosis in swine. Vet Clin North Am Food Anim Pract. 2(2): 455-468. Doi: 10.1016/S0749-0720(15)31256-1. [ Links ]
Surumay QL, González de Moreno L, Morales G, Pino de Morales A, Castillo L. 1994. Parasitosis diagnosticadas en el Instituto de Investigaciones Veterinarias Período 1987-1992. Vet Trop. 19(1): 63-75. [ Links ]
Article citation:
Pinilla JC, Da Silva N. 2017. Prevalencia de Cystoisospora suis en granjas porcinas intensivas de la región central de Venezuela. [Prevalence of Cystoi-sospora suis in swine intensive herds at the central region of Venezuela]. Rev Med Vet Zoot. 64(1): 11-23. Doi: 10.15446/rfmvz.v64n1.65811.