Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.64 no.1 Bogotá Jan./Apr. 2017
https://doi.org/10.15446/rfmvz.v64n1.65813
Doí: 10.15446/rfmvz. v64n1.65813
PROTOCOLO PARA LA OBTENCION DE UN CONCENTRADO AUTOLOGO DE PLAQUETAS EN CONEJOS: ESTUDIO PILOTO
PROTOCOL FOR OBTAINING AUTOLOGOUS PLATELETS CONCENTRATE IN RABBITS: A PILOT STUDY
A. F. Bonilla-Gutiérrez1*, C. Aragón-Urrego1, O. L. Aristizábal-Páez1
1 Grupo de Investigación en Medicina y Cirugía de Pequeños Animales, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima.
Barrio Santa Helena Parte Alta, A.A. 546, Ibagué, Tolima (Colombia).
* Autor para correspondencia: afbonillag@gmail.com
Artículo recibido: 11 de marzo de 2016 • Aprobado: 21 de febrero de 2017
RESUMEN
Una de las principales dificultades que se presenta en la práctica quirúrgica es el restablecimiento de la integridad de los tejidos afectados por la patología o por la técnica quirúrgica implementada para su resolución. Actualmente se desarrollan técnicas y tratamientos enfocados en mejorar los procesos cicatrizales y favorecer la regeneración de los tejidos; uno de ellos es el Concentrado Autólogo de Plaquetas (CAP). El objetivo del presente estudio fue evaluar la técnica de colecta y procesamiento de la sangre para obtener CAP en un modelo experimental lagomorfo utilizando conejos machos de la raza Nueva Zelanda (n = 10) con pesos comprendidos entre 3 y 3,8 kg. La sangre de cada animal fue obtenida por punción de la vena yugular, colectada en tubos con citrato de sodio y centrifugada a 120 g durante 5 minutos. Después del proceso de centrifugación los niveles de eritrocitos, leucocitos y plaquetas presentaron diferencias estadísticamente significativas (P < 0,05) en comparación con la sangre completa. Los resultados de este estudio, permiten concluir que es factible la elaboración de un CAP para la especie leporina, obteniendo plaquetas sin alteración de la morfología a partir de un ciclo de centrifugación.
Palabras clave: plasma rico en plaquetas, medicina regenerativa, regeneración tisular.
ABSTRACT
One of the main difficulties presented in surgical practice, is the restoration of the integrity of the tissues that are affected by the pathology or the surgical technique performed for its resolution. Currently, techniques and treatments are developed focused to improve scarring processes tissue and promote tissue regeneration; one of them is Autologous Platelets Concentrate (APC). The aim of the present study was evaluate the blood collection and processing technique for obtaining APC in a lagomorph model. New Zealand male rabbits (n=10), with weights ranging from 3 to 3.8 kg, were used as experimental model. The blood sample of each animal was obtained by puncture of the jugular vein into tubes with sodium citrate and centrifuged at 120 g for 5 minutes. The levels of erythrocytes, leukocytes and platelets after the centrifugation process presented statistically significant differences (P < 0.05) compared to whole blood. The results of this study support the conclusion that the development of a APC for leporidae species is feasible, obtaining platelets without morphology alterations after a single centrifugation cycle.
Keywords: Platelet-rich plasma, regenerative medicine, tissue regeneration.
INTRODUCCIÓN
Los procedimientos quirúrgicos han tenido gran avance en la medicina veterinaria con resultados cada vez más eficaces y mejores. Sin embargo, una de las principales dificultades que se presenta es el restablecimiento de la integridad y función de los tejidos afectados, indistintamente de cual sea la patología que se presente o la técnica quirúrgica realizada para su resolución. Lo anterior es de especial interés, por cuanto se cuenta con técnicas o tratamientos que han demostrado mejorar el proceso de regeneración de los tejidos y cicatrización de las heridas. Una de estas técnicas, es el Concentrado Autólogo de Plaquetas (CAP) el cual permite disminuir el uso de fármacos y antibióticos que pueden conducir a mayores costos económicos.
Concentrado Autólogo de Plaquetas
El CAP es una porción de la fracción de plasma sanguíneo que presenta una concentración de plaquetas superior a los valores basales: es pertinente recordar que las plaquetas intervienen en la modulación y aceleración de los procesos de cicatrización a través de los factores de crecimiento (GF, por su denominación en inglés, growth factors) presentes en los gránulos a, los cuales son capaces de promover la regeneración y reparación de tejidos (Wu et al. 2016).
Aplicaciones del CAP
El uso de CAP ha sido documentado con antelación en el sentido que los GF presentes en las plaquetas resultan ser beneficiosos por cuanto optimizan el proceso de cicatrización del tejido conectivo, mejoran el proceso de reparación tisular e influyen en la disminución de la morbilidad. El CAP se ha utilizado ampliamente en diversas especialidades médicas que incluyen la odontología, la ortopedia, la neurocirugía, la oftalmología, la cirugía maxilofacial y la cirugía cosmética (Carter et al. 2003; Crane y Everts 2008; Dohan et al. 2005; Gürgen 2008; Bonete et al. 2009; Mishra et al. 2009; Sommeling et al. 2013). En medicina veterinaria se han efectuado trabajos principalmente en equinos con lesiones de ligamentos, tendones y osteoartritis (Carmona et al. 2009; Textor 2011), en colgajos cutáneos y asociado a cerámicas en columna vertebral en ratas (Delgado et al. 2009; Li et al. 2012), en ovejas con infarto agudo de miocardio estimulando la formación de células y vasos sanguíneos, y en la regeneración de cartílago (Carneiro 2013; Gallo et al. 2013), y en cerdos evaluando la capacidad osteogénica en trepanaciones mandibulares (Castañeda-Vega et al. 2010). También en caninos se ha reportado su uso clínico y en estudios experimentales de regeneración ósea maxilar, apendicular y en pruebas de osteointegración (Casati et al. 2007; Moreno et al. 2004; Silva et al. 2012; Silva et al. 2011a; Silva et al. 2007).
Se han descrito algunos protocolos para la colecta de sangre y obtención de CAP en conejos (Batista et al. 2011; Donatti et al. 2013; González et al. 2013). Algunos de estos estudios no describen detalladamente las técnicas o materiales usados, al igual que las gravedades y tiempos de centrifugación, o los resultados no se han podido replicar por parte de los autores de este reporte.
El presente documento expone el estudio piloto de un método para obtener CAP, describiendo la técnica de colecta, el material utilizado y demás herramientas para la centrifugación y obtención del CAP en un modelo experimental como es el conejo, utilizado en diversos campos de investigación médica y con aplicación en humanos y otras especies animales.
MATERIALES Y MÉTODOS
Animales
Se utilizaron 10 conejos macho de la raza Nueva Zelanda con pesos comprendidos entre 3 y 3,8 kg procedentes de la granja "Las Brisas", propiedad de la Universidad del Tolima. Los animales se encontraban clínicamente sanos al momento de la colecta y fueron alojados en jaulas individuales, con comida y agua ad libitum. La utilización de los animales en el presente estudio fue aprobada por el comité de ética para experimentación con animales de la institución de los autores.
Protocolo de obtención de CAP
Previamente a la toma de la muestra sanguínea los animales objeto de estudio fueron premedicados con 0,2 mg/kg de meloxicam (Melodol® 0,5%, Laboratorios Chalver) vía intramuscular y 25 mg/kg de cefalexina (Rilexine® 150, Virbac) vía intramuscular. Para la anestesia se realizó inyección endovenosa de xilacina (Xila-cina® 2%, Erma) 2 mg/kg y ketamina (Ketamina® 50, Holliday) 6 mg/kg por medio de catéter No. 22 (safelet®) posicionado en la vena marginal de la oreja. se realizó tricotomía y antisepsia del área ventral de la región cervical. Siguiendo la técnica propuesta por González et al. (2013), se realizó infiltración de lidocaí-na (Lidocaína® 2%, Virbac) en el tejido subcutáneo adyacente a la vena yugular y posteriormente se realizó la venodisec-ción de la misma. Una vez identificada la vena, se procedió a la venopunción de esta, mediante un sistema de colecta de sangre al vacío con aguja de 22G x 1" (BD®) el cual permitió almacenarla en tubos de 3,5 ml con citrato de sodio al 3,2% (Vacuette®), garantizando con ello la inocuidad de la muestra.
La sangre obtenida se analizó por medio de hemograma automatizado mediante impedancia eléctrica (FC-620 Vet®), determinando los siguientes parámetros hematológicos: leucocitos (WBC), eritrocitos (RBC), plaquetas (PLT), Volumen Plaquetario Medio (MPV) y Volumen de Distribución Plaquetario (PDW). Los tubos se mantuvieron a temperatura ambiente y fueron centrifugados a 120 g durante 5 minutos (centrífuga Hermle Z 32 HK®).
El plasma obtenido de la centrifugación se dividió arbitrariamente en partes iguales. Se extrajo un volumen de 2 ml del 50% del plasma que se encontraba en el nivel inmediatamente superior a la interface leuco-plaquetaria (buffy coat) y fue analizado nuevamente por duplicado utilizando el hemograma automatizado.
Análisis estadístico
Por medio del software estadístico Gra-phPad Prism® versión 6 (GraphPad software, San Diego, CA, USA) se realizó la prueba de Shapiro Wilk a fin de conocer la normalidad de las variables estudiadas. Estas se analizaron por medio del test de Wilcoxon y sus resultados se presentan como media y desviación estándar. Se determinó la eficiencia de colección de plaquetas por medio de la siguiente ecuación (Weibrich et al. 2003):
Eficiencia de Colecta de Plaquetas = volumen de CAP x recuento de plaquetas en el CAP / volumen de sangre entera x recuento de plaquetas en sangre entera X 100
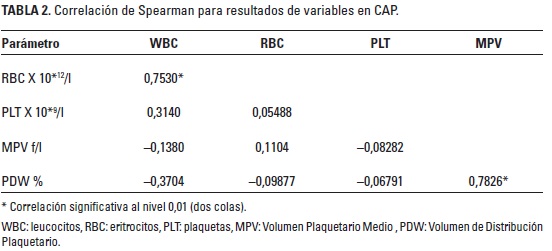
Se realizó correlación de Spearman para evaluar el grado de asociación entre las variables del CAP obtenido.
RESULTADOS
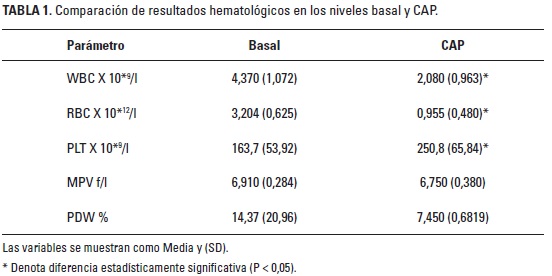
En el análisis hematológico los resultados que presentaron diferencias estadísticamente significativas (P < 0,05) fueron las variables WBC (10*9/l), RBC (10*12/l) y PLT (10*9/l) (Tabla 1). Se encontró correlación positiva moderada entre el MPV y el PDW, al igual que entre el conteo de células rojas y el conteo de células blancas (Tabla 2). La eficiencia en la colección de plaquetas fue de 51,06%. El porcentaje de plaquetas concentradas en el CAP fue de 153% con respecto a la media de plaquetas obtenidas en los resultados basales.
DISCUSIÓN
A pesar de que se conocen diversas publicaciones sobre la obtención de CAP en conejos, la escasa estandarización y la disimilitud entre los diferentes métodos para su obtención dificulta la elección del protocolo más apropiado, razón por la cual a criterio de cada investigador se establece la metodología conforme a las condiciones de trabajo existentes (Aleixo et al. 2011). Entre los métodos reportados se presentan diferencias notorias principalmente en la obtención de la sangre, la centrifugación, el anticoagulante usado y la cantidad de plaquetas concentradas.
La obtención de la sangre se realizó por medio de venodisección de la vena yugular usando el método descrito por González et al. 2013. A consideración de los autores fue el procedimiento más seguro y eficaz, después de realizar pruebas colectando de la vena femoral, la vena safena y las venas marginales de la oreja, descritas en otros estudios (Batista et al. 2011; Donatti et al. 2013; González et al. 2013). En un estudio reciente publicado por Pazzini et al. (2016), lograron colectar sangre de la vena yugular sin disección de los tejidos adyacentes; sin embargo, según la experiencia de los autores, no es posible una adecuada visualización de la vena, lo que podría provocar la presentación de mayores traumatismos vasculares en los conejos y la formación de trombos en las muestras.
Así mismo, se han descrito métodos de doble centrifugación: sin embargo, estos podrían provocar una activación prematura de las plaquetas con la respectiva liberación de los GF (González et al. 2013; Nagata et al. 2010). La eficiencia de colección de plaquetas fue de 51,06%, mayor a la obtenida en otra investigación en la misma especie en la que reportaron eficacias de 20,6% y 18,27% (González et al. 2013). Igual sucede en otras especies donde encontraron eficacias de 50% en felinos, de 29,9% en caninos, y de 7,5% y 19,1% en equinos y bovinos respectivamente: en los dos últimos reportes se usaron métodos de doble centrifugación (Argüelles et al. 2006; López et al. 2012; Silva et al. 2011a; Silva et al. 2011b).
Algunos autores han descrito el uso de diversos anticoagulantes como la heparina, el EDTA, el citrato de sodio, el ácido cítrico y la dextrosa en solución para colectar sangre para obtener CAP. La elección del citrato de sodio se debió a su consecución estéril en los tubos vacutainer, lo que reduce el riesgo de contaminación. En comparación con otros anticoagulantes, el citrato de sodio tiene la capacidad de conservar la estructura y la homogeneidad de las plaquetas (Carmona et al. 2014; White 2000).
La cantidad de plaquetas colectadas en nuestro estudio es menor en comparación con los métodos de doble centrifugación realizados por Nagata et al. (2010) y Pa-zzini et al. (2016), en los que obtuvieron 1.986 x 103 PLT/pl y 1.176 x 103 PLT/ pl, respectivamente. No obstante, los métodos de doble centrifugación causan alteración en la morfología de las plaquetas y son más sensibles a errores en el proceso (Nagata et al. 2010). Se puede considerar que la cantidad de plaquetas obtenida en el presente estudio podría ser suficiente para producir su efecto, ya que se ha observado que la respuesta clínica no tiene correlación con la concentración de plaquetas sino con su integridad (López et al. 2012). Las características de MPV Y PDW, como indicadores de la integridad de las plaquetas, no tuvieron diferencias significativas en los valores basales y el CAP
La cantidad de células de línea blanca en el CAP fue 2.080 x 10*9/l, menor a la obtenida por González et al. (2013), quienes a pesar de colectar mayor número de plaquetas, obtuvieron 7.060 x 10*9/l leucocitos. Algunos autores consideran que la concentración de un gran número de leucocitos en los CAP podría ser perjudicial para los tejidos tratados (Chizzolini et al. 2011; Zimmermann et al. 2003) y aunque se ha estudiado su efecto en diferentes circunstancias, como la reducción del crecimiento bacteriano, su presencia y cantidad en los CAP es aún controversial (Carmona et al. 2011; López et al. 2015).
Aunque se evidenció una diferencia estadística significativa en la cantidad de células de la línea roja entre la sangre entera y el CAP obtenido, esto no supone ningún efecto, pues la concentración es mínima y aún se desconoce su incidencia en los efectos del CAP. Las correlaciones positivas moderadas entre WBC y RBC, y entre MPV y PDW, permiten suponer que a mayor cantidad de hematíes mayor sería la cantidad de leucocitos que se concentrarán en el CAP. A pesar de la cantidad limitada de animales usados, los resultados permiten inferir que el protocolo descrito es viable para la obtención de CAP en conejos.
CONCLUSIONES
Los resultados de este estudio piloto permiten concluir que es factible la elaboración de un CAP para la especie leporina, mediante un protocolo con centrifugación a 120 g durante 5 minutos, obteniendo 153% más plaquetas que los niveles basales, y niveles menores de leucocitos a los reportados en otras investigaciones. Los resultados obtenidos son aplicables en los centros veterinarios para tratar lesiones en conejos: sin embargo, se hace necesaria la realización de más investigaciones con una mayor población para determinar de manera más confiable los resultados aquí expresados.
AGRADECIMIENTOS
Al Dr. Fabián Castañeda, por su colaboración. Al Laboratorio de Diagnóstico Veterinario (ladive), al Laboratorio de Servicios de Extensión en Análisis Químico (laserex) y a la Oficina Central de Investigaciones de la Universidad del Tolima.
REFERENCIAS
Aleixo GAS, Coelho MCOC, Teixeira MN, Mesquita EP, Oliveira FF, Zubieta LMV, Almeida TLC, Guimaraes ALN, Maia FC, Zacarias TFL, et al. 2011. Comparison between two protocols to obtain platelet-rich plasma in dogs. Arq Bras Med Vet Zootec. 63(3): 567-573. Doi: 10.1590/S0102-09352011000300005. [ Links ]
Argüelles D, Carmona JU, Pastor J, Iborra A, Viñals L, Martínez P, Bach E, Prades M. 2006. Evaluation of single and double centrifugation tube methods for concentrating equine platelets. Res Vet Sci. 81(2): 237-245. Doi: 10.1016/j.rvsc.2005.12.008. [ Links ]
Batista M, Leivas T, Rodrigues C, Arenas GC, Belitardo DR, Guarniero R. 2011. Comparison between the effects of platelet-rich plasma and bone marrow concentrate on defect consolidation in the rabbit tibia. Clinics. 66(10): 1787-1792. Doi: 10.1590/S1807-59322011001000018. [ Links ]
Bonete D, Gomar F, Carrasco J. 2009. Utilización de geles plaquetarios en la curación de los defectos óseos. Estudio experimental. Rev Esp Cir Osteoart. 44: 93-101. [ Links ]
Carmona J, López C, Giraldo C. 2011. Uso de concentrados autólogos de plaquetas como terapia regenerativa de enfermedades crónicas del aparato musculoesquelético equino. Arch Med Vet. 43(1): 1-10. Doi: 10.4067/S0301-732X2011000100002. [ Links ]
Carmona J, Prades M, Argüelles D. 2009. Concentrados autólogos de plaquetas como tratamiento de lesiones de tejidos blandos del aparato locomotor en caballos. Arch Med Vet. 41(1): 77-82. Doi: 10.4067/S0301-732X2009000100011. [ Links ]
Carmona JU, Ríos E, Vilar JM, Giraldo CE, López C. 2014. Efectos de dos anticoagulantes sobre el conteo celular y parámetros de activación plaquetaria de plasma rico en plaquetas de bovinos. Arch Med Vet. 46(3): 375-380. Doi: 10.4067/S0301-732X2014000300005. [ Links ]
Carneiro M, Barbieri CH, Barbieri N. 2013. Platelet-rich plasma gel promotes regeneration of articular cartilage in knees of sheeps. Act Ort Bras. 21(2): 80-86. Doi: 10.1590/S1413-78522013000200003. [ Links ]
Carter C, Jolly DG, Worden CE, Hendren DG, Kane CJ. 2003. Platelet-rich plasma gel promotes differentiation and regeneration during equine wound healing. Exp Mol Pathol. 74(3): 244-255. Doi: 10.1016/S0014-4800(03)00017-0. [ Links ]
Casati MZ, de Vasconcelos Gurgel BC, Gonçalves PF, Pimentel SP, da Rocha Nogueira Filho G, Nociti Jr. FH, Sallum EA. 2007. Platelet-rich plasma does not improve bone regeneration around peri-implant bone defects-A pilot study in dogs. Int J Oral Max Surg. 36(2): 132-136. Doi: 10.1016/j.ijom.2006.06.004. [ Links ]
Castañeda-Vega P, López-López J, Chimenos-Küstner E, Manzanares-Céspedes C, Muñoz-Sánchez J, Jané-Salas E, Alvarez-López JM, Gimeno-Sanding A. 2010. Estudio histomor-fológico de la capacidad de regeneración ósea del plasma rico en plaquetas, médula ósea y fosfato tricálcico. Estudio experimental en cerdos "regeneración ósea en cirugía experimental en cerdos". Kiru. 7(1): 25-33. [ Links ]
Chizzolini C, Brembilla NC, Montanari E, Truchetet ME. 2011. Fibrosis and immune dysregulation in systemic sclerosis. Autoim Rev. 10(5): 276-281. Doi: 10.1016/j.autrev.2010.09.016. [ Links ]
Crane D, Everts P. 2008. Platelet rich plasma (PRP) matrix grafts. Prac Pain Manag. [Internet]. [Citado 2016 ago 19]; (Feb): 1-10. Disponible en: http://www.elitesportperformance.com/ieadmin/files/Rehab-PRPMatrix.pdf. [ Links ]
Delgado R, Bonatelli A, Alves M. 2009. Study about fusion using ceramic with platelet-rich plasma in the spine of rats. Act Ortop Bras. 17(5): 282-285. Doi: 10.1590/S1413-78522009000500006. [ Links ]
Dohan S, Dohan A, Choukroun J, Diss A, Simonpier A, Girard MO, Dohan D. 2005. De l'usage des concentrés plaquettaires autologues en application topique. EMC - Odont. 1(2): 141-180. Doi: 10.1016/j.emcodo.2005.04.001. [ Links ]
Donatti C, Brandao C, Ranzani JJT, Perches CS, Padovani CR, Pellizzon CH, Sereno MG. 2013. Use of platelet-rich plasma in the treatment of deep corneal ulcers induced in rabbits. Clinical and histomorphometric evaluation. Arq Bras Med Vet Zootec. 65(3): 809-818. Doi: 10.1590/S0102-09352013000300029. [ Links ]
Gallo I, Sáenz A, Arévalo A, Roussel S, Pérez-Moreiras I, Artiñano E, Martínez-Peñuela A, Esquide J, Aspiroz A, Camacho I. 2013. Efecto del plasma autógeno rico en plaquetas sobre el infarto de miocardio en ovejas. Arch Cardiol Mex. 83(3): 154-158. Doi: 10.1016/j.acmx.2013.04.011. [ Links ]
González JC, López C, Carmona JU. 2013. Evaluación de un método manual para producir plasma rico en plaquetas-puro (P-PRP) en conejos: estudio hematológico. Arch Med Vet. 272(3): 267-272. Doi: 10.4067/S0301-732X2013000300006. [ Links ]
Gürgen M. 2008. Treatment of chronic wounds with autologous platelet-rich plasma. EWMA J. 8(2): 5-10. [ Links ]
Li W, Enomoto M, Ukegawa M, Hirai T, Sotome S, Wakabayashi Y, Shinomiya K, Okawa A. 2012. Subcutaneous injections of platelet-rich plasma into skin flaps modulate proangiogenic gene expression and improve survival rates. Plast Reconstr Surg. 129(4): 858-866. Doi: 10.1097/PRS.0b013e3182450ac9. [ Links ]
López C, Álvarez ME, Carmona JU. 2015. Effect of equine leukocyte-reduced platelet concentrates on methicillin-resistant Staphylococcus aureus cultures and measurement of temporal growth factor degradation. J Equine Vet Sci. 35(3): 219-224. Doi: 10.1016/j.jevs.2015.01.001. [ Links ]
López C, Giraldo C, Carmona J. 2012. Evaluación de un método de doble centrifugación en tubo para concentrar plaquetas bovinas: estudio celular. Arch Med Vet. 44(2): 109-115. Doi: 10.4067/S0301-732X2012000200003. [ Links ]
Mishra A, Woodall J, Vieira A. 2009. Treatment of tendon and muscle using platelet-rich plasma. Clin Sports Med. 28(1): 113-125. Doi: 10.10l6/j.csm.2008.08.007. [ Links ]
Moreno L, Marín G, Enriquez F, González J, Moreno L, Cisneros L, De la Sancha LM. 2004. Utilización de plasma rico en plaquetas para regeneración periodontal en un perro. Rev Odont Mex. 8(3): 64-69. [ Links ]
Nagata MJ, Messora MR, Furlaneto FA, Fucini SE, Bosco AF, Garcia VG, Deliberador TM, de Melo LG. 2010. Effectiveness of two methods for preparation of autologous platelet-rich plasma: an experimental study in rabbits. Eur J Dent. 4(4): 395-402. [ Links ]
Pazzini JM, de Nardi AB, Huppes RR, Gering AP, Ferreira M, Silveira C, Luzzi M, Santos R. 2016. Method to obtain platelet-rich plasma from rabbits (Oryctolagus cuniculus). Pesq Vet Bras. 36(1): 39-44. Doi: 10.1590/S0100-736X2016000100007. [ Links ]
Silva S, Ferrigno C, Sterman F, Baccarin D, Yazbek K, Muramoto C, Amaku M. 2007. Platelet-rich plasma combined with hydroxyapatite on bone callus formation in experimental radii fractures in dogs. Cien Rural. 37(4): 1045-1051. Doi: 10.1590/S0103-84782007000400020. [ Links ]
Silva RF, Rezende CM, Paes-Leme FO, Carmona JU. 2011a. Evaluación del método del tubo para concentrar plaquetas felinas: estudio celular. Arch Med Vet. 43(2): 187-190. Doi: 10.4067/S0301-732X2011000200013. [ Links ]
Silva RF, Rezende CM, Paes-Leme FO, Carmona JU. 2011b. Evaluación del método del tubo para concentrar plaquetas caninas: estudio celular. Arch Med Vet. 98: 95-98. Doi: 10.4067/S0301-732X2011000100014. [ Links ]
Silva R, Carmona J, Rezende C. 2012. The use of in-tra-articular platelet rich-plasma as a postsurgical treatment of cranial cruciate ligament rupture in a dog. Arq Bras Med Vet Zootec. 64(4): 847-852. Doi: 10.1590/S0102-09352012000400009. [ Links ]
Sommeling CE, Heyneman A, Hoeksema H, Verbelen J, Stillaert FB, Monstrey S. 2013. The use of platelet-rich plasma in plastic surgery: a systematic review. J Plast Reconstr Aesthet Surg. 66(3): 301-311. Doi: 10.1016/j.bjps.2012.11.009. [ Links ]
Textor J. 2011. Autologous biologic treatment for equine musculoskeletal injuries: Platelet-rich plasma and IL-1 receptor antagonist protein. Vet Clin Norht Am Equine Pract. 27(2): 275-298. Doi: 10.1016/j.cveq.2011.05.001. [ Links ]
Weibrich G, Kleis WK, Buch R, Hitzler WE, Hafner G. 2003. The Harvest Smart PRePTM system versus the Friadent-Schutze platelet-rich plasma kit. Comparison of a semiautomatic method with a more complex method for the preparation of platelet concentrates. Clin Oral Implants Research. 14(2): 233-239. Doi: 10.1034/j.1600-0501.2003.140215.x. [ Links ]
White JG. 2000. EDTA-induced changes in platelet structure and function: clot retraction. Platelets. 11(1): 49-55. [ Links ]
Wu P, Diaz R, Borg-Stein J. 2016. Platelet-Rich Plasma. Phys Med Rehabil Clin N Am. 27: 825-853. Doi: 10.1016/j.pmr.2016.06.002. [ Links ]
Zimmermann R, Arnold D, Strasser E, Ringwald J, Schlegel A, Wiltfang J, Eckstein R. 2003. Sample preparation technique and white cell content influence the detectable levels of growth factors in platelet concentrates. Vox Sang. 85(4): 283-289. Doi: 10.1111/j.0042-9007.2003.00361.x. [ Links ]
Article citation:
Bonilla-Gutiérrez AF, Aragón-Urrego C, Aristizábal-Páez OL. 2017. Protocolo para la obtención de un Concentrado Autólogo de Plaquetas en conejos: estudio piloto. [Protocol for obtaining Autologous Platelets Concentrate in rabbits: a pilot study]. Rev Med Vet Zoot. 64(1): 24-31. Doi: 10.15446/rfmvz. v64n1.65813.