INTRODUCCIÓN
Los tumores en la pared torácica son relativamente infrecuentes en perros y usualmente se derivan de hueso o componentes cartilaginosos de la pared costal (Halfacree et al. 2007). El condroma es un tumor benigno que se origina del cartílago (Maxie 2007); se puede formar en cualquier hueso de origen endocondral, siendo los omoplatos, las costillas, las vértebras y la pelvis los sitios de localización más comúnes (Morris y Dobson 2001). El manejo de los tumores de la pared torácica requiere de adecuado manejo quirúrgico y diagnostico histopatológico para plantear un tratamiento definitivo (Halfacree et al. 2007). Al respecto, la resección quirúrgica temprana y radical es recomendada para cualquier tumor en la pared torácica (Baines et al. 2002), y la resección en bloque de varias costillas es el tratamiento quirúrgico de elección; para ello, se debe emplear una técnica quirúrgica adecuada, que incluya la selección correcta del material empleado para reestablecer la continuidad de la pared torácica; sin embargo, con los tumores ubicados en el tórax caudal se puede reducir la necesidad de una fijación rígida de la misma (Fossum 2013); en estos casos, cuando la pared abdominal también es afectada, deben buscarse estrategias que permitan una reparación completa del defecto.
Existen diversos materiales prostéticos para corregir defectos en la pared abdominal, los cuales pueden ser usados cuando no sea posible hacer la corrección con tejido musculofascial autógeno para hacer un cierre libre de tensión, o cuando es necesario proveer fuerza adicional durante la reconstrucción primaria del tejido (Clarke et al. 1996). Las mallas de polipropileno (MP) son el material más usado actualmente y aunque se han reportado algunas complicaciones (Fos-sum 2013; Clarke et al. 1996), el uso de omento o músculo autólogo bien vascularizado sobre el implante ha demostrado una reducción de las mismas durante el periodo posquirúrgico. (Fossum 2013).
PRESENTACIÓN DEL CASO
A la Clínica para Pequeños Animales de la Universidad Nacional de Colombia, sede Bogotá ingresó una perra mestiza, de 7 años de edad, que presentaba una masa en el costado izquierdo del abdomen, la cual había crecido lentamente durante aproximadamente dos años. Previamente había sido diagnosticada en otro centro médico veterinario como osteosarcoma; sin embargo, no se realizó ningún estudio histopatológico para comprobar este diagnóstico. El propietario no reportó otros problemas médicos.
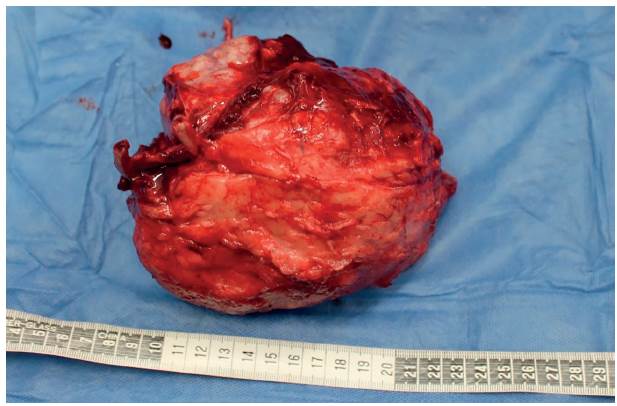
Al examen clínico general la paciente se encontró con constantes fisiológicas dentro de los rangos normales y pesó 15 kg; se evidenció una masa de aproximadamente 15 x 14 x 12 cm adherida a la pared abdominal iniciando de craneal a caudal, aparentemente desde el décimo espacio intercostal, hasta el nivel de la cuarta vértebra lumbar, y de dorsal hacia ventral, desde ventral a las apófisis espinosas de las vértebras lumbares, hasta el aspecto ventral de la pared abdominal izquierda; la masa era dura e indolora a la palpación.
Se plantearon como diagnósticos diferenciales más probables tumores benignos de hueso o cartílago, como osteoma y condroma, aunque no se descartó condrosarcoma y osteosarcoma. Como planes diagnósticos se realizaron estudios radiográficos de abdomen y tórax, y un panel hematológico y bioquímico completo en el cual no se encontró ningún hallazgo anormal. Radiográficamente se evidenció un patrón de radio-opacidad difuso contiguo a las decimosegunda y decimotercera costillas, que parecen entrar dentro de la masa; adicionalmente, se observó que la misma estaba desplazando los órganos abdominales hacia medial, cerca del riñón izquierdo; sin embargo, no fue posible precisar si había compromiso de alguno de los órganos abdominales, así como tampoco clarificar cuál era el límite medial de la masa. Por otra parte, no se encontraron hallazgos compatibles con metástasis pulmonar.
Debido a que los hallazgos radiográficos no fueron concluyentes, se realizó una tomografía computarizada con el fin de delimitar la masa y observar el posible compromiso de los órganos abdominales; en dicha tomografía se observó una estructura de gran tamaño en la pared abdominal izquierda que abarcaba la región abdominal desde el aspecto caudal de la decimosegunda costilla, hasta la altura de la séptima vértebra lumbar, y desde los músculos dorsales epaxiales hasta el borde abdominal ventral; la masa mostraba una forma ovalada con bordes irregulares y densidad de tejido blando (Figura 1). En la porción craneal de la estructura se observó lesión monostótica de la decimotercera costilla izquierda debido a la cual se deformó su recorrido en el tercio medial y distal. No se observó osteólisis; sin embargo, los márgenes corticales mostraron reacción perióstica moderada y desplazamiento periférico de fragmentos óseos y zonas multifocales con densidad ósea que pueden corresponder a focos de mineralización neoplásica. En los cortes transversales se apreció contacto de la masa con el peritoneo y desplazamiento de las vísceras abdominales hacia la derecha del plano medio (Figura 1); sin embargo, la estructura no involucró la cavidad abdominal ni la pared peritoneal.
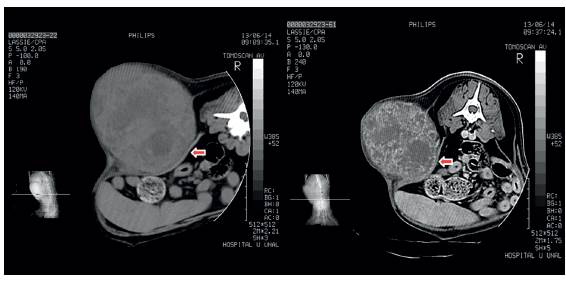
FIGURA 1 Tomografía computarizada realizada a la paciente; se puede observar la masa empujando las vísceras abdominales, sostenida a su vez por el peritoneo (flechas). Izquierda: sin contraste; derecha: con contraste.
Con base en estos hallazgos, la lenta evolución en el crecimiento de la neoplasia, la aparente ausencia de metástasis y la ausencia de compromiso sistémico, se presumió que la masa tenía naturaleza benigna, por lo cual se decidió realizar resección en bloque de la misma, retirando las costillas y la pared abdominal afectada, para posteriormente enviar la estructura a análisis histopatológico.
Procedimiento quirúrgico
Debido a que la paciente no presentaba ninguna enfermedad sistémica y los parámetros hematológicos y bioquímicos se encontraron dentro de los rangos normales, se utilizó un protocolo para un paciente ASA II: premedicación con una combinación de ketamina (2,5 mg/kg), atropina (0,022 mg/kg) y fentanilo (5 μg/kg) vía intravenosa, todas combinadas en la misma jeringa. Se indujo con propofol (3 mg/ kg, vía i.v.) y la anestesia se mantuvo con isoflurano (dosis/efecto). Adicionalmente, se administró una infusión continua de fentanilo (2 μg/kg/h), lidocaína (1 mg/ kg/h) y ketamina (0,125 mg/kg/h) (FLK) por vía i.v. como analgesia intraoperatoria; se administró además cefalotina (20 mg/ kg, vía i.v.) y meloxicam (0,1 mg/kg, vía s.c.). Se ubicó al paciente en decúbito lateral derecho y se realizó antisepsia del área depilada, que comprendía todo el costado izquierdo (Figura 2).
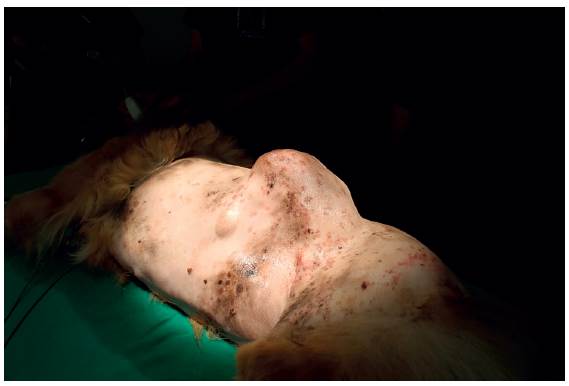
FIGURA 2 Aspecto preoperatorio de la masa. En la figura se puede apreciar la localización y extensión de la misma.
Se incidió la piel por el centro de la masa separando el tejido subcutáneo; una vez descubierta una parte de la masa, se evidenció el musculo oblicuo abdominal externo y se separó de esta mediante disección roma. Con la ayuda de separadores se expuso la masa y se encontró que en efecto esta atrapaba las dos últimas costillas por lo que fue necesario hacer resección de las mismas (Figura 3); para esto, se elevó el periostio de la decimosegunda y decimotercera costillas y se cortaron las mismas con una pinza de Liston (Figura 4).
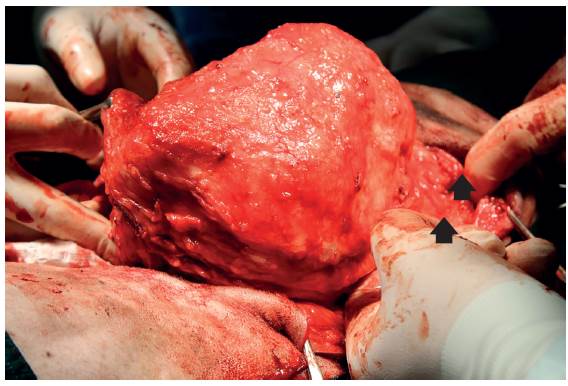
FIGURA 3 Aspecto intraoperatorio de la masa ya separada de la pared abdominal. Evaluación de las costillas infiltradas (flechas negras), que fueron la decimosegunda y decimotercera de la pared torácica izquierda.
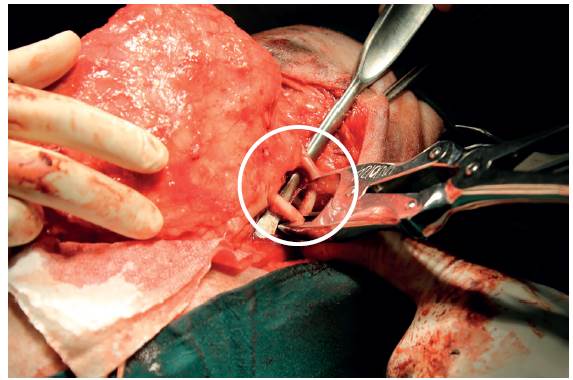
FIGURA 4 Corte de la decimosegunda y decimotercera costillas cerca de la columna vertebral mediante una pinza para cortar hueso de Liston (circulo).
Al realizar la disección, se encontró la unión costo-diafragmática en la decimo-segunda costilla, que debió ser disecada ya que parte del diafragma se adhería a la masa. El ingreso al tórax se hizo de manera segura, debido a que la paciente contó con ventilación mecánica (12 rpm, I:E 1:2, 15 cmH20). De esta manera la masa se separó en su porción craneal. Seguidamente, al llegar al centro y parte caudal de la misma, se encontró que estaba firmemente adherida a los músculos de la pared abdominal, por lo cual tuvieron que ser retirados para poder extraer la masa en su totalidad (Figura 5), en seguida, se procedió a suturar el diafragma a la cara caudomedial de la decimoprimera costilla, anclando la sutura al remanente de la musculatura intercostal, inicialmente con un patrón simple interrumpido con polidioxanona 2-0 (PDS® Ethicon), el cual fue reforzado con un patrón simple continuo con el mismo material de sutura (Figura 6).
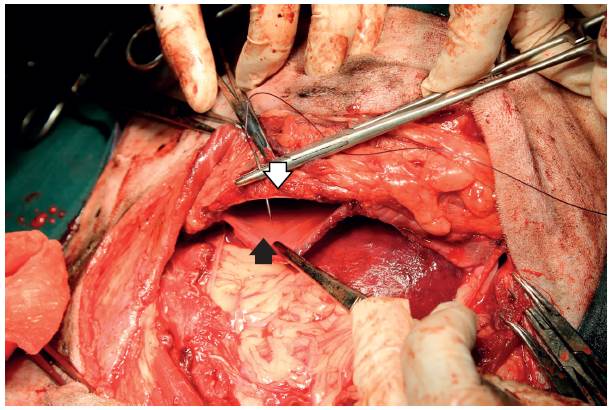
FIGURA 6 Sutura del diafragma (flecha negra) al remanente de los músculos intercostales en el aspecto caudo-medial de la decimoprimera costilla (flecha blanca).
Posteriormente, se retiró el aire de la cavidad torácica usando presión negativa y se comprobó que la cavidad quedara sellada. En este punto se evidenció que el defecto de la pared tenía aproximadamente 20 cm de largo, se verificó que no hubiera ninguna anormalidad con los órganos abdominales y se desplazó una porción de omento mayor para cubrirlos todos, los cuales quedaron expuestos posterior a la síntesis de la pared abdominal; el omento se fijó a la parte craneal en la pared costal con puntos simples interrumpidos (polidioxanona 2-0 PDS® Ethicon) (Figura 7).
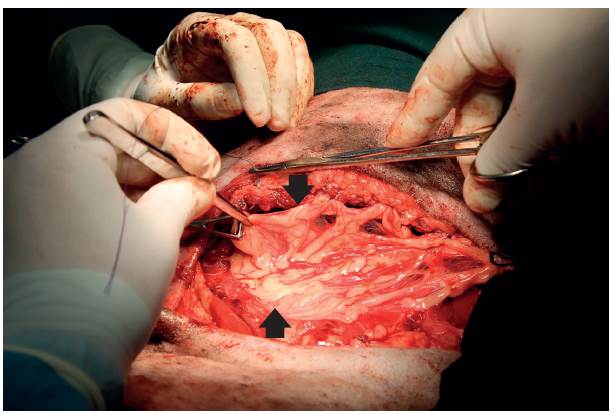
FIGURA 7 Omento mayor cubriendo el defecto de la pared (fechas) al ser suturado a los bordes del defecto mediante puntos simples interrumpidos (polidioxanona 2-0 PDS® Ethicon).
A continuación, se ubicó una malla de polipropileno (Tagumesh®) sobre todo el defecto, la cual se ancló a las zonas donde aún quedaba parte del músculo oblicuo abdominal externo. El anclaje se realizó usando puntos simples interrumpidos (polidioxanona 2-0 PDS® Ethicon) (Figura 8).
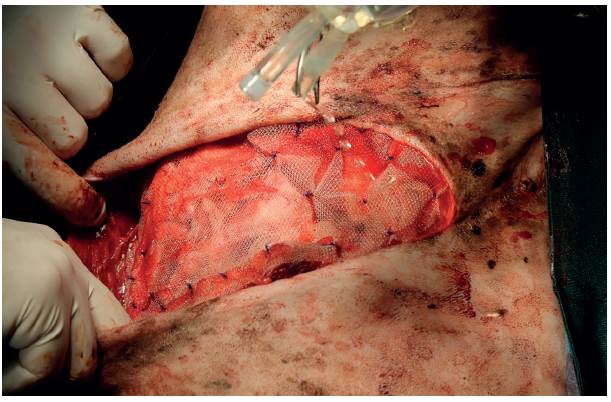
FIGURA 8 Malla de polipropileno cubriendo el defecto de la pared y el omento previamente suturado. La malla fue suturada a los bordes del músculo oblicuo abdominal externo usando puntos simples interrumpidos (polidioxanona 2-0 PDS® Ethicon).
Finalmente, se procedió a hacer el cierre del tejido subcutáneo y piel en tres planos, ubicando tejido subcutáneo sobre la malla. Una vez cerrada la pared abdominal se ubicó un tubo de tórax, con el fin de prevenir un neumotórax posoperatorio.
Manejo y evolución posquirúrgicos
La paciente se recuperó satisfactoriamente de la anestesia; posteriormente se mantuvo en hospitalización con cefalotina (20 mg/kg i.v., q.i.d.), meloxicam (0,1 mg/kg s.c., s.i.d.) y la infusión de FLK durante las primeras 24 horas después de la cirugía; durante este intervalo de tiempo también se realizó succión del tubo de tórax cada tres horas, obteniéndose 500 ml de aire; durante las siguientes 48 horas este valor disminuyó rápidamente, hasta descender a un total de 50 ml el tercer día, por lo cual se decidió retirar el tubo de tórax ese día.
El segundo día después de la cirugía presentó hallazgos compatibles con enfisema en miembro posterior izquierdo, que se resolvió rápidamente sin ningún tratamiento específico. Alrededor del quinto día, se presentó acumulo de líquido en la zona ventral, compatible con un seroma, que se resolvió con el uso de vendajes de compresión. La paciente se dio de alta el octavo día después de la cirugía. En los controles realizados los días 12, 15 y 20 posteriores a la cirugía se evidenció adecuado cierre de la herida quirúrgica; el día 12 se observó nuevamente la formación de un seroma (Figura 9), el cual se manejó de manera conservadora (paños de sulfato de magnesio y agua tibia t.i.d).
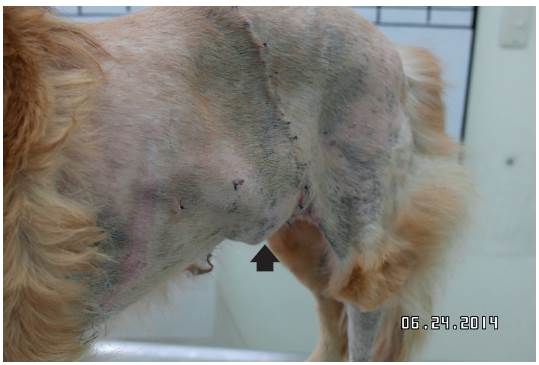
FIGURA 9 Evolución de la paciente 12 días después del procedimiento quirúrgico. La herida ha cerrado favorablemente; se observa un leve edema ventral (fecha).
El día 25 del posquirúrgico se evidenció resolución total de los seromas, con i ntegridad completa de la pared abdominal, sin signos de dolor, incomodidad o infección. Se realizaron controles periódicos cada dos semanas y en el control realizado 45 días después del procedimiento quirúrgico se encontró una recuperación completa del paciente (Figura 10). La pared abdominal se palpaba firme, sin signos clínicos que sugieran la presencia de adherencias o de daño en las vísceras abdominales. Por otra parte, la evaluación histopatológica de la masa arrojó como resultado un eccondroma sin células malignas.
Una vez dada de alta la paciente regresó periódicamente para el seguimiento de la evolución del caso; adicionalmente, estuvo hospitalizada nuevamente al ser necesaria una amputación de cabeza y cuello femoral, debido a una displasia de cadera severa; durante este procedimiento no se encontraron complicaciones anestésicas, quirúrgicas o médicas asociadas a la cirugía previa. Finalmente, la paciente falleció debido a complicaciones relacionadas con una infección hemoparasitaria 13 meses después de realizada la cirugía aquí descrita; no fue posible llevar a cabo la necropsia de la paciente por decisión del propietario.
DISCUSIÓN
Como se mencionaba previamente, los tumores de la pared torácica son infrecuentes en pequeños animales y usualmente se derivan de hueso o componentes cartilaginosos de la pared costal (Halfacree et al. 2007); se presentan con mayor incidencia osteosarco-mas, condrosarcomas y hemangiosarcormas (Baines et al. 2002; Feeney et al. 1982). En un estudio retrospectivo de 46 casos de tumores primarios de origen mesenquimal en la pared torácica en perros, se encontró que 43 de ellos tenían un componente importante de malignidad, por lo cual la escisión quirúrgica temprana y radical es recomendada para cualquier tumor en la pared torácica (Baines et al. 2002).
Un apropiado manejo de los tumores de la pared torácica incluye además el diagnóstico histopatológico previo para poder estadificar al paciente y plantear un tratamiento definitivo (Halfacree et al. 2007); sin embargo, en el caso de la paciente del presente reporte el tiempo de evolución del tumor y la ausencia de metástasis y otros signos clínicos sistémicos permitieron inferir que se trataba de un tumor benigno; hipótesis soportada con evidencia científica en la que se han reportado signos clínicos asociados a la presencia del tumor como disnea, cojera, letargia, tos (Halfacree et al. 2007) y efusión pleural (Feeney et al. 1982), los cuales no presentaba esta paciente; no obstante, la presencia de estos signos también dependerán del sitio en donde esté ubicado el tumor (Maxie 2007; Matthiesen et al. 1992). Adicionalmente, el estudio realizado por Baines et al. (2002) reveló supervivencias medias de entre 17 y 26 semanas para osteosarcoma y condrosarcoma, respectivamente, y tasas de metástasis elevadas con los sarcomas empeorando el pronóstico del paciente (Halfacree et al. 2007; Morris y Dobson 2001; Baines et al. 2002).
La tomografía computarizada fue una herramienta diagnóstica muy importante en este caso, pues permitió establecer de manera precisa la localización y el posible origen del tumor, descartar la afectación de órganos vitales, además de ayudar en la planeación de manera detallada del procedimiento quirúrgico. De otra parte, el eccondroma diagnosticado por histopatología es un tipo de condroma primario de hueso, el cual se divide en encondromas, que se originan desde la cavidad medular del hueso, y eccondromas, que surgen desde el cartílago en cualquier parte del esqueleto; ambas formas son raras en animales (Maxie 2007).
En medicina veterinaria existen varias técnicas reconstructivas que tienen como finalidad realizar un cierre completo de un defecto; estas incluyen aposición directa, colgajos pediculados de omento, colgajos de piel local, colgajos libres musculocutáneos (Halfacree et al. 2007), injertos de tejido de submucosa de intestino delgado porcino, injertos de fascia lata, mallas protésicas de diferentes materiales y avance del diafragma (Henderson et al. 2015). La elección de la técnica depende del tipo y la localización del defecto y se debe lograr integridad funcional con una reparación sin tensión (Fossum 2013; Henderson et al. 2015).
En el presente caso se creó un defecto posterior a la resección de la masa, que no solo afectó la pared torácica, pues se requirió la resección de dos costillas, sino que hubo además compromiso de la inserción del diafragma, y dejó un defecto de grosor total en la pared abdominal; por esta razón, se hizo necesario elegir una técnica que permitiera realizar el cierre del defecto en una sola sesión quirúrgica, reducir el espacio muerto, proporcionar estabilidad y cubrir y proteger las vísceras vitales expuestas (Henderson et al. 2015). Así pues, teniendo en cuenta que el defecto del tórax era caudal y que comprometía las dos últimas costillas, se decidió corregir mediante avance del diafragma; técnica que fuera descrita por primera vez por Aronsohn (1984) y que tiene como objetivo recuperar la integridad de la cavidad torácica, suturando el musculo diafragmático a los músculos intercostales y epaxiales de la última costilla íntegra. Con este procedimiento se eliminó la necesidad de materiales protésicos en el tórax y probó además ser adecuado cuando los defectos están caudales a la novena costilla (Aronsohn 1984); sin embargo, al finalizar la cirugía y como medida de precaución se dejó un tubo de tórax.
La evolución posquirúrgica del paciente no evidenció complicaciones asociadas a la técnica usada para reconstruir el defecto a nivel torácico, lo que reafirma que el uso de esta técnica es viable y además, al disminuir el uso de prótesis en el tórax se favorece la recuperación posquirúrgica del paciente. En este sentido, una de las técnicas más usadas en la actualidad para la reconstrucción de la pared torácica es el colgajo miocutáneo del musculo Latissimus dorsi, la cual demostró buenos resultados cuando se usó en cinco perros con condrosarcoma primario de costillas (Halfacree et al. 2007); sin embargo, el tumor más grande que se extrajo en ese caso fue de 10 cm de diámetro, mucho más pequeño que el del paciente descrito en el presente reporte; adicionalmente, la mayoría de los tumores en este estudio afectaron de la cuarta a la novena costillas y la unión costocondral (Halfacree et al. 2007; Baines et al. 2002). Así, la ubicación del tumor en el presente caso imposibilitaba la realización de este tipo de procedimiento.
Por otra parte, para la reconstrucción de la pared abdominal se decidió usar una MP (malla de polipropileno) soportada con omento del animal, es decir, se usa la mezcla de una técnica autógena con el uso de un material protésico. La MP es frecuentemente considerada como el material de "oro" para la reconstrucción de paredes corporales (Arnold et al. 2009) y su uso se ha reportado desde la década de los cincuenta (Grevious et al. 2006); tiene como cualidades que es comparativamente barata, de fácil disponibilidad, se puede cortar fácilmente para corregir diferentes tamaños de defectos, es relativamente inerte y mantiene su integridad estructural indefinidamente; además, es un material que no deja detritos, es moldeable, se deja fijar muy bien, es resistente al calor (temperaturas por encima de 168° C) y adicionalmente el tamaño de los poros le provee gran resistencia a las infecciones (Henderson et al. 2015; Arnold et al. 2009; Liptak et al . 2008). Sin embargo, se han planteado desventajas en el uso de MP, como la generación de un rango amplio de complicaciones al compararla con materiales absorbibles sintéticos o biológicos (Feeney et al. 1982). En humanos se han reportado desde infecciones de la herida, erosión de vísceras abdominales, falla en la reparación, rechazo o perdida de la malla, hasta complicaciones catastróficas como fistulas entéricas y obstrucción intestinal; además, en algunas personas se ha reportado dolor asociado al implante que se relaciona con la formación de cicatriz sobre la malla (Grevious et al. 2006). Esta complicación no ha sido específicamente evaluada en pacientes veterinarios; no obstante, se descartó en el presente caso debido a que durante el monitoreo posoperatorio el paciente manifestó comodidad, sin presentar alteraciones de la frecuencia cardiaca, estatus mental o postura. Adicionalmente, bajo la experiencia de los autores con esta malla en al menos 30 pacientes para otro tipo de reparaciones (por ejemplo, hernias perineales y abdominales) no se han observado manifestaciones de dolor.
Evaluaciones histológicas realizadas en perros para comparar el uso de biomateriales absorbibles, en conjunto con el uso de MP para la reconstrucción de pared abdominal, demostraron que los tejidos vecinos crecen hacia adentro de la malla de manera desorganizada, lo que puede generar leve reacción de cuerpo extraño (Arnold et al. 2009); sin embargo, se presenta reparación de todo el grosor del defecto y fuerte adhesión del omento a la malla (Clarke et al. 1996). En un estudio retrospectivo en el que se usó la malla para la reconstrucción de paredes corporales en 21 pacientes veterinarios con tumores, no hubo complicaciones relacionadas con fallos en la malla o infecciones (Bowman et al. 1998). Por otra parte, en un estudio experimental en donde se compararon las características mecánicas de cuatro diferentes tipos de materiales usados para reemplazo en tejidos blandos, se encontró que la MP produce los resultados más consistentes debido a su naturaleza sintética y la calidad y control de su producción, comparativamente con biomateriales; se encontró también que la orientación paralela al eje de tensión de las cuerdas longitudinales de la malla debería tenerse en cuenta para la reparación de defectos en el tórax, debido a los movimientos que este hace en la respiración; sin embargo, clínicamente esto parece ser menos importante en la reparación de la pared abdominal (Arnold et al. 2009).
Por su parte, Liptak et al. (2008) demostraron una baja tasa de complicaciones al usar MP en un estudio en el que compararon las complicaciones y el resultado de la reconstrucción de la pared torácica con tres diferentes técnicas protésicas usando colgajos musculares autógenos, MP y una técnica compuesta, en la que se usó la malla más omento autólogo o el colgajo muscular, en 44 perros después de la resección de tumores en las costillas. Los autores concluyeron que grandes defectos de la pared torácica pueden ser reconstruidos con cualquiera de las técnicas, pero al usar la malla esta debe ser cubierta con un tejido bien vascularizado ya sea musculo u omento (Liptak et al. 2008). En este sentido, los pedículos de omento han sido reportados en otros estudios con animales donde ninguno de ellos presentó complicaciones mayores (Matthiensen et al. 1992; De Castro Marques et al. 2009). Esto último ha sido también reportado en medicina humana, pues se ha demostrado que asociar omento con el uso de MP en la corrección de hernias o grandes defectos en la pared abdominal es rentable y seguro, incluso en pacientes que tenían estrangulación o encarcelación de intestino y a los que se les realizó enteroanastomosis (Sorour 2014; Bright et al. 1982).
Con relación a las complicaciones reportadas en el estudio de Liptak et al. (2008), estas se presentaron de manera temprana en solo ocho de los 44 animales; las complicaciones incluyeron seromas (la más común), seguido de edema periférico, efusión pleural y edema pulmonar, y solo un animal presentó una complicación tardía, asociada con infección de la malla 767 días después de la cirugía. Similar a lo reportado en este estudio, la única complicación que presentó la paciente descrita en el presente reporte fue un seroma ventral, el cual fue manejado de forma conservadora y que cedió pocos días después de la cirugía. En total, en el citado estudio de Liptak et al. (2008), las complicaciones se presentaron en el 10,3% de los animales en que se usaron colgajos musculares, en 25% en los que se usó la técnica mixta y en 66,7% en los que se usó la malla sola. Esta evidencia lleva a concluir que no debería usarse MP sin un soporte vascular adecuado, lo cual respalda la decisión del uso de la malla con omento como material protésico en la paciente.
Es importante tener en cuenta que no existen reportes previos en los que se realizara la corrección de un defecto que incluyera parte del tórax y de la pared abdominal; la mayoría de los reportes de reconstrucción de paredes corporales se han hecho únicamente en la pared torácica y su importancia, además del material por sí mismo, radica en que en personas con reconstrucción de grandes defectos en el tórax, se han evidenciado complicaciones asociadas al movimiento respiratorio (Grevious et al. 2006; Liptak et al. 2008); esto no se ha observado en perros o gatos (Henderson et al. 2015; Liptak et al. 2008). No obstante, aún se necesitan más estudios para evaluar si existen o no diferencias biomecánicas en la reconstrucción de la cavidad abdominal. En este caso no se presentaron hallazgos clínicos compatibles con afectación del movimiento abdominal, respiración o locomoción del animal.
La recuperación de la paciente, y el seguimiento hecho a la misma durante un año, demostró que el abordaje clínico y quirúrgico, así como la elección de la técnica reconstructiva, fueron exitosos. La pared abdominal se palpaba firme y no se evidenciaron signos clínicos que sugirieran la presencia de adherencias o de daño en las vísceras abdominales. Así mismo, el pronóstico de vida asociado al diagnóstico histopatológico de la masa encontrada en este caso es bueno, aunque existe evidencia de reincidencia con este tipo de tumor: en un reporte de caso, un perro con diagnóstico de condroma originado en las costillas tuvo un periodo de sobrevida de apenas un año; sin embargo, en ese paciente únicamente se llevó a cabo tratamiento conservador (Hamilton et al. 1973); un estudio retrospectivo posterior describió la escisión en bloque de tres tumores con diagnostico histológico de condroma, osteocondroma y condrosarcoma, y se encontró que el condroma recurrió después de 71 meses, se retiró, y reincidió de nuevo 22 meses después (Bowman et al. 1998). En estos dos reportes, sin embargo, la reincidencia puede obedecer a una escisión incompleta o conservadora. Esto contrasta con el estudio llevado a cabo por Baines et al. (2012), en el que dos perros con este tipo de tumor, a los que se les hizo una escisión más agresiva, sobrevivieron por largo tiempo, sin recurrencia del mismo El fallecimiento de la paciente, debido a complicaciones médicas no relacionadas con el procedimiento quirúrgico aquí descrito, impidió hacer un seguimiento a largo plazo. Sin embargo, durante los 13 meses siguientes a la cirugía el animal no presentó ninguna complicación asociada al procedimiento, ni al tipo de neoplasia diagnosticado; por el contrario, se mejoró de manera importante su calidad de vida.