INTRODUCCIÓN
Recientemente se han demostrado coincidencias en el desarrollo temprano de las lesiones carcinomatosas de la glándula mamaria (GM) entre mujeres y hembras caninas; también denominadas lesiones intraepiteliales (LIEs) (Antuofermo et al. 2007), neoplasias intraepiteliales ductales y lobulares (Galimberti et al. 2013) o enfermedades de seno limítrofes "borderline breast disease" (Masood 2010), entre otras. Al respecto, Lopez-García et al. (2010) propusieron que durante la formación de algunos carcinomas (Ca) mamarios ocurren algunas de estas anormalidades histológicas antes de la manifestación clínica de la lesión, por lo cual, las LIEs son factores de riesgo morfológico que se relacionan con el desarrollo de cáncer. Las hay de riesgo bajo e intermedio [adenosis, hiperplasia ductal usual (HDU), hyperplasia ductal atípica (HDA), lesión de células columnares (LCC) e hiperplasia compleja (HC)] y de alto riesgo [carcinoma in situ (CalS) y carcinoma complejo (CaC)] (Caicedo e Iregui 2015).
Además de las similitudes morfológicas de las LIEs en mujeres y hembras caninas, en el plano molecular se han descrito otras semejanzas, entre ellas, que pueden ser positivas o negativas a estrógenos y que la expresión de progesterona en ambas especies es significativamente baja en el carcinoma in situ (CalS) de bajo grado (Mouser et al. 2010); adicionalmente, para los CalS se han descrito, según la expresión de estrógenos (e), progesterona (p), ERB-B2 y citoqueratinas (CK), los mismos subtipos moleculares que hay en mujeres: luminal A (e o p + y ERB-B2 +), luminal B (e o p + y ERB-B2 -), ERB-B2 (e o p-y ERB-B2+), basal (e o p-y ERB-B2 - pero CK 4 o CK5+) (Sassi et al. 2010).
Actualmente, las LIEs mamarias se diagnostican con frecuencia como resultado del éxito de programas de educación y concientización en mujeres. No obstante, establecer un modelo animal de estas lesiones se justifica ya que es un requisito previo para desarrollar ensayos clínicos en humanos y posteriormente probar tratamientos o programas preventivos (Antuofermo et al. 2007; Sierra 2009).
Además de su utilidad en el diagnóstico temprano de neoplasias mamarias, algunas de estas LIEs, como el CalS, pueden ser empleadas en el análisis de los primeros cambios genotípicos y fenotípicos que indiquen posibles rutas patogénicas a través de las cuales las células manifiestan sus propiedades invasivas tempranas. En este sentido, en las neoplasias mamarias humanas se describen cambios en distintas glicoproteínas, por ejemplo, hay expresión de mucinas aberrantes (MUC1 y MUC4) en la membrana celular de células tumorales (Cazet et al. 2010); también, los niveles de ARNm para muchos de los genes implicados en la glicosilación difieren significativamente entre los tejidos de mama normal y maligno, lo que indica que la síntesis, la degradación y la adhesión mediada por glicanos puede alterarse drásticamente en los carinomas de mama (Cazet et al. 2010; Mukhopadhyay et al. 2011; Potapenko et al. 2010).
Por su parte, en perras también se han demostrado cambios fenotípicos de antígenos carbohidrato que normalmente no se encuentran en el epitelio de los acinos y ductos, pero que se expresan en tumores mamarios clínicamente manifiestos; entre ellos, los antígenos sialyl lea, T/Tn (Nowak et al. 2009) y galectina-3 (Choi et al. 2004). Sin embargo, no se conocen estudios que reporten la expresión de antí-genos carbohidrato en lesiones tempranas mamarias de perras, lo cual es importante pues se conoce que los cambios en los patrones de glicosilación celular están implicados en la progresión del cáncer (Hakomori 2002).
Por otra parte, aunque el aumento de la expresión de galectina-3 en algunos tipos de tumores malignos (tiroides, paratiroides, Ca renal, entre otros) se ha correlacionado con la transformación y eventos propios de la metástasis; una disminución en la expresión de la galectina-3 en distintos tumores, entre los que se incluye el cáncer de seno, también se ha asociado con progresión tumoral y metástasis (Castronovo et al. 1996; Cay 2012). Estos resultados aparentemente contradictorios demuestran que el papel de la galectina-3 en la carcinogénesis aún es en parte incomprendido. En efecto, se sabe que la GM de perras no expresa galectina-3, sin embargo, en tumores benignos se sobreexpresa y en tumores malignos disminuye su expresión (Choi et al. 2004); no obstante, aún no se conoce su papel en los estadios de iniciación del tumor. En este contexto, el objetivo de este trabajo fue caracterizar la expresión de galectina-3 en LIEs de GM de perras sin evidencia de tumor mamario.
MATERIALES Y MÉTODOS
Descripción de las LIEs incluidas en el estudio para hacer la inmunomarcación de galectina-3.
Se realizó un estudio descriptivo del fenotipo del estroma en lesiones intraductales e intraacinares no invasivas en GM de perras, denominadas como lesiones intraepiteliales (LIEs) en la literatura internacional (Antuofermo et al. 2007; Mouser et al. 2010). El estudio se realizó en muestras de GM con LIEs de seis hembras reproductivamente enteras (cinco perras de raza mestiza y una de raza pastor alemán), con de más de un celo y sin evidencia de tumor mamario. Dos de ellas se obtuvieron de la casuística de necropsia del Laboratorio de Patología Veterinaria (LPV) de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia (FMVZ-UN) y las restantes cuatro fueron hembras sometidas a eutanasia en el Centro de Zoonosis de Bogotá, todas sin evidencia de tumores mamarios. Estos procedimientos fueron practicados por médicos veterinarios calificados entre el 14 de febrero y el 14 de diciembre de 2012, después de la aprobación del Comité de Bioética de la FMVZ-UN en 2011 y del concepto a favor del Tribunal de Ética Profesional de COMVEZCOL en 2012.
De estos seis animales se tomó tejido mamario completo de todas las GM visibles; posteriormente, todas las muestras fueron procesadas siguiendo los protocolos de rutina de histotecnia de inclusión en parafina, fijación en formalina al 3,7%, corte (3-4 µm), desparafinado, hidratación y tinción con hematoxilina y eosina, PAS y tricrómica de Masson. Para confirmar las lesiones complejas se utilizaron anticuerpos contra miosina pesada.
Para el diagnóstico de las LIEs espontáneas se siguieron los criterios propuestos por Antuofermo et al. (2007), los cuales se establecieron a partir de la interconsulta de casos de LIEs de GM en perras con patólogos de humanos; también, se consultaron revisiones de patología mamaria de perras (Goldschmidt et al. 2011) y literatura reciente sobre patología de seno (Dabbs 2012; O'Malley et al 2011; Rosen 2009). Por su parte, para las lesiones columnares se utilizó la clasificación establecida para perras por Ferreira et al. (2010). A su vez, el grado histológico para los Ca se estableció tomando en cuenta el pleomorfismo nuclear o presencia de mitosis con la siguiente interpretación: grado bajo o 1, grado intermedio o 2 y grado alto o 3 (Antuofermo et al. 2007; Lester et al. 2009; Mouser et al. 2010; Rosen 2009).
Se diagnosticaron 50 LIEs y 7 Ca invasivos (Cal) en 19 GM afectadas de las seis perras incluidas en el estudio como se resume en la Tabla 1, que también muestra el número y el tipo lesiones por animal y por GM (Caicedo e Iregui 2014).
TABLA 1 Distribución detallada según el animal, tipo de lesión intraepitelial y glándula afectada
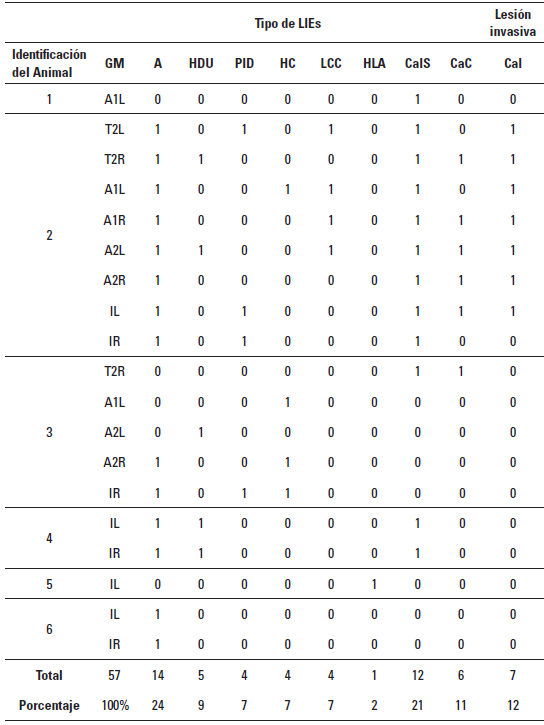
A (adenosis), HDU (hyperplasia ductal usual), PID (papiloma intraductal), HC (hyperplasia compleja), LCC (lesiones de células columnares), HLA (hiperplasia lobular atípica), CaIS (carcinomas in situ), CaC (carcinoma complejo), CaI (carcinoma invasivo), GM (glándula mamaria): T2L (Torácica 2 lado izquierdo); T2R (torácica 2 lado derecho); A1L (abdominal 1 lado izquierdo); A1R (abdominal 1 lado derecho); A2L (abdominal 2 lado izquierdo); A2R (abdominal 2 lado derecho); IL (inguinal izquierda); IR (inguinal derecha).
Las adenosis constituyeron el 24% de las LIEs (14/57), mientras que los CalS el 21% (12/57), los CaC el 11% (6/57) y los Cal 12% (7/57), que combinados constituyeron el 45% de la casuística.
Por su parte, en cuanto a los carcinomas in situ (CalS), en 12 GM de cuatro perras se diagnosticaron CalS de dos tipos, Ca ductal in situ (CDIS) y Ca lobular in situ (CLIS). Adicionalmente, dentro de cada una de estas GM se hizo un conteo para describir cada uno de los diferentes patrones de CalS; en total se diagnosticaron 42 lesiones de este tipo. Estas alteraciones variaron desde grado histológico nuclear bajo hasta alto. En la Tabla 2 se resumen los subtipos según arreglo arquitectónico y grado histológico.
TABLA 2 Frecuencia de presentación de los subtipos arquitectónicos de carcinoma ductal in situ (CDIS) y de carcinoma lobular in situ (CLIS) en glándula mamaria de perras y su grado histológico.
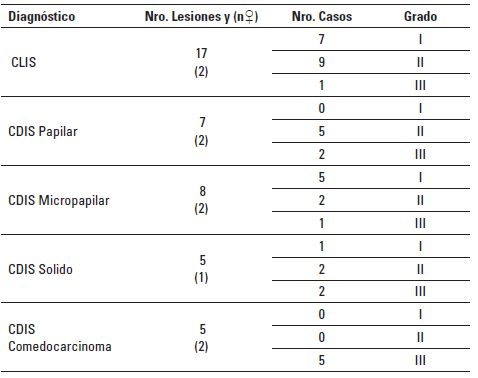
Grados bajo (I), intermedio, (II) y alto (III). Nro. de lesiones: número total de lesiones. n ♀:: número de hembras con esta lesión.
Protocolo para la prueba de detección inmunohistoquímica (IHQ) de galectina-3 (LPV, FMVZ-UN 2013)
Esta prueba provee una detección cualitativa de la expresión de la galectina-3 en tejidos fijados en formalina y embebidos en parafina, utiliza un anticuerpo primario monoclonal liofilizado producido en ratón (NCL-GAL3; Laboratorio Novocastra, Newcastle, UK) dirigido contra la proteína galectina-3. La galectina-3 es una lectina que se une a la enzima beta-galactosidasa que cataliza la hidrólisis de galactósidos a monosacáridos y se localiza en el citoplasma y en el núcleo de varios tipos de células (Cay 2012). Para el revelado se utilizó un juego de reactivos comercial de marca DAKO LSAB®2 Link (USA).
Procesamiento de los tejidos para inmunohistoquímica (IHQ): se cortaron secciones de 3 um de espesor, se desparafinizaron con xileno y se rehidrataron mediante una serie de soluciones graduadas de etanol/agua. Para mejorar la inmuno-rreactividad del tejido se sumergieron las láminas en un frasco de plástico con un búfer de desenmascaramiento Tris-EDTA y se calentaron en un horno microondas durante 25 minutos; a continuación, las secciones se lavaron con agua durante 10 minutos y se bloquearon durante una hora con 200ul de leche descremada al 5% en TBST a temperatura ambiente. Para visualizar la expresión de la galectina-3, sobre cada tejido de GM desparafinado se aplicaron 200µl de Ig anti-galectina-3 a una dilución de 1:100; posteriormente, se incubó durante una hora en cámara húmeda a 25°C y para el revelado de la reacción se utilizó un sistema de detección IgG anti-ratón producido en Cabra (Dako, Dinamarca). Se utilizó como cromógeno diaminobencidina (Dako-Cytomation) lista para usar y como tinción de contraste, hematoxilina de Meyer.
Interpretación: las células marcadas con el anticuerpo contra galectina-3 muestran un patrón de tinción en el citoplasma o en el núcleo celular de color pardo a rojizo. Como testigo positivo, se utilizó tejido prostático (Figura 1) y como testigo negativo, tiroides, ambos de origen humano (Figura 2). Adicionalmente, en las GM se evaluaron los macrófagos como un testigo adicional, ya que normalmente presentan marcación positiva para galectina-3.
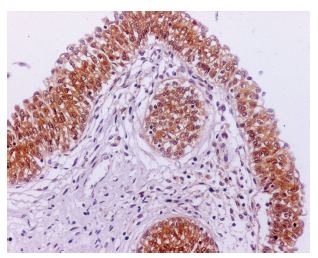
FIGURA 1 Próstata de humano, testigo positivo de tinción IHQ para la galectina- 3. La marcación es de tono café en el citoplasma de las células epiteliales y de algunos macrófagos en el estroma subepitelial. IHQ 200x.
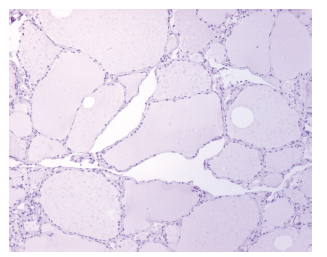
FIGURA 2 Tiroides de humano, testigo negativo de tinción IHQ para la galectina- 3. No hay marcación en ninguna célula de los folículos. IHQ 100x.
Lectura de inmunohistoquímica (IHQ): se llevó a cabo un análisis semicuantitativo de la expresión de galectina-3, según lo descrito por Choi et al. (2004), pero modificado, debido a que en el presente estudio se tuvo en cuenta la intensidad de la reacción del color en las células del tejido mamario, comparado con el testigo positivo de próstata y los macrófagos en el interior de la GM (Tabla 3).
TABLA 3 Análisis semicuantitativo en la lectura de la IHQ para galectina-3
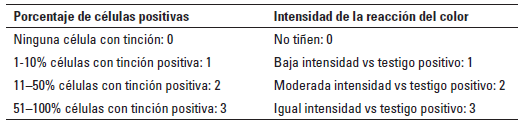
*De acuerdo con Choi et al. (2004). Los conteos se realizaron en el aumento de 400x.
RESULTADOS
Caracterización de la expresión de galectina-3 en LIEs de GM de perras sin evidencia de tumor por IHQ.
Los resultados de la expresión de galectina-3 para cada tipo de lesión diagnosticada en este trabajo se resumen en las Tablas 4 y 5.
TABLA 4 Inmunomarcación para galectina-3 según tipo de LIEs en cuanto al porcentaje de células positivas.
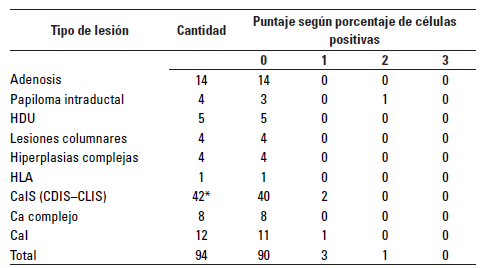
*Se diagnosticaron CaIS en 12 GM; en adición, se realizó un conteo según subtipo y arreglo de cada CaIS con el cual se obtuvieron en total 42 CaIS.
TABLA 5 Inmunorreactividad a la marcación para galectina-3 según tipo de LIEs en cuanto a la intensidad de la reacción del color.
| Tipo de lesión | Cantidad | Puntaje según la intensidad de la reacción del color | |||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | ||
| Adenosis | 14 | 14 | 0 | 0 | 0 |
| Papiloma intraductal | 4 | 3 | 0 | 1 | 0 |
| HDU | 5 | 5 | 0 | 0 | 0 |
| Lesiones columnares | 4 | 4 | 0 | 0 | 0 |
| Hiperplasias complejas | 4 | 4 | 0 | 0 | 0 |
| HLA | 1 | 1 | 0 | 0 | 0 |
| CaIS (CDIS-CLIS) | 42* | 40 | 1 | 1 | 0 |
| Ca complejo | 8 | 8 | 0 | 0 | 0 |
| CaII | 12 | 11 | 1 | 0 | 0 |
| Total | 94 | 90 | 2 | 2 | 0 |
*Se diagnosticaron CaIS en 12 GM; en adición, se realizó un conteo según subtipo y arreglo de cada CaIS con el cual se obtuvieron en total 42 CaIS.
No hubo inmunomarcación para galectina-3 en las adenosis, las hiperplasias ductales usuales, la hiperplasia lobular atípica, las lesiones de células columnares, el Ca complejo o las hiperplasias complejas.
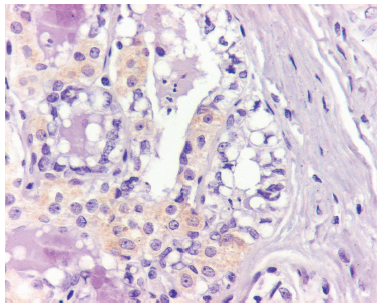
Un papiloma/ adenoma con hiperplasia de acinos tuvo inmunomarcación multifocal en 11-50% de las células epiteliales con moderada intensidad con respecto a los testigos positivos (Figura 3). Un Ca invasivo (Cal) tuvo inmunomarcación en 1-10% de las células con baja intensidad. Dos CaIS, ambos del subtipo CLIS, uno de grado histológico intermedio y otro de alto grado, tuvieron marcación en 10% de las células, pero uno tuvo intensidad baja y el otro, intensidad moderada con respecto al tejido prostático (testigo positivo) de IHQ (Figura 4).
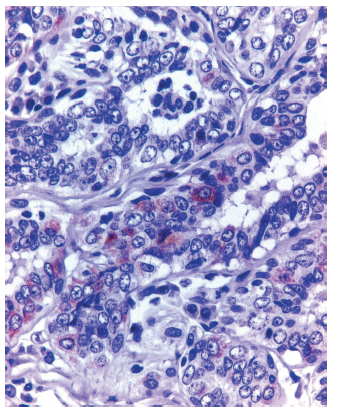
FIGURA 3 Papiloma/adenoma con foco de hiperplasia de acinos. Las células epiteliales tienen inmunomarcación multifocal positiva color café en su citoplasma. IHQ para galectina- 3. 400x.
DISCUSIÓN
Este estudio demuestra que la mayoría de las LIEs encontradas no expresaron galectina-3; tampoco se percibió la expresión de esta molécula en el epitelio de ductos ni acinos normales; finalmente, hubo expresión de galectina-3 en un papiloma/ adenoma, dos CLIS y un Cal la cual fue de poca extensión e intensidad débil. La ausencia de expresión de galectina-3 en epitelio normal, así como la baja expresión de este antígeno en adenomas clínicamente manifiestos de GM de perras ha sido documentada por Choi et al. (2004). En principio, los resultados pertinentes al epitelio normal son directamente comparables entre este estudio y el de Choi et al. (2004); de igual manera, se podría concluir que existe similitud entre los dos estudios en lo referente a los resultados de los adenocarcinomas, así como en los hallazgos en el caso de las lesiones de alto grado en las que la marcación para galectina-3 fue escasa. En todo caso, se debe recordar que en la investigación de los citados autores, las perras ya tenían tumores clínicamente manifiestos en contraste con las muestras del presente trabajo.
De esta forma, con base en los resultados se podría afirmar que la expresión de galectina-3 en LIEs de perras no es una característica importante en la evolución de las lesiones malignas mamarias en sus primeros estadios de desarrollo y que su expresión es mayor en tumores clínicamente evidentes (Choi et al. 2004); en tal caso, dicha expresión correspondería a una fase tardía de su evolución.
La galectina-3 en tumores mamarios manifiestos bien desarrollados de hembras caninas desempeña varias funciones estrechamente relacionadas con los primeros pasos del proceso metastásico y otros procesos de malignidad (De Oliveira et al. 2010) porque: 1) La galectina-3 interactua con proteínas oncogénicas (HRAS y KRAS); 2) La galectina-3 regula las ciclinas A, D y E promotoras del ciclo celular, además, regula los niveles de moléculas inhibidoras del ciclo celular p21 (WAF 1) y p27 (KIP1); 3) La galectina-3 tiene efectos anti-apoptóticos- por interactuar con la familia de proteínas BCL2 (Honjo et al. 2001). También se considera a la galectina-3 como un quimioatrayente para células endoteliales y estimula la neovascularización in vivo, por lo tanto, contribuye a la angiogénesis del tumor y proporciona una vía de escape por el cual las células potencialmente malignas pueden abandonar el tumor primario y entrar en los vasos sanguíneos (Nangia-Makker et al. 2000).
CONCLUSIONES
Los hallazgos de este estudio sugieren que para el caso de las lesiones tempranas iniciales la galectina-3 no tiene un papel significativo en el origen y evolución de los Ca mamarios en las primeras fases de desarrollo; es posible que otras vías metabólicas pudieran tener mayor significado.