INTRODUCCIÓN
Los silúridos constituyen un orden de peces de gran importancia para la economía de muchas regiones en el mundo; su distribución es muy amplia al igual que su variedad de formas y son el grupo de mayor importancia en América Latina después de los carácidos (Galvis et al. 1997, Galvis et al. 2006). Para Colombia se reporta la presencia de 12 familias (Cala 1996). Los silúridos se caracterizan por ausencia de escamas, cuerpo cilíndrico, desnudo o con placas o escudos óseos, algunos son muy alargados y otros anguiliformes; presentan barbillas maxilares o mentonianas y en algunos casos en las narinas anteriores, dientes dispuestos en formas de parches o almohadillas (Galvis et al. 1997; Malabarba y De Souza 2014). "La cintura pectoral es normalmente bien desarrollada y casi siempre unida al cráneo, sus aletas suelen estar bien desarrolladas y la dorsal y pectoral precedidas por un radio duro osificado a manera de espina, que puede ser aserrada o no, generalmente cubierta por un epitelio glandular urticante o venenoso, poseen un alto número de radios branquiostegas y sus aletas pelvicas en posición abdominal" (Galvis et al. 2006).
El capitán de la sabana, Eremophilus mutisii (Pisces: Trichomycteridae), es una especie íctica endémica del altiplano cundiboyacense, emblemática dentro de la cultura andina y que ha sido catalogada como el bagre de agua dulce con mayores probabilidades para la piscicultura en zonas frías altoandinas (Pinilla et al. 2006; Landines et al. 2017). Según Prieto y Landinez (2015), esta especie conserva un interés comercial y de consumo a nivel regional para la población rural de los alrededores de embalses y lagunas donde habita. Dichos autores afirman también que se tienen registros que indican que, solamente considerando el sistema de la laguna de Fúquene (Cundinamarca), las capturas de E. mutisii permiten calcular para la zona un consumo medio de 3,5 kg persona/año.
Por lo anterior, varios autores reiteran que deben dirigirse esfuerzos hacia el avance en la reproducción en cautiverio para asegurar su permanencia, puesto que para el 2002 la especie había sido catalogada en el Libro Rojo de los Peces como especie "casi amenazada" (Mojica et al. 2002) y para el 2012 se reclasificó como especie "vulnerable" (Mojica et al. 2012).
En este sentido, se ha señalado que cuando una especie comienza a ser cultivada se reduce la presión de la pesca en el medio natural y las poblaciones naturales pueden aumentar (Diana 2009). Por ello, es importante desarrollar un sistema de producción sostenible en cautiverio que busque garantizar un aprovechamiento adecuado de la especie partiendo de un conocimiento profundo de su biología. El objetivo de este trabajo fue caracterizar la morfometría y los índices corporales de Eremophilus mutisii para contribuir a el conocimiento de la biología de la especie como soporte para su futura producción en cautiverio.
MATERIALES Y MÉTODOS
Material biológico y morfometría
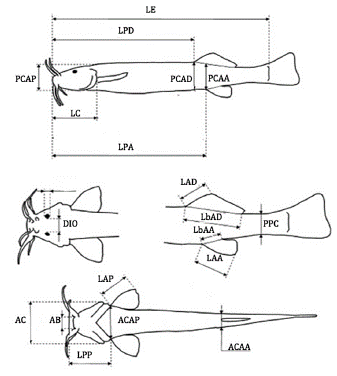
Treinta y tres especímenes (veintisiete hembras y seis machos) procedentes del río Bogotá, específicamente en la región de Suesca (5°06' Norte, 73°48'Oeste, 2584 msnm), conservados en solución de formaldehído (10%), se pesaron de manera individual y se utilizaron para tomar las medidas típicas para los siluriformes, así: longitud total (LT); longitud estándar (LE); longitud de la cabeza (LC); longitud preanal (LPA); profundidad del cuerpo en la aleta pectoral (PCAP); ancho del cuerpo en la aleta pectoral (ACAP); ancho del cuerpo en la aleta anal (ACAA); ancho de la cabeza (AC); distancia interorbital (DIO); ancho de la boca (AB); longitud predorsal (LPD); longitud prepectoral (LPP); longitud de la aleta pectoral (LAP); longitud de la aleta dorsal (LAD); longitud de aleta anal (LAA); longitud de la base de la aleta dorsal (LbAD); longitud de la base de la aleta anal (LbAA); profundidad del pedúnculo caudal (PPC); profundidad corporal en aleta dorsal (PCAD) y profundidad corporal en aleta anal (PCAA). Dichas medidas fueron realizadas utilizando un calibrador Vernier* con precisión de 0.1 mm (Figura 1).
Índices corporales
Posteriormente, se realizó la disección de los animales que permitió la clasificación macroscópica de la gónada como lo reportaron Holden y Raitt (1974): ovario en desarrollo, ovario desovado o testículo, para determinar así la condición sexual de los animales (hembras en maduración n = 24, hembras desovadas n = 3, machos n = 6). Posteriormente, se registró el peso de la gónada, el peso del hígado, el peso de las vísceras y la longitud del intestino. Con los datos colectados se calcularon los siguientes índices:
Índice gonadosomático: (peso gónada /peso corporal) x100
Índice hepatosomático: (peso hígado /peso corporal) x 100
Rendimiento en carcasa: (peso carcasa /peso corporal) x 100. Dónde: peso carcasa = peso corporal-(peso vísceras + peso de la gónada)
Longitud relativa del intestino: longitud del intestino/longitud total
Factor de condición (K): (peso/longitud total3) x 100
Relación de aspecto de la aleta caudal: se determinó con el análisis de fotografías de la aleta caudal de cada uno de los ejemplares mediante en el software ImageJ® versión 1.51p22 (http://imagej.nih.gov/ij/) y la siguiente expresión: A=h 2 /S. Donde A, es la relación de aspecto de la aleta caudal; h, la altura de la aleta caudal y S, su área superficial (Sambilay 1990).
Análisis estadístico
Los datos morfométricos y los índices corporales se caracterizaron mediante estadística descriptiva (media, desviación estándar, mínimo y máximo) para cada uno de los sexos. Para evaluar la relación entre la forma del pez y la condición reproductiva (macho, hembras en maduración y hembras desovadas) se realizó un análisis discriminante canónico, utilizando los datos morfométricos del animal (excepto longitud de las aletas). Inicialmente los valores de dichas medidas fueron transformados para eliminar el efecto del tamaño de los animales; para ello, se probaron dos transformaciones (Turan 1999):
Razón: Maj = M/LE
Alométrica Maj = logM - P1x(LogLE-logLEpromedío)
Donde Maj = medida ajustada, M= medida morfométrica original, LE = longitud estándar, logLE = longitudpromedio estándar promedio, β1 = coeficiente de la regresión lineal general (considerando todos los ejemplares) del logM en función de logSL; se utilizó logaritmo en base diez para cada una de las variables.
Para comprobar la eficiencia de la trasformación se verificó la significancia de los coeficientes de correlación de Pearson entre las variables transformadas y la longitud estándar. Los análisis se ejecutaron en el programa R* v3.4.0 utilizando el paquete Candisc (Friendly y Fox 2012). Para probar la hipótesis de diferencia multivariada entre el vector de las medidas transformadas de los dos grupos se utilizó la prueba Lambda de Wilks (Turan 1999). Modelos de regresión lineal polinomial se ajustaron para predecir el peso de la gónada y el rendimiento en carcasa en función del peso del animal. De otra parte, se determinaron los parámetros de la relación alométrica, mediante regresión no lineal, entre la longitud total del pez (LT) y su peso corporal, la cual es de la forma Peso = aLTb, donde a es el peso cuando LT = 1 y b es el coeficiente alométrico. Dichos análisis se realizaron para hembras en maduración y machos.
RESULTADOS
Morfometría
Para todas las medidas morfométricas evaluadas las hembras presentaron medias numéricamente superiores respecto al de los machos. Asimismo, en los ejemplares evaluados se presentó mayor rango de tamaño para las hembras que para los machos (Tabla 1).
TABLA 1 Medidas corporales (cm) en hembras y machos de Eremophilus mutisii.
| Sexo | Hembras n=27 | Machos n = 6 | ||||||
|---|---|---|---|---|---|---|---|---|
| Medida* | Promedio | SD | Mínimo | Máximo | Promedio | SD | Mínimo | Máximo |
| LT | 28,6 | 3,5 | 20,2 | 34,0 | 28,1 | 3,6 | 23,5 | 33,1 |
| LE | 25,8 | 3,3 | 17,4 | 31,0 | 25,0 | 3,1 | 20,7 | 28,7 |
| LC | 3,5 | 0,5 | 2,5 | 4,3 | 3,4 | 0,5 | 2,8 | 4,3 |
| LPA | 18,4 | 2,2 | 12,8 | 21,1 | 17,7 | 2,1 | 14,9 | 20,7 |
| PCAP | 2,1 | 0,4 | 1,4 | 2,9 | 2,1 | 0,4 | 1,6 | 2,5 |
| ACAP | 3,0 | 0,5 | 2,0 | 3,8 | 2,7 | 0,4 | 2,4 | 3,3 |
| ACAA | 1,8 | 0,4 | 1,1 | 2,6 | 1,7 | 0,4 | 1,2 | 2,0 |
| AC | 3,2 | 0,4 | 2,4 | 3,9 | 3,1 | 0,5 | 2,5 | 3,9 |
| DIO | 1,4 | 0,2 | 0,8 | 1,8 | 1,3 | 0,2 | 1,1 | 1,7 |
| AB | 1,1 | 0,2 | 0,6 | 1,5 | 1,2 | 0,4 | 0,8 | 2,0 |
| LPD | 16,6 | 2,0 | 12,2 | 19,1 | 16,3 | 2,2 | 13,2 | 19,0 |
| LPP | 3,5 | 0,4 | 2,5 | 4,1 | 3,4 | 0,3 | 3,0 | 3,9 |
| LAP | 2,3 | 0,4 | 1,7 | 3,2 | 2,6 | 0,6 | 1,8 | 3,3 |
| LAD | 3,2 | 0,5 | 2,0 | 4,0 | 3,0 | 0,6 | 2,3 | 4,0 |
| LAA | 2,7 | 0,5 | 1,8 | 3,4 | 2,5 | 0,4 | 2,1 | 3,1 |
| LbAD | 2,7 | 0,5 | 1,7 | 3,5 | 2,5 | 0,5 | 2,0 | 3,5 |
| LbAA | 2,2 | 0,4 | 1,4 | 2,9 | 2,0 | 0,3 | 1,5 | 2,3 |
| PPC | 2,8 | 0,5 | 1,5 | 4,0 | 2,7 | 0,3 | 2,2 | 3,2 |
| PCAD | 3,8 | 0,6 | 2,1 | 5,0 | 3,5 | 0,6 | 2,8 | 4,2 |
| PCAA | 3,4 | 0,5 | 1,9 | 4,4 | 3,2 | 0,5 | 2,5 | 3,8 |
*LT: longitud total, LE: longitud estándar, LC: longitud de la cabeza, LPA: longitud preanal, PCAP: profundidad del cuerpo en la aleta pectoral, ACAP: ancho del cuerpo en la aleta pectoral, ACAA: ancho del cuerpo en la aleta anal, AC: ancho de la cabeza, DIO: distancia interorbital, AB: ancho de la boca, LPD: longitud predorsal, LPP: longitud prepectoral, LAP: longitud de la aleta pectoral, LAD: longitud de la aleta dorsal, LAA: longitud de aleta anal, LbAD: longitud de la base de la aleta dorsal, LbAA: longitud de la base de la aleta anal, PPC: profundidad del pedúnculo caudal, PCAD: profundidad corporal en aleta dorsal y PCAA: profundidad corporal en aleta anal. SD: desviación estándar.
Análisis morfométrico mediante análisis multivariado
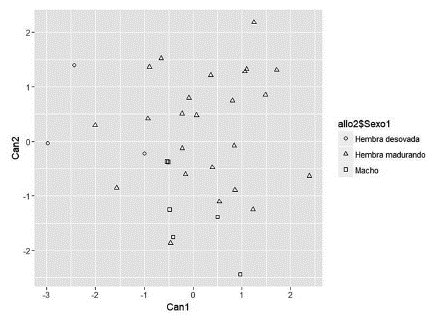
La trasformación alométrica permitió eliminar el efecto del tamaño de los animales para la realización del análisis discriminante canónico. Los coeficientes de correlación de Pearson entre las variables transformadas y la longitud estándar fueron no significativos (p > 0,05). Por su parte, el análisis de varianza multivariado (MANOVA) para las variables transformadas indicó que las tres categorías reproductivas (hembra en maduración, hembras desovadas y machos) no diferían en su vector de medias (Prueba de Lambda Wilks p > 0,9441). De manera similar, las funciones discriminantes canónicas obtenidas no permitieron una diferenciación clara entre las tres categorías reproductivas (Tabla 2; Figura 2). Sin embargo, se observó que las hembras desovadas presentaron valores negativos para la función 1, la cual tiene una alta carga factorial para la profundidad corporal en aleta dorsal (PCAD); es decir, que las hembras desovadas tienen menor profundidad corporal que las que están en maduración.
TABLA 2 Coeficientes de las funciones discriminantes canónicas.
| Variable | Funciónl | Función2 |
|---|---|---|
| LC | -0,237 | 0,368 |
| AC | 0,325 | -0,792 |
| AB | 0,778 | 0,260 |
| LPD | -0,180 | -0,596 |
| LPP | 0,400 | -0,154 |
| LPA | 0,172 | 0,882 |
| LbAD | 0,032 | -0,036 |
| LbAA | -0,740 | 0,045 |
| PPC | -0,439 | -0,324 |
| ACAP | 0,347 | 0,780 |
| ACAA | -0,021 | 0,892 |
| PCAP | -0,493 | -0,688 |
| PCAD | 0,997 | 0,613 |
| PCAA | -0,449 | -0,318 |
Índices corporales
El promedio de peso corporal de las hembras fue 23% superior al de los machos; en general, en los ejemplares evaluados el rango de peso fue superior en las hembras que en los machos. Además, las hembras se caracterizaron por presentar un índice gonadosomático mayor que el de los machos. Asimismo, la variación de dicho índice fue mayor para las hembras que para los machos, lo que se asoció al estado de desarrollo gonadal, que a su vez se relaciona con el peso corporal y también con la ocurrencia o no del desove. Para las hembras desovadas (n = 3) el índice presentó un valor medio de 4,71% ± 4,80, que fue inferior al de las 15 hembras en maduración evaluadas, para las cuales el valor medio fue de 14,73% ± 4,10.
Por su parte, el índice viscerosomático y la longitud relativa del intestino fueron similares entre machos y hembras; sin embargo, el rango fue mayor en hembras que en machos. A su vez, el índice hepatosomático fue numéricamente superior para las hembras que para los machos (Tabla 3). Para las hembras en maduración se encontró una correlación significativa entre el factor de condición y el peso corporal (r = 0,53; p < 0,05), esto se refleja en que para hembras entre 46 y 172 g el promedio de factor de condición fue 0,82 ± 0,13 y para hembras entre 181 y 362 g fue de 0,95 ± 0,15. Para las tres hembras desovadas el promedio de peso fue de 237 g y el del factor de condición 0,90 ± 0,16. La relación de aspecto de la aleta caudal presentó un promedio de 1,57 sin diferencias numéricas entre machos y hembras.
TABLA 3 Índices corporales en hembras y machos de Eremophilus mutisii.
| Sexo | Hembras n=27 | Machos n = 6 | ||||||
|---|---|---|---|---|---|---|---|---|
| Parámetro | Promedio | SD | Mínimo | Máximo | Promedio | SD | Mínimo | Máximo |
| Peso (g) | 222,7 | 77,8 | 46,0 | 362,5 | 181,1 | 66,0 | 95,0 | 257,3 |
| Longitud intestino (cm) | 19,0 | 4,2 | 9,0 | 26,6 | 16,5 | 1,9 | 14,5 | 18,6 |
| Índice gonadosomático | 13,6 | 5,6 | 0,2 | 23,2 | 5,3 | 2,2 | 2,3 | 8,3 |
| Índice hepatosomático | 0,9 | 0,4 | 0,4 | 1,9 | 0,6 | 0,3 | 0,4 | 1,1 |
| Índice viscerosomático | 2,9 | 0,8 | 1,6 | 5,3 | 2,9 | 0,6 | 2,0 | 3,6 |
| Relación LI / LT | 0,7 | 0,1 | 0,4 | 0,9 | 0,6 | 0,1 | 0,5 | 0,7 |
| Factor de condición (K) | 0,9 | 0,1 | 0,6 | 1,2 | 0,8 | 0,1 | 0,7 | 0,9 |
| Relación de | ||||||||
| aspecto de la | 1,6 | 0,2 | 1,3 | 1,9 | 1,5 | 0,1 | 1,4 | 1,6 |
| aleta caudal | ||||||||
SD: desviación estándar, LI: longitud intestino, LT: longitud total.
Relación longitud total-peso
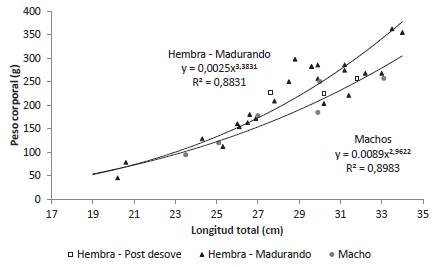
El coeficiente alométrico de la relación LT-Peso (Peso = aLTb) fue numéricamente superior para las hembras en maduración que para los machos. Tanto para las hembras en maduración como para los machos el coeficiente alométrico fue significativo (p < 0,05). Para dos de las tres hembras desovadas evaluadas el peso fue inferior al peso predicho para su LT lo cual se debe fundamentalmente a la pérdida de peso ocasionada por el desove (Figura 3).
Relación peso corporal-peso de la gónada
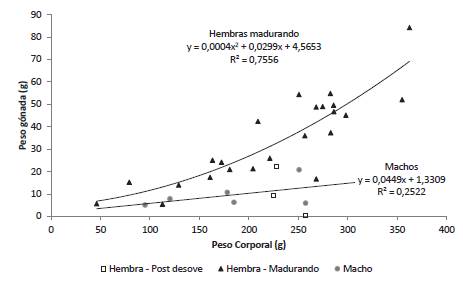
Para las hembras en maduración el incremento del peso del ovario en función del peso corporal se ajustó a un modelo cuadrático (p < 0,05) que sugiere una velocidad del crecimiento relativo del ovario mayor que el resto del cuerpo. El peso del ovario de las hembras desovadas fue inferior al predicho por la ecuación de regresión ajustada para las hembras en maduración lo cual es producto de la disminución del peso de la gónada causada por el desove (Figura 4). Para los machos la relación entre el peso del testículo y el peso corporal fue ajustada a un modelo de regresión lineal simple; sin embargo, debido al limitado tamaño de muestra y a la baja variación en el peso del testículo el coeficiente de determinación fue bajo y la pendiente no significativa (p = 0,31).
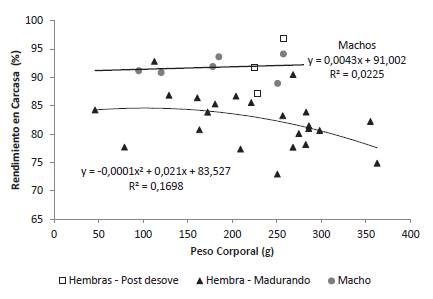
Relación peso corporal-rendimiento en carcasa
El rendimiento en carcasa de los machos (91,79% ± 1,91) fue superior al de las hembras en maduración, pero similar al de las hembras desovadas (91,89% ± 4,85). Para los machos el peso del animal no afectó el rendimiento de carcasa. Para las hembras en maduración entre 46 y 181 g de peso corporal (n = 8) el rendimiento en carcasa fue de 84,76% ± 4,46 y para las hembras en maduración con pesos entre 204 y 363 g (n = 15) el rendimiento fue de 81,11% ± 4,54. Se observó así una asociación entre el peso corporal y el rendimiento en carcasa que se describió por una ecuación cuadrática que sugiere una disminución del rendimiento de carcasa a partir de los 105 g de peso corporal. Para dicha ecuación el coeficiente de determinación fue bajo y el modelo no significativo (p = 0,15) lo cual se explica por la baja variación del rendimiento en carcasa (coeficiente de variación 6,7 %) en el intervalo de pesos corporales de las hembras en maduración evaluadas y a la dispersión de los datos alrededor de la línea de regresión, lo que sugiere que otros factores no considerados en el modelo afectan dicho rendimiento (Figura 5).
DISCUSIÓN
En los ejemplares analizados se evidenció una superioridad en el tamaño de las hembras respecto a los machos, dicha superioridad ha sido documentada ampliamente (Flórez y Sarmiento 1989; Bastidas y Lemus 2014; Landines et al. 2017). No obstante, en la literatura consultada no se encontraron estudios que detallaran las medidas morfológicas para la especie. Por su parte, el uso de técnicas multivariadas como el análisis discriminante y el análisis discriminante canónico para diferenciar el sexo de los peces y camarones a partir de las medidas morfométricas de los individuos ha sido reportado previamente (McGrath y Hilton 2012; Accioly et al. 2013). Asimismo, el grado de actividad reproductiva de algunas especies de peces se ha identificado a partir del uso de dichas técnicas (Kashefi et al. 2012). En el presente estudio no fue posible identificar diferencias entre machos, hembras en maduración y hembras desovadas mediante análisis discrimínate canónico; lo que posiblemente pueda asociarse al reducido tamaño de muestra para machos y hembras desovadas.
Por otro lado, el factor de condición K ha sido una forma de evaluar el estado de condición corporal de los peces y también se ha relacionado con el estado reproductivo de los animales (Weatherley y Gill 1987). En el presente estudio dicho parámetro fue superior para las hembras en maduración de más de 172 g, seguido por las hembras desovadas, las hembras en maduración de menos de 172 g y los machos. Resultados similares para el factor de condición K se han descrito previamente para el bagre pintado, Pseudoplatystoma corruscans, con valores cercanos a 1,19 para hembras en maduración, 1,15 para hembras desovadas y 1,1 para machos en diferentes estados de maduración gonadal (Brito y Bazzoli 2003). La disminución en el factor de condición de las hembras durante el desove se debe a que los animales pierden peso sin disminuir su talla. El coeficiente alométrico "b" de la relación longitud total-peso fue numéricamente superior para las hembras en maduración que, para los machos, lo que coincide con lo encontrado para otros silúridos como el bagre del nilo, Synodontis schall, y el Auchenipterichthys longimanus (Dadebo 2016; Freitas et al. 2016). Lo anterior, indica que el incremento en peso en función del tamaño es más acentuado en hembras que en machos, sobre todo durante la maduración gonadal. Dicha diferencia puede explicarse en gran parte por las diferencias que existen en el peso de las gónadas, donde el índice gonadosomático fue superior para las hembras en maduración al comprarlo con el de los machos. Dicho hallazgo concuerda con los registros de Landines et al. (2017) con un valor medio de 10,82% para hembras, con peso medio de 94 g y de 4,33 % para los machos, con peso medio de 81 g. De esta manera es de suponer que luego de iniciar los procesos de maduración gonadal la hembra debe destinar una mayor proporción de energía y nutrientes hacia la función reproductiva para soportar un mayor crecimiento de la gónada (ovario) que el macho. Ahora bien, se ha reportado que esta especie logra la primera madurez sexual al alcanzar longitudes entre 14 y 20 cm, con 40 a 50 g de peso corporal (Pinilla et al. 2006).
Estas dinámicas de desarrollo gonadal tienen implicaciones no sólo en aspecto reproductivo de la especie sino también en el rendimiento en carcasa, el cual es superior para machos y hembras desovadas que para hembras en maduración, para las cuales, se evidenció una tendencia a disminuir dicho rendimiento en función del peso corporal. Tendencias similares se han relatado para otros bagres como Rhamdia quelen, con valores cercanos a 87% para machos entre 200 y 500 g y de 80,34% para hembras entre 500 y 600 g, en las cuales el índice gonadosomático fue de 11,11% (Carneiro et al. 2004).
Eremophilus mutisii ha sido catalogada como una especie omnívora con tendencia carnívora registrando como ítems alimentares anélidos, moluscos, crustáceos, larvas de insectos, insectos adultos y pequeñas ostras de agua dulce (Rodríguez 2000; Bastidas y Lemus 2014), además de plantas (Tovar et al. 2008). Adicionalmente, estos reportes coinciden con la longitud intestinal relativa encontrada en el presente estudio, la cual varió entre 0,4 y 0,9; valores que ya habían sido publicados por Pinilla et al. (2006) para animales criados en embalses del municipio de Caldas, Boyacá. Al respecto, Davis et al. (2013) señalaron que por lo general los intestinos relativamente cortos están presentes en especies de peces de hábitos carnívoros. Por otra parte, los valores bajos de la relación de aspecto de la aleta caudal caracterizada en el presente estudio, y que señalan al E. mutisii como una especie relativamente sedentaria, concuerdan con descripciones previas de la especie como un pez bentónico, de "migraciones cortas" y nado lento (Rodríguez 2000; Tovar et al. 2008; González y Rosado 2010; Landines et al. 2017). Asimismo, con el hecho de que la relación de aspecto de la aleta caudal se correlaciona positivamente con la velocidad de nado de los peces (Sambilay 1990). Adicionalmente, se ha documentado una correlación positiva entre la relación de aspecto de la aleta caudal con la tasa metabólica en reposo de los peces (Killen et al. 2016), lo que implica que peces con baja relación de aspecto de la aleta caudal tienden a tener una menor producción de calor en ayuno y un menor requerimiento de energía para el mantenimiento.
CONCLUSIONES
La relación de aspecto de aleta caudal y en general la forma del pez confirma los hábitos sedentarios del capitán de la sabana, Eremophilus mutisii, lo cual tendría implicaciones a futuro si se quieren generar sistemas de producción en cautiverio con fines de preservación y/o comercialización. Asimismo, es importante tener en cuenta los menores rendimientos en canal que se obtienen con las hembras en maduración por presentar mayores índices hepatosomático y gonadosomático al incrementar su peso corporal, como es de esperarse en los peces en general.