INTRODUCCIÓN
Las intoxicaciones accidentales son frecuentemente descritas en la literatura, no solo para la especie canina sino para otras especies animales; el uso de cebos y aplicaciones por fumigación de productos carbamatos y organofosforados es frecuente en Medellín (Colombia), por lo que representa un riesgo para la salud animal y pública. Dentro de estas sustancias se describe el uso de metomilo (Dagger®, Allister©, México), un inhibidor reversible de la enzima acetilcolinesterasa (Ferré et al. 2015; Makrides et al. 2005); el cual causa acumulación de la acetilcolina en los receptores nicotínicos de los artrópodos y en los muscarínicos y nicotínicos de mamíferos, reptiles y aves. Esta acumulación de la acetilcolina por la inhibición enzimática provoca en el huésped un síndrome colinérgico, caracterizado por tres síndromes (Cabble y Doherty 1999; Coleman et al. 1990) el primero, es el síndrome nervioso el cual se debe a la estimulación de los receptores muscarínicos dentro del sistema nervioso, con signos como excitación, euforia, delirio, convulsiones clónicas o tónicas, vocalización, ataxia, incoordinación, miosis puntiforme, sialorrea, rinorrea, broncorrea, epifora, emesis, disnea, diaforesis, paro respiratorio, coreoatetosis, dolor abdominal, incontinencia urinaria y fecal (Brittain et al. 2016); el segundo, un síndrome cardiovascular con bradicardia, hipertensión, mucosas hiperemicas, y el tercero, un síndrome intermedio, más descrito para los inhibidores irreversibles como los organofosforados con parálisis de músculos respiratorios, parálisis de lengua, parálisis de nervios craneales y debilidad del músculo faríngeo, este proceso puede presentarse en alrededor del 57% de los casos y ocurre 24-96 horas después del evento (Vale y Lotti 2015).
En cuanto a la frecuencia de este tipo de intoxicación en Colombia, existen pocos datos de su prevalencia en caninos aunque en seres humanos ha sido ampliamente descrita (Córdoba 2001); además, se desconocen cuáles son los agentes usados con mayor frecuencia, y aunque son bien conocidos sus síndromes y signos, no se conoce la epidemiología de la intoxicación pues el diagnóstico es comúnmente dado por el antecedente a la exposición al tóxico y los signos clínicos típicos (miosis, sialorrea, bradicardia y fasciculaciones). Por su parte, en el ámbito veterinario la medición de acetilcolinesterasa en sangre se utiliza con menor frecuencia, mientras que en pacientes humanos la hematología es poco concluyente (Córdoba 2001); en las especies domésticas se ha descrito la presencia de leucocitosis (Cable y Doherty 1999; Coleman et al. 1990).
El tratamiento de las intoxicaciones por carbamatos, al igual que la de los organo-fosforados, se basa en los mismos principios generales para el manejo de cualquier intoxicación, en donde la descontaminación del paciente es primordial mediante el lavado gástrico en caso de ingesta, el uso de adsorbentes como el carbón activado, caolín pectina o diosmectita, o de quelantes como bismuto y las medidas de urgencias A (Air), B (Breathing), C (Circulation) y D (Disability). Posteriormente, el suministro de antídotos y el control de síntomas, para los cuales se describe el uso de atropina hasta causar atropinización [0,02-0,04 mg/kg intramuscular (IM)] (Brittain et al. 2016) y difenhidramina [2 mg/kg EV (endovenoso)] cada 8 horas como antinicotínico; por su parte, los síntomas pueden ser tratados con benzodiacepinas, barbitúricos o anestésicos GABAérgicos, también, se debe mantener el balance iónico y evitar la acidosis metabólica con bicarbonato de sodio [1-3 mEq/kg día] en caso de no disponer de equipos para medición de ionograma. Por último, es importante, y tal como se ha descrito para las intoxicaciones por organofosforados, el suministro de los activadores de la colinesterasa obidoxima [3-6 mg/kg EV] o pralidoxima [10-20 mg/kg EV] cada 8 horas (Restrepo 2012).
En Colombia no se ha descrito la intoxicación por metomilo en la especie canina o el cuadro de severa intoxicación que causa en la raza pastor colie, así como tampoco el uso de pralidoxima como tratamiento para esta intoxicación.
DESCRIPCIÓN DEL CASO
Anamnesis
Un macho pastor colie de 4 años de edad fue ingresado de urgencia a la Clínica Veterinaria Catdog en la ciudad de Medellín (Colombia) debido al consumo de metomilo (Dagger®, Allister©, México). Si bien se desconoce el momento exacto del consumo, el tiempo durante el cual estuvo expuesto el canino al metomilo fue de 120 minutos, posterior al cual, el canino presentó un severo cuadro excitatorio y convulsivo (convulsiones de tipo clónico tónicas).
Examen físico
Paciente que ingresa con cuadro neurológico en evaluación, se encontró un paciente eufórico, delirante con vocalización, atáxico, con miosis puntiforme sin respuesta a reflejos lumínicos, signos de incoordinación, obnubilado, sialorreico y con emesis. En la evaluación de parámetros fisiológicos se encontró un paciente con frecuencia cardíaca de 170 ppm, frecuencia respiratoria de 60 rpm, pulso aumentado, mucosas iyectadas, temperatura de 38°C, tiempo de llenado capilar 1 segundo y pliegue cutáneo 1 segundo, sin signos de deshidratación, pero se presumió cuadro de acidosis metabólica.
Ayudas diagnósticas
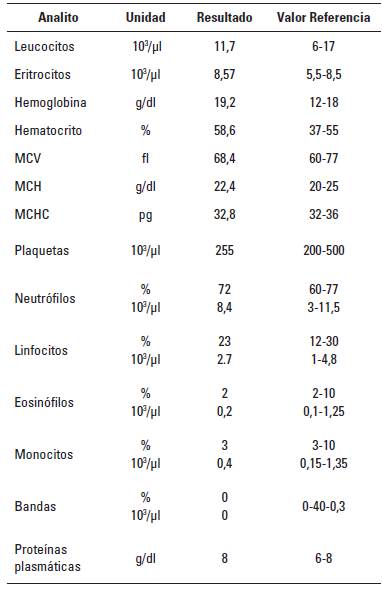
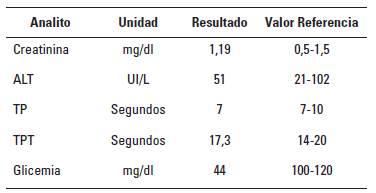
El paciente fue sometido a hemograma completo con el cual se pudo observar incremento en eritrocitos 8,57 x 103/ µl, hematocrito 58,6% y hemoglobina 19,2 g/dl al compararlos con sus valores de referencia: 5,5-8,5 x 103/µl, 37-55% y 12-18 g/dl, respectivamente. El resto de los valores se encontraron normales para la especie canina (Tabla 1). En cuanto a creatinina, alanina aminotrasferasa (ALT), tiempo de protrombina (TP) y tiempo parcial de tromboplastina (TPT), fueron normales para cánidos (Tabla 2).
Diagnóstico
El paciente presentó una intoxicación con metomilo (Dagger®, Allister©, México), un compuesto químico insecticida perteneciente a la familia de los carbamatos, el cual es un inhibidor reversible de la acetilcolinesterasa. Se dedujo que esta fue la causa de la intoxicación debido a que la historia describe el uso del producto 2 horas antes en el ambiente donde habita el canino, por tal motivo no se consideró la necesidad de medir acetilcolinesterasa en sangre. Este producto insecticida es frecuentemente usado en Colombia para el control de insectos en cultivos agrícolas y debido a su efectividad, en los últimos años viene siendo usado para el control de insectos rastreros en hogares.
Tratamiento
El paciente fue canalizado con solución Hartman a razón de 1 gota/segundo; posteriormente, se instauró un tratamiento con atropina (0,04 mg/kg IM) cada 30 minutos hasta causar atropinización del paciente (midriasis y xerostomía), se aplicaron tres dosis repetidas con intervalo de 30-45 minutos; a continuación, se realizó lavado gástrico con suministro de carbón activado a dosis 50 gr cada 10 minutos durante las primeras dos horas. Debido a que el paciente presentaba euforia severa se suministró una dosis de diazepam (0,5 mg/kg) la cual no ofreció respuesta y el canino continuó con el proceso excitatorio, delirante y con rigidez; por ello, se procedió a someter a terapia de sueño con pentobarbital (12 mg/kg EV) cada 24 horas, durante dos días; adicionalmente, se estableció terapia con difenhidramina (2 mg/kg EV) cada 6 horas por 36 horas y pralidoxima (10 mg/kg EV) cada 8 horas, por tres días; se suplementó la solución Hartman con bicarbonato de sodio (1 mEq/kg) una sola vez al día y debido a la hipoglicemia (44 mg/dl) se suministró un bolo de dextrosa (0,2 ml/kg); además, se instauró manitol (0,5 mg/kg) cada 12 horas, durante 24 horas. El paciente se entubó y parmaneció en terapia de sueño por 48 horas, mismo tiempo de duración de la entubación; además, se mantuvo con oxigenación permanente a razón de 2 L.
Evolución
El paciente estuvo hospitalizado durante 7 días sometido a protocolos de cuidados críticos para caninos: oxigenación, hidratación y cambios en posicionamiento cada 2 horas. Durante las primeras 24 horas el paciente mostró marcados signos nerviosos, particularmente de tipo excitatorios, con hiperreflexia, euforia y convulsión, por lo que se decidió mantenerlo en terapia de sueño a base de pentobarbital (12 mg/ kg) durante 24 horas, en infusión de 1 gota/6 segundos. De esta forma, durante las primeras 24 horas el paciente se encontró en coma inducido por la medicación, con oxigenoterapia constante (Figura 1).

FIGURA 1 Paciente en estado de coma inducido con pentobarbital, con el fin de evitar la excitación y delirio.
Pasadas las primeras 24 horas de hospitalización el paciente presentó una nueva crisis nerviosa con excitación y delirio, por lo cual se mantuvo la terapia de sueño establecida y se adicionó infusión constante de propofol (1 mg/kg EV) por 24 horas. Se observaron signos anticolinérgicos como midriasis, xerostomía, taquicardia y taquipnea; por su parte, las fasciculaciones disminuyeron con el uso de difenhidramina la cual se continuó suministrando a igual dosis. A su vez, para evitar las lesiones en el ojo asociadas a la midriasis se aplicó pilocarpina cada 8 horas para estimular la miosis. Entre tanto, se continuó la terapia con pralidoxima a la misma dosis y en el mismo intervalo. Durante estas primeras 24 horas el paciente presentó frecuencia cardíaca de 63 ppm, frecuencia respiratoria de 34 rpm, arrítmico, con mucosas rosadas, temperatura de 38,5°C, tiempo de llenado capilar normal, con saturación de oxigeno de 94% y continuaban los signos neurológicos como euforia e hiperreflexia.
Luego de 48 horas de hospitalización los parámetros fisiológicos se presentaron estables, con frecuencia cardíaca dentro de los valores normales (60-80), pulso (6080), rítmico, arco alto y fuerte, frecuencia respiratoria (30-40), tiempo llenado capilar de 1 segundo, pliegue cutáneo de 1 segundo y temperatura entre 38-39°C. La producción de orina en promedio diario fue de 2 ml/kg/hora.
De otra parte, a las 72 horas el paciente presentó paro cardiorrespiratorio, un síndrome intermedio frecuente en las intoxicaciones por inhibidores de la acetil-colinesterasa, por lo cual se ejecutaron las medidas de reanimación cardiopulmonar.
A las 96 horas el paciente estuvo consciente (Figura 2) pero mostró arreflexia pupilar leve en el ojo izquierdo; adicionalmente, al examen clínico el canino mostró un leve letargo, apatía y hemiparesia ambulatoria derecha, con hiporreflexia espinal en miembro anterior derecho (MAD) y miembro posterior derecho (MPD), pero con normorreflexia espinal de miembros izquierdos, panículo normal, perineal normal, propiocepción disminuida en MPD (los demás miembros normales), reflejo de Babinski negativo, corrección postural negativo, reflejo flexor normal y en pares craneales el paciente presenta hiporreflexia pupilar izquierda, demás reflejos en pares craneales normales, sin resistencia a mover extender o flexionar el cuello.

FIGURA 2 Paciente en estado de conciencia, con dificultad locomotriz, pero con respuesta al medio, consumiendo líquidos y alimentos a voluntad.
Siete días después de la hospitalización el paciente se dió de alta continua con arreflexia del reflejo pupilar izquierdo, completamente consciente, respondiendo a estímulos y con desplazamiento normal (Figura 3).
DISCUSIÓN
Las intoxicaciones con inhibidores de la acetilcolinesterasa han sido ampliamente descritas en medicina humana pues se consideran un tipo de intoxicación suicida (Córdoba 2001, Liddle et al. 1979); para el caso de animales, se describen como accidentales o iatrogénicas (Radhey 2010). Sin embargo, han sido mayormente descritas las intoxicaciones por inhibidores irreversibles de la acetilcolinesterasa, como metrifonato, coumafos, diclórvos, diazinón, clorpirifos, etc. Por el contrario, las intoxicaciones por inhibidores reversibles son menos frecuentes, debido a que son productos menos tóxicos que sus similares organofosforados; ahora bien, cuando se presentan, los productos más descritos han sido bendiocarb, aldicarb y propoxur (Ferré et al. 2015), su acción menos tóxica posiblemente se debe a que su inhibición es reversible con un efecto tóxico menos severo y más pasajero (Botana 2016; Molina 2016; Sumano y Ocampo 2006). No obstante, en el presente caso, donde un carbamato (metomilo) fue el agente tóxico, este resultó comportarse como altamente tóxico para el paciente.
Al respecto, los perros de la raza pastor collie presentan particularidades genéticas, en especial la expresión del gen MDR-1 (Correa-Salgado y Castaño 2014) que pudiera explicar la severidad del cuadro clínico ocurrido en el presente caso. En este sentido, ya que los signos nerviosos son fácilmente identificables resultan ser, para muchos autores, los determinantes en la supervivencia del paciente (Lotti y Moretto 2006) y aunque la inhibición de la acetilcolinesterasa siempre es de tipo periférica, el ingreso al sistema nervioso central (SNC) es una variable importante para discutir en el caso de la raza pastor collie, la cual posee una mutación en el mencionado gen MDR-1 que ocasiona alteración en la glicoproteína P (Gp-P). Esta mutación, localizada en el cromosoma 14, consiste en una pérdida de 4 pares de nucleótidos del ADN en una región codificante del gen, lo que hace que se produzca un cambio en el cuadro de lectura del ARN mensajero y que aparezca una señal de fin muy prematura, con lo que no se sintetiza la Gp-P, sino una proteína mucho más corta y no funcional. Esta alteración permite que muchos fármacos logren atravesar la barrera hematoencefálica (Correa-Salgado y Castaño 2014) que puede ser la posible causa de los severos síntomas de intoxicación en este paciente.
El metomilo (N-(metilcarbamoiloxi) tioacetimidato de S-metilo) es un carbamato que tiene como mecanismo de acción la inhibición reversible de la acetilcolinesterasa (Linddle et al. 1979; Salcedo y Melo 2005), presenta una DL50 oral de 23 mg/kg (en rata), 17 mg/kg en promedio (Liddle et al. 1979) y una DL50 tópica de 1080 mg/kg. Por su parte, la DT50 para animales es de 15,5 mg/kg en promedio (Salcedo y Melo 2005). Se requiere de 0-5 mg/kg para causar signos tóxicos en animales y en personas (MinSalud 1992), y aunque el fabricante considera que es un insecticida ligeramente tóxico (categoría IV), con DL50 mayor a 500 mg/kg, los estudios realizados por Salcedo y Melo (2005) en la región del Putumayo (Colombia) lo describen como un producto extremadamente tóxico (categoría I), que representa en esta zona del país 7,08% de las intoxicaciones en humanos. Como se ha mencionado, este carbamato es usado frecuentemente en Colombia para el control de plagas en cultivos agrícolas, así como en el control de insectos en hogares, por lo cual su exposición es frecuente no solo para seres humanos, sino también para animales domésticos.
Como se ha descrito anteriormente, el metomilo es un carbamato inhibidor reversible de la acetilcolinesterasa (Vale y Lotti 2015; Wismer y Means 2012), lo cual ocasiona una acumulación de la acetilcolina en los receptores muscarínicos y nicotínicos, provocando con ello los síndromes colinérgicos (Tabla 3). En este sentido, la gravedad de la intoxicación por un carbamato no solo depende de la magnitud de la exposición sino del tipo de compuesto; en este orden de ideas, la diferencia entre metomilo con respecto a propoxur, bendiocarb y aldicarb (Eddleston et al. 2010, 2012) es alta, pues el primero se considera un producto extremadamente tóxico -categoría I- (Wismer y Means 2012), mientras que los otros tres son categorizados como ligeramente tóxicos -categoría III- (Fernández et al. 2010).
TABLA 3 Síndromes característicos de la intoxicación por inhibidores del acetilconesterasa en caninos.
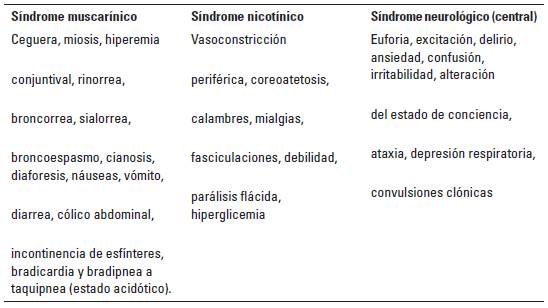
En relación con los síndromes colinérgicos descritos para el caso de intoxicación por inhibidores, el paciente ingresó con síndrome neurológico compuesto por excitación, delirio, ataxia y convulsiones de tipo clónico tónicas, similar a las descripciones de Vale y Lotti (2015) y Fernández et al. (2010); además, presentaba alteraciones muscarínicas clásicas como miosis puntiforme, sialorrea y emesis (Wismer y Means 2012; Vale y Lotti 2015), las mucosas, en vez de cianosis, se observaron hiperemicas, sin relajación de esfínter ni signos de dolor abdominal. De otra parte, la frecuencia cardíaca difirió de lo descrito por Restrepo (2012) en un paciente taquicardico y taquipneico; la taquipnea puede ser indicativa de cuadro de acidosis metabólica como lo describen algunos autores como signo clásico (Del Riego y Flores 2010), lo cual es bien descrito por la literatura para los cuadros de intoxicación tanto de organofosforados como de carbamatos (Ferré et al. 2015). Ahora bien, es importante resaltar que la miosis puntiforme, con más del 44% de los casos, es el síntoma que más se describe en los casos de intoxicación con organofosforados y carbamatos (Hirschberg y Lerman 1984); aún más, en otros estudios la miosis alcanzó hasta el 82% de los casos (Bardin et al. 1987; Lee et al. 2011), lo cual es muy importante a la hora de reconocer este tipo de intoxicaciones en caninos. Por su parte, la presencia de vómito se ha descrito también con frecuencia en el cuadro agudo (Vale y Lotti 2015) así como en el presente caso. De otra parte, algunos autores describen la presencia de convulsiones clónicas como un signo frecuente en la intoxicación por inhibidores de acetilcolinesterasa (Molina y Duque 2016; Lee et al. 2011). A su vez, es probable que la taquicardia sinusal se presente en algunos pacientes (Fikes 1990), pero es más frecuente la bradicardia debido a los efectos muscarínicos (Fikes 1990; Wismer y Means 2012).
Existen otros efectos descritos posteriormente como: diarrea, tenesmo, incontinencia, ataxia y delirio, bloqueo auriculoventricular, cambios S-T o alcanzar el punto máximo de ondas T y prolongación del intervalo QT, las cuales con frecuencia causan la muerte del paciente (Saadeh et al. 1997); para el presente caso solo fueron evidentes la presencia de incontinencia, ataxia y delirio.
Por otro lado, con frecuencia los pacientes intoxicados con carbamatos pueden morir por insuficiencia respiratoria (Hirschberg y Lerman 1984), en especial en intoxicaciones severas. Para el presente caso se presentó como un cuadro de tipo intermedio 48 horas después de la hospitalización, cuando el paciente presentó cuadro de paro cardiorrespiratorio, por lo cual se requirieron maniobras de reanimación.
Ahora bien, la triada de muscarínico, nicotínico y sistema nervioso central (SNC) es descrita frecuentemente (Finkelstein et al. 1989) con síntomas severos, debido a los cuales los pacientes requieren ventilación de tipo mecánica; en el presente caso, aunque se presentaron síntomas de los tres síndromes, el paciente permaneció estable, exceptuando el día del paro respiratorio el cual se logró superar con maniobras de reanimación. Una de las características del síndrome neurológico es el fenómeno de hipotermia (Tsao et al. 1990), ausente en el presente caso ya que el canino mostró temperatura normal.
Con respecto a la presencia de convulsiones en los pacientes intoxicados con organofosforados y carbamatos, estas son atribuibles a la inhibición de la acetilcolinesterasa (Wismer y Means 2012) en el SNC; por su parte, Lipp (1973) indicó que puede ser debido a la alteración del ácido gamma-aminobutírico (GABA), lo que explica la respuesta positiva al uso de benzodiacepinas para su control. No obstante, lo anterior difiere con lo encontrado en el presente caso, en el cual únicamente el uso de barbitúricos como el pentobarbital garantizó la ausencia de los signos convulsivos. Al respecto, las convulsiones presentes en la intoxicación por metomilo son de tipo opsoclono (De Bleecker 1992), en la cual hay mioclonos combinado con movimientos oculares, característica ausente en el presente caso donde solo se presentaron reacciones clónicas.
En las intoxicaciones por organofosforados es frecuente encontrar que en promedio 48 horas después de la fase aguda se presente un síndrome intermedio, el cual se caracteriza por una recaída después de la aparente resolución de los síntomas colinérgicos. Este síndrome se destaca por la parálisis muscular que afecta particularmente músculos de las extremidades superiores, flexores del cuello y cráneo (Singh et al. 2000), situación que fue evidente en el paciente del presente caso; no obstante, difiere con las descripciones hechas por otros autores en las cuales se indica que el síndrome intermedio solo pasa en pacientes intoxicados con organofosforados y no con carbamatos (De Bleecker 1992; Karalliedde et al. 2006; Jayawardane et al. 2009; Abdollahi y Karami-Mohajeri 2012). Por su parte, Tinson et al. (2017) describieron el caso de un labrador retriver intoxicado con methiocarb, el cual demostró la presencia de un síndrome intermedio. Aunque la etiología del síndrome no es clara, se presume que se trata de la inhibición irreversible del acetilcolinesterasa y la acumulación del acetilcolina (ACh) en la placa neuromuscular (Karalliedde et al. 2006; Avasthi y Singh 2000; Dandapani et al. 2003; John et al. 2003), lo cual tiene una gran relevancia pues se ha descrito que en mayor medida el síndrome intermedio afecta tardíamente a los músculos respiratorios, por ende, se describe la presencia de parálisis respiratoria mortal (Singh et al. 2000).
Dentro de las descripciones de las alteraciones neurológicas algunos autores han documentado la presencia de una neuropatía periférica (Lotti y Moretto 2006) posterior al cuadro agudo, que fue evidente en el presente caso, pues el paciente, al trascurrir los días, mostró signos de parálisis palpebral, pérdida de movilidad en miembros anteriores y posteriores. Este cuadro se debe a la fosforilación y desgaste de enzimas de tipo esterasa (Casida et al. 2008; Wijeyesakere y Richardson 2010); al presentarse esta neuropatía esterasa (NET), donde hay un envejecimiento y perdida de la función enzimática, se pueden ver alteraciones en la homeostasis de fosfolípidos de membrana y funciones del retículo endoplasmático, incluyendo cambios en el transporte axonal e interacciones gliales-axonales (Glynn 2006). La degeneración axonal se produce por la desmielinización de fibras nerviosas (Johnson 1969) y aunque en particular este síndrome solo se ha descrito en la intoxicación con metamidofos (Senanayake y Johnson 1982), los signos clínicos posteriores presentados en el presente caso por el pastor colie pueden ser indicativos de que este proceso se puede presentar también en la intoxicación con carbamato, situación que en general es poco frecuente.
Por su parte, la neuropatía se da por degeneración de los axones y si bien no es clara su fisiopatología, comúnmente se presenta entre una a cuatro semanas después de la exposición (Lotti y Moretto 2005), tiempo durante el cual es posible identificar signos como ataxia, incoordinación, hiporreflexia, parestesia, paraplejía y cuadriplejia, algunos de los cuales fueron evidentes en el presente caso, correspondiendo con lo que descrito por Lotti y Moretto (2005).
En pacientes humanos se ha indicado que estas alteraciones pueden afectar el comportamiento, produciendo variaciones neuropsicológicas (Sánchez-Santed et al. 2004; McConnell et al. 1994; Miranda et al. 2004), con pérdida de capacidad cognoscitiva (Delgado et al. 2004); hasta el momento, esta información no está disponible para la especie canina.
En cuanto al diagnóstico de la intoxicación con metomilo en la especie canina y en otras especies, este se basa en gran medida en el historial (Brahmi et al. 2005; Makrides et al. 2005); así, en el hemograma los pacientes pueden mostrar algo de leucocitosis, hiperglicemia y cuerpos cetónicos (Wismer y Means 2012), variables que no se observaron en este caso. La hipoglicemia (44 mg/dl) fue la única variable descrita en la literatura que correspondió con el cuadro, pues el hemograma no mostró alteraciones significativas para la especie canina, aunque algunos autores como Vale y Lotti (2015) describen que hay eritroctopenia y en algunos estudios se ha descrito que la intoxicación con metomilo causa lisis de los globulos rojos, por lo cual, pueden observarse pacientes con un número bajo de eritrocitos, bajo hematocrito y hemoglobina, como lo describe Garg et al. (2009) en un estudio para evaluar la efectividad del uso de vitamina E como hemoprotector; sin embargo, en el presente caso no hubo evidencia de cambios en línea roja. En cuanto a los datos evaluados en la química sanguínea como creatinina y ALT los valores fueron normales para la especie canina (Tabla 2).
En el medio colombiano, la forma más frecuente de diagnóstico para la especie canina es por la amnesis y la identificación de los síntomas (miosis, fasciculaciones, sialorrea, tremores); pero cabe indicar que el método más acertado es la medición de butirilcolinesterasa (BuChE) y de acetil-colinesterasa (AChE) (Ferré et al. 2015; Pérez et al. 2012), ambos son sustitutos de la actividad de AChE en el SNC y periféricos del sistema nervioso. La actividad de la AChE de eritrocitos es invariablemente más específica que la actividad de la BuChE en plasma como marcador de exposición a insecticidas organofosforados, aunque algunos insecticidas deprimen la actividad de la BuChE en plasma en mayor grado que la actividad de la colinesterasa eritrocítica (Vale y Lotti 2015).
En cuanto al tratamiento, este debe abordarse como una emergencia, por ello, el paciente debe ser sometido a un lavado gástrico si la ingestión ocurrió en un lapso menor a una hora; en caso contrario, como lo describió Lee (2013), debe evitarse al igual que el uso de carbón activado, el cual solo debe ser suministrado en los primeros 30 minutos después de la ingestión (Lee 2013), si bien es de notar que no está comprobada su eficacia (Li et al. 2009). No obstante, en el presente caso se hizo lavado gástrico y se suministró carbón activado ya que, si bien se sabía que el tiempo durante el cual estuvo expuesto el canino al metomilo fue de 120 minutos, se desconocía el momento exacto del consumo.
La administración de atropina, oximas y diazepam en el tratamiento por intoxicación con organofosforados se ha descrito por varios autores (Blain 2011; Brittain et al. 2016) quienes concluyen que el uso de diazepam puede ser beneficiosos al disminuir la ansiedad, la inquietud, las fasciculaciones, suprimir las convulsiones y reducir la morbilidad-mortalidad cuando se usa en conjunto con otros fármacos. A su vez, la atropina es un antagonista competitivo de la ACh en el receptor muscarínico cuya dosis recomendada es de 0,02-0,04 mg/kg vía subcutánea o intramuscular (Wismer y Means 2012; Vale y Lotti 2015; Brittain et al. 2016) y debe repetirse cada treinta minutos hasta llegar a atropinizar el paciente (Wismer y Means 2012). En el presente caso la dosis fue de 0,04 mg/kg hasta llevar al paciente a los signos anticolinérgicos xerostomía y midriasis, pero la respuesta antagonista no logró superar los síndromes colinérgicos, situación que, según la literatura, debería haberse logrado únicamente con el uso de la atropina (Wismer y Means 2012); por el contrario, en el presente caso los signos muscarínicos, nicotínicos, y en especial los nerviosos, continuaron tras el uso de repetidas dosis de atropina, con la que únicamente se logró disminuir la miosis, la sialorrea y la emesis.
Ahora bien, es importante documentar que el uso de oximas está bien descrito en la literatura (Wismer y Means 2012), en especial en casos relacionados con humanos cuando se trata de intoxicaciones por organofosforados (Bohórquez et al. 2012).
No obstante, su uso en el tratamiento de la intoxicación por inhibidores reversibles de la AChE es discutido, debido a que las oximas, o reactivadores de la AChE, permiten que la acetilcolina (ACh) sea hidrolizada y se reanude la normalidad en la neurotransmisión colinérgica (Vale y Lotti 2015); por esta razón, si hablamos de carbamatos se debe suponer que su acción AChE es reversible, es decir, debería pasar su acción una vez termine su vida media sanguínea. En general, se sostiene que los carbamatos no requieren el uso de oximas (Wismer y Means 2012), pero en el presente caso los efectos tóxicos fueron tan severos y la eficiencia del antagonista fue tan baja, que se requirió su uso. Las descripciones de los efectos benéficos de las oximas indican que están confinados a los receptores nicotínicos periféricos y al sistema nervioso central (Sakurada et al. 2003), como en el caso específico de la pralidoxima, la cual atraviesa la barrera hematoencefálica, lo que reduce sustancialmente las alteraciones del SNC (Willems et al. 1993).
La dosis de pralidoxima descrita para la especie canina es 20 mg/kg, intramuscular o endovenosa, cada 12 horas (Wismer y Means 2012; Fikes 1990, Plumb 2018; Papich 2016), otros autores sugieren 10-15 mg/kg intramuscular, cada 8 horas (Plumb 2018; Papich 2016); por su parte, el estándar para el uso de pralidoxima según la organización mundial de la salud debe ser de 30 mg/kg (Buckley et al. 2011). La dosis del presente caso correspondió a 10 mg/kg cada 8 horas, similar a las descripciones documentadas por Papich (2016) y Plumb (2018), dosis que mostró efectividad al revertir los síntomas neurológicos luego de 24 horas de iniciado el tratamiento debido a que con ella se alcanzaron concentraciones plasmáticas de 4 mg/l (Sundwall 1961), con un volumen de distribución aparente de 67,5 l, lo que permite ingresar al SNC con facilidad, y una biodisponibilidad de 1,48%, que es baja; esta puede ser una de las razones por la cual varios autores sugieren dosis mayores a la descrita en el caso (Willems et al. 1993) para obtener el efecto AChE.
Por otra parte, debe indicarse que algunos autores describen que el uso de pralidoxima en el manejo de intoxicaciones por carbamatos aumentó su toxicidad (Sanderson 1961; Harris et al. 1989), mientras que otros indican que tienen un efecto benéfico (Farago 1969; Mercurio-Zappala et al. 2007). Entre tanto, lo que se ha descrito en la mayoría de los reportes en humanos es que no existe evidencia científica suficiente para recomendar o prohibir el uso de pralidoxima en casos de intoxicación grave con insecticidas carbamatos (Burgess et al. 1994; Nelson et al. 2001).
Existe otra oxima llamada obidoxima cuyo uso está descrito en pacientes humanos intoxicados por organofosforados (Sidell et al. 1972; Bohórquez et al. 2012), en cuanto a caninos, la dosis descrita es de 10 mg/kg (Flores et al. 1982) pero existen otros autores que describen dosis endovenosas un poco menores de 3-6 mg/kg cada 8 horas (Córdoba 2001; Thiermann et al. 2010; Eyer et al. 2009). Es importante tener presente el uso de esta oxima como otra alternativa en el tratamiento por intoxicación por organofosforados o carbamatos en pacientes con intoxicaciones complicadas o de baja respuesta al uso de antagonistas como la atropina (Bohórquez et al. 2012).
Ahora bien, el uso de otros fármacos es importante en el tratamiento de las intoxicaciones por organofosforados y carbamatos, en especial aquellos que tiene efecto sobre el SNC, principalmente para el control de las convulsiones (Sellströom 1992); al respecto, el diazepam es el utilizado con mayor frecuencia (Marrs 2003) y aunque sus cualidades farmacodinámicas lo convierten en el fármaco de elección (Bokonjic et al. 1987), en el presente caso su respuesta fue nula, similar a otras descripciones en intoxicaciones en perros pastores, donde el uso de diazepam tuvo poca efectividad para el control de convulsiones después una intoxicación con metrifonato (Molina y Duque 2016). Así pues, en el presente caso el diazepam no pudo controlar las convulsiones, excitación y delirio del canino, ni la hiperreflexia, fasciculaciones y rigidez de los miembros, por ende, se recurrió al uso de barbitúricos como pentobarbital, un agonista del GABA más potente que el diazepam (Johnson et al. 2000). La dosis de pentobarbital para caninos es de 3-10 mg/kg, endovenosa, cada 12 horas (Plumb 2018), en el paciente del presente caso se usó una posología de 12 mg/kg, cada 12 horas, la cual ha sido efectiva para realizar terapia de sueño en pacientes bajo efecto convulsivo, como la descrita por Molina (2014) en intoxicaciones por fluoracetato de sodio, para las se requiere terapia anticonvulsiva de mayor potencia.
Finalmente, con relación a este caso en particular, cabe resaltar que las descripciones de varios autores frente al metomilo indican que los síntomas se resuelven rápidamente en pocas horas sin necesidad de llegar a la atropinización (Coleman et al. 1990; Testud et al. 1999); no obstante, lo descrito en este caso fue completamente diferente, ya que el paciente mostró un cuadro de intoxicación grave y aunque se ha descrito que la intoxicación con metomilo no deja graves secuelas, la intoxicación aguda si es de relevancia (Driskell et al. 1991; Cable y Doherty 1999), esto, teniendo en cuenta además que, teóricamente, un carbamato causa menos polineuropatía que los organofosforados (Yang et al. 2000). Por último, aunque similar a la presente descripción del pastor colie, Hu et al. (2010) indicaron que el metomilo también causa neuropatía axonal.