INTRODUÇÃO
Nowinsky, em 1876, e posteriormente Sticker, em 1906, mostraram que tumores venéreos de cães eram transmissíveis, através de procedimentos experimentais envolvendo transplantes tumorais (Ganguly et al. 2016). O Tumor Venéreo Transmissível Canino (TVTC) integra um pequeno e fascinante grupo de canceres transmissíveis conhecidos na natureza (Metzger et al. 2016). Propaga-se naturalmente entre os cães pela transferência alogênica de células tumorais durante o coito (Ganguly et al. 2016; Murgia et al. 2006; Strakova y Murchison 2014), podendo ainda ser encontrado em ocorrência extragenital devido aos hábitos sociais de interação canina, como cheirar, lamber, arranhar e morder (Rocha et al. 2014).
Acredita-se que o TVTC surgiu pela transformação de células somáticas em um único ancestral canino há aproximadamente 11.000 anos e, posteriormente, sofreu adaptações para se tornar transmissível e sobreviver como um aloenxerto entre as gerações (Strakova y Murchison 2015). Para isso, há a hipótese de que as células do tumor não expressam moléculas do complexo principal de histocompati-bilidade (MHC), como um mecanismo de escape da rejeição imunológica. É um tumor de células redondas, de origem mieloide (Ganguly et al. 2016), classificado conforme o tipo citomorfológico plasmocitóide, linfocitóide e misto (Amaral et al. 2004; Flórez et al. 2012) que mostra variação no comportamento biológico e na resposta quimioterápica (Duzanski et al. 2017).
Apesar de dificilmente o tumor implicar na morte do cão, possui potencial maligno e complicações como metástases por vezes surgem comprometendo seriamente a saúde e a qualidade de vida do animal. Neste estudo, relata-se as manifestações clínicas de um caso de TVTC misto com metástase esplênica e a resistência tumoral ao tratamento quimioterápico com sulfato de vincristina, considerados eventos incomuns. Buscou-se discutir os principais mecanismos associados ao comportamento biológico agressivo do tumor.
Histórico do caso e achados
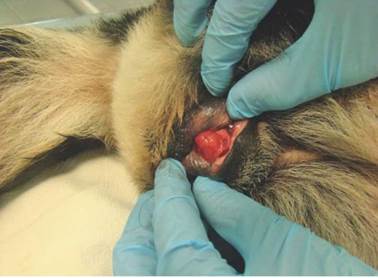
Uma fêmea canina da raça Australian Cattle Dog, não castrada, 14 kg e idade de cinco anos, foi encaminhada ao Hospital Veterinário da Faculdade de Medicina Veterinária e Zootecnia, da Universidade Estadual Paulista (UNESP) de Botucatu, apresentando histórico de secreção vaginal serosanguinolento, lambedura vulvar, inapetência e emagrecimento progressivo, com dois meses de evolução. O proprietário relatou que a cadela estava no cio e havia escapado para as ruas há alguns meses antes de apresentar os sinais. No exame físico foi observado temperatura retal de 39,3°C, leve desidratação e aumento de volume abdominal que na palpação revelou esplenomegalia. O hemograma não mostrou alterações além de uma discreta linfopenia (900 linfócitos/mm3). Ao exame específico apresentou massa de natureza vegetante, multilobulada, friável, indolor e de coloração avermelhada no vestíbulo vaginal (Figura 1). No exame citológico aspirativo por agulha fina (CAAF) da massa genital foi observado celularidade acentuada composta por células redondas individualizadas, de tamanhos variáveis entre 13 a 24 µm, citoplasma com contornos bem delimitados e distintos, discretamente basofílico, contendo múltiplos vacúolos claros dispersos, núcleo redondo com cromatina grosseira e nucléolo evidente. Foram observadas alterações malignas como anisocitose, anisocariose, macrocariose, hipercromasia, células fantasma e em raquete, além de figuras de mitose (Figura 2). Fragmentos do tumor de aproximadamente 1,5cm3 também foram coletados por biópsia incisional para posterior análise histológica, imunoistoquímica e citogenética que vieram confirmar o diagnóstico de TVTC.
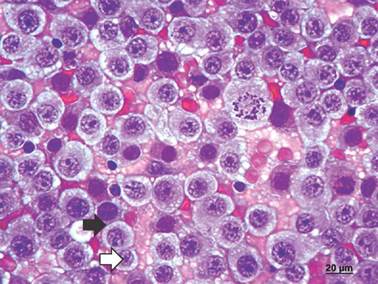
FIGURA 2 Citologia aspirativa por agulha fina no diagnóstico de TVTC. Fenótipo linfocitóide (seta preta). Oncócitos redondos, com núcleo tendendo a centralização. Fenótipo plasmocitóide (seta branca). Oncócitos ovalados, com núcleo excêntrico. Célula fantasma, células em raquete, padrão grosseiro da cromatina, ranhura nuclear e mitose indicando fortes critérios de malignidade celular. Coloração pelo papanicolau, 630x.
A cadela foi ainda submetida ao exame ultrassonográfico do abdome que mostrou uma alteração no parênquima esplênico, com presença de estrutura heterogênea predominantemente ecogênica com áreas cavitárias em permeio causando deslocando da cápsula e alteração do contorno normal do órgão e útero apresentando paredes irregulares e acentuadamente espessadas, sugerindo processo neoplásico com possível metástase no baço. No exame de Doppler colorido, tanto o baço como o útero apresentaram evidente vascularização (Figura 3). Inicialmente o tratamento instituído foi a quimioterapia com sulfato de vincristina na dose de 0,75 mg/m2, uma vez por semana. Contudo, tanto o tumor genital como a neoformação esplênica não mostraram resposta à ação da vincristina após quatro sessões seguidas de tratamento, sendo recomendada a realização de ovariohisterectomia e esplenectomia terapêutica. A análise histopatológica de amostras do baço excisionado confirmou a metástase do TVTC genital. Depois de 10 dias da cirurgia a cadela também recebeu doxorrubicina intravenosa, na dose de 30mg/m2, a cada 21 dias, totalizando duas aplicações, como forma de prevenir o risco de recorrência pós-operatória. Por fim, a cadela recebeu monitoramento clínico durante 12 meses e não apresentou recidiva do tumor.
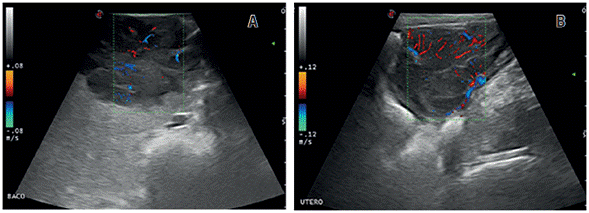
FIGURA 3 Imagem ultrassonográfica do abdômen canino. (A) Parênquima esplênico alterado, com presença de estrutura heterogênea predominantemente ecogênica com áreas cavitárias em permeio, causando deslocando cápsula e alteração do contorno normal do órgão. (B) Útero apresentando paredes irregulares e acentuadamente espessadas. Evidente vascularização ao exame de Doppler colorido sugerindo processo neoplásico.
Análise histológica
Em relação à fase evolutiva do TVTC, Stockmann et al. (2011) descrevem que o tumor pode ser classificado em fase de progressão (alta celularidade imersa em delicado estroma), fase de regressão inicial (evidência moderada de tecido estromal substituindo o parênquima tumoral) efase de regressão final (colapso do parênquima tumoral e intensa proliferação de tecido estromal). Neste estudo, a avaliação histológica do tumor genital mostrou um arranjo de células redondas sustentadas por um escasso tecido estromal, caracterizando a fase clínica de progressão do TVTC. Os oncócitos apresentaram núcleos redondos e hipercromáticos, nucléolo proeminente, citoplasma granular, levemente basofílico e vacuolizado. Infiltrado inflamatório e figuras mitóticas foram observados (Figura 4). Também no útero foi evidenciado proliferação neoplásica de células redondas, de aspecto nodular, mal delimitada, em lúmen de corno uterino que por vezes se estendia ao endométrio. As células estavam dispostas em mantos entremeadas a um estroma fibrocolagenoso, formando septos delicados. O citoplasma das células era basofílico e vacuolizado, e o núcleo redondo com cromatina granular.
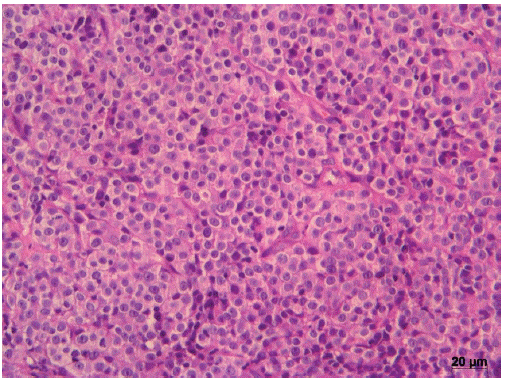
FIGURA 4 Fase de progressão doTVTC na análise hitológica. Alta celularidade disposta em cordões imersos em delicado estroma. Coloração pelo H.E, 200x.
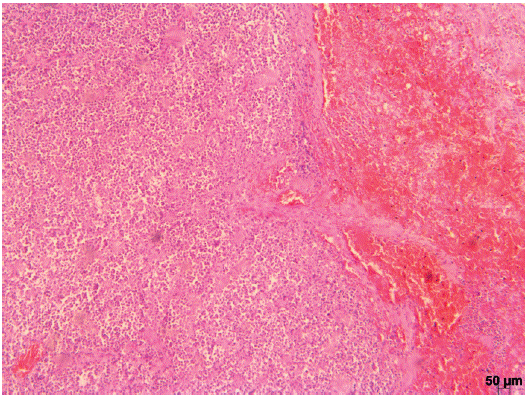
Quanto à análise do baço foi evidenciada proliferação neoplásica de células redondas, infiltrativa, substituindo e comprimindo o tecido esplênico que exibia acentuada quantidade de vasos congestos e perda de folículos linfóides. As células estavam permeadas por delicado estroma fibrocolagenoso. O citoplasma era basofiílico e por vezes vacuolizado, núcleo redondo com cromatina densa ou grosseira e nucléolo indistinto. Havia áreas de discreta hemorragia associada à neoplasia e discreto infiltrado inflamatório neutrofílico multifocal (Figura 5).
Cultura primária de TVTC
Os isolamentos das culturas do TVTC seguiram conforme descrito em estudos prévios (Ballestero et al. 2018; Flórez et al. 2016). As amostras tumorais foram mantidas em solução de tripsina (TrypLE Select - Invitrogen), a 37,5°C por 60 minutos no homogenizador magnético. Após centrifugação e descarte do sobrenadante, o sedimento celular foi ressuspendido com 5 mL de meio de cultivo [solução DMEM alta glicose (Gibco), suplementada com 10% de soro fetal bovino (Gibco), 100U/mL de penicilina, 100mg/mL de estreptomicina (Gibco), e 3µg/mL de Anfotericina B (Gibco)], e acondicionado em frascos para cultura celular de 25 cm2 (Sarstedt). Por fim, as amostras foram incubadas em estufa de CO2 a 5%, umidade 95% e temperatura de 37,5°C. A viabilidade e concentração celular foram determinadas pelo teste de exclusão com azul de tripan, em câmara de NeuBauer. Após três passagens de cultura, as amostras foram submetidas à análise citogenética que revelou um número de 59 cromossomos nas células tumorais.
Imunoistoquímica
Cortes histológicos seriados de 3µm foram estendidos em lâminas (Slidetech Plus Novocastra® Newcastle UK). O material foi desparafinizado em xilol e hidratado em álcool etílico em concentrações decrescentes. O bloqueio da peroxidase endógena foi alcançado em solução de peróxido de hidrogênio a 3% diluído em metanol; para a recuperação antigênica as lâminas imersas em tampão citrato 10mM, pH 6 foram levadas ao forno micro-ondas por 15 minutos; e para o bloqueio das reações inespecíficas foi utilizado leite em pó a 5%.
Em seguida as amostras histológicas foram incubadas com os anticorpos (anti-MHC I DG-H58A, monoclonal, 1:100 e anti-MHCII DG-TH14B, policlonal, 1:200) em câmara úmida overnight, a 4°C. O sistema NovolinkTM (Leica Biosystems Newcastle Ltd) foi utilizado para imuno-marcação de moléculas de MHC classe I, e o sistema EnvisionTM (Dako) para imunomarcação de moléculas de MHC classe II. A revelação foi feita com solução cromógena Diaminobenzidina (DAB, 3.3'-Dako) e a contra-coloração com Hematoxilina de Meyer. Como controle positivo da reação imune foi utilizado amostra tecidual de linfonodo de cão saudável. Quanto ao controle negativo, o anticorpo foi substituído por solução tampão de Tris-HCl pH7,4.
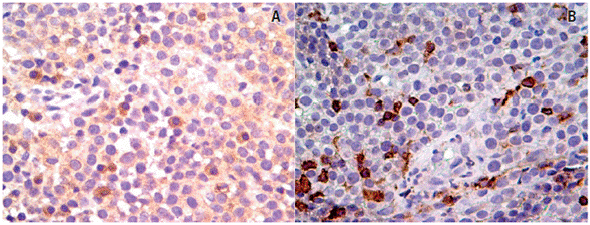
As reações imunes foram avaliadas de forma semi-quantitativa, sendo contadas 100 células por lâmina. As imagens foram capturadas no microscópio óptico Carl zeiss, LAb A1, Germany, nas objetivas 10X e 40X, utilizando o software Axio-Vision 4.8. Em todos os casos a avaliação foi realizada de forma independente por dois patologistas e os dados apresentados com a média das observações, obtendo uma marcação para o MHC (4,4 ± 2% classe I e 11 ± 4,1% classe II) comforme os descrito por Hsiao et al. (2008) (Figura 6).
DISCUSSÃO
O TVTC é comumente diagnosticado em cães sexualmente ativos com idade entre 2 e 8 anos, e sem raça definida (SRD). Acomete naturalmente ambos os sexos, prevalecendo em países tropicais e subtropicais, e em locais com grandes populações de cães nas ruas (Strakova y Murchison 2014). Há registros bem documentados do tumor em praticamente todo o mundo (Ganguly et al. 2016), representando os principais tumores que acometem os cães (Horta et al. 2012; Sousa et al. 2000).
Amaral et al. (2004) observou que, entre o período de 1994 e 2003, o TVTC foi a segunda neoplasia mais diagnosticada em cães na região de Botucatu, Brasil. A falta de rigor nas políticas públicas de controle epidemiológico de cães errantes, somada ao não impedimento dos cães aos hábitos de vida livre favorecem a transmissão e a disseminação do tumor. No caso aqui em discussão, segundo o relato do tutor, a cadela escapou para as ruas no período de cio antes de apresentar os sintomas da doença. A transmissão do TVTC ocorre por contato direto de um cão doente com outro sadio pelo coito, lambedura, farejo e mordedura (Rocha et al. 2014), sendo que a célula tumoral se propaga naturalmente entre os indivíduos como uma linhagem celular contagiosa (Strakova y Murchison 2015). O coito é o principal modo de transmissão e nesse caso, a genitália é o local mais comumente afetado (Ganguly et al. 2016; Strakova y Murchison 2014).
Experimentalmente o TVTC parece evoluir conforme o estágio inmunologico. Apresenta uma fase de progressão, seguida de estabilização e por último uma fase de regressão, quando estabelecido em animais adultos e saudáveis (Chandler y Yang 1981; Chu et al. 2001). A iniciação e progressão do tumor parecem ocorrer principalmente pela evasão das células tumorais aos mecanismos de imunovigilância relacionados à via do MHC (Hsiao et al. 2002), além da conversão de seu microambiente para um estado de imunossupressão (Hsiao et al. 2004; Liao et al. 2003), enquanto a regressão tumoral é associada ao infiltrado linfocitário (Chandler y Yang 1981; Hsiao et al. 2004; Pérez et al. 1998), expressão de moléculas do MHC classe I e II (Hsiao et al. 2002; Hsiao et al. 2008) e apoptose das células tumorais (Santos et al. 2008).
Neste estudo a análise histologica do tumor mostrou alta celularidade imersa em delicado tecido estromal, caracterizando a fase de progressão (Figura 4). A qualidade e a quantidade de estroma observado nos TVTCs naturais classificados histologicamente em fase de progressão foi diferente daqueles classificados em fase de regressão, que mostraram depósito expressivo de colágeno em substituição ao parênquima tumoral colapsado (Ballestero et al. 2018; Duzanski 2017). Foi observado também uma baixa expressão de moléculas de MHC (4,4 ± 2% classe I e 11 ± 4,1% classe II) na analise imunoistoquimica (Figura 6), corroborando com estudos experimentais que descrevem que aproximadamente 5% das células do TVTC expressam MHC I ou II durante a fase de progressão (Hsiao et al. 2002; Hsiao et al. 2008; Pérez et al. 1998).
O comportamento biológico do TVTC natural é incerto e diferente do tumor experimental. Embora uma fase de crescimento seguida de estabilização seja observada, a remissão espontânea em cães naturalmente acometidos pelo tumor não é documentada em estudos com acompanhamento clínico (Rogers 1997). Ainda, foi observada resistência quimioterápica no tumor classificado em fase de regressão (Ballestero et al. 2018).
Portanto, há controvérsia acerca da regressão espontânea. A resposta imune local em TVTCs naturais e os eventos da interação entre células tumorais e hospedeiras foram pouco estudados. Ainda não está claro o papel central das células imunes na evolução clínica do tumor natural e também não há um consenso sobre os princípios que explicam por que os tumores naturais tem um comportamento biológico diferente do tumor induzido experimentalmente, apesar da contínua ação do sistema imune (Duzanski 2017). Evidências crescentes têm mostrado que a resposta imune gerada pelo hospedeiro pode moldar a imunogenicidade do tumor ao longo do tempo, dando origem a variantes resistentes à pressão exercida pela imunovigilância, num processo descrito como imunoedição tumoral. Nesse processo as células tumorais continuam a se proliferar como células editadas, in-detectáveis pela imunidade antitumoral, podendo levar a malignidade do tumor (Dunn et al. 2004; Sengupta et al. 2010).
O efeito do microambiente tumoral sobre as características funcionais das células imunes e as mudanças no perfil biológico das células tumorais parecem influenciar o comportamento e o estágio do TVTC (Flórez et al. 2017). Foram descritos casos de metástases do TVTC em locais distantes como olhos, pele e tecido subcutáneo, tonsilas, cérebro, ossos, cavidades oral e nasal, glândula mamária, rins, baço, pâncreas, fígado, pulmão, ovários, testículos, embora sejam encontradas mais comumente nos linfonodos regionais e no períneo (Chikweto et al. 2013; Strakova y Murchison 2014). Uma vez que o MHC é fundamental na rejeição imunológica de cânceres transmissíveis (Murgia et al. 2006; Sengupta et al. 2010), a baixa expressão de moléculas do MHC I e II no tumor observada neste caso pode ter inibido o reconhecimento e a ação imune antitumoral, sendo determinante no momento da progressão do tumor e na formação de metástase para o baço. Além disso, fatores como microambiente tumoral e expressão gênica podem ter regulado o comportamento agressivo do TVTC (Ballestero et al. 2018).
O TVTC é classificado como plas-mocitóide, quando no mínimo 60% das células neoplásicas apresentam-se ovóides, com menor relação núcleo: citoplasma e núcleo excêntrico; linfocitóide, quando pelo menos 60% das células tumorais são arredondadas, mostram maior relação núcleo:citoplasma, núcleo redondo e central, assemelhando-se a linfócitos; ou misto, quando ambos os tipos celulares estão presentes (Amaral et al. 2004; Flórez et al. 2012). Neste estudo, a CAAF foi eficaz no diagnóstico do tumor e serviu para caracterizar o tipo citomorfológico neoplásico. O tumor genital mostrou celularidade mista entre os tipos celulares linfocitóide e plasmocitóide, sem que nenhum tipo citológico ultrapassasse 60% do total de oncócitos (Figura 2).
Estudos in vitro descrevem que tumores plasmocitóides possuem maior frequência de anormalidades nucleares e nucleolares, maiores índices mitóticos e de proliferação celular (marcador Ki-67), expressão de glicoproteína-P, além de menor quebra de DNA no teste do cometa. Acredita-se que este tipo é mais agressivo, e pode implicar maiores taxas de metástases e resistência à quimioterapia em comparação aos tumores linfocitóide e misto (Duzanski et al. 2017). De acordo com Simermann (2009), tumores plasmocitóide podem apresentar prolongamento no tempo de tratamento quimioterápico. Porém essa relação não tem sido sustentada por estudos clínicos que não encontraram nenhuma diferença entre os tipos citológicos do tumor e a resposta ao tratamento com sulfato de vincristina, assim como aos critérios de malignidade e metástases (Lima et al. 2013; Paranzini et al. 2015). Outros estudos mostraram ainda que tumores plasmoci-tóides apresentaram remissão completa com apenas três ou quatro sessões de quimioterapia com vincristina (Amaral et al. 2012; Duzanski 2017; Lima et al. 2013).
Neste estudo o TVTC de fenótipo celular misto não mostrou resposta à quimioterapia com vincristina na dose de 0,75 mg/ m2 após quatro sessões semanais seguidas de tratamento. Portanto, as observações dos estudos clínicos (Lima et al. 2013; Paranzini et al. 2015) somadas aos achados deste estudo levam a acreditar que fatores intrínsecos ao comportamento biológico do tumor, tais como quimioresistência e agressividade, não parecem estar associados unicamente ao tipo citológico do TVTC, sendo que são necessários estudos para melhor associar o subtipo tumoral ao seu comportamento biológico e estabelecer uma correlação positiva com o valor prognóstico. Apesar da população tumoral ser considerada sensível a vincristina (Calvert et al. 1982; Hantrakul et al. 2014), há resistência em alguns casos, que parece ocorrer devido à superexpressão de glicoproteína-P pelas células tumorais, uma molécula que age no efluxo da droga (Floréz et al. 2017). Além disso, as células imunes que integram o microambiente tumoral têm sido estudadas e podem exercer influência na resposta clínica ao tratamento (Ballestero et al. 2018). Outros mecanismos que se acredita estar relacionados ao comportamento maligno do tumor incluem mudanças em genes pró e anti-apoptótico da família BCL-2 e sistemas de reparo de DNA, associados à família TP53. Porém, este aspecto também foi pouco estudado no TVTC (Floréz et al. 2017).
A diferença de cariótipo entre as células normais do cão e as tumorais é bastante significativa. Enquanto no cão o cariótipo normal é de 78 cromossomos, dos quais 76 são acrocêntricos e um par sexual é metacêntrico (Ganguly et al. 2016), as células do TVTC exibem variação no número de cromossomos, entre 56 a 68 (Flórez et al. 2016), sendo que 15 ou 17 são metacêntricos e 42 ou 40 são acrocêntricos, e apesar disso a quantidade total de DNA permanece próxima do normal (Ganguly et al. 2016; Murgia et al. 2006; Strakova y Murchison 2015). Tais diferenças cromossômicas entre tumor e cão podem resultar de fusões equilibradas, que terminam em rearranjo de material genético (Murgia et al. 2006). Neste estudo, o genótipo tumoral não mostrou correlação com o genótipo do hospedeiro correspondente, sendo que caracterização citogenética do TVTC foi de 59 cromossomos. Isso demonstra que o TVTC é uma linhagem clonal de células cancerígenas transmitida em geração e não ocorre devido à transformação neoplásica das células somáticas do seu hospedeiro.
CONCLUSÃO
Neste estudo relatou-se um caso de tumor venéreo transmissível genital de fenótipo citológico misto com metástase para o baço e a resistência tumoral à quimioterapia com sulfato de vincristina. A associação dos dados clínicos, cito-histológico e imunoistoquímica possibilitou diagnosticar o TVTC metastático e em fase clínica de progressão. A baixa expressão de moléculas do MHC I e II no tumor pode ter colaborado no momento da progressão neoplásica por inibir mecanismos relacionados à rejeição imunológica. A cadela foi submetida à ovariohisterectomia e esplenectomia terapêutica e não apresentou recidiva do tumor após 12 meses de acompanhamento clínico.