INTRODUCCIÓN
Colombia es un país con gran biodiversidad animal, donde los mamíferos silvestres han alcanzado niveles importantes con respecto al panorama mundial (Rangel-Ch 2015); sin embargo, según un estudio de la Organización de las Naciones Unidas (2019) por el impacto de la actividad humana en la naturaleza, un promedio de alrededor del 25% de los animales están ahora en peligro de extinción, incluyendo a los mamíferos. Estas acciones antropogénicas han provocado un aumento en el ingreso de animales, sobre todo mamíferos, a centros de atención y valoración para su reintroducción en los ecosistemas (Schenk y Souza 2014).
Durante el cautiverio los protocolos de recuperación y prevención de enfermedades son puestos en acción para mantener la salud y bienestar animal. Entre ellos, el diagnóstico y control de parásitos gastrointestinales constituye una de las medidas realizadas por los centros de atención y valoración, debido a la fácil propagación e ingesta de agentes capaces de causar enfermedades intestinales con alta morbilidad y mortalidad en la población cautiva (Maesano et al. 2014). Las condiciones de cautiverio propician la permanencia en el hospedero debido a la autoinfección o reinfección cuando las condiciones y factores como la alimentación, manejo y presencia de hospederos intermediarios o vectores lo permiten (Acosta et al. 2015).
Los estudios en el ámbito de la sanidad animal de mamíferos silvestres cautivos o en libertad, se han enfocado principalmente en las enfermedades producidas por bacterias y virus (Llanos-Soto y González-Acuña 2019). Sin embargo, las enfermedades intestinales producidas por parásitos son más frecuentes debido a la alometría conductual de los mamíferos (Han et al. 2015). Además, este tipo de enfermedades se caracterizan por la pérdida de nutrientes, desnutrición y otras complicaciones que predisponen al animal a enfermedades fisiológicas, infecciosas y a microorganismos oportunistas (Aivelo y Norberg 2017).
Adicionalmente, los parásitos intestinales como factores influyentes en el deterioro de la salud animal y la extensión en el tiempo de recuperación para la reintroducción de los animales, están involucrados como posibles riesgos zoonóticos para el personal de los centros de atención y valoración encargados de su manipulación (Santos et al. 2015). Esta posibilidad aumenta en comunidades dedicadas a la caza y comercialización de estos animales.
Teniendo en cuenta los factores que predisponen una parasitosis y que en condiciones de cautiverio puede ser mortal para los animales, es importante que los centros de atención y valoración de fauna silvestre ofrezcan bienestar para el animal desde su ingreso hasta su reintroducción, y esto incluye métodos parasitológicos efectivos. El objetivo del presente estudio fue determinar la presencia de parásitos gastrointestinales en mamíferos silvestres del Centro de Atención y Valoración de Fauna silvestre del Centro de Educación Ambiental San Emigdio, San Emigdio, Palmira (Colombia).
MATERIALES Y MÉTODOS
Ubicación de estudio
La investigación se realizó en el Centro de Atención y Valoración de Fauna Silvestre San Emigdio del Centro de Educación Ambiental San Emigdio ubicado la vereda La Zapata, municipio de Palmira, Valle del Cauca (Colombia) a una altitud de 1250 ms. n. m. y una temperatura media anual de 23,8 °C (Centro de Educación Ambiental San Emigdio 2018).
Población de estudio
El estudio se realizó en 25 mamíferos cautivos ingresados en el Centro de Atención y Valoración de Fauna silvestre durante el mes de noviembre de 2019. Las especies analizadas fueron: Ateles fusciceps (n=4), Ateles hybridus (n=4), Ateles belzebuth (n=3), Nasua nasua (n=2), Potos flavus (n=3), Lagothrix lagotricha (n=1), Eira barbara (n=1), Leoparduspardalis (n=2), Cerdocyon thous (n=5), los cuales se encontraban en tres recintos separados con óptimas condiciones como piso de cemento, aseo frecuente e ingesta de agua potable, identificados como bloque 1, bloque 2 y bloque 3 tomados como criterio su división en grupos.
Toma de muestra
Por cada animal se tomaron tres muestras de materia fecal fresca (3 g/muestra) hacia las 6:00am. Para la recolección se tuvo en cuenta la parte central de las heces sin tener contacto con el suelo u otra superficie contaminante (Alvarado-Villalobos et al. 2017).
Las muestras se rotularon con fecha, hora de la toma de muestra y un código numérico que correspondía al microchip de identificación que poseía cada animal. Según la Resolución 1172 de 2004 estos dispositivos se utilizan como medio de identificación segura de animales, sin excluir el empleo de otros métodos; para los animales que no portaban el microchip se asignó una identificación alfanumérica teniendo en cuenta el recinto y número de la jaula donde se encontraban. Posteriormente, las muestras se transportaron a los laboratorios del Centro de Atención y Valoración para el análisis parasitológico. El tiempo transcurrido entre la toma de la muestra y su procesamiento fue en todos los casos inferior a una hora.
Procesamiento de muestra
Las muestras de material fecal se analizaron por dos técnicas: a) montaje con solución salina al 0,85 % y solución de lugol al 1% entre porta y cubreobjetos en microscopía de luz (aumentos 100 x y 400 x) y b) técnica de flotación por solución saturada (Sheather) con densidad de 1,28g/ml con observación en microscopio óptico (aumentos 100 x y 400 x). Para la identificación de estructuras parasitarias se utilizaron claves taxonómicas (World Health Organization 2019; Moravec 2010; Skryabin et al. 1991a; Skryabin et al. 1991b).
RESULTADOS
De manera general se encontró un total de nueve individuos positivos (36%) de los 25 analizados. Entre los parásitos identificados se encuentran Enterobius vermicularis, Fasciola sp., Entamoeba sp. y Ancylostoma sp. La distribución de los parásitos intestinales en cada grupo de animales se presenta en la Tabla 1.
La carga parasitaria de cada animal se midió y se interpretó de acuerdo a la cantidad de cruces, de la siguiente forma: una cruz (+), infestación leve de 1-5 estructuras parasitarias por campo; dos cruces (++), infestación moderada de 6-10 estructuras parasitarias por campo, y tres cruces (+++), infestación grave de 11 a 20 estructuras parasitarias por campo (Canto y Figueroa Castillo 2018).
TABLA 1 Resultados de los análisis parasitológicos de los mamíferos cautivos en el Centro de Atención y Valoración del Centro de Educación Ambiental San Emigdio.
| Bloque 1 | Número de Identificación | Resultado de análisis parasitológico |
|---|---|---|
| Ateles fusciceps | 84626 | Negativo |
| Ateles hybridus | 83510 | Negativo |
| Ateles belzebuth | 53893 | Negativo |
| Ateles fusciceps | 52834 | Negativo |
| Ateles hybridus | 40369 | Huevos de Enterobius vermicularis +++ |
| Ateles belzebuth | 75400 | Huevos de Enterobius vermicularis +++ |
| Ateles fusciceps | 41030 | Huevos de Enterobius vermicularis +++ |
| Ateles hybridus | 83460 | Huevos de Enterobius vermicularis +++ |
| Ateles belzebuth | 74010 | Huevos de Enterobius vermicularis +++ |
| Ateles hybridus | 74526 | Huevos de Enterobius vermicularis +++ |
| Nasua nasua | 94532 | Negativo |
| Potos flavus | 38210 | Negativo |
| Potos flavus | 75536 | Negativo |
| Potos flavus | 52357 | Negativo |
| Bloque 2 | ||
| Nasua nasua | 75692 | Negativo |
| Ateles hybridus | 84442 | Negativo |
| Lagothrix lagotricha | 83963 | Negativo |
| Bloque 3 | ||
| Eira barbara | 85966 | Huevos de Fasciola sp. + |
| Leopardus pardalis | B3J3 | Quistes de Entamoeba sp. + |
| Leopardus pardalis | B3J4 | Negativo |
| Cerdocyon thous | B3J5 | Negativo |
| Cerdocyon thous | B3J61 | Negativo |
| Cerdocyon thous | B3J62 | Negativo |
| Cerdocyon thous | B3J63 | Negativo |
| Cerdocyon thous | 84437 | Huevos de Ancylostoma sp. + |
Se debe mencionar que los primates que resultaron positivos a estructuras parasitarias estaban agrupados en dos jaulas consecutivas en grupos de tres; los demás mamíferos positivos se encontraban en jaulas individuales.
En las siguientes imágenes se evidencia el hallazgo de las estructuras parasitarias:
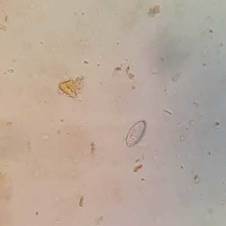
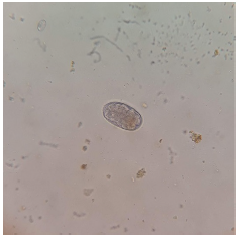
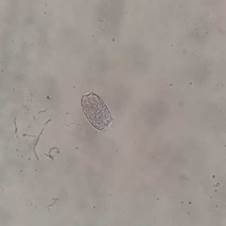
FIGURA 1 Huevos de Enterobius vermicularis observados en mamíferos primates Ateles sp. Elaboración propia.
DISCUSIÓN
El porcentaje de prevalencia de parásitos gastrointestinales en mamíferos silvestres está mediado principalmente por factores exógenos. De acuerdo con la condición de cautividad la parasitosis aumenta o disminuye. Un estudio en el Zoológico Parque de Las Leyendas en Perú encontró que el cautiverio se relaciona con la predisposición de animales a un aumento en la infección por parásitos gastrointestinales (Acosta et al. 2015).
En el caso de los primates el factor social aumenta la vulnerabilidad a las infecciones parasitarias, debido a que generalmente viven en grupos cerrados que facilitan su transmisión independientemente de su condición de cautividad o libertad (Jasso Del Toro et al. 2020); permanecer en manadas los mantiene propensos a presentar altas cargas y prevalencia de parásitos gastrointestinales.
Los parásitos identificados en el presente estudio coinciden con infecciones reportadas tanto en cautiverio como en libertad (Botero et al. 2011), lo que evidencia que la vida silvestre no evita la infectividad por parásitos; sin embargo, el cautiverio contiene factores con posibilidad de favorecer infecciones de parásitos intestinales y consigo la predisposición a infecciones secundarias o fisiológicas (Santos et al. 2015).
En el caso de los félidos, Chinchilla-Carmona et al. (2020) y Manjunatha et al. (2019) han reportado parásitos del género Entamoeba sp., en los Leopardus pardalis alojados en un centro de atención y valoración de fauna silvestre.
La prevalencia de Entamoeba sp. en félidos es relativamente baja en el centro de atención y valoración del presente estudio, posiblemente debido a las condiciones ofrecidas, como el tipo de alojamiento, el piso de cemento, el aseo frecuente y la ingesta de agua potable. Estudios similares manifiestan que estas condiciones habrían evitado la presencia de otros protozoos como Isospora sp., Sarcocystis sp., Hammondia sp., Toxoplasma gondii y Cytoisospora sp. en animales en cautiverio (Barrios 2017).
Otros estudios mencionan que la infectividad por Fasciola sp., en mamíferos como Eira barbara no es tan frecuente como otras especies de parásitos que prevalecen en la mayoría de los estudios (Gómez Fraga y Lascano 2013). Sin embargo, puede ocasionar patologías relativamente graves como hepatomegalia e ictericias (López-Villacís et al. 2017). Además, debemos mencionar su importancia en la salud humana al ser un parásito zoonótico. Los problemas de salud por fasciolasis pueden agudizarse debido a los factores climáticos como las altas temperaturas que perpetuán el ciclo de vida del parásito (Mas-Coma et al. 2018).
La presencia y elevada carga parasitaria de Enterobius vermicularis en primates no humanos analizados en esta investigación podría estar implicada en posibles complicaciones de la salud animal, con síntomas como irritación intestinal que puede acarrear dolores abdominales (Bundy et al. 2020) debido a una posible trasmisión por contacto directo entre los primates que se encuentren en un mismo encierro. La manipulación y exposición a este agente parasitario representa así mismo posibles riesgos zoonóticos. La presencia de este parásito es mayormente frecuente en humanos en edad infantil, pero se han reportado casos en adultos (Dick y Hannay 2017).
Independientemente de encontrar otros parásitos con posibilidad de riesgo zoonótico y con reportes frecuentes en humanos como Entamoeba sp. y Fasciola sp., Enterobius vermicularis contiene mayor riesgo para la salud humana, principalmente por la similitud genética existente entre humanos y primates no humanos (Davoust et al. 2018), a diferencia de otros grupos de mamíferos silvestres presentes en el estudio.
CONCLUSIÓN
Los parásitos gastrointestinales encontrados evidencian la susceptibilidad de los mamíferos en cautiverio a una infección parasitaria, deteriorando significativamente su salud debido a la condición en la que se encuentran. Es necesario implementar medidas preventivas y de control para la salud animal en los centros de atención y valoración y evitar así posibles riesgos zoonóticos, principalmente aquellos derivados de parásitos que afectan a los primates no humanos, que por su similitud genética con los humanos y por las elevadas cargas de parásitos que pueden portar, como Enterobius vermicularis, representan un riesgo. Así mismo, la presencia de parásitos como Entamoeba sp. y Fas-ciola sp. también representa una riesgo de zoonosis por la manipulación de animales en cautiverio.