INTRODUCCIÓN
Los probióticos han sido descritos en varios estudios como una alternativa de origen biológico y bajo costo al uso de antibióticos como promotores de crecimiento, garantizando la inocuidad del alimento y minimizando los riesgos de generación de resistencia bacteriana a antimicrobianos (Gutiérrez et al. 2013). Aunado a esto, la producción avícola actualmente viene atravesando nuevos retos, sobre todo en sistemas intensivos donde las aves pueden llegar a enfrentar niveles significativos de estrés, lo que dificulta implementar dietas y manejo que promuevan el equilibrio de la microbiota intestinal de las aves; predisponiendo la colonización de enteropatógenos (Kabir 2009). Es allí donde los probióticos actúan, ya que compiten por la adhesión en los receptores del epitelio intestinal y por nutrientes (Blajman et al. 2015). Los niveles de estrés a los cuales pueden estar sometidos los pollos de engorde pueden incluso alterar las poblaciones celulares de la línea de defensa, lo cual puede también influir en el desarrollo de una infección ya sea parasitaria o bacteriana (Hirakawa et al. 2020); sin embargo, este aspecto no es evaluado en el presente estudio.
Las levaduras como Saccharomyces cerevisiae se encuentran dentro del grupo de los probióticos más usados debido a que sus propiedades fisicoquímicas les confieren la capacidad de generar una relación simbiótica entre el huésped y su microbiota intestinal; de manera que la adición de estas en los piensos es una de las opciones más prácticas para disminuir el riesgo de alteraciones intestinales en las aves de producción (Díaz et al. 2017); además, ha sido descrito que Saccharomyces cerevisiae permite que las bacterias entero-patógenas se adhieran a ella través de las fibras dietéticas, en vez de adherirse a los receptores de células epiteliales intestinales, evitando así la colonización e infección bacteriana (Becker and Galleti 2008).
Ha sido documentado que Escherichia coli K88 y Salmonella enterica sv. Typhimu-rium aisladas de cerdos se unían efectivamente a un producto comercial elaborado a base de una levadura, que al igual que S. cerevisiae cuenta con manosas en su superficie. Con base a lo anterior, Becker and Galleti (2008) afirman que el tratamiento en aves de corral con productos que contienen manosa podría disminuir la infección causada por diferentes bacterias y a su vez, el riesgo de transmisión de patógenos zoonóticos al consumidor final.
Varios estudios han descrito cambios en la morfología intestinal de pollos de engorde suplementados con diferentes probióticos. Por ejemplo, que la altura media de la vellosidad en duodeno, yeyuno e íleon fue mayor y la profundidad media de la cripta del duodeno también fue más alta, lo cual da lugar a un área mayor de absorción de nutrientes como resultado de la suplementación con probióticos (Sun et al. 2005; Lemos et al. 2013; Padihari et al;2014).
Debido a que numerosos estudios son realizados in vitro es necesario explorar en detalle algunas implicaciones de la suplementación con probióticos en las dietas de animales de producción, en este trabajo puntualmente el objetivo fue determinar los cambios en la histomorfología intestinal de animales suplementados con Saccharomyces cerevisiae.
Para respaldar los diferentes reportes de los efectos benéficos de la levadura Saccharomyces cerevisiae sobre la morfometría intestinal, se buscó determinar el efecto de esta específicamente sobre las criptas y la producción de moco, realizando conteo y medición de las áreas de las criptas de Lieberkühn en duodeno y yeyuno y determinando el porcentaje de producción de moco en ambas secciones intestinales de las aves suplementadas con el probiótico vs grupo control.
MATERIALES Y METODOS
Localización
El presente estudio se realizó en el Laboratorio de Histopatología de la Escuela de Ciencias Animales, Programa Medicina Veterinaria y Zootecnia, perteneciente a la Facultad de Ciencias Agropecuarias y Recursos Naturales de la Universidad de los Llanos, ubicada a una altura de 465 ms. n. m, temperatura promedio de 25,5°C, precipitación anual de 4050 mm y humedad relativa entre 67 y 83%. Los pollos se mantuvieron confinados en un galpón que contaba con 18 jaulas (dimensiones: 1 m X 70 cm X 50 cm) cada una equipada con su respectivo comedero y bebedero.
Diseño experimental
Fueron utilizados tejidos obtenidos de pollos Cobb 500 de 45 días de edad. Los individuos pertenecientes al estudio fueron criados en un mismo galpón, divididos en jaulas, considerando los grupos control y experimental. Los individuos contaban con agua y alimento a voluntad, fueron alimentados con dieta comercial Italcol® iniciación durante los primeros 15 días de acuerdo con las indicaciones del fabricante y engorde, tanto en el grupo control como en el grupo experimental. La suplementación con el probiótico inició a partir del día 15 con 5 días de acostumbramiento, iniciando registros a partir del día 20 de su consumo. El probiótico empleado correspondió a un producto comercial Levapan®, fueron administrados 5 mg del producto seco por cada kilogramo de la dieta comercial. Los registros fueron tomados desde el día 20 de vida de los individuos. La totalidad del estudio fue realizada en la granja Barcelona de la Universidad de los Llanos.
Se utilizaron dos grupos de estudio: grupo control cuya dieta no contenía Saccharomyces cerevisiae (GC) (n=12) y grupo suplementado con Saccharomyces cerevisiae en el concentrado (GP) (n=15), asegurando la concentración de 107 UFC/g del probiótico en la dieta experimental.
También se llevó a cabo la cuantificación histopatológica del número de criptas por milímetro de las mismas porciones de intestino a través del programa Image J, que permite realizar el conteo de estas en un espacio de 1 mm en las fotografías tomadas previamente a un aumento de 4X; se usaron 8 ejemplares para GC y 15 para GP.
Procesamiento de tejidos y análisis histopatológico
Los tejidos fueron procesados en el laboratorio de histopatología, siguiendo los protocolos histotécnicos de rutina, cortados a 4[i de grosor y coloreados con hematoxilina y eosina y ácido peryódico de SchifF(PAS).
Las microfotografías analizadas fueron tomadas usado un microscopio óptico LEICA® DM 500 y una cámara LEI-CA® ICC50W Posteriormente, se realizó la medición de áreas de criptas de las porciones de intestino delgado: duodeno y yeyuno, se usó la fórmula para elipse a través de la toma de diámetro transverso y longitudinal de la cripta tanto en duodeno como yeyuno. Fueron seleccionadas 5 criptas por individuo y con el software LAS EZ® se realizaron las mediciones en aumentos de 4X y 10X. Para estas variables fueron analizadas para GC, 10 muestras (n=10) y para GP, 15 muestras (n=15).
Posteriormente, se determinó el porcentaje de moco en duodeno y yeyuno usando la coloración de ácido peryódico de Schiff (PAS). Para determinar el porcentaje de moco se usó el software Image Pro-Plus ® que permitió realizar mediciones del área con presencia de moco y determinar su porcentaje por campo. Las fotografías fueron tomadas en el aumento 40X, tomando cinco campos de cada segmento por individuo. Para esta variable fueron analizadas para GC, 12 muestras (n=12) y para GP, 14 muestras (n=14).
Análisis estadístico
Para el análisis estadístico los datos fueron tabulados en Microsoft Office Excel, se realizó estadística paramétrica. La primera prueba hecha fue la prueba de normalidad d'Agostino y Pearson. Una vez constatado el patrón de normalidad se realizó la prueba T no pareada para comparar los resultados obtenidos de los grupos experimentales. Se consideraron estadísticamente significativos los valores menores a 0,05 (p < 0,05).
RESULTADOS
Área de criptas
La prueba de "t no pareada" reveló diferencias estadísticas en el GP que presentó una mayor área de la cripta del duodeno (p = 0,0119) así como mayor área para yeyuno (p= 0,0355), haciendo más robustas las criptas intestinales con relación a GC. Los resultados son ilustrados en las Figuras 1 y 2.
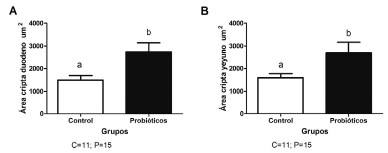
FIGURA 1 Área de las criptas de Lieberkuhn (μm2) de duodeno (A) y yeyuno (B) evaluada en el grupo control y el grupo suplementado con probiotico Saccharomyces cerevisiae. Esta figura muestra la diferencia en el área de las criptas en duodeno y yeyuno de pollos Cobb 500 de 45 días de edad, de individuos grupo control (A) y del grupo (B) suplementado con probiotico S. cerevisiae proveniente de levadura comercial a razón de 5 mg/kg de dieta comercial desde el día 20 de vida. Las letras diferentes sobre las columnas indican diferencia estadística. Los datos son expresados como media ± SE. P < 0,05 (prueba “T no pareada”).
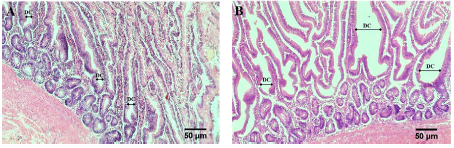
FIGURA 2 Microfotografía de criptas de Lieberkühn en duodeno de pollos Cobb 500 de 45 días de edad, de individuos del grupo control (A) y del grupo (B) suplementado con probiótico Saccharomyces cerevisiae proveniente de levadura comercial a razón de 5 mg/kg de dieta comercial desde el día 20 de vida. Coloración con hematoxilina y eosina. A. Duodeno 10X. Se observan criptas de Lieberkühn en la mucosa duodenal del grupo control. B. Duodeno10X. Se observan criptas de Lieberkühn en la mucosa duodenal del grupo suplementado. DC: diámetro de cripta.
Porcentaje de moco
La prueba de "t no pareada" reveló diferencias estadísticas (p = 0,0185) con relación a la producción de moco en el duodeno de los animales del GP siendo estadísticamente mayor el porcentaje respecto a GC. En tanto que en yeyuno no hubo diferencias estadísticas (p = 0,3369) entre GP y GC. Los resultados son ilustrados en las Figura 3 y 4.
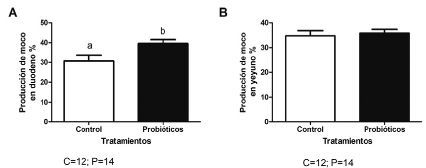
FIGURA 3 Efecto de la suplementación con Saccharomyces cerevisiae sobre la producción de moco en duodeno (A) y yeyuno (B) en pollos de engorde evaluados en el grupo control y grupo suplementado con probiótico. Esta figura muestra la diferencia causada en el aumento en la producción de moco con la suplementación de S. cerevisiae en duodeno, y ninguna diferencia por efecto del probiótico en yeyuno con respecto a sus controles. Letras diferentes sobre las columnas indican diferencia estadística. Los datos son expresados como media ± SE. P < 0,05 (prueba "T no pareada").
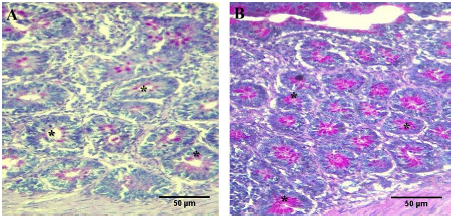
FIGURA 4 Microfotografía de criptas del duodeno de pollos Cobb 500 de 45 días de edad, de individuos del grupo control (A), y del grupo (B) suplementado con probiótico Saccharomyces cerevisiae proveniente de levadura comercial a razón de 5 mg/kg de dieta comercial desde el día 20 de vida. Células caliciformes marcadas con la coloración diferencial de Ácido Peryódico de Schiff, productoras de moco en criptas del duodeno. Grupo control muestra coloración magenta (A). Criptas del duodeno grupo tratado con probiótico Saccharomyces cerevisiae (B) con células caliciformes marcadas con la coloración diferencial de Ácido Peryódico de Schiff 40x. A. Duodeno 40X. Se observa escaso moco (*) en glándulas de la mucosa duodenal de grupo control. B. Duodeno 40X. Se observa abundante presencia de moco (*) en glándulas de la mucosa duodenal de grupo suplementado con probióticos. Es evidente la diferencia en la densidad de moco presente en los dos grupos.
Número de criptas por milímetro
Con respecto al número de criptas de Lieberkühn por milímetro la prueba "t no pareada" evidenció una diferencia significativa en el duodeno (p < 0,05) para GP, cuyo efecto fue disminuir el número de criptas por milímetro (p = 0,0420) con relación al GC. Lo que no se observó con relación al yeyuno de los pollos de engorde tratados con probióticos en donde no se revelaron diferencias estadísticas comparadas a sus respectivos controles. Los resultados son ilustrados en la Figura 5.
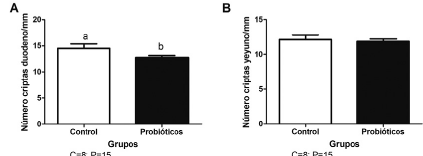
FIGURA 5 Número de criptas de Lieberkühn por milímetro en los segmentos intestinales evaluados: duodeno (A) y yeyuno (B) de pollos Cobb 500 de 45 días de edad, de individuos del grupo control y del grupo suplementado con probiótico Saccharomyces cerevisiae proveniente de levadura comercial a razón de 5 mg/kg de dieta comercial desde el día 20 de vida. Letras diferentes sobre las columnas indican diferencia estadística. Los datos son expresados como media ± SE. P< 0.05 (prueba "T no pareada").
DISCUSIÓN
En el presente estudio se encontró que los pollos de engorde suplementados con Saccharomyces cerevisiae a través de una levadura comercial presentaron una mayor amplitud del área de las criptas en duodeno y yeyuno en comparación al grupo control, en un 45,3% en duodeno y en 40,6% en yeyuno. Estos resultados son similares a los reportados por López et al. (2008) quienes evaluaron tres cepas de levaduras aisladas de frutas encontradas en ambientes naturales y dos levaduras de uso comercial, revelando que las aves presentaron criptas más profundas en el duodeno, pero las criptas más altas se encontraron en los pollos que recibieron levadura nativa, por lo que concluyeron que esta influye sobre la profundidad y altura de las criptas, lo que genera un incremento en el recambio de revestimiento del intestino y la producción de moco.
La cripta es considerada la fábrica de vellosidades, de modo que una cripta más profunda puede indicar un recambio de tejidos más rápido, lo que permite una renovación de las vellosidades que han sufrido alteraciones por acciones patógenas y por consiguiente, mejor capacidad de absorción nutricional; esto también repercute sobre el huésped ya que gastaría más energía en este proceso influyendo indirectamente sobre los parámetros productivos de las aves. Gao et al. (2008) afirmaron que las variaciones en la profundidad de las criptas de Lieberkühn pueden ser interpretadas de varias formas; así, una profundidad mayor de las criptas se refleja en más producción y almacenamiento de mucina, por consiguiente, se genera una respuesta eficaz de protección física frente a patógenos.
Barrios et al. (2018) reportaron que la adición de una mezcla de Saccharomyces cerevisiae, Lactobacillus acidophilus y Ba-cillus subtilis generó beneficios a nivel intestinal, influyó favorablemente sobre el área de la cripta, revelando que fue mayor en duodeno y yeyuno frente a sus respectivos controles. Los probióticos también generaron mayor producción de moco en duodeno y yeyuno frente a sus controles, lo cual se atribuyó a la combinación de los tres probióticos que potencian su acción sobre el área de la cripta y la cantidad de células caliciformes del duodeno y yeyuno.
Estos resultados son consistentes con la presente investigación en relación al área de la cripta donde se evidenció el efecto de la levadura en duodeno y yeyuno, ya que aumentó con respecto a sus controles y coinciden parcialmente en lo referente a la producción de moco, ya que en el presente estudio se incrementó solamente en el duodeno del grupo suplementado con Saccharomyces cerevisiae, difiriendo así de lo reportado previamente por los Barrios et al. 2008, quienes obtuvieron aumento del porcentaje de moco en duodeno y yeyuno. Con base a los resultados anteriores de esta investigación se plantea una mayor absorción de nutrientes y producción de moco en el duodeno a causa de la suplementación probiótica.
En varios estudios se ha reportado que la levadura influye positivamente sobre la morfología intestinal ya que en el íleon aumentó la profundidad de las criptas (Teng et al. 2017). Resultados similares obtuvieron Wang et al. (2017) al evaluar la levadura viva S. cerevisiae sobre la histo-morfología intestinal en pollos de engorde desafiados a lipopolisacárido, encontraron que la suplementación con 0,5 % del probiótico redujo la profundidad de la cripta en yeyuno e íleon, de modo que la proporción usada de S. cerevisiae influye en las diferencias de los resultados, al aumentar o disminuir la profundidad de las criptas como se observó en las anteriores investigaciones.
Entre otras combinaciones de probióticos y prebióticos con resultados favorables se encuentra el estudio realizado por Seifi et al. (2020) quienes describieron la administración de cultivo de levadura Saccharomyces cerevisiae y microbios sobre la histomorfología intestinal en pollos de engorde sometidos a estrés calórico y deficiencia nutricional; en dicho estudio las aves fueron expuestas a temperaturas por encima de 30°C durante por lo menos 8 horas diarias y los productos utilizados para los tratamientos fueron prebióti-co: 0.1% de una levadura comercial de Saccharomyces cerevisiae cultivada en un medio de sacarosa y melaza de caña y el probiótico: que contiene diferentes microrganismos. Los resultados revelaron una mayor profundidad de la cripta de las aves suplementadas con la combinación de prebióticos y probióticos, lo que demuestra una potenciación de los efectos como ocurrió en la investigaciones mencionadas previamente.
Es de importancia documentar otras investigaciones donde han usado la levadura combinada con otros probióticos con el fin de comparar la suplementación de pollos con antibióticos y probióticos y su efecto sobre la histomorfología intestinal de las aves. Se ha revelado que pollos de engorde alimentados con tratamiento antibiótico a dosis de 75 mg/kg de clor-tetraciclina y tratamiento probiótico a 500 mg/kg en la fase 1 y 300 mg/kg en la fase 2, compuesto por Saccharomyces cerevisiae 1x109 UFC/g Bacillus subtilis 5x109 UFC/g, Bacillus licheniformis 2.5x1010 UFC/g tienden a mostrar menor profundidad de cripta en duodeno, lo que indica que los probióticos puede promover el desarrollo de la superficie de absorción de las vellosidades en el duodeno de las aves (Tengfei et al. 2019), lo cual podría explicar las diferencias obtenidas en el presente estudio, con relación a los resultados descritos anteriormente, debido a que ellos administraron una mezcla de los probióticos y cada uno puede generar un efecto diferente potenciando o disminuyendo los beneficios sobre el huésped.
Por el contrario, en otro estudio donde fue usada la pared celular de la levadura Saccharomyces cerevisiae a una dosis de 1000 mg/kg como sustituto a un tratamiento antibiótico, donde las aves se sometieron a exposición oral con Salmonella pullorum, no se observaron efectos benéficos sobre la histomorfología intestinal por parte de la levadura, pero sí sobre el rendimiento productivo y un efecto preventivo sobre la colonización de bacterias patógenas como Salmonella pullorum e inmunoestimulante frente a la enfermedad de New Castle (Muthusamy et al. 2011). Estos resultados difieren con la presente investigación probablemente por la estimulación patógena de la bacteria S. pullorum como también por la diferencia en la dosis administrada del probiótico.
Los resultados obtenidos en esta investigación difieren de otros estudios que han descrito la acción del probiótico S. cerevisiae a 0,2% a nivel microscópico, encontrando que la profundidad de cripta fue afectada solo en yeyuno y se redujo (Santin et al. 2001).
Por otro lado, Zhang et al. 2005 evaluaron la suplementación con la levadura completa de S. cerevisiae a dosis de 0,3% y la pared celular de la misma a dosis de 0,2% sobre la histomorfología intestinal en los pollos de engorde machos y no encontraron diferencias por acción del probiótico sobre la profundidad de la cripta entre tratamientos. Las dosis administradas y el sexo pueden ser factores influenciadores sobre el efecto del probiótico.
Otra investigación realizada en pavos evaluó los efectos de la levadura Saccharomyces cerevisiae individualmente y en combinación con Yarrowia lipolytica sobre parámetros histomorfológicos, los resultados del examen histológico revelaron que S. cerevisiae aumento la profundidad de las criptas en el intestino delgado. En cuanto a la administración combinada de ambas levaduras se observó que generó una reducción en la profundidad de la cripta en duodeno y ciego; de manera que la levadura ejerce efectos contrarios si se administra junto a otros probióticos (Czech et al; 2020). Esto coincide con los anteriores reportes ya que la combinación puede potenciar o disminuir el efecto de cada probiótico.
Con relación a la producción de moco, los resultados de la presente investigación arrojaron que fue mayor solamente en el duodeno con relación a su respectivo control, y coinciden parcialmente con lo referenciado por Ghosh et al. (2012) quienes obtuvieron efectos positivos con la suplementación con S. cerevisiae hidrolizada y la pared celular de la levadura sobre la histomorfología intestinal de pollos de engorde; estos autores afirmaron que la suplementación, tanto con pared celular, como con levadura completa hidrolizada, aumenta el número de células caliciformes en las vellosidades del duodeno, yeyuno e íleon, lo cual permite inferir que hay aumento de la producción de moco en las tres secciones. Determinaron también que la suplementación con levadura completa mejoró la morfología intestinal, pero que la pared celular de la levadura mostró mejores resultados sobre la salud intestinal de las aves. En la presente investigación se usó levadura comercial completa y los resultados coinciden con lo reportado por estos autores, ya que aumento el área de las criptas en duodeno y yeyuno y en cuanto a la producción de moco fue mayor solamente en duodeno, así que la acción del probiótico fue favorable.
Los resultados del presente estudio coinciden con lo reportado por Brümmer et al. (2010), quienes reportaron que la pared celular de S. cerevisiae influyó positivamente sobre la producción de moco en pollos de engorde, ya que en aves suplementadas con un producto comercial que contenía la levadura, luego de 15 días de haber administrado el tratamiento, se revelaron densidades y tamaños de células caliciformes significativamente mayores en el yeyuno. La densidad de las células caliciformes en los grupos de tratamiento varió de 10 a 27 células caliciformes por área de vellosidad de 10 000 um2, con un tamaño de estas que osciló entre 61,21 um2 y 94,93 um2. El aumento de la cantidad de células caliciformes se apreció en todos los grupos de tratamiento en comparación con los grupos control; esto supone el incremento en la producción de moco como posible respuesta a la presencia de patógenos, por lo que se puede considerar su efecto como protector de barrera.
Por su parte, Rajput et al. (2018) obtuvieron resultados similares al evaluar el efecto de la levadura Saccharomyces boulardii y Bacillus subtilis B10 sobre el desarrollo e inmunidad de la mucosa en pollos de engorde, pues encontraron que aumentó el número de células caliciformes en yeyuno en los grupos suplementados por ambos tratamientos probióticos.
Es de resaltar otro reporte donde se administró mananooligosacarido, un glúcido derivado de la pared celular de la levadura S. cerevisiae, comparado con lignina como tratamientos dietéticos alternativos a los antibióticos y los resultados mostraron un número mayor de células caliciformes por vellosidades en yeyuno en las aves suplementadas con el probiótico frente a los demás tratamientos y respectivos controles (Baurhoo et al. 2007). De igual modo, Baurhoo etal. (2009) encontraron que la pared celular de la levadura S. cerevisiae purificada y administrada a 1,5 kg/t en el alimento incrementó el número de células caliciformes en la membrana de las vellosidades y por consiguiente, genera el crecimiento de bacterias benéficas del yeyuno, lo cual mejora la capacidad de reducción y eliminación de patógenos intestinales a causa del incremento en la producción de mucina.
En otra investigación también se describieron los beneficios de la adición de un derivado de la pared celular de S. cerevisiae sobre las células caliciformes en pollos de engorde; los resultados revelaron que las aves suplementadas con 800 g/t del carbohidrato aumentaron significativamente el área de las células caliciformes por 165 μm2 de vellosidades en yeyuno. Por consiguiente, se asocia a una mayor producción y almacenamiento de mu-cina; de esta manera, se plantea que las aves suplementadas pudieran defenderse contra agentes patógenos a través de una mayor capacidad de almacenamiento de mucina y esta, a su vez, ejerce un efecto protector de barrera y lubricante en la mucosa intestinal de las aves (Lea et al. 2012) que es consistente con los resultados de la presente investigación.
Por el contrario, Bradley et al. (1994) reportaron disminución en la producción de moco, lo cual asociaron a alteraciones en la microbiota intestinal de las aves suplementadas, y a una disminución en la cantidad de bacterias agresivas por acción del probiótico, lo que disminuye la cantidad de moco como mecanismo de defensa.
Chand et al. (2019) describieron la administración de mananoligosacárido en pollos de engorde en diferentes dosis, lo que generó cambios benéficos sobre la histomorfología intestinal. En su investigación se administraron tres tratamientos: 0g/kg, 50g/kg y 100 g/kg; los resultados demostraron que el mayor nivel de mananooligosacarido en la dieta generó más profundidad de cripta e incrementó significativamente el número de células caliciformes respecto a los demás tratamientos, lo que coincide con los resultados del presente estudio. El probiótico también revelo datos favorables sobre los parámetros productivos; por lo anterior, los autores asociaron el incremento de células caliciformes con el aumento en la secreción de mucina y por consiguiente, con una mayor respuesta en la eliminación de microrganismos patógenos y en la absorción y consumo de alimento.
En el presente estudio la cantidad de criptas por milímetro en duodeno del grupo suplementado con el probiótico fue menor respecto a su control; estos datos son semejantes a los encontrados por Barrios et al. (2018) quienes trabajaron con una mezcla de 3 probióticos Saccharomyces cerevisiae, Lactobacillus acidophilus y Bacillus subtilis en pollos de engorde y observaron disminucion en las criptas de duodeno. De manera similar, Tomaszewska et al. (2018) reportaron el uso de la levadura en codornices japonesas hembras y machos, y observaron que en las aves suplementadas con 1,5% o 15 g/ kg S. cerevisiae inactivada por secado se reducía la cantidad de criptas totales y activas en el duodeno de codornices de ambos sexos.
Es importante mencionar los beneficios que ofrece el probiótico con base a los datos reportados por Ochoa et al. (2019) quienes describieron la administración de la levadura Saccharomyces cerevisiae en combinación con Lactobacillus acidophilus y Bacillus subtilis a concentración de 107 UFC/g en la dieta de pollos de engorde para evaluar su efecto sobre parámetros histomorfológicos a nivel intestinal de las aves. Los resultados fueron positivos al revelar las siguientes correlaciones positivas: área de la cripta en duodeno con número de células por vellosidad en íleon (r=0,8628 p=0,0269); de igual manera, en yeyuno se correlacionó el área de cripta con la producción de moco (r=0,1480 p=0,0009); el diámetro longitudinal de cripta en duodeno con el área de cripta (r=0,9750 p=0,0009), y el diámetro longitudinal de cripta íleon con el número de células por vellosidad en duodeno (r=0,8232 p=0,0441), por lo que se afirma que al ser mayor el tamaño de la cripta, será menor su cantidad por milímetro; por tal razón, los autores afirmaron que al mejorar un parámetro el probiótico repercute directamente sobre otro, demostrando el vínculo funcional de las tres secciones de intestino delgado.
Por último, es necesario evaluar las vías de administración de los probióticos. En el presente estudio se administró en forma seca sobre el alimento y los resultados fueron benéficos; por su parte, otros autoresque ha reportado el uso de probióticos con dietas húmedas encontraron que la profundidad de las criptas suele ser menor en estas aves (Yasar and Forbes 2010), por lo tanto, la mucosa de la cripta es engrosada mayormente en las dietas húmedas independientemente de la suplementación; los mismos autores también se observaron un mayor consumo de alimento, lo que se asocia a que la dieta húmeda actúa como un estímulo para la digestión y absorción, y a una penetración más rápida por las enzimas digestivas.
CONCLUSIONES
En la presente investigación se observó un incremento del área de las criptas en duodeno y yeyuno como consecuencia de la adición del probiótico Saccharomyces cerevisiae; las criptas por su mayor tamaño disminuyen su cantidad en número, lo que se asocia con un recambio epitelial más veloz que indirectamente beneficia la vellosidad encargada de la absorción de nutrientes. Se evidenció aumento del área de las criptas de duodeno y yeyuno, así como aumento en la producción de moco en duodeno por las células caliciformes en las aves suplementadas; esta mucina puede actuar como un mecanismo de defensa frente a una estimulación patógena, por lo que se puede afirmar que el probiótico generó beneficios a nivel intestinal en los pollos de engorde evaluados.
Estos hallazgos respaldan el uso de herramientas biológicas que permitan disminuir el uso de antimicrobianos en sistemas de producción avícola, para disminuir el posible impacto de estos sobre la resistencia antimicrobiana y su efecto sobre la salud pública.














