INTRODUCCIÓN
El organismo cuenta con sistemas antioxidantes que protegen a las células del daño que pueden causar los agentes oxidantes. Estos sistemas se pueden dividir en enzimáticos o no enzimáticos (Kehrer y Klotz 2015). El primero corresponde a enzimas como la superoxidodismutasa, la catalasa, la glutatión peroxidasa o la glutatión reductasa. Estos factores enzimáticos dependen de otros nutrientes esenciales como el selenio, el cobre o el zinc o vitaminas como la riboflavina. El segundo sistema antioxidante, y paralelo al primero, está formado por depuradores no enzimáticos de las especies reactivas de oxígeno (ERO), algunos de estos compuestos son el glutatión, el AAL, las vitaminas C, E y A, y los carotenoides, entre otros (Sharma et al. 2018). El AAL se sintetiza en el hígado, corazón y riñones (Rochette et al. 2015), en particular en las mitocondrias, mediante síntesis enzimática a partir del ácido octanoico, participando de manera importante en el metabolismo energético de las mismas. A pesar de que la síntesis de novo parece aportar la cantidad de AAL necesaria para su función en el metabolismo, también puede absorberse a partir de la dieta. De hecho, el AAL se absorbe intacto a partir de las fuentes dietéticas y se acumula de forma transitoria en diversos tejidos (hígado, corazón y músculo esquelético). La teoría de los radicales libres y el estrés oxidativo se fundamenta en la producción de forma incontrolada de especies derivadas del oxígeno que causan daños irreversibles a las macromoléculas. Cuando los sistemas fisiológicos se saturan, ya sea por producción excesiva de radicales libres o por descenso de la capacidad de los sistemas endógenos antioxidantes, se induce el estrés oxidativo, que puede definirse como una pérdida de equilibrio entre los niveles de producción de ERO y de nitrógeno, y de los mecanismos de defensa antioxidante (Davies 2019). De todos los tejidos del cuerpo, el cerebro puede ser particularmente vulnerable al estrés oxidativo, en parte porque está altamente enriquecido en hierro no hemo, que está catalíticamente involucrado en la producción de ERO (Salim 2017). Además, el cerebro contiene niveles relativamente altos de ácidos grasos insaturados, que son sustratos particularmente buenos para las reacciones de peroxidación lipídica (Johnson et al. 2014). Los principales mecanismos de defensa que utiliza el cerebro para combatir los equivalentes reductores son sus antioxidantes enzimáticos (Bjørklund y Chirumbolo 2017). Una fuente principal de daño provocado por el estrés oxidativo es la peroxidación lipídica (PL), que se atribuye a su alta naturaleza propagativa y a la citotoxicidad de sus subproductos metabólicos. La PL es, por lo tanto, un índice establecido de estrés oxidativo relacionado con la edad (Hulsegge, 2016). El AAL es un ácido anfipático, por lo que tiene capacidad de disolverse tanto en un medio acuoso como en un medio graso, es por ello que se lo denomina "antioxidante universal" y puede actuar tanto a nivel intra como extracelular, en cualquier parte y a cualquier nivel dentro del organismo. Se considera a la mitocondria como la principal generadora endógena de especies reactivas de oxígeno. Las principales funciones de las mitocondrias son la obtención de energía en forma de adenosina trifosfato (ATP), el mantenimiento de la homeostasis y el control de la apoptosis celular. Para la producción de energía, se vale de 2 procesos metabólicos coordinados: el ciclo de Krebs y la fosforilación oxidativa. Las especies reactivas de oxígeno son continuamente generadas en ellos, así como en la cadena de transporte de electrones (Durand y Mach, 2013). Se seleccionó el cerebro por su alta capacidad de producción de radicales libres y el corazón por poseer alta presión parcial de oxígeno. El presente estudio fue diseñado para determinar si las mitocondrias de corazón y cerebro de rata podrían ser un objetivo para la PNE, así como para establecer el nivel de protección de dichas membranas incubadas con AAL. El proceso degradativo fue seguido por la determinación de QL (Omanovic y Valzacchi 2017).
MATERIALES Y MÉTODOS
Se utilizaron ratas hembras Wistar AH/HOK del Bioterio de Animales (Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata). La albúmina de suero bovino (ASB-BSA) (fracción V) se obtuvo de Wako Pure Chemical Industries Ltda., Japón. El AAL fue suministrado amablemente por Laboratorio Craveri S. A., Arengreen 830 / Miranda 5237 C1405CYH, Capital Buenos Aires, Argentina. El ácido ascórbico L (+) fue adquirido de Laboratorios Merck. Todos los demás reactivos y productos químicos fueron de grado analítico de Sigma.
Preparación de la solución de AAL (ácido lipoico)
Se pesó un comprimido de 200 mg de ácido lipoico, se trituró y se diluyó en 20 ml de agua destilada. De esta solución madre se tomó 1 ml y se diluyó en 10 ml de agua destilada, obteniéndose una concentración de 1 mg/ml. Posteriormente, para los experimentos, se usaron las siguientes concentraciones: 250, 750 y 1250 μg/ml.
Animales y preparación de mitocondrias
Se utilizaron ratas hembras Wistar AH/HOK de 7 semanas de edad, con un peso de 120 a 137 g. Fueron alimentadas con comida comercial para ratas y agua a voluntad. Se sacrificaron por dislocación cervical. Los corazones y los cerebros fueron rápidamente removidos, se cortaron en pequeños trozos y se lavaron exhaustivamente con una solución de NaCl 0,15 M. Las mitocondrias se obtuvieron por el método descrito por Schneider y Hogeboom (1951), para lo cual se preparó un homogenado al 30% (p/v) con una solución de sacarosa 0,25 M, Tris-HCl 10 mM, pH 7,4, realizado con un homogeneizador Potter-Elvejhem. El homogeneizado se centrifugó a 10.000 rpm durante 10 min. Todas las operaciones se realizaron a 4°C y con luz tenue. Con este método Schneider y Hogeboom (1951) demostraron que el medio en el que se realiza la homogeneización tiene un profundo efecto sobre las propiedades morfológicas, citológicas y bioquímicas de las mitocondrias aisladas, así como sobre su rendimiento. En cuanto a la pureza de la fracción, tanto los estudios químicos como los estudios con microscopios de luz, campo oscuro, fase y microscopios electrónicos indicaron que la fracción estaba libre de contaminación.
Peroxidación no enzimática de mitocondrias de corazón y cerebro de rata
La QL y la PNE se iniciaron con el agregado de ascorbato-Fe++ a ambas mitocondrias (Wright et al. 1979). Las mitocondrias (1 mg de proteína mitocondrial) fueron incubadas con la solución de ácido lipoico (250, 750 y 1250 μg/ mlgrupo AAL) a 37°C con tampón fosfato 0,01 M pH 7,4, ascorbato 0,4 mM, volumen final 2 ml. El tampón de fosfato contenía suficiente hierro para proporcionar el hierro ferroso o férrico necesario (la concentración final en la mezcla de incubación fue de 2,15 μM) para la PNE (Tadolini y Hatkin 1996). Simultáneamente se sometieron a la PNE preparaciones de mitocondrias que carecían de ascorbato-Fe++ (grupo control). La emisión lumínica de las membranas se determinó durante un periodo de 120 min, la QL se registró como cuentas por minuto (cpm) cada 10 min y la suma de la QL total se usó para calcular cpm/mg de proteína. La emisión lumínica se midió en un contador de centelleo líquido en un equipo Packard 1900 TR provisto de un programa de QL.
Determinación de proteínas
Las proteínas se determinaron por el método de Lowry et al. (1951) y se utilizó ASB como estándar.
Análisis estadístico
Los resultados se expresaron como la media ± desvío estándar (DE) de 6 experimentos independientes. Los datos fueron sometidos a la prueba test de Student. El nivel de 0,05 fue seleccionado como el punto mínimo de significancia estadística. El criterio estadístico de significación se seleccionó en diferentes valores de p y se indicó en cada caso.
RESULTADOS
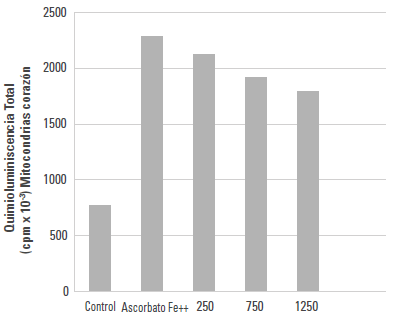
Emisión lumínica de las mitocondrias de corazón de rata durante la peroxidación no enzimática
Durante el ensayo de PNE se observó que, en el grupo control comparado con las muestras en presencia de ascorbato-Fe++ (grupo ascorbato-Fe++), la diferencia de emisión lumínica (cpm) fue altamente significativa (p < 0,0005). Luego de la incubación de las mitocondrias de corazón de rata en un sistema ascorbato-Fe++ a 37°C durante 120 min, se observó que el grupo AAL comparado con el grupo ascorbato-Fe++ no mostró diferencias significativas para las concentraciones 250 y 750 μg/ml. La figura 1 muestra la emisión lumínica obtenida del grupo AAL y del grupo ascorbato-Fe++. Los valores fueron 2285,33 ± 104,36 para el grupo ascorbato-Fe++ y 1796,00 ± 69,80 cpm para la concentración 1250 μg/ml de AAL, con una significancia de p < 0,05.
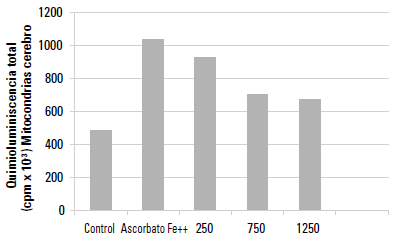
Emisión lumínica de las mitocondrias de cerebro de rata durante la peroxidación no enzimática
Durante el ensayo de PNE se observó una diferencia altamente significativa (p < 0,0005) en la emisión lumínica cuando se comparó el grupo control con las muestras en presencia de ascorbato-Fe++ (grupo ascorbato-Fe++). Luego de la incubación de las mitocondrias de cerebro de rata en un sistema ascorbato-Fe++ a 37°C durante 120 min, se observó que el grupo AAL comparado con el grupo ascorbato-Fe++ mostró diferencias significativas para las concentraciones 750 y 1250 μg/ml. La figura 2 muestra la emisión lumínica obtenida del grupo AAL y del grupo ascorbato-Fe++. Los valores fueron 1039,33 ± 112,86 en el grupo de ascorbato-Fe++ y 706,67 ± 80,04 y 671,33 ± 92,76 cpm con la adición de 750 y 1250 μg/ml de AAL, respectivamente, y en ambas concentraciones la significancia fue p < 0,05.
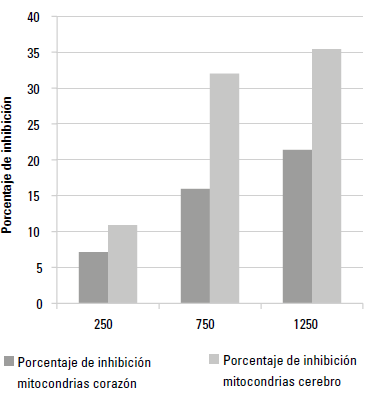
Porcentaje comparativo de inhibición de la emisión lumínica en mitocondrias de corazón y cerebro de rata
Luego de la incubación de ambas mitocondrias en un sistema ascorbato-Fe++ (120 min a 37°C) adicionadas con diferentes concentraciones de AAL se observó que el porcentaje de cpm/mg de proteína originado por la emisión lumínica (QL) fue menor en las mitocondrias de cerebro. Así mismo, el porcentaje de inhibición de la peroxidación producida por AAL fue del 21,41% en mitocondrias de corazón a 1250 μg/ml de AAL y de 35,41% en mitocondrias de cerebro a 1250 μg/ml de AAL (figura 3).
DISCUSIÓN
El cuerpo contiene un elaborado sistema de defensa antioxidante que depende de la ingesta dietética de vitaminas y minerales antioxidantes y la producción endógena de compuestos antioxidantes como el glutatión. Las vitaminas C y E y el beta caroteno son los principales antioxidantes vitamínicos. Además del glutatión, existen numerosas enzimas involucradas en la extinción o eliminación de radicales libres (Valko et al. 2016). No se sabe completamente si el sistema de defensa antioxidante natural del cuerpo es suficiente para contrarrestar el aumento de radicales libres o si se necesitan suplementos adicionales. Se ha visto que existe una asociación entre la incidencia de cáncer y la dieta, de modo que los suplementos nutricionales podrían actuar como factores protectores y terapéuticos (Shapira 2017). Dentro de estos, el AAL se absorbe fácilmente y se convierte en su forma reducida ácido dihidrolipoico en una variedad de tejidos celulares (Micillo et al. 2018), en los que ambos actúan como antioxidantes. Además de desempeñarse como un potente antioxidante, el AAL aumenta y mantiene los niveles de otros antioxidantes como la ubiquinona, el glutatión y el ácido as-córbico (Ohta et al. 2015). El AAL se usa actualmente como agente terapéutico en una variedad de trastornos neurológicos (Wu et al. 2015). Se ha encontrado que los pacientes diagnosticados con cirrosis hepática, diabetes mellitus, aterosclerosis y polineuritis contienen un nivel reducido de AAL endógeno (Saunders et al. 2013). La disminución en el nivel de AAL se ha manifestado durante el proceso de envejecimiento (Davalli et al. 2016) porque, durante el proceso de envejecimiento, el equilibrio entre oxidantes y antioxidantes se altera gradualmente debido al exceso de producción y la eliminación insuficiente de ERO. Los estudios previos respaldan el uso combinado de los antioxidantes vitamina E y AAL para disminuir el estrés oxidativo (Sies 2015) y mejorar el rendimiento cardíaco (Kenedy et al. 2016). Por lo tanto, se ha sugerido que la suplementación dietética de vitamina E y AAL prolonga el tiempo de coagulación mediante la inhibición de una vía de coagulación intrínseca. El objetivo de nuestro estudio fue evaluar la capacidad de la solución de AAL para proteger las mitocondrias cardíacas y cerebrales contra la peroxidación. En este estudio, demostramos que las mitocondrias de cerebro de rata incubadas con solución de AAL estaban mejor protegidas contra la peroxidación lipídica en comparación con membranas similares del grupo control, como lo demuestran los resultados de la quimioluminiscencia. También observamos en este estudio que existe una protección diferencial en ambos órganos, ya que las mitocondrias de cerebro estaban protegidas a dosis más bajas de AAL. En efecto, las mitocondrias de cerebro de rata incubadas con dosis 750 y 1250 μg/ml de AAL estaban protegidas de los efectos de la peroxidación lipídica. Pero ese mismo efecto no se observó en las mitocondrias de corazón, en las que solo se observó protección con la dosis más alta de AAL (1250 μg/ml). La quimioluminiscencia es la emisión lumínica derivada de una reacción química como la última reacción de peroxidación lipídica en la que moléculas químicamente excitadas decaen al estado basal electrónico y emiten fotones. La reacción es muy útil desde un punto de vista analítico porque, en condiciones experimentales adecuadas, la emisión de luz está directamente relacionada con la concentración analítica, permitiendo así un análisis cuantitativo preciso y sensible. Además, la emisión de luz está usualmente representada mediante estudios cinéticos, los cuales simplifican el manejo de las muestras y los procedimientos de medición. La quimioluminiscencia se ha utilizado ampliamente como un indicador de la formación de especiesreactivas de oxígeno en las células y los órganos, lo que permite el estudio de una serie de condiciones patofisiológicos relacionadas con el estrés oxidativo (Roda et al. 2016). La reducción en la síntesis de proteínas, que ocurre durante el envejecimiento debido a la disminución en la producción de ATP (Dziechciaz et al. 2014), también puede ser la causa de la reducción de las actividades enzimáticas antioxidantes. La administración exógena de AAL en virtud de su capacidad para mejorar la producción de ATP (Hádicke et al. 2015) podría mejorar la síntesis general de proteínas (y, por lo tanto, enzimas) en las células. La AAL, por su naturaleza antioxidante, inhibe la peroxidación lipídica y evita que las membranas sufran más daño peroxidativo.
CONCLUSIONES
Aunque el AAL actúa principalmente como cofactor del metabolismo energético de las mitocondrias, podría desempeñar un papel importante en la protección contra el estrés oxidativo en el cerebro durante el envejecimiento y, además, en ciertas alteraciones relacionadas con el tejido cardíaco. El análisis de QL indicó que las mitocondrias de cerebro fueron protegidas de manera más eficiente que las mitocondrias de corazón de rata. En este último caso, será necesario probar nuevas dosis de AAL para demostrar los efectos en estas membranas.