INTRODUCCIÓN
Durante mucho tiempo el control de nematodos gastrointestinales en rumiantes se ha realizado casi exclusivamente con fármacos antihelmínticos; sin embargo, el inadecuado uso de estos medicamentos como las inexactas dosificaciones, la aplicación continua del mismo principio activo y elevada frecuencia de tratamientos condujeron al desarrollo de resistencia a la mayoría de principios químicos comúnmente disponibles (resistencia múltiple), especialmente en explotaciones ovinas y caprinas (Gasbarre 2014; Kaplan y Vidyashankar 2012; Birhan et al. 2020).
Los nematodos gastrointestinales (NGI) se caracterizan por una elevada prolificidad, adaptabilidad y resistencia a diversas condiciones climáticas que les confieren una amplia distribución geográfica y una alta prevalencia, tanto en regiones con clima templado como tropical (Hoste y Torres 2011; Calvete et al. 2014) y sus afecciones causan importantes pérdidas económicas que oscilan entre un 10% y un 50% (Azando et al. 2011; Hoste et al. 2012; Naeem et al. 2021).
El género Haemonchus spp. pertenece a la familia Trichostrongylidae. Haemonchus contortus se considera el nematodo más patógeno en pequeños rumiantes (Arsenopoulus et al. 2021). Este parásito se destaca por su elevada patogenicidad, por causar significativas pérdidas económicas, por su amplia distribución geográfica y por ser uno de los principales géneros parasitarios, que presenta resistencia múltiple a tratamientos antihelmínticos (Gasbarre 2014; Hernández 2011; Arsenopoulus et al. 2021; Naeem et al. 2021). La elevada patogenicidad en el parásito adulto está dada por la caracte rística de succionar sangre capilar de la pared del estómago del hospedador, lo que conduce a cuadros severos de anemia con la ocasional muerte de los animales infectados. La primera consecuencia de la infección por H. contortus es la re ducción significativa en la producción animal, que incluye disminución del crecimiento de los animales y disminución de la producción de leche y lana, lo que resulta en pérdidas económicas para los productores (Arsenopoulus et al. 2021).
Haemonchus contortus se encuentra distribuido en todo el mundo. Las con diciones climáticas tienen un significativo impacto en el desarrollo de la infección. El clima cálido y húmedo de los países tropicales y subtropicales es la combinación óptima para el desarrollo de la infección parasitaria en los rumiantes. Sin embargo, el cambio climático está provocando reportes de haemoncosis en países con clima templado. (Naeem et al. 2021). Haemonchus ha desarrollado resistencia múltiple a los fármacos antihelmínticos comúnmente utilizados, reportándose resistencia simultánea a benzimidazoles, imidazotiazoles, lactonas macrocíclicas y monepantel en muchas partes del mundo (Arsenopoulus et al. 2021).
La creciente aparición de resistencia de los nematodos a los antihelmínticos y la presencia de residuos de drogas en los alimentos y su acción sobre otros organismos en el ambiente han causa- do la emergente necesidad de encontrar alternativas para el control y reducir el uso de antihelmínticos (Learmount et al. 2015; Moreno 2010; Birhan et al. 2020). Entre ellas el uso de plantas bioactivas con propiedades antihelmínticas es una de las opciones más prometedoras como tratamiento fitoterapéuticos o nutracéuticos por su comprobada eficacia contra nematodos, como opción de reemplazo parcial o total del uso de químicos sin- téticos corrientemente usados, y es un método amigable con el medioambiente (Mederos et al. 2012; Moreno 2010).
Hay evidencias que muestran que los taninos condensados (TC) provenientes del extracto de quebracho (Schinopsis spp.) y de otros extractos vegetales pueden redu cir la excreción de huevos y la fecundidad de las hembras parásitas, al igual que la carga de parásitos nematodos gastrointesti nales adultos en rumiantes (Athanasiadou et al. 2001; Hoste et al. 2012).
El objetivo de este trabajo fue evaluar in vitro la eficacia antiparasitaria del extracto de quebracho (Schinopsis balansae) presente en un producto comercial de uso animal disponible en el mercado, Bioquina®, sobre larvas infectantes (L3) de Haemonchus contortus de ovinos susceptibles a todos los grupos químicos de antihelmínticos, bajo condiciones de laboratorio.
MATERIALES Y MÉTODOS
Diseño experimental
El trabajo experimental se realizó en la Facultad de Ciencias Veterinarias (FCV) de la Universidad Nacional del Centro de la Provincia de Buenos Aires (UNCPBA), Tandil, Argentina, y fue aprobado por el Comité de Bienestar Animal de la FCV- UNCPBA (Resol. 021/12).
Se realizó un ensayo in vitro para evaluar la eficacia antiparasitaria del extracto de quebracho sobre larvas infectantes (L3) susceptibles de H. contortus de ovinos, utilizando la técnica de inhibición de la migración larval (IML) desarrollada por Wagland et al. (1992) y modificado por Rabel et al. (1994) y Demeler et al. (2010). Las larvas se obtuvieron a partir de cultivos de materia fecal de ovejas infectadas con cepas susceptibles provenientes de cultivos puros de H. contortus. El cultivo y posterior recuperación de larvas infectivas se realizó siguiendo las técnicas descriptas por Henriksen y Korsholm (1983), y Baermann (1917), respectivamente, citadas por Fiel et al. (2011). Con el fin de imitar las condiciones a las que se expone el parásito en el ambiente gastrointestinal y lograr el contacto directo entre taninos condensados y el nematodo se procedió al desenvaine de las larvas utilizando el protocolo del laboratorio de parasitología de la FCV de la UNCPBA, adaptado de la técnica de criopreservación de larvas L3 de nematodos de Van Wyk (1977). Para ello, 5 ml de una solución con 2000 larvas L3/ml fue mezclada con 4 ml de una so- lución de hipoclorito de sodio al 0,16%. El proceso fue monitoreado microscópicamente hasta verificar el desenvaine del 90% de las larvas L3. Posteriormente, la mezcla fue lavada con solución fisiológica y centrifugada durante 3 minutos a 2500 rpm.
La fuente de taninos utilizada fue el producto comercial Bioquina®, que es una mezcla balanceada de quebracho colorado, en polvo, de uso exclusivo en alimentación animal como aditivo alimenticio. La cantidad usada contenía 573 mg/g de polifenoles totales (PT) y 458 mg/g de taninos totales (TT), según el análisis químico del Laboratorio de Estudios Fisicoquímicos de Alimentos, Facultad de Ingeniería Química, UNL, Santa Fe, Argentina. La determinación de los PT se realizó mediante la técnica de Folin-Ciocaulteu (Folin y Ciocaulteu 1927) y la de TT mediante la técnica gravimétrica de Makkar (PVPP) (Makkar et al. 1993).
Las diluciones evaluadas fueron 5 mg/ml, 15 mg/ml y 30 mg/ml, elegidas por antecedentes previos debido a que son comparables con las concentraciones usadas in vivo (Moreno 2010). Para ello, en un erlenmeyer que contenía 100 mg de extracto de quebracho (EQ), se agregaron 50 ml de solución buffer fosfato (0,1 M fosfato, 0,05M NaCl; pH 7,2), se mezcló a 20°C, durante 2 h, y se sonicó durante 4 min. A partir de esa solución madre, se realizaron las diluciones en serie, las cuales fueron almacenadas en tubos de ensayo plásticos debidamente sellados, rotulados y mantenidos en gradilla a temperatura ambiente.
Para el test se construyeron filtros con tubos de acrílico transparente (20 mm de largo y 7 mm de diámetro interno) a los que se les adhirió una malla de 20 µm en uno de sus extremos y fueron fijados de a 6 en una barra de acrílico, según diseño descrito por Demeler et al. (2010). Se utilizaron tubos de 2 ml a los que se les agregó 0,4 ml de extracto de quebracho (EQ) con las diluciones finales (5 mg/ml, 15 mg/ml, y 30 mg/ml) y, aproximadamente, 200 larvas L3 suspendidas en 0,1 ml de solución acuosa.
Se realizaron 10 repeticiones para las diluciones de 15 mg/ml y 30 mg/ml y, por disponibilidad de larvas, 7 repeticiones para la dilución de 5 mg/ml. Un control negativo (larvas L3 en buffer fosfato) y un control positivo (larvas L3 muertas), a 70°C por 10 min en un baño maría (Álvarez, comunicación personal) con 6 repeticiones, se corrieron en paralelo.
Los tubos dispuestos en gradillas se ubicaron dentro de un recipiente plástico con tapa y fueron llevados a estufa de incubación (37ºC por 16 h). Posteriormente, el contenido de los tubos (0,5 ml) fue transferido a los filtros colocados sobre placas de cultivo celular de 24 celdas e incubados a 37ºC por 18 h para permitir a las larvas migrar a través de estos dentro de cada celda en la placa. Luego, los filtros fueron removidos de las placas y el número total de larvas en cada celda y en los filtros fue contado con la ayuda de un microscopio óptico y un microscopio invertido. Una gota de solución de lugol fue adicionada a cada celda cuando fue necesario para matar las larvas L3 y favorecer su conteo.
La inhibición de la migración larval (IML) se determinó usando la siguiente fórmula:
IML = A - B/A × 100
Donde:
A: proporción de larvas migradas en el control negativo.
B: proporción de larvas migradas en los tratamientos.
Los porcentajes de migración de larvas L3 de H. contortus ajustados por un control (buffer) (variable respuesta) a 3 diluciones diferentes de extracto de quebracho (5 mg/ml, 15 mg/ml y 30 mg/ml) (variable explicativa) se compararon mediante un análisis de varianza y la estimación de las diferencias entre grupos (a posteriori) se realizó por medio de la prueba LSD Fisher, utilizando el procedimiento PROC GLM de SAS V.9.2 (SAS, 2009).
RESULTADOS
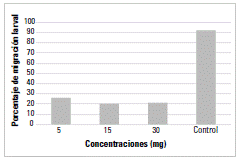
La tabla 1 muestra la estadística descriptiva de la variable migración larval después de la incubación de larvas infectivas de H. contortus con extracto de quebracho a diluciones de 5 mg/ml, 15 mg/ml y 30 mg/ml. Los resultados mostraron un alto porcentaje promedio de migración de larvas L3 de H. contortus en el tratamiento control negativo (92,35% con un error estándar de 0,97) y, en general, bajos porcentajes promedios en las diluciones evaluadas. Las concentraciones de 15 mg/ml y 30 mg/ml fueron las de menor porcentaje promedio de migración.
TABLA 1 Porcentaje de migración de larvas infectivas de H. contortus después de la incubación con extracto de quebracho a 5 mg/ml, 15 mg/ml y 30 mg/ml
| Dilución (mg/ml) | N | % de migración promedio | EE | CV | Mín. | Máx. |
|---|---|---|---|---|---|---|
| Control (-) | 6 | 92,35 | 0,97 | 2,5 | 90,34 | 96,19 |
| 5 | 7 | 26,89(a) | 1,49 | 14,69 | 19,19 | 31,42 |
| 15 | 10 | 20,36(b) | 1,58 | 24,58 | 13,95 | 27,87 |
| 30 | 10 | 20,95(b) | 2,09 | 31,60 | 14,14 | 33,63 |
Letras diferentes indican diferencias significativas al 0,05. EE: error estándar; CV: coeficiente variación Fuente: elaboración propia con base en los resultados de investigación.
Del análisis de varianza surgen diferencias significativas entre tratamientos (p = 0,0494). Al realizar la prueba de comparación de medias se evidenciaron diferencias estadísticamente significativas (p < 0,05) entre los promedios de migración a las diluciones de 5 mg/ml y 15 mg/ml y a las diluciones de 5 mg/ml y 30 mg/ml, mientras que no se detectaron diferencias significativas entre la dilución de 15 mg/ml y la de 30 mg/ml.
TABLA 2 Resultados de comparaciones de medias de porcentaje de migración larval para las distintas diluciones de extracto de quebracho analizadas
| Diluciones (mg/ml) | Estimada | Error estándar | t-Valor | p valor |
|---|---|---|---|---|
| 5 vs. 15 | 6,53 | 2,69 | 2,43 | 0,0229 |
| 5 vs. 30 | 5,94 | 2,68 | 2,21 | 0,0368 |
| 15 vs. 30 | -0,59 | 2,44 | -0,24 | 0,8111 |
Fuente: elaboración propia con base en los resultados de investigación.
DISCUSIÓN
El efecto del extracto de quebracho (EQ) demostrado en el presente estudio es acorde con una serie de trabajos in vitro que respaldan las propiedades antihelmínticas de los taninos condensados (Alonso Díaz et al. 2008; Calderón-Quintal et al. 2010).
Los resultados obtenidos mostraron una significativa acción del extracto de quebracho en la inhibición de la migración de larvas infectantes L3 de H. contortus de ovinos a las diferentes concentraciones evaluadas. Las diferencias significativas entre la dilución más baja de 5 mg/ml y las diluciones de 15 mg/ml y 30 mg/ml indican que, a mayor concentración, mayor es el efecto sobre la migración larval. Sin embargo, se observó que no existen diferencias significativas en el porcentaje de migración entre las concentraciones de 15 mg/ml y 30 mg/ml (tabla 1), lo que sugiere que por más que se aumente la concentración de extracto de quebracho el efecto sobre la IML no se incrementaría.
El efecto inhibitorio del extracto de quebracho en la migración de larvas L3 de H. contortus ovino observado en nuestro estudio concuerda con los resultados obtenidos por Athanasiadou et al. (2001), quienes evaluaron in vitro el efecto antihelmíntico de los TC del extracto de quebracho, sobre la viabilidad de larvas L3 de H. contortus, Teladorsagia circumcincta y Trichostrongylus vitrinus en ovinos a concentraciones de 0, 12,5, 25, 50 y 100 mg/ml, mediante la prueba de desarrollo y viabilidad larval. Moreno (2010) evaluó in vitro el efecto antihelmíntico de extractos de plantas nativas australianas sobre L3 de H. placei, H. contortus, Cooperia spp. y Trichostrongylus colubriformis, utilizando la técnica de IML a concentraciones de 5 mg/ml, 15 mg/ml y 30 mg/ml, encontrando efectos inhibitorios de la migración larval con los diferentes extractos de plantas en cada uno de los géneros parasitarios evaluados. Uno de los desafíos cuando se usan extractos para medir la actividad antihelmíntica de plantas medicinales está relacionado con la concentración de compuestos activos en el extracto y aquel encontrado en la planta. Un extracto de planta obtenido mediante algún proceso de extracción inevitablemente tiene una alta concentración de compuestos activos. En la mayoría de los casos esto no se corresponde con la concentración de compuestos activos consumidos por el hospedador parasitado cuando la planta es incluida en sus dietas. Como consecuencia es común observar alta eficacia antihelmíntica de plantas medicinales cuando sus extractos son probados in vitro o cuando estos son ofrecidos como suplemento medicinal. Sin embargo, la eficacia no es alta cuando la planta entera es ofrecida al hospedador parasitado (Moreno 2010).
El efecto de los vegetales con propiedades antihelmínticas contra L3 de helmintos en ensayos in vitro parece depender de la concentración a la que sean sometidos. Entre los autores que pregonan esta idea se encuentran Alonso Díaz et al. (2008), quienes, al evaluar el efecto de 4 extractos de plantas taníferas tropicales a diferentes concentraciones en larvas L3 susceptibles de H. contortus caprino, encontraron inhibición en la migración larval con los extractos de plantas con niveles más altos de polifenoles totales, taninos totales y taninos condensados demostrando efecto dosis dependiente. Hoste et al. (2009) observa- ron reducciones en la migración larval con concentraciones similares, pero de extractos de plantas leñosas contra larvas L3 de H. contortus, T. circumcincta y T. colubriformis de ovinos y caprinos. Birhan et al. (2020) investigaron la actividad antihelmíntica in vitro de extractos de plantas taníferas tropicales sobre la inhibición del desarrollo larvario de Haemonchus contortus en ovejas y encontraron que los extractos demostraron un efecto inhibitorio dependiente de la dosis. Molan et al. (2000) encontraron que extractos de Sulla (Hedysarum coronarium) adicionados al fluido ruminal y abomasal inhiben la migración de larvas L3 de H. contortus en un 72% y 81%, respectivamente, a la concentración de 1 mg/ml de TC. Es probable que diferencias metodológicas, tipo y concentraciones de TT hayan contribuido a variaciones de eficacia entre nuestros resultados y los reportes anteriormente citados. En nuestro estudio se evaluó el efecto inhibitorio utilizando L3 desenvainadas con el fin de simular las condiciones fisiológicas de las larvas en el hospedador, mientras que en los ensayos previamente mencionados, a excepción de Alonso Díaz et al. (2008), se utilizaron larvas L3 envainadas. Además, presentan diferencias relacionadas con tiempos y temperaturas de incubación. Varios estudios in vitro reportan que existe una relación dosis-dependiente entre la eficacia antihelmíntica y la concentración de los metabolitos secundarios de las plantas (MSP) (taninos o flavonoides) presentes en los extractos de plantas (Alonso et al. 2008; Athanasiadou et al. 2001; Azando et al. 2011; Birhan et al. 2020). Sin embargo, en nuestro estudio las concentraciones de 15 mg/ml y 30 mg/ml que fueron las más altas utilizadas y de mejor comportamiento, mostraron una tendencia a estabilizar el efecto antihelmíntico, lo que indica que probablemente existe un umbral antihelmíntico para los taninos utilizados en este ensayo. Estas variaciones dosis-dependientes probablemente estén determinadas por las diferentes características químicas de los TC, las proporciones de cada uno de ellos en las fuentes y la etapa parasitaria (Birhan et al. 2020; Hounzangbe et al. 2005; Paolini et al. 2003b). Brunet et al. (2011), en un estudio en el que compararon cambios ultraestructurales entre larvas L3 desenvainadas y envainadas de H. contortus y T. colubriformis expuestos a TC de extracto de esparceta (Onobrychis viciifoli) describieron que los cambios funcionales en la biología de las larvas L3 estuvieron determinados por una acción directa de los TC del extracto sobre la estructura del nematodo. En larvas L3 envainadas, las lesiones parecen estar asociadas principalmente con la cutícula, ocasionando un bloqueo en la regulación fisicoquímicas que esta realiza y afectando intercambios entre el medioambiente y el parásito, resultando en asfixia y toxicidad celular debida a la acumulación de productos metabólicos. Con respecto a las larvas L3 desenvainadas, el daño más frecuentemente observado ha sido en células intestinales, posiblemente debido a la ingestión de algunos metabolitos secundarios presentes en los extractos que podrían interferir con los procesos digestivos de las larvas y afectar su nutrición (Brunet et al. 2011). Alowanou et al. (2019) reportaron que la IML de los extractos evaluados en su estudio puede ser atribuida a la presencia de MSP como saponinas, alcaloides, taninos y flavonoides que se encontraron en las hojas de las plantas estudiadas. Estos MSP pueden difundirse a través de la cutícula de las larvas o hacia sus células intestinales para inhibir la migración o causar su mortalidad.
Alonso Díaz et al. (2011) compararon la diferencia de sensibilidad entre larvas L3 envainadas y desenvainadas de H. contortus con extractos de plantas tropicales ricas en taninos mediante las técnicas de IML y la de inhibición de larvas desenvainadas (IML), encontrando una potente inhibición de la motilidad de las larvas L3 de H. contortus desenvainadas, en relación con las envainadas. Resultados similares fueron reportados por Son de Fernex et al. (2012). La capacidad de las larvas L3 desenvainadas para alimentarse favorecerían el accionar de los polifenoles, ya que afectarían directamente los sistemas digestivo y muscular, determinantes para la supervivencia larval (Athanasiadou et al. 2001; Brunet et al. 2011; Hoste et al. 2012).
Aunque existe numerosa información acerca de la actividad antihelmíntica del extracto de quebracho, en general, los estudios realizados a la fecha presentan resultados dispares. Es necesario que los resultados generados in vitro sean validados con estudios in vivo. Algunos estudios han encontrado concordancia entre los resultados in vitro e in vivo (Athanasiadou et al. 2000a; Paolini et al. 2003a, 2003b). Sin embargo, se requiere prudencia en la extrapolación de los resultados in vitro a condiciones in vivo, debido a que los componentes químicos de las plantas pue- den ser modificados luego de pasar por el tracto digestivo, particularmente rumen y pueden afectar a los taninos por degradación bacteriana y formación de complejos con proteínas (Paolini et al. 2004). Por otro lado, las diferencias dosis-respuestas encontradas en los estudios citados, sugiere la necesidad de continuar con otras investigaciones que permitan establecer un umbral de actividad antihelmíntica.
CONCLUSIONES
Los resultados de este estudio in vitro sugieren la existencia de propiedades antihelmínticas asociadas al extracto de quebracho y, si bien su eficacia no es comparable a la de los antihelmínticos químicos convencionales, su aplicación podría estar justificada al no dejar residuos en el animal ni en el ambiente y que además puedan tener efectos nutricionales o beneficios en el metabolismo del animal aún poco conocidos.