INTRODUCCIÓN
El síndrome de úlcera gástrica en mulas (SUGM) ha sido poco estudiado, sin embargo, recientemente un estudio describió una frecuencia de presentación de 42,3% (Calixto 2020). Aunque se determinó la presencia de úlceras en ambas mucosas gástricas en las mulas, la presentación y el grado de severidad fue menor a lo reportado en equinos y asnales. Por el contrario, el síndrome de úlcera gástrica en equinos (SUGE) es ampliamente estudiado, con prevalencias que oscilan entre 60% y 100% y con la identificación de factores de riesgo en diferentes razas, grupos de edades y sistemas de manejo (Aranzales et al. 2012; Gómez et al. 2020; Jonsson y Egenvall 2006; Sykes et al. 2015; Vatistas et al. 1999; Zuluaga y Martínez 2018).
Las ulceraciones gástricas se consideran de naturaleza multifactorial, donde factores inherentes al animal, como sexo, raza, edad, temperamento, al igual que factores extrínsecos, como manejo alimentario, estabulación, administración de antiinflamatorios no esteroideos (AINE), tipo e intensidad del ejercicio y entrenamiento y eventos estresantes, se han implicado como factores predisponentes al generar desequilibrio entre los mecanismos de defensa de la mucosa gástrica y los agentes agresores tanto endógenos como exógenos (Banse y Andrews 2019; Martínez y Silveira 2014; Martínez et al. 2015; Murray y Eichorn 1996; Padalino et al. 2020; Pedersen et al. 2018). Adicionalmente, microbiota, bacterias ácido-resistentes, metabolitos bacterianos y parásitos (Gasterophilus spp., Habronema spp) también son señalados de ocasionar lesiones en la mucosa gástrica (Al-Mokaddem et al. 2014; Andrews et al. 2006; Cardona et al. 2016).
En seres humanos, el Helicobacter pylori es bien descrito como agente causal de úlcera gástrica (Campuzano 2007; Scarano et al. 2005); sin embargo, en equinos es controversial en la etiología de SUGE, una vez que se ha detectado H. pylori y H. equorum en ambas mucosas, tanto en potros y adultos (Moyaert et al. 2007) como en sanos y enfermos (Zuluaga et al. 2018); si bien se ha descrito histológicamente la respuesta inflamatoria que induce en la mucosa glandular gástrica el Helicobacter spp. (Cardona et al. 2009b). Sin embargo, en mulas no existe literatura sobre la presencia o participación de esta familia de microorganismo en la génesis o perpetuación del SUGM. Por tanto, este trabajo tuvo como objetivo establecer la presencia de Helicobacter spp. en mucosa gástrica glandular de mulas a través de la prueba rápida de la ureasa (PRU) y el análisis histopatológico.
MATERIALES Y MÉTODOS
Animales
Un total de 97 mulares (65 machos y 32 hembras), con promedio de edad de 8,7 ± 4,4 años, peso promedio de 290,5 ± 37,6 kg, condición corporal promedio de 5 ± 0,8 (Henneke et al. 1983), manejados a pasto y suplementados con subproductos de la caña de azúcar y agua ad libitum, destinados a trabajos agropecuarios y clínicamente sanos, fueron incluidos en el estudio. Animales menores de dos años y con historial de tratamientos gástricos, administración de antibióticos y/o AINE durante los últimos seis meses fueron excluidos.
Comité de ética
Este trabajo se realizó con la aprobación del Comité de Ética para la Experimentación con Animales de la Universidad de Antioquia, Protocolo no. 1222019.
Toma de biopsias gástricas a través del gastroscopio
Previo periodo de ayuno de sólidos y líquidos de 12 y 4 horas, respectivamente, y sedación con xilacina al 10% (1,3 mg/kg/iv), se procedió a la introducción del gastroscopio (PortaScope®, 1800PVS, Bradenton, FL, EUA) vía nasoesofágica, para luego introducir la pinza de biopsia transendoscópica flexible a través del canal del trabajo del endoscopio (Murray et al. 1989). Se tomaron tres (3) muestras de aproximadamente 3x3 mm de la mucosa gástrica glandular, se usaron dos en las pruebas de actividad de la ureasa (PRU) y una fue conservada en solución de formol al 10% para análisis por histopatología (Zuluaga y Martínez 2018).
Prueba rápida de ureasa (PRU)
Las muestras de mucosa gástrica fueron sumergidas inmediatamente en dos medios (caldo y Agar Urea) para la identificación de Helicobacter spp. El caldo urea modificado fue preparado con 10 g de úrea al 100% (Merck, Darmstadt, Alemania), diluido en 500 ml de agua destilada, más 0,005 g de rojo fenol y 0,2 ml de HCl al 97%, con pH de 7 y alicuotado en tubos Eppendorf de 1,5 ml (Zuluaga y Martínez 2018). Para la preparación del Agar Urea (prueba de oro), se diluyó 2 g de base Agar Urea (Urea Agar Base Christensen® para microbiología, Merck KGaA, Darmstadt, Alemania) en 100 ml de agua destilada, y alicuotado en tubos Eppendorf de 1,5 ml (Zuluaga y Martínez 2018).
Ambos medios fueron transportados en condiciones de refrigeración y se estableció un periodo de reacción a temperatura ambiente de 48 horas, subdividido en tiempos de 6 a 12 horas (T1), 12 a 24 horas (T2), 24 a 48 horas y no reacción (NR); tiempos utilizados para la observación y el análisis colorimétrico (Zuluaga y Martínez 2018).
Análisis histopatológico
Las muestras tomadas durante las gastroscopias fueron seleccionadas de acuerdo con el grado de ulceración (> 2°) según Andrews et al. (1999); se analizaron con técnicas convencionales y de rutina de inclusión en parafina, cortadas a 5 μm y sometidas a las tinciones de H&E y Giemsa, para la descripción de hallazgos anormales del tejido e identificar la presencia de bacterias curvoespiraladas compatibles con Helicobacter spp., respectivamente.
Análisis estadístico
La información obtenida fue recolectada y analizada usando los programas SPSS® y Microsoft Office Excel® (Microsoft Office 2013®, Microsoft Corporation, WA, USA), se implementó estadística descriptiva, análisis de frecuencia absoluta y relativa. Estos datos fueron representados en gráficos de distribución de barras.
RESULTADOS
Los resultados de reacción de la PRU se muestran en la figura 1. El caldo urea presentó un mayor porcentaje de reacción de positividad (4,1%) al compararse con el medio Agar Urea. Por otro lado, el 9,27% de las muestras reaccionó en ambos medios.
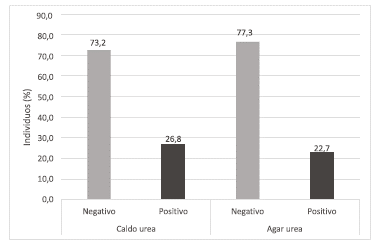
Fuente: Elaboración propia.
FIGURA 1 Resultados de reacción de la prueba rápida de la ureasa (PRU), utilizada para la determinación de Helicobacter spp. en muestras de mucosa gástrica glandular de mulares.
Las reacciones de las muestras en los tiempos establecidos para ambos medios se presentan en la figura 2. En T1 y T2, el caldo urea mostró mayor reacción, mientras que el Agar Urea reveló mayor reacción en T3. Adicionalmente, ambos medios presentaron elevados porcentajes de NR.
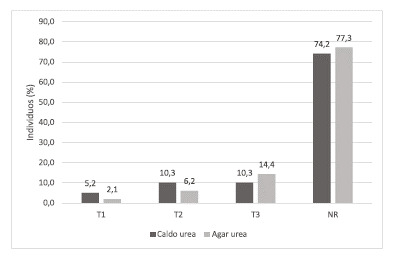
Fuente: Elaboración propia.
FIGURA 2 Distribución de las reacciones en los periodos de tiempo establecidos para la PRU, utilizada para la determinación de Helicobacter spp. en muestras de mucosa gástrica glandular de mulares.
Se analizó por histopatología 19/97 muestras de mucosa glandular gástrica, correspondientes a las de mayor grado de ulceración (3° y 4°). La tinción H&E reveló mucosa con erosión, hemorragia subepitelial, focos de ulceración y procesos inflamatorios crónicos (figura 3a) que se clasificaron como: gastritis crónica activa hemorrágica (33,4%) (figura 3b), gastritis crónica fibrosante (33,3%), gastritis crónica fibrosante y atrófica (16,5%), gastritis crónica activa (5,6%), gastritis crónica fibrosante y proliferativa (5,6%) y gastritis crónica activa eosinofílica con parásitos intralesionales (5,6%) (figuras 3c y 3d). Para la tinción Giemsa, ninguna de las muestras fue positiva a la presencia de bacterias curvoespiraladas compatibles con Helicobacter spp.
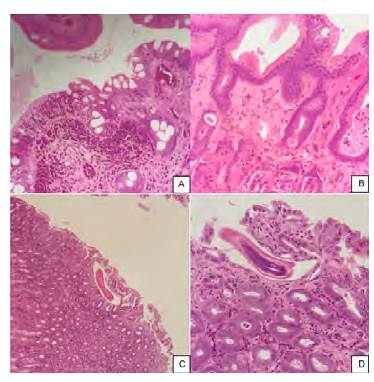
Fuente: Elaboración propia.
FIGURA 3 Lesiones histopatológicas en la mucosa glandular gástrica de los mulares estudiados. Tinción Hematoxilina-Eosina (H&E). A. Mucosa con erosión, hemorragia subepitelial y focos de ulceración (20x). B. Gastritis crónica hemorrágica con depósitos de colágeno (10x). C. Gastritis crónica activa con parásitos intralesionales (4x). D. Forma parasitaria compatible con nematodo en mucosa gástrica (40x).
DISCUSIÓN
El diagnóstico de Helicobacter spp. ha sido indicado cuando dos pruebas son positivas (Cardona et al. 2009b), esto para que haya una menor brecha entre falsos positivos y negativos. No obstante, este principio fue evidente en una proporción menor al 10% de las muestras de este estudio, cuando se presentó reactividad para ambas pruebas PRU. Sin embargo, este resultado no es concluyente, una vez que el caldo urea superó la reactividad del Agar Urea, considerada la prueba de oro para estos tipos de test, en los menores tiempos de reacción, mientras que el Agar Urea mostró mayor positividad en el periodo de tiempo más prolongado, hecho que afecta los aspectos de sensibilidad y especificidad de las PRU.
Las especies del género Helicobacter spp. exigen condiciones de incubación adecuadas que incluyen un medio microaerofílico y una temperatura entre 35°C y 37°C (López-Brea et al. 2004), lo cual no se logró cumplir en el presente trabajo, ya que las muestras se mantuvieron a temperatura ambiente alrededor de los 21°C, lo que explica la amplitud de tiempo que se dio para el cambio de coloración, situación que pone en duda su validez. Adicionalmente, se debe tener en cuenta que una baja población bacteriana puede inducir falsos negativos en la PRU, al no haber la suficiente producción de ureasa que induzca el cambio de coloración por parte del indicador de pH del medio.
El análisis histopatológico (H&E) de las muestras seleccionadas reportó en su totalidad gastritis crónica de varios tipos (hemorrágica, fibrosante, proliferativa y eosinofílica), en concordancia con los hallazgos gastroscópicos relacionados con SUGM y diferentes a las lesiones ulcerativas. Lo anterior reflejó la aplicación del criterio de inclusión, una vez que se analizaron muestras de mucosas con grados 3 y 4 de severidad, lo que también influyó en la ausencia de gastritis aguda. Sin embargo, la histopatología permitió clasificar los cuadros inflamatorios observados en la endoscopia.
En adición a los hallazgos histopatológicos descritos, se identificaron procesos inflamatorios crónicos, con presencia de parásitos intralesionales, acompañados de infiltrado eosinofílico, similar a lo reportado por Al-Mokaddem etal. (2014) en burros de Egipto. En equinos también se ha reportado infiltrados inflamatorios crónicos, pero sin presencia de formas parasitarias (Zuluaga et al. 2018), lo que podría indicar diferencias en la aplicación de estrategias antiparasitarias en los protocolos sanitarios de estas especies.
Las PRU (caldo y Agar Urea) no se asociaron con el análisis histopatológico con tinción Giemsa, al no reportar presencia de bacterias curvoespiraladas compatibles con Helicobacter spp., aunque algunos individuos mostraron reacciones positivas a las dos PRU. Lo anterior concuerda con estudios realizados en equinos, que las consideraron ambiguas y no encontraron asociación entre el Helicobacter spp. y el SUGE (Zuluaga y Martínez 2018). Adicionalmente, los resultados falsos positivos pueden obedecer a la presencia de otras bacterias productoras de ureasa (Proteus miribialis, Pseudomona aureginosa, Klebsiella spp., Yersinia spp.) sobre las superficies gástricas de equinos descritas previamente (Belli et al. 2003; Cardona et al. 2009a).
Sin embargo, es pertinente mencionar que, a pesar de la ausencia de bacterias curvoespiraladas por histopatología, se reportó gastritis crónica en la totalidad de muestras de las mulas; este mismo hallazgo se describió en estómagos de equinos de planta de beneficio, positivos a la actividad de la ureasa y con presencia de bacterias compatibles con Helicobacter spp. (Cardona et al. 2009a; Cardona et al. 2009b), varios aspectos hicieron diferencias en los resultados de esos estudios, como el uso de la tinción Whartin Starry reportada como más eficiente, el lugar de toma y el número de muestras, siendo no representativa una sola muestra de toda la superficie gástrica; y el uso de la PRU en otras investigaciones ha mostrado positividad en ambas mucosas (escamosa y glandular) (Zuluaga y Martínez 2018).
Recientemente, la técnica de cromoendoscopia gástrica simple se implemento en un grupo de caballos, lo que reveló lesiones prematuras que no fueron identificadas con la endoscopia convencional (Mira et al. 2020). Al utilizar el rojo fenol como revelador en la cromoendoscopia, se demostró gastritis crónica como hallazgo histopatológico en los sitios de reacción; sin embargo, no se identificaron bacterias curvoespiraladas con tinción Giemsa. Por tanto, la cromoendoscopia es una técnica con potencial para orientar la identificación de bacterias ureasa positivas o de lesiones asociadas en la superficie gástrica de équidos, sin necesidad de obtener un número elevado de muestras para que sea representativo de la superficie gástrica.
Un limitante en este trabajo fue el uso de una sola muestra de mucosa glandular ulcerada, influyendo en el diagnóstico de helicobacteriosis el número de muestras tomadas, al igual que el aislamiento en ambas mucosas y que las úlceras no ofrecen condiciones favorables para la viabilidad del microorganismo (Contreras et al. 2007; Cardona et al. 2009b; Zuluaga y Martínez 2018; Zuluaga et al. 2021).
CONCLUSIONES
En el presente trabajo no se encontró asociación entre la presencia de helicobacteriosis y las lesiones gástricas, sin embargo, el uso de técnicas como la cromoendoscopia convencional y complementada por técnicas moleculares en superficie gástrica de mulas contribuiría a determinar o aclarar la participación o presencia de Helicobacter spp. en el SUGM. Por tanto, en condiciones del presente trabajo y, teniendo en cuenta que solo se realizó histopatología en una muestra, no se puede descartar ni confirmar la participación de esta bacteria en SUGM, debido a las limitaciones de este estudio y por ser controversial aún en los equinos.














