INTRODUCCIÓN
Dientamoeba fragilis es un protozoario intestinal de distribución mundial y comúnmente identificado en el humano (Cacciò 2018; Stark et al. 2016). Se reportan prevalencias que varían entre 0,2% y 82%, con mayor frecuencia en países en desarrollo (Cacciò 2018). Dientamoeba fragilis fue descubierto en 1909 por Charles Wenyon, luego de examinar sus propias preparaciones de heces, pero solo hasta 1918, Jepps y Dobell realizaron su descripción morfológica, clasificándolo inicialmente como una ameba (Stark et al. 2016). Estudios posteriores tanto ultraestructurales, mediante microscopía electrónica, como inmunológicos y filogenéticos acercaron a Dientamoeba a protozoarios flagelados del género Histomonas y Trichomonas (Stark et al. 2016). En la actualidad, D. fragilis se ubica taxonómicamente dentro del grupo Parabasalia (protozoarios flagelados sin mitocondrias, con hidrogenosomas y aparato parabasal), clase Tritrichomonadidae, orden Trichomonadida (trofozoítos uninucleados o binucleados, con hasta 5 flagelos), familia Dientamoebidae (sin membrana ondulante y costa, ancestros con 4 flagelos), género Dientamoeba, y especie fragilis (Cepicka et al. 2010). La caracterización molecular de aislados humanos mediante el análisis del gen que codifica para la subunidad pequeña del ARN ribosomal ha revelado la presencia de dos genotipos (1 y 2) de D. fragilis, en el que el genotipo 1 es el más frecuente en el ámbito mundial (Windsor et al. 2006).
Dientamoeba fragilis presenta un trofozoito pleomórfico, con un tamaño que oscila entre 4 a 20 um (con un rango promedio de 5 a 15 μm), generalmente binucleado, aunque en ocasiones puede presentar un solo núcleo, con un cariosoma que contiene entre 4 a 8 gránulos de cromatina y un flagelo intracitoplasmático (Stark et al. 2016). Aunque inicialmente muchos autores reportaron la ausencia del estadio de quiste en el ciclo de vida de D. fragilis, estudios recientes en un modelo animal murino describen la presencia de estos estadios parasitarios en la materia fecal de los animales infectados (Munasinghe et al. 2013). Otros investigadores han detectado estadios quísticos en muestras de humanos (Stark et al. 2014). Sin embargo, a pesar de estos hallazgos, la existencia de quistes en D. fragilis todavía es controversial.
El ciclo de vida de D. fragilis aún no se ha esclarecido, pues se desconocen aspectos relacionados con las rutas de transmisión, el rango de hospedadores naturales y el estadio parasitario infectante, entre otros (Barratt et al. 2011a). Se han postulado dos principales mecanismos de infección para este protozoario, sin embargo, no hay evidencias que soporten uno u otro (Barratt et al. 2011a; Stark et al. 2016). En el primero se considera la participación de un helminto (Enterobius o Ascaris) que actúa como vector de los trofozoítos de este parásito. El segundo implica la transmisión de D. fragilis a través de la ruta oro-fecal mediante el consumo de trofozoítos o quistes en agua o alimentos contaminados.
En cuanto a los hospedadores y posibles reservorios para D. fragilis, además de los humanos, este parásito se ha identificado en otros animales que incluyen principalmente primates no humanos (gorilas, macacos, mandriles) y cerdos (Cacciò 2018). Los cerdos domésticos y salvajes (Sus scrofa) son susceptibles a una amplia gama de enfermedades infecciosas, incluidas las parasitarias (Solaymani-Mohammadi y Petri 2006), por lo que son considerados los reservorios más importantes de patógenos zoonóticos, debido al gran tamaño de su población a nivel mundial (más de mil millones), al contacto cercano con los humanos y al manejo inadecuado de sus heces fecales (Cacciò et al. 2012). Si bien la mayoría de animales domésticos no se infectan normalmente con D. fragilis (Roberts et al. 2012), los cerdos se consideran hospedadores naturales para este protozoario, y por tanto una importante fuente de infección (Cacciò et al. 2012).
Los estudios de prevalencia de D. fragilis en cerdos presentan resultados variables, desde su ausencia en porcinos en Australia (Chan et al. 2016), hasta datos entre un 43,8% (Crotti et al. 2007) a un 70% (Cacciò et al. 2012) en Italia. Adicionalmente, análisis moleculares han confirmado la circulación del genotipo 1 (predominante en humanos) en cerdos de diferentes granjas en Italia (Cacciò et al. 2012).
Dientamoeba fragilis es un parásito intestinal que se detecta con frecuencia en humanos que presentan una variedad de síntomas clínicos, que incluyen principalmente dolor abdominal y diarrea, aunque se describen otras manifestaciones como pérdida de peso, anorexia, flatulencia, fatiga, náuseas, vómito y prurito anal (Barratt et al. 2011b; Van Gestel et al. 2019). En adición, también se ha asociado con enfermedades inflamatorias intestinales, como el síndrome del intestino irritable, una enfermedad cada vez más común que afecta la calidad de vida de las personas, y con alteraciones cutáneas como la urticaria. Sin embargo, este protozoario también se ha encontrado comúnmente en sujetos asintomáticos, por lo que su relevancia clínica aún es controversial (Wong et al. 2018; Van Gestel et al. 2019).
Teniendo en cuenta la escasez de datos con respecto a la frecuencia de D. fragilis a nivel mundial, y la importancia de los cerdos como posibles reservorios de parásitos potencialmente patógenos, el presente estudio tuvo como objetivo determinar la presencia de D. fragilis y otros protozoarios intestinales en una población porcina en fase preceba de una granja tecnificada del corregimiento de San Antonio de Prado mediante examen microscópico de muestras fecales procesadas por coprológico directo y tinciones especiales.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo de corte transversal con muestreo por conveniencia en una granja de porcicultura tecnificada, la cual alberga aproximadamente 1.200 porcinos en diferentes etapas de crecimiento. El sitio de muestreo se ubica en el corregimiento de San Antonio de Prado, municipio de Medellín, departamento de Antioquia, Colombia, a 6°10'60" Norte y 75°40'0" Oeste, a 2.440 msnm. La temperatura ambiente promedio es de 15,8 °C, presenta una humedad relativa entre 80,62% y 88,43% y una precipitación promedio anual de 2.919 mm (Climate-data.org). Los animales estaban sometidos a los cambios de temperatura y humedad propios del clima (el control de estas variables se realiza por medios físicos como paredes de concreto). La granja cuenta con iluminación natural y alrededor no existen fuentes importantes de ruido. En cuanto a la infraestructura, los corrales se dividen por paredes de concreto, puertas y ventanas de barrotes; el suelo presenta una división (media plaqueta y medio concreto), al cual se le realiza diariamente lavado y desinfección (Polybiocidex NF, BioAra SA veterinaria). Cada corral dispone de varios bebederos y comederos y contiene aproximadamente 90 animales. Los cerdos de la granja se alimentan a base de concentrado, cada animal consume aproximadamente 200 kg de alimento desde el destete hasta la salida a sacrificio. El agua proviene de un nacimiento, es tratada con pastillas de cloro y está libre de aguas negras y heces humanas. Se calcula que cada cerdo bebe aproximadamente 2 litros de agua al día. Para el ingreso de personal a la granja, se exige baño previo, al igual que uso de overol y botas.
Población y muestra
La población estuvo constituida por 1.200 cerdos de las razas Pietran y Camburok en etapa preceba de una granja de la vereda Las Playas del corregimiento de San Antonio de Prado, Medellín, distribuidos en 6 corrales según la edad (30 a 65 días de nacidos) y el género (proporción machos y hembras 50/50), con un peso que oscilaba entre 8 kg y 16 kg. Se realizó un muestreo por conveniencia, tomando muestras al azar de 10 a 13 cerdos por corral para un total de 70 cerdos. Lo anterior teniendo en cuenta el periodo destinado para la recolección de las muestras y la financiación del proyecto. Adicionalmente, se aplicó un cuestionario que incluía datos sobre la granja y los animales, datos de contacto del administrador, el veterinario responsable y el estado de salud de los cerdos. Las muestras fueron recolectadas entre mayo y junio de 2018.
Comité de ética
El manejo de los animales y la obtención de las muestras se realizó según las disposiciones descritas en las leyes colombianas (decreto 2257 de 1986, artículo 49 y resolución 8430 de 1993). La investigación contó con el aval del Comité de Ética de la Sede de Investigación Universitaria (SIU), acta n.° 117 del 25 de abril de 2018.
Recolección de la muestra
Se recolectaron 2 g de materia fecal de forma manual directamente del recto de los animales. Inmediatamente se realizó un extendido delgado en lámina portaobjetos (Garcia et al. 2018), el cual se mantuvo en solución fijadora de Shaudin hasta su procesamiento por tinción tricrómica en el laboratorio. El resto de la muestra se depositó en frascos de plástico tapa rosca. Cada muestra fue marcada con la identificación del animal, la fecha y el número del corral. El resto del material recolectado se conservó en solución preservante de SAF (acetato de sodio, ácido acético y formaldehído) para mantener la morfología de los estadios parasitarios. Todas las muestras fueron transportadas al laboratorio de la Escuela de Microbiología de la Universidad de Antioquia para su procesamiento por coprológico directo y tinción de Ziehl Neelsen modificado y tricrómica.
Coprológico
Se realizó examen macroscópico y microscópico de las muestras de materia fecal de cada cerdo. Se evaluaron aspectos macroscópicos como color, consistencia, presencia de moco y sangre. Se realizó evaluación microscópica con objetivo de 10X y 40X de montajes en solución salina y lugol. El reporte de los resultados se efectuó de forma cualitativa, anotando la presencia de parásitos en la muestra.
Tinción tricrómica
Se siguió el protocolo de tinción descrito por el fabricante del colorante tricrómico (Para-Pak® Trichrome Stain, Meridian Bioscience, Inc. Cincinnati, OH, USA) con algunas modificaciones. En breve: los extendidos fueron fijados en Shaudin de 18 a 24 horas. Cada una de las placas fue sumergida de manera consecutiva en frascos coplin que contenían los siguientes reactivos: alcohol yodado durante 10 minutos, alcohol al 70% por 4 minutos (2 veces), colorante tricrómico por 8 minutos, etanol ácido por 15 segundos (sin enjuagar), alcohol al 95% por 2 segundos, alcohol al 95% por 5 minutos (2 veces), alcohol absoluto por 3 minutos y finalmente en xilol por 3 minutos. Los extendidos se analizaron por microscopía óptica de luz con objetivo de 100X. Se evaluó la presencia de trofozoítos de D. fragilis.
Tinción de Ziehl Neelsen modificado
Se siguió el protocolo de tinción descrito por Magi et al. (2006) con algunas modificaciones. En breve: el extendido de materia fecal se fijó durante 5 minutos en metanol absoluto. Luego se sumergió por 20 minutos en fucsina fenicada, se realizó lavado y se continuó con el paso de decoloración en ácido sulfúrico al 7% durante 30 segundos. Posteriormente, se colorearon las placas con azul de metileno (colorante de contraste) durante 3 minutos y se realizaron lavados con agua. Se evaluó la presencia de coccidias y Cryptosporidium spp. mediante análisis microscópico con objetivo de 100X. El reporte de los resultados se efectuó de forma cualitativa, registrando la presencia de parásitos en cada muestra.
Análisis estadístico
Los datos obtenidos en el cuestionario y los resultados de las diferentes técnicas de laboratorio se ingresaron en una base de datos en SPSS, a partir de la cual se calculó la frecuencia para cada uno de los parásitos. Además, se aplicaron pruebas como Chi Cuadrado y la prueba U de Mann-Whitney con un nivel de confianza del 95% para la asociación de D. fragilis con los demás parásitos encontrados y variables como la edad, el sexo y la presencia de diarrea.
RESULTADOS
Se realizó un estudio descriptivo en el que se evaluaron muestras de materia fecal de cerdos en etapa preceba en una granja del corregimiento de San Antonio de Prado, Medellín, entre abril y octubre de 2018. Los cerdos estaban distribuidos en corrales de acuerdo con la edad y el sexo (tabla 1). Del total de muestras evaluadas, nueve (13%) tenían consistencia diarreica, las cuales provenían de cerdos de tres corrales (5, 6 y 8), siendo más frecuente esta característica en los animales del corral 6 (4 muestras), donde se albergaban solo hembras.
TABLA 1. Población de estudio. Cerdos en fase preceba de una granja de la vereda Las Playas del corregimiento de San Antonio de Prado (Medellín)
| Número de corral | Número de animales evaluados/número de animales por corral | Género | Edad promedio /días | Rango de peso / kg |
|---|---|---|---|---|
| 5 | 10/78 | Machos | 65 | 14-16 |
| 6 | 10/72 | Hembras | 65 | 14-16 |
| 7 | 13/136 | Machos | 58 | 10-12 |
| 8 | 12/136 | Hembras | 58 | 10-12 |
| 9 | 13/62 | Machos | 30 | 8-10 |
| 10 | 12/53 | Hembras | 30 | 8-10 |
Fuente: Elaboración propia.
Mediante tinción tricrómica, se detectó la presencia de trofozoítos de D. fragilis en 9 de las 70 muestras evaluadas, con una prevalencia para este parásito del 13%. En la figura 1, se observa un trofozoito de D. fragilis encontrado en una de las muestras positivas para este protozoario. Este parásito se encontró en al menos un animal de los corrales que se eligieron para el estudio, independientemente del sexo y la edad. No se encontraron asociaciones estadísticamente significativas entre D. fragilis y el resto de los parásitos observados, tampoco con variables como el sexo y la edad de los animales, ni con la presencia de diarrea (p> 0,05). En 69 de las 70 muestras evaluadas (98%) se encontró al menos un parásito, con frecuencias variables, entre las cuales las más altas correspondieron a Entamoeba spp. (66%); Blastocystis spp. (64%), Balantioides coli (36%) y Cryptosporidium spp. (36%) (tabla 2). No se observaron helmintos en las muestras analizadas.
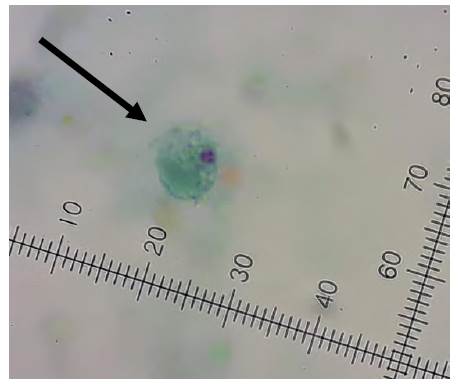
Fuente: Grupo de Microbiología ambiental, Escuela de Microbiología, Universidad de Antioquia.
FIGURA 1 Trofozoítos de Dientamoeba fragilis en materia fecal de porcinos. Tinción tricrómica. Objetivo 100X.
TABLA 2 Prevalencia de Dientamoeba fragilis y otros protozoarios intestinales en cerdos en fase de preceba de una granja del corregimiento de San Antonio de Prado (Medellín)
| Parásito | Número total de animales positivos | Prevalencia (%) |
|---|---|---|
| Entamoeba spp. | 46 | 66 |
| Blastocystis spp. | 45 | 64 |
| Balantidium coli | 25 | 36 |
| Cryptosporidium spp. | 25 | 36 |
| Lodamoeba butschlii | 12 | 17 |
| Dientamoeba fragilis | 9 | 13 |
| Coccidias | 3 | 4 |
| Giardia spp. | 1 | 1,4 |
Fuente: Elaboración propia.
En 8 de las 9 muestras positivas para D. fragilis se encontraron otros parásitos intestinales (tabla 3), que incluyeron comensales como Entamoeba spp. y Endolimax nana y patógenos como Balantioides coli, Cryptosporidium spp., Blastocystis spp. La coinfección más frecuente fue la de este último parásito.
TABLA 3 Prevalencia de coinfecciones entre Dientamoeba fragilis y otros parásitos intestinales en los cerdos evaluados en el estudio
| Coinfecciones | n.° (%) |
|---|---|
| D. fragilis + Entamoeba spp. + Endolimax nana+ Blastocystis spp. + Cryptosporidium spp. | 1 (11,1%) |
| D. fragilis + Entamoeba spp. + Blastocystis spp. + Cryptosporidium spp. | 1 (11,1%) |
| D. fragilis + Entamoeba spp. + Blastocystis spp. + Balantioides coli | 1 (11,1%) |
| D. fragilis + Blastocystis spp. | 2 (22,2%) |
| D. fragilis + Blastocystis spp. + Giardia spp. | 1 (11,1%) |
| D. fragilis + Balantioides coli | 1 (11,1%) |
| D. fragilis + Cryptosporidium spp. | 1 (11,1%) |
Fuente: Elaboración propia.
DISCUSIÓN
Los animales son considerados hospedadores de una gran variedad de parásitos intestinales, lo que facilita su transmisión a los humanos, siendo los cerdos uno de los más importantes reservorios para agentes infecciosos de origen parasitario (Solaymani-Mohammadi y Petri 2006). Factores como el hacinamiento, la inmadurez inmunológica, el estrés y las condiciones sanitarias de manejo favorecen la infección de estos animales (Solaymani-Mohammadi y Petri 2006). Adicionalmente, el continuo crecimiento en el número y la distribución geográfica de porcinos aumenta la probabilidad de exposición directa o indirecta de las personas a los parásitos que los infectan (VanderWaal y Deen 2018).
Dientamoeba fragilis es un protozoario intestinal que infecta con gran frecuencia humanos y del que se desconocen varios aspectos biológicos y epidemiológicos, como hospedadores naturales y reservorios (Barratt et al. 2011a). Hasta el momento, son escasos los datos que soportan la existencia de hospedadores diferentes al hombre y que sugieran un potencial zoonótico para este protozoario. En la literatura científica hay pocas investigaciones enfocadas en la búsqueda de D. fragilis en animales, incluyendo porcinos (Cacciò et al. 2012; Crotti et al. 2007; Stark et al. 2008), por lo que los datos de prevalencia obtenidos en este estudio son los primeros de su tipo en Colombia. En Australia, se evaluó la presencia del parásito en muestras de materia fecal de gorilas, aves, cerdos y una variedad de mamíferos tanto silvestres como domésticos (Stark et al. 2008). Los autores solo encontraron D. fragilis en las muestras procedentes de gorilas, lo que sugiere un rango estrecho de hospedadores para este protozoario. Sin embargo, las limitaciones del estudio, como el número reducido de muestras y el procesamiento mediante PCR de muestras fijadas con SAF, pudieron haber influido en la ausencia de muestras positivas procedentes de los otros animales evaluados en dicho trabajo. Por el contrario, dos investigaciones realizadas en población porcina en Italia reportaron prevalencias de D. fragilis del 43,8% (Crotti et al. 2007) y 70% (Cacciò et al. 2012) mediante análisis microscópico y PCR, respectivamente. En el presente estudio, se obtuvo una frecuencia de D. fragilis del 13%. La variabilidad observada en los datos reportados hasta el momento puede deberse a las diferencias en sensibilidad y especificidad de las técnicas utilizadas en cada investigación; las condiciones y la tecnología de manejo de los animales en las granjas evaluadas y el tamaño de la muestra, entre otros. En adición, en el presente estudio no se encontraron asociaciones estadísticamente significativas entre la presencia de D. fragilis y variables como la edad y el sexo de los cerdos evaluados y la presencia de otros parásitos; sin embargo, en la mayoría de las muestras (8 de las 9 positivas), se encontró coinfección con otros parásitos intestinales tanto comensales como patógenos. Crotti et al. (2007) hallaron una asociación entre D. fragilis y la edad de los cerdos evaluados y coinfecciones frecuentes con protozoarios comensales como Iodamoeba bustschlii y Endolimax nana. En otro estudio, estos mismos autores describieron la presencia de coinfecciones frecuentes entre D. fragilis y Blastocystis spp., Balantioides coli y Endolimax nana (Crotti et al. 2011).
En el presente estudio, de los porcinos positivos para D. fragilis solo uno presentó síntomas intestinales, específicamente diarrea. Es probable que el comportamiento de esta parasitosis en cerdos sea similar a la descrita en humanos, en quienes la infección, aunque suele ser sobre todo asintomática (Cacciò 2018), también se ha asociado con una variedad de síntomas tanto intestinales como extraintestinales, lo que incluso sugiere su relación con enfermedades intestinales inflamatorias (Aykur et al. 2020), que pueden ser debilitantes y en algunos casos producir complicaciones que ponen en riesgo la vida. En otras investigaciones no se han descrito síntomas en los animales infectados con D. fragilis, y no se conocen hasta el momento los efectos negativos sobre la población porcina.
Además de D. fragilis, se detectó un alto porcentaje de protistas intestinales en los porcinos evaluados, siendo los más frecuentes Entamoeba spp., Blastocystis spp., Balantioides coli y Cryptosporidium spp. Varias especies del género Enta-moeba pueden infectar un amplio rango de vertebrados, incluidos humanos y cerdos (Li et al. 2018). Entamoeba suis y Entamoeba polecki se han identificado como las principales especies asociadas a infección en porcinos (Hirashima et al. 2017; Li et al. 2018). Sin embargo, algunos autores postulan que estos animales también pueden actuar como potenciales reservorios para Entamoeba histolytica (Schuster y Visvesvara 2004), única ameba considerada como patógena para humanos hasta el momento. Entamoeba suis puede causar colitis hemorrágica a través de la invasión de la lámina propia y E. polecki se ha asociado con enteritis proliferativa porcina, por lo que ambas especies se han asociado con infecciones sintomáticas en porcinos (Li et al. 2018). Teniendo en cuenta que en el presente estudio la detección de estos protozoarios se realizó mediante examen microscópico, y que las diferentes especies del género presentan características morfológicas similares, no fue posible definir las especies circulantes en la población porcina evaluada. Aunque se confirmó la alta frecuencia de Entamoeba spp. en cerdos, la aplicación de estudios moleculares mediante marcadores genéticos que incluyen el gen que codifica para la subunidad pequeña del ARN ribosomal (18S) y sus regiones interespaciadoras (ITS) permitiría establecer la prevalencia de amebas patógenas para los cerdos y su potencial de transmisión zoonótica (Ji et al. 2019). Otros estudios en Colombia han reportado la presencia de Entamoeba coli en cerdos de traspatio criados en el área metropolitana de Bucaramanga (Pinilla et al. 2020; Pinilla et al. 2021).
El segundo parásito más frecuente en los porcinos evaluados fue el cromista Blastocystis spp., el cual se ha descrito al infectar el tracto gastrointestinal de humanos, primates no humanos, cerdos, bovinos, aves, anfibios y, menos frecuentemente, roedores, reptiles e insectos (Stensvold y Clark 2016). Lo anterior indica la baja especificidad de hospedadores que presenta este protista, y por tanto su gran potencial zoonótico. Similar a lo descrito para D. fragilis, la patogenicidad de este parásito aún es controversial, pues se describen cohortes de humanos infectados tanto sintomáticos como asintomáticos (Wawrzyniak et al. 2013). Blastocystis spp. se ha reportado como un parásito intestinal frecuente en cerdos en diferentes regiones geográficas en el mundo (Fayer et al. 2014; Paik et al. 2019; Song et al. 2017; Süli et al. 2018; Thathaisong et al. 2003), lo cual sugiere un importante papel de estos animales como reservorio para el parásito. Sin embargo, aún no es claro si el contacto estrecho entre cerdos y humanos representa un riesgo de transmisión. En Colombia, dos estudios realizados en población porcina de Cundinamarca encontraron prevalencias de Blastocystis spp. del 3% (Mendoza-Gómez et al. 2015) y 37,5% (Pulido Villamarín et al. 2013). En este estudio se obtuvo una prevalencia para Blastocystis del 86%, lo que sugiere la importancia de los cerdos como posibles fuentes de infección para este parásito.
Con respecto a B. coli, este es el único ciliado que infecta a los humanos, y para el cual se han descrito como principales reservorios los cerdos y primates no humanos (Schuster y Ramírez-Ávila 2008). En los hospedadores infectados, causa diversas manifestaciones gastrointestinales, entre las que se destaca la diarrea con moco y sangre (Barbosa et al. 2015). Sin embargo, la mayoría de las infecciones por B. coli en cerdos son subclínicas y generalmente se limitan a la luz intestinal. Este parásito se ha encontrado con prevalencias que varían entre 40,5% y 42% en población porcina de granjas tecnificadas en Cundinamarca, Colombia (Mendoza-Gómez et al. 2015; Pulido Villamarín et al. 2013), valor cercano al encontrado en este estudio, en el que se obtuvo una prevalencia del 36%; mientras que en cerdos de traspatio en el área metropolitana de Bucaramanga se reportó una del 52,7% (Pinilla et al. 2020; Pinilla et al. 2021).
En cuanto a Cryptosporidium spp., hasta el momento seis especies se han asociado a infección en cerdos, (C. suis, C. scrofarum, C. parvum, C. muris, C. tyzzeri y C. andersoni), con C. suis y C. scrofarum como las más frecuentes en esta población animal (Wang et al. 2018). Aunque la criptosporidiosis en porcinos suele ser asintomática, incluso en animales jóvenes, tanto C. suis como C. scrofarum se han descrito como causantes de infección en humanos, por lo que se consideran potencialmente zoonóticas y pueden representar un problema grave de salud pública (Wang et al. 2018). Una limitante de este estudio fue la detección del parásito mediante examen microscópico de muestras procesadas por tinción, técnica que no permite la identificación de especies y, por tanto, la confirmación de los cerdos como reservorios para la transmisión de especies de Cryptosporidium infectantes para humanos en el área analizada. En Colombia, Mendoza-Gómez et al. (2015) encontraron una prevalencia de Cryptosporidium spp. del 5% en porcinos de granjas semitecnificadas de Cundinamarca y Pinilla et al. (2020) reportaron una prevalencia del 5,7% en cerdos de traspatio criados en el área metropolitana de Bucaramanga, datos menores a los obtenidos en este estudio, en el que el 36% de los cerdos fueron positivos para este apicomplexa. Teniendo en cuenta la alta resistencia que presenta Cryptosporidium a los métodos de desinfección comúnmente utilizados en el tratamiento del agua, incluyendo el cloro, es posible que la alta frecuencia de este parásito se relacione con el uso de agua no potable en la granja evaluada. Hasta la fecha, no se conocen otros estudios de Cryptosporidium en cerdos en Colombia. Los datos de prevalencia en el ámbito mundial son variables, con un rango entre 1,4% y 89% (Wang et al. 2018). Las discrepancias en los reportes probablemente se deban a las diferencias en la edad de los animales, los métodos de detección y los entornos ecológicos.
El alto porcentaje de cerdos parasitados por una variedad de protozoarios intestinales en la granja estudiada indica la exposición de los animales a fuentes de infección que facilitan dicha transmisión, por lo que su identificación es esencial para establecer las medidas apropiadas de control y prevención. Teniendo en cuenta que el agua es una de las principales fuentes de infección para los parásitos, se debe hacer un control adecuado tanto fisicoquímico como microbiológico de esta por lo menos una vez al año para garantizar su calidad. Otras medidas importantes incluyen un correcto manejo de la higiene de las instalaciones, con protocolos de drenaje, desinfección y eliminación de las heces de los cerdos, disminuyendo la exposición a patógenos y el desarrollo de enfermedades; y extremar las medidas de control para el ingreso y salida de animales, personas y vehículos desde y hacia la granja. Adicionalmente, se debe establecer un protocolo de manejo ambiental de los desechos de los animales, los cuales también pueden ser una fuente de infección de parásitos para los humanos.
CONCLUSIONES
Los resultados obtenidos en este trabajo evidencian el posible papel de los cerdos como reservorios de parásitos intestinales potencialmente patógenos para el hombre. Se requiere la realización de estudios moleculares que permitan la identificación de las especies de parásitos que circulan en estos animales y que representen un peligro de salud pública para el hombre, y de esta manera establecer las adecuadas medidas de prevención y control. Este es el primer reporte de D. fragilis en porcinos en Colombia y uno de los pocos a nivel mundial. Nuevas investigaciones enfocadas en la evaluación de los genotipos de D. fragilis circulantes tanto en cerdos como en los trabajadores de granjas porcinas permitirán establecer el papel de estos animales en la transmisión de este protozoario a los humanos, para esclarecer a su vez aspectos del ciclo de vida.














