INTRODUCCIÓN
La aparición de brotes de enfermedades infecciosas ha demostrado ser una de las principales limitaciones para la piscicultura intensiva. La estreptococosis es una enfermedad bacteriana causada por Streptococcus agalactiae responsable de las altas tasas de morbilidad y mortalidad de muchas especies de peces de agua dulce, marinos y estuarinos, y se caracteriza por septicemia y meningoencefalitis (Evans et al. 2002; Mian et al. 2009). Los efectos ambientales, sociales y económicos de los brotes de enfermedades en la acuicultura son muchos y pueden ser muy importantes (FAO 2020). En 2017, la tilapia fue uno de los 10 principales grupos de especies acuícolas (clasificada en el cuarto lugar) en términos de cantidad y valor de producción (Cai et al. 2019).
La tilapia Oreochromis niloticus es la más afectada por enfermedades producidas por Streptococcus agalactiae, lo que resulta en una alta mortalidad que puede alcanzar entre 30% y 90% al año, asociada con grandes pérdidas económicas para la industria de la acuicultura anualmente (Li et al. 2015). En los cultivos de tilapia, se ha observado un aumento en el número de casos informados durante la última década, como consecuencia de la intensificación de la producción (Mian et al. 2009).
En condiciones naturales, la interacción pez-patógeno habitualmente no es causa de enfermedad; sin embargo, en los sistemas intensivos de producción y según las condiciones de manejo, los agentes etiológicos se exacerban y producen cuadros clínicos asociados a pérdidas económicas (Fu et al. 2014). Los principales factores de riesgo para la aparición de brotes de estreptococosis son el aumento de la temperatura del agua (por encima de 27 °C), el manejo intensivo, las altas densidades de población, la interacción con los individuos y las altas concentraciones de amoníaco y nitrito (Evans et al. 2002; Mian et al. 2009; Yannog y Francis-Floid 2013). La presentación clínica de estreptococosis en la forma clásica de la enfermedad es atípica y puede ocurrir de manera concomitante en las fincas (Leal y Figuereido 2018). La tilapia puede infectarse debido a varias razones, incluido el estrés como factor predisponente (Liao et al. 2020).
Los métodos para controlar la enfermedad son la vacunación como medida preventiva y el uso de tratamientos con antibióticos, lo que conlleva el aumento de los costos de la producción. Otra alternativa es la selección genética de peces resistentes a la enfermedad. Es posible que los genes de resistencia y tolerancia estén asociados con los principales factores de la respuesta inmune (Glass 2012). Se puede utilizar la información presente en los candidatos seleccionados o en padres cercanos, especialmente en el caso de enfermedades (Yáñez et al. 2014). Varios estudios en diferentes especies acuícolas han demostrado que la resistencia a enfermedades tiene una moderada heredabilidad (h2) en condiciones de desafío a patógenos bacterianos y virales varían entre 0,03 a 0,60 (0degárd et al. 2011). La variación genética aditiva de Streptococcus sp. en tilapia cultivada se determinó con una h2 del 0,42 ± 0,07 para S. iniae y 0,58 ± 0,09 para S. agalactiae (Lafrentz et al. 2016) y 0,38 ± 0,11 en la selección para S. agalactiae (Shoemaker et al. 2016). Mediante el uso de diferentes modelos de estimación en el desarrollo de líneas resistentes de tilapia del Nilo a S. agalactiae se han encontrado h2 que oscilan entre 0,15 ± 0,03 y 0,26 ± 0,05 (Joshi et al. 2021). El desarrollo de individuos resistentes representa una estrategia sostenible a largo plazo para controlar esta enfermedad.
Se deben considerar diferentes variables al elegir mejorar la resistencia, como la supervivencia. La metodología de Kaplan-Meier (Kaplan y Meier 1958) permite el análisis de las respuestas de supervivencia, definidas como la probabilidad de que un individuo sobreviva en un periodo de tiempo dado frente a un desafío o tratamiento considerando el tiempo en muchos intervalos pequeños; cuando algunos de los sujetos pueden no experimentar el evento o la muerte antes del final del estudio, se conoce como observaciones censuradas (Goel et al. 2010). Analizar la supervivencia y estimar el tiempo que los animales sobreviven bajo condiciones de enfermedad son buenos estimadores, en contraste con la comparación de los porcentajes de individuos que desarrollan el evento (Goel et al. 2010). La selección indirecta de candidatos permite la selección de peces más resistentes dentro de la familia.
Comprender el panorama en relación con la sanidad de los peces y programar una estrategia para seleccionar genes resistentes a una enfermedad determinada reducirá sustancialmente la probabilidad de epidemias porque se observa que, incluso en casos de brotes causados por diferentes bacterias, hay algunos animales que no muestran síntomas de enfermedad y sobreviven. El objetivo de este trabajo fue evaluar la respuesta en la supervivencia a la infección por Streptococcus agalactiae en tres familias de tilapia.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en el Laboratorio de Enfermedades de los Peces de la Universidad Federal de Lavras (UFLA) en Brasil. Se utilizaron 135 peces con un peso de 93,7 ± 54 g. Se utilizaron 45 peces para cada una de las tres familias (FA, FB y FC), provenientes del plantel de piscicultura de la UFLA, distribuidos aleatoriamente en cada unidad experimental (cuatro réplicas + grupo de control), en acuarios de vidrio de 57 litros con flujo continuo de agua. Los parámetros de calidad del agua fueron monitoreados al principio y al final de cada día, temperatura promedio de 26 °C, pH (7,3 ± 0,8 ) y concentración de oxígeno disuelto (OD = 6 mg/L ± 1), alimentados dos veces al día con alimento comercial extruido (30% PC), en la proporción de 2% de peso vivo.
Comité de ética
El experimento se realizó de acuerdo con el Comité de Ética sobre el Uso de Animales (CEUA) de la Universidade Federal de Lavras (UFLA), protocolo 017/13.
Para el estudio, se utilizó un aislado patogénico de Streptococcus agalactiae obtenido de un brote de estreptococosis en tilapia del Nilo en el estado de Minas Gerais, Brasil, perteneciente al banco bacteriano del Laboratorio de Bacteriología del Departamento de Medicina Veterinaria de la UFLA. La muestra utilizada fue previamente identificada en términos fenotípicos y genotípicos mediante pruebas bioquímicas y posteriormente mediante PCR especie-específico para S. agalactiae (Berridge et al. 2001). El aislado bacteriano fue almacenado en un congelador a -80 °C, se descongeló y se sembró en agar tripticasa de soya suplementado con sangre equina al 5% (TSA sangre) a 28 °C durante 24 h. Transcurrido este tiempo, se inocularon en caldo BHI (Infusión Cerebro Corazón) durante 18h a 30° C hasta alcanzar una densidad óptica de 0,1 a 600 nm, equivalente a una carga bacteriana de 107 UFC/mL.
Los peces se aclimataron por 10 días, después de lo cual se suspendió la alimentación durante un día. Durante el experimento de inoculación, los peces fueron anestesiados por inmersión con benzocaína con una dosis de 100 mg / L. Posteriormente, cada pez fue inoculado por vía intraperitoneal (IP) con (107 UFC/ mL) de Streptococcus agalactiae. El grupo control negativo fue solo inoculado vía IP con 1 mL de caldo BHI. Luego de esto, la temperatura del agua de los acuarios se elevó de los 26 °C a 30 °C y fueron monitoreados durante 15 días. Los peces que morían en cada acuario fueron contados y sometidos a exámenes bacteriológicos de riñón y cerebro.
Para visualizar las curvas de supervivencia, se realizó un Kaplan-Meier y las pruebas de Log-rank y Peto & Peto para comparar los resultados de supervivencia entre grupos de familias de tilapia desafiadas con Streptoccocus agalactiae con un a = 0,05. Los análisis se realizaron con el software RStudio 3.2.3.
RESULTADOS
Durante el experimento, no hubo mortalidad en los grupos de control de las tres familias. Por tanto, se evaluaron 36 peces por familia, excluyendo el grupo de control de estos análisis. En los peces inoculados, independientemente del día de muerte, se obtuvo crecimiento de S. agalactiae en todas las placas en las que se sembraron muestras de riñón y cerebro, lo que resultó en una eficiente inoculación de todas las familias evaluadas. Los peces que murieron 24 h después de la inoculación mostraron un comportamiento similar en las tres familias con natación errática, lenta y balanceo lateral del cuerpo y no mostraron signos clínicos de la enfermedad antes de la muerte. Después de 48 h del desafío, se observó la presencia de exoftalmos, coloración oscura en toda el cuerpo, letargo y dilatación abdominal antes de la muerte en varios peces de las tres familias evaluadas. En la necropsia, se confirmó la presencia de S. agalactiae en los peces inoculados. Se presentó mortalidad del 2,8%, 25% y 8,3% para las familias FA, FB y FC, respectivamente a las 24 horas de iniciado el desafío. Sin embargo, en el último día del estudio se presentaron valores del 78%, 91% y 75% como promedio acumulado de mortalidad para las familias FA, FB y FC, respectivamente.
Se observa en la tabla 1 que la variable "sin censura" es la cantidad de peces muertos durante el desafío por familia. Los peces censurados fueron los que sobrevivieron al desafío, siendo inferiores en FB. Durante los 15 días del desafío, el tiempo promedio de supervivencia de un individuo en las familias FA, FB y FC fue de 9,4, 6,90 y 8,14 días, respectivamente. La mediana de supervivencia que se estimó con el percentil 50 de la distribución en las familias FA, FB y FC fue de 9, 8 y 7 días, respectivamente.
TABLA 1 Supervivencia promedio de la tilapia del Nilo hasta el día 15 después de la inoculación de Streptococcus agalactiae, con el número de peces censurados y sin censura por familia
| Famílias | N.° | Supervivencia % | Mediana | Censurados** | No censurados** |
|---|---|---|---|---|---|
| FA | 36 | 9,40 | 9 | 8 | 28 |
| FB | 36 | 6,90 | 8 | 3 | 33 |
| FC | 36 | 8,14 | 7 | 9 | 27 |
*Peces sobrevivientes al desafío.
**Peces muertos por familia.
Fuente: elaboración propia.
La tabla 2 muestra dos pruebas no paramétricas para la comparación de las curvas de supervivencia Log-rank propuesta por Mantel-Haenszel y la Peto & Peto, en la que se evidencia que no hubo diferencia significativa entre las familias (p > 0,05).
TABLA 2 Pruebas no paramétricas de Log-rank y Peto & Peto utilizadas para comparar curvas de supervivencia de diferentes familias
Fuente: elaboración propia.
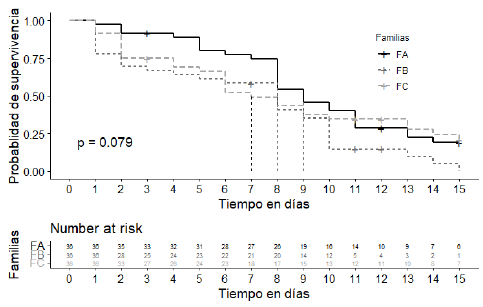
Las funciones de supervivencia estimadas de Kaplan-Meier (figura 1) no fueron estadísticamente significativas entre las curvas de supervivencia de las tres familias evaluadas (p > 0, 05), la estimación de las curvas solo cambió en momentos en que ocurría un evento, siendo más pronunciados a medida que se censuraron más peces, number risk indica que después de 10 días de desafío quedan en riesgo de evento 14,5 y 12 individuos de la FA, FB y FC, respectivamente. En el tiempo cero, la probabilidad de supervivencia es 1,0 (100% vivos) para las tres familias, en el día 1, la mayor caída fue observada en la familia FB, llegando al 0,75 (75%) y muy leve en la familia FA 0,97 (97%); en el día 6, la probabilidad de supervivencia es aproximadamente 0,78 (78%) para la familia FA, 0,61 (61%) para la familia FB y 0,52 ( 52%) para la familia FC; al final del desafío (día 15), la probabilidad de supervivencia es del 0,08% de la familia FB y del 22% y 25% de las familias FA y FC, respectivamente.
Fuente: elaboración propia.
FIGURA 1 Función de distribución de supervivencia de Kaplan-Meier por familias durante el desafío de 15 días.
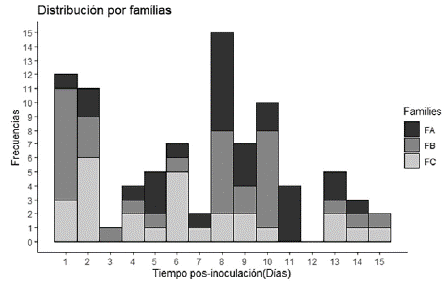
En la evaluación de frecuencias (figura 2), es posible observar las distribuciones de cada familia según cada grupo de barras en el histograma, en los días 8, 1 y 2 hubo una mayor incidencia de mortalidad para las familias FA, FB y FC, respectivamente.
DISCUSIÓN
Gjedrem (2015) reporta que la selección en los programas de mejoramiento genético reduce con éxito la mortalidad, con una ganancia genética bastante baja en la supervivencia de (5%-8,4%) por generación en diferentes especies, siendo del 5% en Oreochromis spp. Joshi et al. (2021) observan en 35 días de desafío con S. agalactiae una mortalidad promedio del 60,2 % y osciló entre 49,5% y el 67% en todas las líneas de tilapia del Nilo. Joshi et al. (2020) encuentran que el porcentaje de mortalidad para tilapias del Nilo desafiadas a S. agalactiae vía IP en líneas seleccionadas y normales es del 28,67% y 49,67%, respectivamente, y el Kaplan-Meier arroja significancias estadísticas, entre ellas P < 0, 0001. En el presente estudio, la mortalidad promedio esdel 81,3% con 15 días de desafío, y el gráfico de supervivencia de Kaplan-Meier no revela diferencias significativas entre las tres familias FA, FB, FC (P > 0,05). Fagundes et al. (2016) evalua la supervivencia en tilapias del Nilo con pesos de (100 ± 10 g) las cuales fueron inoculadas con suero inactivado y suero activado que contenía anticuerpos anti Streptococcus agalactiae y, luego de 48 horas de desafío, con LD50 (1 x 108 UFC/ mL) de S. agalactiae; en la evaluación de supervivencia, el grupo control muestra una tasa de supervivencia del 0%.
Anshary et al. (2014) observan una supervivencia promedio de 1,83 días en el análisis de supervivencia de Kaplan-Meier en tilapia del Nilo infectada con 107 UFC de S. agalactiae. En comparación con esta investigación, en los resultados obtenidos en este estudio se encuentra un mayor valor de supervivencia, con 9,4, 6,9 y 8,14 días para las familias FA, FB y FC, respectivamente. Sukhavachana et al. (2019) encuentran después de 14 días de inoculación por vía intraperitoneal (1 x 109 UFC/mL) de S. agalactiae en tilapia roja (Oreochromis spp.) en las 128 familias de las generaciones base (G0) evaluadas una tasa de supervivencia del 15% y 19 % para los lotes 1 y 2, respectivamente.
Delannoy et al. (2014), tras inocular, vía intraperitoneal, diferentes dosis (102, 105 e 107 UFC/mL) de la cepa S 60 de S. agalactiae en tilapia, encuentran, por la metodología de Kaplan-Meier, con la dosis de 107 UFC, en el día 5 después de la inoculación, una mortalidad del 100%. Se observa que en las tres familias evaluadas no se presentó mortalidad del 100 % a los 15 días de la posinoculación en peces llamados censurados.
Abuseliana et al. (2011) evaluan diferentes dosis de S. agalactiae en juveniles de tilapia roja infectadas por vía intraperitoneal (IP), e identifican que la dosis (3 x107CFU / ml) presenta en el día 5 después de la infección un 80% de mortalidad (16/20) y el día con mayor mortalidad es el día 2 (7 peces), siendo el más letal. Suebsong et al. (2019) inocularon por vía intraperitoneal 30 peces por familia con S. agalactiae con una dosis (1 x 107 UFC / ml), después de 14 días de desafío observan una supervivencia promedio de 9,9% y 18,7% para los lotes 1 y 2, respectivamente. Según la metodología de Kaplan-Meier, las familias evaluadas no difieren entre sí, siendo un resultado confiable para incluir en programa de selección.
CONCLUSIONES
Aunque no se presentaron diferencias al análisis de supervivencia en los peces expuestos a la bacteria S. agalactiae entre las diferentes familias, los resultados demuestran que este análisis en desafíos contra patógenos es un punto importante para incluir en los planes de selección de peces para resistencia a enfermedades.