INTRODUCCIÓN
La parasitosis consiste en la presencia de un agente parasitario que vive en otro animal u organismo, generándole daño, afectando animales de compañía, producción e incluso a seres humanos, considerándose como una zoonosis (Senasa 2017).
Las parasitosis gastrointestinales en bovinos de producción son unos de los problemas sanitarios más importantes a nivel mundial. Estos nematodos ocasionan problemas gastroentéricos que se caracterizan clínicamente por diarrea, debilidad, hemorragias y deshidratación (Senasa 2017). Entre las parasitosis gastrointestinales causadas por nematodos en ganado bovino, destacamos las familias: Trichuridae, Trichostrongylidae, Ancylostomidae, Ascaridae y Strongyloididae (Colina et al. 2013; Pinilla et al. 2019; Regassa et al. 2006).
En países latinoamericanos como Brasil, se han estimado pérdidas de 13,96 billones de dólares americanos debido a las parasitosis en bovinos, considerando solamente las reducciones en producción y sin contemplar el impacto económico relacionado con honorarios veterinarios, costo del personal de campo y de los medicamentos. Estas pérdidas económicas (en dólares) fueron discriminadas de la siguiente manera: por parásitos gastrointestinales, 7,11 billones; garrapatas (Rhipicephalus microplus), 3,24 billones; Mosca paletera (Haematobia irritans ), 2,56 billones; tórsalo (Dermatobia hominis), 0,38 billones; gusaneras (Cochliomyia hominivorax), 0,34 billones; y mosca de los establos (Stomoxys calcitrans) 0,34 billones. Al considerar que en América Latina la existencia de ganado bovino es de alrededor de 400 millones de cabezas y hacer un paralelo con la información de Brasil, teniendo en cuenta un impacto económico del 75% (debido a que en las áreas centro sur de Uruguay, Chile y Argentina el impacto de los ectoparásitos es muy reducido), podemos estimar que las pérdidas económicas llegan a 22,79 billones de dolares para América Latina (Grisi et al. 2014).
Para el diagnóstico de diversas formas parasitarias (huevos, larvas o estados adultos), es necesario disponer de la realización de técnicas coproparasitológicas, las cuales corresponden a un conjunto de técnicas que constituyen la indicación metodológica para la identificación de la mayoría de las enteroparasitosis de tipo protozoarios o helmintos. La sensibilidad para establecer un diagnóstico correcto depende de la adecuada indicación y preparación de la muestra, los datos clínicos y antecedentes de interés que sean aportados al laboratorio, y de su correcta y completa ejecución con examen directo microscópico, enriquecimiento y examen macroscópico (Salvatella y Eirale 1996).
Las técnicas de laboratorio se dividen en cualitativas y cuantitativas. Las cualitativas so lo indican si el animal está parasitado o no, pero esto no es contundente, ya que, mientras la presencia de parásitos significa indudablemente que el animal es positivo, la ausencia no significa que sea negativo, debido a varios factores, que pueden ser desde una muestra insuficiente hasta causas biológicas inherentes de cada parásito, como la frecuencia de ovoposición y el número de hembras parasitando al animal (Alarcón 2016; Espitia 2010).
Las técnicas cuantitativas indican el número de huevos y/u ooquistes presentes en un gramo de heces. Para su interpretación, se deben considerar los factores que determinan la variación en la cantidad de huevos y/u ooquistes eliminados, tales como: diferencias en la prolificidad de las especies, ritmo en la ovoposición, número de hembras y consistencia de las heces (Alarcón 2016; Espitia 2010; López 2003).
El objetivo del presente estudio fue comparar la eficacia de las diferentes técnicas coproparasitológicas descritas en medicina veterinaria en ganado bovino de producción de carne con el fin de determinar cuál es la más efectiva en la detección de parásitos gastrointestinales.
MATERIALES Y MÉTODOS
Los bovinos incluidos en este estudio se encontraban en la localidad de Polincay, Región de los Lagos, Chile. Las muestras se tomaron entre los meses de septiembre a noviembre de 2020. Se incluyeron bovinos de producción cárnica que no presentaban sinología clínica que evidenciara la existencia de alguna enfermedad sistémica, en este caso se procedió a la realización de un examen clínico a cada paciente, considerando condición corporal de 3-3,5, pesos según registros prediales de 400 a 600 kilos, superiores a 1 año e inferior a 3 años, sin distinción racial y de sexo, en el caso de las hembras ninguna de ellas se encontraba en periodo de gestación y sin antecedentes de desparasitación antes de 6 meses de la toma de muestras.
Se realizó la recolección transrectal de 150 gramos heces de manera individualizada, con la finalidad de ejecutar las técnicas coproparasitológicas de tipo cualitativo: examen directo de heces frescas, método de flotación, método de sedimentación, y de tipo cuantitativo: coprocultivo, técnica de McMaster, técnica de sedimentación-flotación, técnica de Baermann. Se analizó un total de 250 muestras, que fueron subdividida s en 12 grupos, asignando una letra en orden alfabético desde la A hasta la O. Cada grupo fue de 20 muestras, con la excepción del grupo E, el cual fue de 30 muestras.
En cuanto a la preparación y visualización de la muestra, se empleó microscopía óptica en el laboratorio de ciencias de la Universidad Santo Tomás en la sede de Puerto Montt.
Comité de ética
El trabajo en mención, por formar parte de actividades propias de asignaturas de la carrera de medicina veterinaria, es declarado por parte del Comité de Ética Macrosur ORD: N.° 132 de la Universidad Santo Tomas, Puerto Montt, en la calidad de a lugar, sin restricciones en ejecución por ser parte de una actividad académica.
Análisis estadistico
La elaboración de la base de datos se ejecutó por medio del análisis de variables que se destinaron en este estudio (técnicas coproparasitológicas). Los datos se tabularon y analizaron en el programa estadístico SPSS v18 (IBM Corporation, Route 100), permitiendo realizar una diferenciación de grupos de animales y de las técnicas consideradas mediante estadística descriptiva.
RESULTADOS
Se observó la presencia de huevos o estados infectantes de parásitos gastrointestinales en los diferentes grupos de muestras de estudio por medio de las diferentes técnicas coproparasitológicas empleadas (tabla 1).
TABLA 1 Resultados de las distintas técnicas empleadas para la detección de nematodos gastrointestinales en ganado bovino de carne
Fuente: elaboración propia.
Al observar los porcentajes en las figuras 1 y 2, es posible comparar las diferentes técnicas diagnósticas coproparasitológicas cualitativas y cuantitativas.
Es posible destacar que, principalmente en los métodos de flotación, en este caso utilizando una solución con sulfato de zinc y de magnesio, fue posible identificar un 50% de estados infectantes parasitarios. Es preciso clarificar que, de las 30 muestras, 20 fueron sometidas a la técnica con sulfato de zinc y 10 con sulfato de magnesio (figura 1).
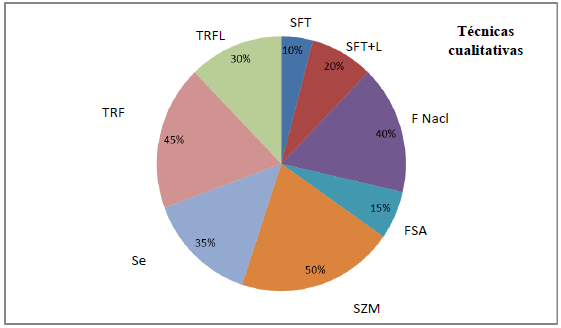
FST = Fisiológico templado (38-40°C), SFT+L = Fisiológico templado (38-40°C) + Lugol, F Nacl = Flotación de solución saturada de NaCl, FSA = Flotación de solución saturada de azúcar, SZM = sulfato de zinc y magnesio, Se = Sedimentación, TRF = Técnica de Ritchie modificada o de formol-éter, TRFL = Técnica de Ritchie modificada o de formol-éter con Lugol.
Fuente: elaboración propia.
FIGURA 1 Porcentaje en la detección de parásitos entre las técnicas cualitativas.
Al continuar con los análisis de las técnicas coproparasitológicas cualitativas, la segunda técnica que evidenció porcentajes cercanos al 50% en la identificación de estados infectantes de agentes parasitarios fue la técnica de Ritchie modificada o de formol- éter (FE), con 45% (figura 1). En relación con las técnicas que presentaron un menor porcentaje de identificación de estados infectantes parasitarios, fue posible observarlas en las técnicas de examen directo de heces frescas con suero fisiológico templado (38-40°C) y con adición de lugol, las cuales no sobrepasaron más de un 20% (figura 1).
Con respecto a la identificación de estados infectantes parasitarios por medio de las técnicas coproparasitológicas de tipo cuantitativo, se pudo observar una distribución homogénea entre las técnicas de coprocultivo, McMaster y flotación- sedimentación, todas ellas demostraron un porcentaje de identificación de 40% en las muestras analizadas (figura 2).
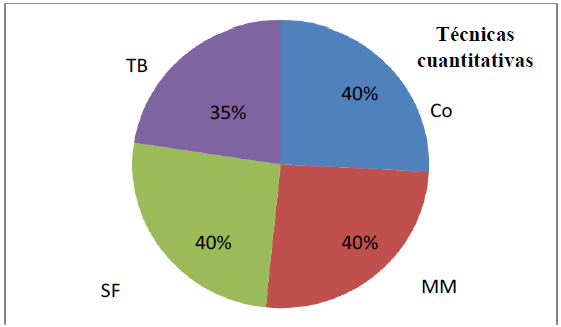
Co = Coprocultivo, MM = Técnica de McMaster, SF = Técnica de sedimentación-flotación, TB = Técnica de Baermann.
Fuente: elaboración propia.
FIGURA 2 Porcentaje en la detección de parásitos entre las técnicas cuantitativas.
Sin embargo, la técnica de Baermann no evidenció de manera similar la presencia de elementos parasitarios pues, a diferencia de las otras técnicas, el porcentaje de identificación fue de un 35%. Es preciso clarificar que esta técnica permite la detección de larvas (las cuales pueden ser infectantes).
DISCUSIÓN
A partir de los diversos resultados del presente estudio, es posible establecer variados porcentajes en la identificación de estados infectantes de parásitos gastrointestinales por medio de la utilización de diferentes métodos diagnóstico-coproparasitológicos.
La utilización de técnicas con una alta calidad con respecto al diagnóstico de enfermedades infecciosas y parasitarias requiere de la combinación de varias técnicas que se caractericen por una alta sensibilidad, especificidad, precisión, reproducibilidad y la capacidad de detectar y controlar efectivamente las infecciones que representan problemas para la salud pública y animal (Serrano 2010).
En relación con las técnicas cualitativas, las técnicas de examen directo de heces frescas presentaron un rango entre 10% y 20% de éxito al momento de analizar las muestras, las cuales difieren de los resultados indicados en estudios realizados por Aquino et al. (2012), quienes demostraron que se logró un porcentaje de identificación de agentes parasitarios del 47%.
Con respecto a las técnicas de sedimentación, esta fue de entre 30% y 45% en el presente estudio, lo cual nuevamente difiere de lo presentado en estudios realizados por Aquino et al. (2012), lo cual demostró un porcentaje de identificación de un 70%.
En relación con los resultados de los métodos cuantitativos, todas las técnicas presentaron un porcentaje de identificación cercano a un 40%, con la excepción de la técnica de Baermann, la cual fue de 35%, resultado que difiere a lo indicado por Lau et al. (2005), quienes indican que el porcentaje de la técnica se acerca a un 59,52%.
Estudios realizados por Espitia (2010) en técnicas cualitativas señalan que la cantidad de huevos y/u ooquistes que hay en 1 gramo de heces puede diferir en su lectura según la cantidad de estados infectantes de estos elementos excretados, dependiendo exclusivamente de la carga parasitaria, el ritmo de ovoposición, el número de hembras y las características de las heces.
Si se realiza una comparación sobre técnicas de mayor complejidad y elaboración en tiempo, como es el caso del coprocultivo, los resultados obtenidos fueron de un 40%, lo cual difiere de estudios realizados por Sandoval et al. (2012), quienes indican una efectividad en sus estudios cercana al 100%. No se deja de lado considerar que los resultados aquí presentados pueden ser distintos debido a los caracteres propios de las muestras seleccionadas.
A continuación se señala lo indicado por estudios realizados por Fiel et al. (2011) sobre coprocultivo, donde se señala que esta técnica permite identificar la morfología y diferencias características de los estados infectantes de parásitos. Esta técnica cuantitativa por elección es útil para contabilizar y demostrar huevos de helmintos en muestras fecales frescas (Cardona, 2005).
Por otra parte, según Lopez et al. (2005), la técnica de sedimentación posee una especificidad del 100%, pero una sensibilidad de 70% en un examen, si bien esta se incrementa al hacer exámenes seriados a un mismo animal. Los resultados del presente estudio fueron de un 40% de eficacia en la detección de estados infectantes de parasitosis gastrointestinales sin la consideración de un muestreo seriado. Se debe considerar que no es posible realizar comparación entre sensibilidad y eficiencia entre las técnicas aplicadas en este estudio y las indicadas por la literatura, ya que solo se orientó a identificar el porcentaje de eficacia de cada una de las técnicas coproparasitológicas en diversos pool de muestras fecales de bovinos de raza carnicera, estratificados en diferentes grupos designados por una letra.
Es pertinente dar continuidad a este estudio mediante una reproductividad de todas las técnicas coproparasitológicas aplicadas en un pool de muestras fecales donde se incluya el rebaño por completo, y no por medio de una categorización por grupos.
CONCLUSIONES
Los resultados entregados por este estudio indicaron que el mayor porcentaje en la identificación de estados infectantes parasitarios se dio por medio de las técnicas coproparasitologicas de tipo cualitativo, con principal énfasis en las técnicas de flotación de sulfato de zinc y magnesio, con un 50%.
Con respecto a las técnicas coproparasitológicas de tipo de cuantitativo, tres de estas técnicas demostraron una eficacia en la identificación de estados infectantes parasitarios cercanos a un 40%.
La importancia de la realización de este trabajo radicó en identificar las distintas técnicas de identificación de agentes parasitarios utilizadas en medicina veterinaria para dilucidar cuáles de los principales métodos coproparasitológicos descritos en la literatura presentan una mejor eficacia en la detección de estos agentes.
Es importante dar continuidad a este tipo de estudios para identificar mayor cantidad de variables y generar comparaciones en aspectos de eficiencia y sensibilidad.















