INTRODUCCIÓN
La anestesia se utiliza por diversas razones en la clínica aviar, desde procedimientos diagnósticos y clínicos no invasivos hasta los quirúrgicos invasivos, los cuales requieren de la implementación de protocolos anestésicos y analgésicos bien balanceados (Alonso 2018; Doss y Mans 2021).
El éxito de los procedimientos anestésicos en psitácidos debe incluir el conocimiento de avances en su farmacología y fisiología, así como el conocimiento de las funciones y los parámetros cardiovasculares y respiratorios y las características morfofisiológicas como el tamaño del ave, la especie y edad, al igual que su manejo y susceptibilidad para reducir el estrés (Sabater y Adami 2022). La utilización de la anestesia para realizar el examen físico rutinario en las aves tiene múltiples ventajas en comparación con la contención manual, debido a la reducción del estrés (Escalante et al. 2018). Se han descrito diversas combinaciones farmacológicas por vía parenteral para inducir anestesia en Melopsittacus undulatus como la Alfaxalona (15 mg/kg IM) y la combinación de Butorphanol (2,5 mg/kg IM) con Midazolam (1,25 mg/kg IM) (Escalante et al. 2018), de lo cual se reportan resultados confiables con adecuada sedación y recuperación sin accidentes anestésicos, logrados con la supervivencia de los ejemplares posanestesia; sin embargo, una de sus principales limitantes es que, una vez administrados los fármacos, estos no podrán removerse del organismo hasta ser metabolizados. Por otra parte, la anestesia fija también involucra un riesgo alérgico a alguno de los fármacos que sean utilizados, y la utilización de anestesia inhalada requiere el uso de una máquina anestésica que puede representar una inversión económica considerable (Sadegh 2013). Una alternativa para la restricción química, para diagnóstico y cirugía, son los agentes anestésicos inhalados (Doss y Mans 2021; Escobar et al. 2016); el isoflurano es el anestésico de elección en las aves debido a su rapidez en los tiempos de inducción y recuperación, así como mínimos efectos secundarios a nivel cardiovascular (Escobar et al. 2016).
Por lo anterior, se midieron las constantes fisiológicas respiratorias y cardiacas mediante un pulsioxímetro para evaluar la seguridad del isoflurano como agente anestésico. La oximetría de pulso se basa en que la hemoglobina oxigenada (O2Hb) y la hemoglobina desoxigenada (HHb) absorben de manera diferencial la luz roja y la luz infrarroja cercana (IR). O2Hb absorbe mayores cantidades de luz IR y menores cantidades de luz roja que HHb; esto es consistente con la experiencia: la sangre bien oxigenada con sus concentraciones más altas de O2Hb aparece de color rojo brillante a la vista porque dispersa más luz roja que la HHb. Por otro lado, HHb absorbe más luz roja y parece menos roja. Aprovechando esta diferencia en las propiedades de absorción de luz entre O2Hb y HHb, los oxímetros de pulso emiten dos longitudes de onda de luz, roja a 660 nm y casi IR a 940 nm. El oxímetro de pulso utiliza la cantidad relativa de luz roja e IR absorbida para determinar en última instancia la proporción de Hb unida al oxígeno. La capacidad de la oximetría de pulso para detectar la saturación parcial de oxígeno (SpO2) solo de sangre arterial se basa en el principio según el cual la cantidad de luz roja e IR absorbida fluctúa con el ciclo cardíaco, ya que el volumen de sangre arterial aumenta durante la sístole y disminuye durante la diástole (Chan et al. 2013). Esto demuestra la necesidad expuesta y propone una posible evaluación que requiere ser validada en M. undulatus, una especie frecuente como animal de compañía bajo cuidado humano y de la cual, debido a su tamaño, se requieren parámetros fisiológicos basales de referencia y antecedentes de protocolos anestésicos confiables y eficientes que garanticen la vida de los pacientes.
MATERIALES Y MÉTODOS
Aves
Se utilizaron 19 periquitos australianos (Melopsittacus undulatus) (12 machos y 7 hembras) con edades entre los 10 y 12 meses, criados en las mismas condiciones e incluidos como pacientes al azar que representan una población real; clínicamente sanos, libres de ectoparásitos y endoparásitos, sin ruidos respiratorios y sin secreciones en mucosas sugerentes de algún proceso infeccioso; con peso corporal de 31,37 ± 1,9 g y 36,01 ± 3,7, machos y hembras respectivamente. Se alojaron de manera individual en jaulas de 70 cm x 50 cm, con exposición a 12 horas de luz natural, se alimentaron con dieta comercial especializada Trill®, Complete Budgie Food y agua ad libitum y se sometieron a un ayuno de 2 horas previas al procedimiento de su anestesia.
Comité de ética
Se cumplió con la NOM-062-ZOO-1999 "Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio" (SAGARPA, 1999), además el proyecto se encuentra aprobado por el Comité Interno para el Cuidado y Uso de Animales de Laboratorio (CICUAL-UAM-X) con el número 009.22, proyecto número 234, titulado: "Evaluación de diferentes protocolos de sedo analgesia y anestesia general para periquito australiano (Melopsittacus undulatus)".
Evaluaciones fisiológicas
Antes del monitoreo de los parámetros basales preanestésicos, las aves fueron alojadas en el laboratorio con iluminación tenue y escasos sonidos que pudieran perturbarlas durante al menos 10 minutos, esto con el propósito de facilitar su relajación.
Asimismo, previo a la inducción anestésica, las aves fueron valoradas clínicamente para determinar sus parámetros fisiológicos de frecuencia respiratoria (FR), pulso en latidos por minuto (LPM) y saturación parcial de oxígeno (SpO2) basales (Botman et al. 2016). Para ello se utilizó un oxímetro OX 100 (KONTROLab®, Italia) colocando el electrodo de pinza sobre la arteria braquial del ala izquierda. La FR, LPM y SpO2 se midieron durante la anestesia y la recuperación (Reyes 2016).
Electrocardiograma
Con el ave en estado de anestesia, se realizó el electrocardiograma (Hassanpour et al. 2016) con un electrocardiógrafo modelo ECG 10AV (SHINOVA®, China), los electrodos se colocaron con el ave en decúbito dorsal, en ala izquierda el electrodo (L), en ala derecha (R), en el tarsometatarso izquierdo (F), en el tarsometatarso derecho (N) y en músculo pectoral (C). Se obtuvieron los intervalos PR (ms), P/QRS/T (ms), QT/QTc (ms) y el eje P/QRS/T (Deg). La interpretación de la nomenclatura y del electrocardiograma (ECG) se realizó con base en métodos estandarizados para aves (Hassanpour et al. 2011), los ECG se estandarizaron a 10 mm/mV a una velocidad de 50 mm/s y se evaluaron los patrones morfológicos de las desviaciones de P-QRS-T para cada derivación.
Inducción anestésica
Se utilizó un equipo de anestesia inhalada para isoflurano con un vaporizador Isotec 3 (Branton Vet Anesthesia Service®. EUA), acoplado a un circuito abierto tipo Bain, el cual fue conectado a una cámara de anestesia diseñada para este estudio, construida con acrílico con un volumen de 2.500 cm3 (figura 1), en la cual se introdujo al ave para inducir su anestesia con isoflurano (SofloranVet ® Pisa Agropecuaria. México) al 3% para inducción, con un flujo de 2 litros por minuto (L/min) de oxígeno medicinal. El plano anestésico profundo fue considerado cuando el ave presentó respiración profunda, sin respuesta al sonido exterior ni al manejo por contacto, además de inmovilidad en decúbito esternal, acompañados de ausencia del reflejo palpebral y disminución del tono mandibular (Doss y Mans 2021; Reyes 2016). Posteriormente, el ave se retiró de la cámara de inducción y se ubicó sobre un tapete suave para colocarle una máscara de anestesia, elaborada con un tubo de 50 ml, acoplado en su parte distal a un conector para tubo endotraqueal y a la parte proximal a un tubo de látex a manera de empaque (figura 1); en este momento se redujo a 2,5% la concentración de isoflurano, sin cambios en el flujo de oxígeno, posteriormente se colocó el sensor del oxímetro OX 100, para así mantener una anestesia por 10 min a cada ave.

Fuente: elaboración propia.
FIGURA 1 Cámara y mascarilla para la inducción y mantenimiento del plano anestésico. 1A. Cámara de 2500 cm3, construida con acrílico. 1B. Mascarilla diseñada para M. undulatus. acoplada en su parte distal a un conector para tubo endotraqueal y a la parte proximal a un tubo de látex.
Recuperación anestésica
Una vez terminado el procedimiento anestésico, se suspendió la administración de isoflurano, se retiró la máscara de anestesia y se regresó al ave a la cámara de anestesia administrando únicamente oxígeno (2 L/min). Se colocó en un lugar con luz tenue y ruidos mínimos. Se determinó la recuperación anestésica del ave cuando esta presentó aleteo, respiración continua, buen tono muscular general permaneciendo de pie y moviendo la cabeza a voluntad (Doss y Mans 2021), momento en que se realizó la última monitorización de los parámetros fisiológicos evaluados, frecuencia respiratoria (FR) pulso (LPM) y saturación parcial de oxígeno (SpO2).
Análisis estadísticos
Como medidas de resumen, se determinaron el percentil 50 (mediana) ± error estándar (E.E) y como medidas de dispersión adicionales el intervalo entre percentil 25 y 75 de las variables FR, LPM y SpO2. Se comparó la SpO2 y LPM durante la inducción, mantenimiento y recuperación de la anestesia entre machos y hembras.
De manera adicional, se compararon los tiempos de inducción, el mantenimiento y la recuperación de la anestesia entre ambos sexos. El análisis fue realizado mediante las pruebas de Kruskal Wallis y Mann Whitney, tomando como valor significancia estadística para ambas pruebas el valor de p<0,05.
RESULTADOS Y DISCUSIÓN
La estabilidad y profundidad anestésica de los periquitos durante el procedimiento fue demostrada cuando el ave presentó respiración profunda, sin respuesta al sonido exterior ni al manejo por contacto, además de inmovilidad en decúbito esternal, acompañados de ausencia del reflejo palpebral y disminución del tono mandibular. El tiempo de inducción a la anestesia en los machos fue de 1:30 ± 0:31 minutos, para las hembras fue de 2:19 ± 0:16 minutos. La duración de la anestesia en hembras y machos fue de 7:00 ± 1:39 minutos. Por otra parte, el tiempo que tardaron en recuperarse de manera total de la anestesia fue en los machos de 3:00 ± 0:36 minutos y para las hembras de 2:00 ± 1:23 minutos. No se observaron diferencias significativas en los tiempos de inducción y recuperación de la anestesia entre ambos sexos (p> 0,05). Durante este estudio no se registraron muertes de las aves, no se observaron alteraciones en el ritmo cardiaco, con un ritmo sinusal normal en todas las aves. Nuestros resultados coinciden con otros estudios en los que también se obtuvieron lecturas de ECG con anestesia inhalada en aves. Deori et al. (2017) utilizaron diferentes dosis de isoflurano en aves domésticas y encontraron disminución marginal de la frecuencia cardíaca sin afectar el límite fisiológico.
Se registró una estabilidad en la SpO2 y el LPM durante la evaluación inicial y el mantenimiento de la anestesia entre las hembras y los machos (p>0,05); sin embargo, en las hembras se presentó una disminución en los valores de la SpO2 en el periodo de recuperación anestésica (p<0,05) (tabla 1). La disminución de la SpO2 durante la recuperación anestésica en las hembras puede deberse a que estas tardan más tiempo en recuperarse del estrés después de una amenaza (Duggan 2017). Hay que considerar que el isoflurano deprime de manera leve la oxigenación a nivel del miocardio, disminuyendo así el gasto cardiaco, por esta razón, se considera al miocardio como un indicador sensible a la hipoxia, situación que se demuestra por la taquicardia evidenciada por un incremento de los LPM en las hembras durante recuperación de la anestesia (Botman et al. 2016).
TABLA 1 Parámetros de LPM y SpO2 en cada etapa del procedimiento anestésico de periquitos australianos
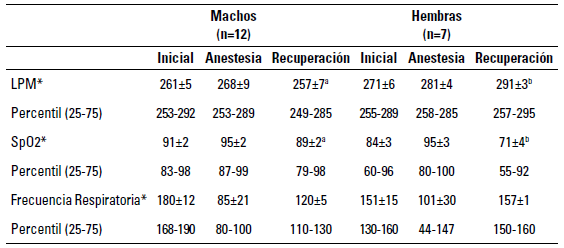
SpO2: Diferentes literales a, b en la misma fila indican diferencias con significancia estadística P<0,05 (Mann-Whitney). (*) Resultados numéricos expresados en mediana ± E.E
Fuente: elaboración propia.
La curva pletismográfica obtenida tanto en machos como hembras durante el mantenimiento de la anestesia fue similar en todas las aves evaluadas. Durante la anestesia, los parámetros electrocardiográficos no presentaron cambios (p>0,05) entre machos y hembras cuando se comparan los intervalos PR, P/QRS/T, QT/QTc, P/ QRS/T (tabla 2). En concordancia con la misma idea, se ha descrito que el isoflurano tiene efecto vasodilatador, lo cual disminuye la resistencia vascular sistémica y en consecuencia produce hipotensión, la cual se ha correlacionado con la profundidad de la anestesia en otras especies aviares (Botman et al. 2016).
TABLA 2 Parámetros de electrocardiografía durante la anestesia de periquito
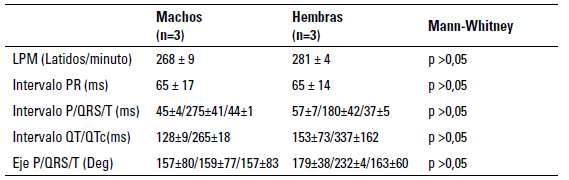
Datos sin diferencia significativa para el análisis estadístico de Mann Whitney (p > 0,05). (*) Resultados numéricos expresados en mediana ± E.E.
Fuente: elaboración propia.
En los valores obtenidos en la onda P no se observaron anormalidades. A diferencia de lo que sucede con los mamíferos, la onda QRS se observa que va ligeramente deprimida en comparación con la línea isoeléctrica, lo que se considera normal en aves (Hassanpour et al. 2011). En el caso de la onda T fue predominantemente positiva con respecto a la línea isoeléctrica y contrario a lo descrito en animales no sometidos a procedimiento anestésico (Hassanpour et al. 2011).
CONCLUSIONES
El protocolo anestésico implementado demostró seguridad farmacológica de utilidad clínica. Los parámetros fisiológicos determinados respaldan esta conclusión, pues aportan datos de referencia cardiorrespiratorios confiables para otros procedimientos en la actividad clínica veterinaria de M. undulatus.















