INTRODUCCIÓN
Los microorganismos hemotrópicos, comúnmente denominados hemoparásitos, son agentes infecciosos que varían desde nematodos (filarias), protozoos (Hepatozoon canis, Babesia spp., Leishmania spp.) y bacterias (Ehrlichia spp., Rickettsia spp., Anaplasma spp., Borrelia spp., Mycoplasma spp., Bartonella spp.). Son transmitidos principalmente por vectores artrópodos, durante la alimentación del vector infectado a una gran variedad de huéspedes mamíferos y con un gran potencial zoonótico. Existen además otras vías de transmisión como es el caso de Hepatozoon spp., el cual ingresa por la ingesta de garrapatas infectadas, asimismo puede transmitirse por el uso de agujas contaminadas, transfusiones y se han descrito casos de transmisión vertical (Mierzejewska et al. 2014).
Después de la transmisión, se diseminan en la sangre por el sistema mononuclear fagocítico, dentro del eritrocito o por el torrente sanguíneo en forma de larva, como es el caso de las filarias, y son capaces de migrar a cualquier órgano, lo cual genera una respuesta inmunitaria caracterizada por la producción de anticuerpos (Bazzocchi et al. 2003). Estos agentes pueden generar una variedad de signos clínicos que dependen del estado o fase de la enfermedad, ya sea aguda, subclínica y en algunos casos crónica (Harrus et al. 1998). Por esto, los signos clínicos varían desde asintomático hasta potencialmente mortal, lo que depende de manera parcial de la susceptibilidad del huésped, enfermedades concurrentes, inmunosupresión o individuos esplenec-tomizados (Messick 2004).
El diagnóstico puede ser complejo según la carga del agente y la fase clínica de la enfermedad, y a menudo se presentan coinfecciones (Rojas et al. 2014; Andrade et al. 2014). Entre las ayudas diagnósticas, el extendido de sangre periférica es un método rápido y de bajo costo, pero con una baja sensibilidad, debido a una baja carga del agente y que solo se observa en fases agudas (Derakhshandeh et al. 2017), el extendido tiene un nivel de detección en paciente inmunocompetente del 17% (Hamilton et al. 2004). También se cuenta con pruebas serológicas que se basan en la búsqueda de anticuerpos (Ac) utilizando métodos como ELISA e IFI (Franco-Zetina et al. 2019), donde la presencia de Ac indica exposición al patógeno y puede no ser detectable en estadios tempranos y agudos de la infección (Maggi et al. 2014). Existen pruebas comerciales que permiten la detección de anticuerpos IgG con una sensibilidad y especificidad variable de hasta 97,8% y 92,3%, respectivamente (Franco-Zetina et al. 2019). Además, se ha documentado una reacción cruzada con las diferentes especies de Ehrlichia spp. y con Anaplasma spp. (Harrus y Waner et al.2011). Por su parte, la PCR cuenta con una sensibilidad del 95% y especificidad del 100% (Franco-Zetina et al. 2019). Finalmente, en un estudio donde se comparó una prueba de inmunocromatografia comercial (serología) con la PCR en el diagnóstico de VBD, se evidenció un 85% de concordancia en los resultados positivos, con una discordancia con Ehrlichia canis y Anaplasma platys (Wong et al. 2011). Otro limitante de la serología es la falta de pruebas para babesiosis, Hepatozoon, Mycoplasma y Bartonella, mientras que la detección molecular permite identificar una gran variedad de agentes y sus diferentes especies.
En Colombia, existen numerosos reportes de hemotrópicos en perros por todo el país, siendo la erliquiosis la más estudiada y diagnosticada (Otalora et al. 2022; Vargas-Hernández, et al. 2012). Un estudio de seroprevalencia en 354 perros usando SNAP 4DX PLUS en Barranquilla y Puerto Colombia encontró que la seropositividad era: Ehrlichia spp. (62%), Anaplasma spp. (22%), Dirofilaria immitis (11,3%) y Borrelia burgdorferi (0,56%) (Otalora et al. 2022). Adicionalmente, el 40% de perros presentaban coinfección por dos o más patógenos, y tan solo 8,2% (29/354) de perros presentaban signos clínicos. En perros de las ciudades de Bogotá, Bucaramanga y Villavicencio, se evidenció una seroprevalencia de Ehrlichia spp. y Babesia spp. del 82,4% (75/91) y 51,6% (47/91), respectivamente (Vargas-Hernández et al. 2012a). En los mismos perros, solo 40,6% (37/91) y 5,5% (5/91) resultaron positivos mediante qPCR para Ehrlichia canis y Babesia vogeli, respectivamente. Además, el 31,8% (29/91) de perros también fueron positivos para Hepatozoon canis (Vargas- Hernández et al. 2012b). En Medellin, se detectó Ehrlichia spp. por qPCR en 11 de 33 perros (33,3%) (Carrillo-Bonilla et al. 2012). En una revisión de todos los patógenos transmitidos por vectores en Latinoamérica, se describen la mayoría de los estudios de prevalencia en Colombia (Maggi y Kramer 2019). No obstante, aún faltan estudios sobre otros agentes hemotrópicos en perros y gatos del país.
El objetivo de este estudio fue evaluar la frecuencia de 9 agentes hemotrópicos en perros de la ciudad de Medellín mediante qPCR y correlacionar la presencia de estos agentes con alteraciones en el hemoleuco-grama y manifestaciones clínicas.
MÉTODOS Y MATERIALES
Base de datos de perros
El estudio se realizó con una base de datos de 3.300 muestras de perros remitidos al laboratorio Testmol de Medellín entre julio de 2021 y marzo de 2022. Del total de perros analizados por qPCR, la historia clínica y hemogramas fueron aportados en 29 perros remitidos de 3 clínicas veterinarias.
Base de datos de los hemogramas
Se trató de aportes de clínicas veterinarias que se tabularon en una base de datos de Excel para su análisis posterior en SPSS versión 22. Las muestras hematológicas de esas bases de datos se analizaron usando el equipo Abacus (Abacus Vet Junior, Diatron MI Ltd, Budapest, Hungary), calibrado para la especie canina, para determinar 15 parámetros hematológicos, incluyendo las tres poblaciones y el conteo diferencial directo. El equipo se calibró cada vez con los blancos y calibradores proporcionados por los fabricantes. Se registraron los siguientes analitos: recuento RBC, concentración HGB, PCV (o HCT), MCV, MCH, MCHC, RDW, conteo plaquetas (PLT), conteo de WBC y niveles de neutrófilos, linfocitos, monocitos, eosinófilos, basófilos, fibrinógeno y proteínas totales TP. Se realizaron conteos absolutos y relativos.
El volumen de células empaquetadas (PCV) se midió usando el método estándar de microhematocrito (Van Assendelft et al. 2001). El plasma restante de la centrifugación se depositó en un refractómetro (Atago Co. Ltd., Tokyo, Japan), con el cual se realizó el análisis de proteínas totales plasmáticas como indica el proceso estándar (Walker et al., 1990).
En el hemograma, se interpretó anemia cuando el hematocrito estaba por debajo del valor mínimo del rango normal (<37%), la severidad se determinó así: leve (30-37%), moderada (20-29%), severa (13-19%), muy severa (<13%). El porcentaje de reticulocitos corregido con base en el hematocrito del paciente y el valor normal de 45% se empleó para determinar si la anemia era regenerativa (>1%) o no regenerativa (<1%). El leucograma inflamatorio se consideró si existía una o varias de las siguientes alteraciones: eosinofilia (>1000/µL), monocitosis (>1350/pL), leucocitosis (>30.000/µL), presencia de neutrófilos tóxicos. Se consideró que había trombocitopenia cuando las plaquetas estaban disminuidas (<200.000/µL).
Comité de ética
El estudio renunció a la revisión y aprobación de un comité de ética, ya que solo hace uso de las bases de datos del laboratorio Testmol SAS y las historias clínicas de los pacientes, brindadas por los Médicos Veterinarios que realizaron la toma de muestras y cumpliendo con todos los protocolos de ética profesional en Colombia para la manipulación de animales en el ejercicio médico veterinario bajo la ley 576 del 2000 y la ley 84 de 1989.
Procedimiento de extracción de ADN utilizado en el laboratorio
Los resultados de las bases de datos se obtuvieron de la base de datos del laboratorio Testmol, los resultados de la extracción, por el método automatizado con el equipo de extracción abierta Kingfisher™ Duo (Thermo Fisher Scientific Inc.) y el kit de purificación de ácido nucleico MagMAX ™ CORE M Express-96 system (Thermo Fisher Scientific, Waltham, MA, USA), de acuerdo con condiciones establecidas del fabricante para muestras de sangre con EDTA.
Resultados de base de datos de qPCR y las condiciones de ensayo utilizado en el laboratorio
Los resultados para qPCR obtenidos en la base de datos se obtuvieron de procesos con cebadores específicos (Macrogen, Corea) para cada agente evaluado, los cuales iban dirigidos a los genes bacterianos 16S y parasitarios 18S. Todos los controles positivos fueron proporcionados por el laboratorio Testmol-Centro de Investigación y Diagnóstico. Se usó agua de grado PCR como control negativo. Para control de extracción e interno se utilizaron cebadores específicos para genes de Citocromo B en mamíferos.
El ensayo de PCR en tiempo real fue realizado en un (Mic 4 Channels, Biomo-lecular Systems, Australia), con protocolos propios del laboratorio.
Análisis estadístico
Las evaluaciones estadísticas se realizaron mediante medidas de tendencia central y se utilizó la prueba exacta de Fisher y la prueba de chi-cuadrado para evaluar relación entre variables; p < 0,05 se consideró estadísticamente significativo. Los cálculos se realizaron utilizando estadísticas de ciencias sociales. (http://www.socscis-tatistics.com/).
Resultados
Del total de perros evaluados en las bases de datos, el 60,5% (1.999/3.300) fueron positivos por qPCR a uno o más microorganismos hemotrópicos. El número de animales infectados con uno, dos o tres agentes fue del 42,9% (1.416/3.300), 17,7% (583/3.300), y 1,3% (42/3.300), respectivamente (tabla 1). En orden de mayor a menor presencia de hemoparásitos el número de perros positivos a un solo agente fue de: Anaplasma spp. (14,1%), Mycoplasma spp. (13,9%), Ehrlichia spp. (6,1%), Hepatozoon spp. (5,4%), Babesia spp. (1%), filarias (0,9%), y Bartonella spp. (0,6%). Las coinfecciones más frecuentes de mayor a menor presencia fueron: Anaplasma spp. y Mycoplasma spp. (6,8%), Ehrlichia spp. y Mycoplasma spp. (3,5%), Anaplasma spp. y Hepatozoon spp. (1,4%), y Ehrlichia spp. y Hepatozoon spp. (1,1%), Anaplasma spp. y Babesia spp. (0,9%).
TABLA 1 Frecuencia de hemoparásitos y coinfecciones identificadas por qPCR en perros de la ciudad de Medellín (n= 3.300 perros muestreados)
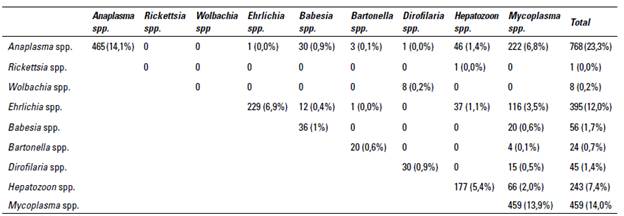
Fuente: elaboración propia con soporte en las bases de datos de 3.300 muestras de perros remitidos al laboratorio Testmol de Medellín entre julio de 2021 y marzo de 2022. **Valores en negrilla corresponden a la frecuencia de cada agente infeccioso
Los datos de los hemogramas de 20 perros infectados con uno o más hemoparásitos se muestran en la tabla 2. Trece animales tenían infecciones por un solo agente y 7 con coinfecciones por dos agentes. De 11 infecciones con Mycoplasma spp., 5 de ellas eran coinfecciones con otro agente, y el hemograma era normal en 9 animales. Dos perros coinfectados con Anaplasma spp. y Mycoplasma spp. tenían signos clínicos compatibles con hemotrópicos (anorexia, vómitos, decaimiento) y presentaron anemia moderada, uno regenerativo y el otro no regenerativo. El leucograma era inflamatorio en 1 de los 2 perros y normal en el otro. De dos animales infectados solo con Anaplasma spp. Uno presentó anemia moderada no regenerativa, trombocitopenia, con leucograma inflamatorio y el otro no presentaba alteraciones hematológicas. De 3 animales infectados con Hepatozoon spp. Uno presentó anemia leve con leucograma inflamatorio y el otro estaba normal. El otro estaba coinfectado con Hepatozoon spp. y Babesia spp. y su hemograma era normal a pesar de tener signos clínicos de fiebre, anorexia y decaimiento. Infección por Ehrlichia spp. Se presentó en 3 animales, 2 de ellos coinfectados con Mycoplasma spp. El infectado solo con Ehrlichia spp. tenía anemia muy severa no regenerativa con leucograma de estrés. Los dos coinfectados tenían un hemograma normal, excepto en uno que tenía trombocitopenia leve de 130 x103 plaquetas/pL. Un animal infectado con Babesia spp. tenía una anemia severa no regenerativa, trombocitopenia y leucograma de estrés. Por último, un perro positivo a filarias tenía una anemia moderada no regenerativa, trombocitopenia y leucograma inflamatorio con leucocitosis marcada (54.000 glóbulos blancos/pL) y desviación a la izquierda.
TABLA 2 Perfil hemático de perros positivos a hemoparásitos en la ciudad de Medellín
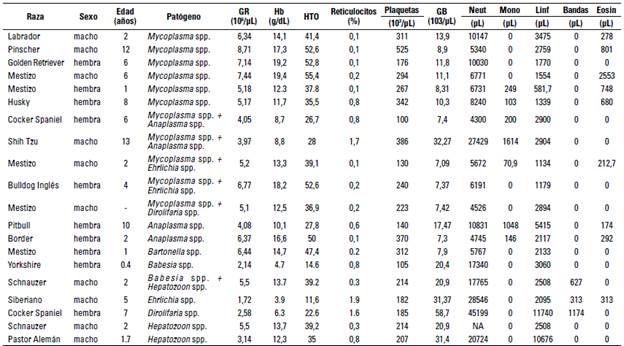
Fuente: elaboración propia con soporte en las bases de datos de 3.300 muestras de perros remitidos al laboratorio Testmol de Medellín entre julio de 2021 y marzo de 2022. *GR: glóbulos rojos, Hb: hemoglobina, GB: glóbulos blancos. HTO: Hematocrito. ** Valores en negrita están por fuera del rango normal en perros
Al realizar las pruebas de Fisher y Chi-cuadrado no se evidenció relación estadísticamente significativa entre las variables analizadas.
DISCUSIÓN
Al determinar la frecuencia de perros positivos a uno o más de los 9 agentes hemotrópicos evaluados en la ciudad de Medellín mediante qPCR, y teniendo presente que no existe hasta la fecha ningún estudio que haya valorado tantos microorganismos hemotrópicos simultáneamente en Colombia, identificamos que el 60.5% de los perros testados eran positivos a uno o más agentes. No obstante, puesto que los animales testados no fueron escogidos aleatoriamente de la población en Medellín, los resultados no pueden considerarse como una prevalencia. Sin embargo, corroboran los hallazgos en otras partes del país donde la prevalencia es alta tanto en animales sintomáticos como sanos (Carrillo-Bonilla, et al. 2012; Otalora et al. 2022; Rojas-Triviño et al. 2013; Molano et al. 2008; Thomas et al. 2020; Vargas-Hernández et al. 2012a; Vargas-Hernández et al. 2012b). Los agentes más identificados fueron: Anaplasma spp. (14,1%), Mycoplasma spp. (13,9%) y Ehrlichia spp. (6,9%). En estudios previos en Colombia, la seroprevalencia se estimó en 22% (78/354) en Barranquilla y Puerto Colombia (Otalora et al. 2022); en 40% (89/223), 51% (51/100) y 12% (21/175) para A. phagocytophilum en Barranquilla, Cartagena y Medellín, respectivamente (McCown et al. 2014a); y 53% (116/218) para A. platys en Barranquilla (McCown et al. 2014b). En el último estudio, tan solo 16% (35/218) de los perros eran positivos por qPCR (McCown et al. 2014b), lo cual sugiere que los animales seropositivos habían eliminado la infección, o bien que no existía presencia del organismo circulando para ser detectados por qPCR. En otro reporte en Barranquilla tan solo el 10,2% (8/78) de los perros seropositivos a Anaplasma spp., y el 9,5% (21/219) positivos a Ehrlichia spp. mostraban signos clínicos compatibles con agentes hemotrópicos (anorexia, letargo, trastornos digestivos, anemia) (Otalora et al. 2022). En este estudio, 3 de 4 perros infectados con Anaplasma spp. (2 coinfectados con Mycoplasma spp.) presentaban anemia moderada, de los cuales 2 presentaban un leucograma inflamatorio. Los 3 perros con anemia presentaban signos de anorexia, vómitos y decaimiento.
Mycoplasma spp. se detectó en el 13,9% de perros. A diferencia de las infecciones con otros agentes más frecuentes (Babesia spp., Ehrlichia spp. y Anaplasma spp.), que a menudo se reportan asociadas a signos clínicos y anemia (Galvan et al. 2018; Castro et al. 2004), las infecciones por hemoplasmas suelen ser subclínicas y pueden no generar alteraciones hematológicas en perros infectados (Cannon et al. 2017; Constantino et al. 2017), a menos que se encuentre inmunodeprimido, en coinfección o esplenectomizado. En este estudio, 9 de 10 perros tenían un hemograma normal y solo un animal tenía anemia moderada asociada a un leucograma inflamatorio. A pesar de la falta de estudios en Colombia, en Suramérica se ha demostrado que los Myco-plasmas hemotrópicos son muy prevalentes en perros sanos con valores de 77,1% en Argentina (Mascarelli et al. 2016); 23,8% en Chile (Cataldo et al 2021), 44,7-5,1% en Brasil (Biondo et al. 2009; Constantino et al. 2017; Vieira et al. 2015; Valle, et al. 2014). En el caso de Ehrlichia spp., se identificó en el 6,9% de perros testados. En numerosos estudios se ha determinado una seroprevalencia a E. canis en distintas ciudades de Colombia: 26% en Medellín, 67% en Bogotá, 74-83% en Barranquilla, 80% en Cartagena, 45,2% en Villavicencio y 45,2% en Bucaramanga (Vargas-Hernandez et al. 2012a; McCown et al 2014b). Al igual que ocurre con Anaplasma spp. (McCown et al. 2014b) y Babesia spp. (Vargas-Hernández, et al. 2012a), cuando la seroprevalencia frente a E. canis era del 82,3% en perros de tres ciudades de Colombia, tan solo el 40,6% eran positivos por qPCR (Vargas-Hernández et al. 2012a), debido a que la presencia de anticuerpos solo indica exposición al agente y el diagnóstico definitivo en ausencia de detección molecular se debe correlacionar con hallazgos clínicos y alteraciones en el hemoleucograma sugerentes de hemotrópicos, ya que también es posible que un perro presente una enfermedad concurrente no relacionada después de un tratamiento exitoso y aún muestre una persistencia continua de anticuerpos séricos (Frank et al. 1999).
En este estudio, de 3 animales positivos a Ehrlichia spp. y con hemograma, solo uno presentaba anemia muy severa no regenerativa con leucograma compatible de estrés y recuento de plaquetas en 182 x103/µL. Los otros 2 estaban en coinfección con Mycoplasma spp. y su hemograma solo evidenció trombocitopenia (130 x103/pL) en un animal. Otros estudios en perros con anemia observaron que aquellos animales coinfectados con E. canis y Mycoplasma spp. presentaban un grado de anemia y trombocitopenia más severo que los infectados únicamente con E. canis (Kaewmongkol et al. 2017). Hepatozoon spp. fue identificado en 177 perros (5,4%), en coinfección con Anaplasma spp. en 46 (1,4%) y con Ehrlichia spp. en 37 (1,1%). En un estudio en 3 ciudades de Colombia se diagnosticó H. canis por qPCR en 29/91 (31,8%) de perros, la mayoría de ellos en refugios donde el control de garrapatas es inadecuado (Vargas-Hernández et al. 2012). Otro estudio en 83 perros de refugios en Italia reportó que, en la época de garrapatas en verano, 51,2% y 41,5% de animales eran positivos por qPCR y citología de la capa leucocitaria, respectivamente (Otranto et al. 2011). Y ningunos de ellos presentaba signos clínicos a pesar de que el 74,8% de los infectados mostraba alguna alteración hematológica, principalmente eosinofilia y un leucograma inflamatorio. En este estudio solo un paciente positivo presentaba fiebre, rigidez, letargo, depresión, descargas oculares mucopurulentas y caquexia por atrofia muscular asociadas a una anemia leve no regenerativa con leucocitosis. Babesia spp. se identificó en 78 perros (2,3%), de los cuales 30 y 12 casos tenían coinfección con Anaplasma spp. y Ehrlichia spp., respectivamente. Hay descritas 3 subespecies de B. canis que afectan a los perros: B. canis canis, B. canis vogeli y B. canis rossi (Koster et al. 2015). En Colombia, estudios moleculares han identificado B. vogeli y B. canis (Galván et al. 2018; Vargas-Hernández et al. 2012a). Todas las especies pueden producir distintos grados de anemia hemolítica y trombocitopenia. Signos clínicos agudos como fiebre, anorexia, letargo, debilidad, membranas mucosas pálidas, ictericia y esplenomegalia (Koster et al. 2015). No obstante, en el presente estudio solo un caso clínico positivo a Babesia spp. presentaba una anemia muy severa no regenerativa, hipoalbuminemia (proteínas en 4 mg/dL) y leucograma de estrés.
La frecuencia evidenciada en este estudio para filarias es del 0,9%, y en coinfección con Mycoplasma spp. en un 0,5%. En otros estudios en Colombia se ha reportado una prevalencia general de D. immitis en perros de refugio en el área metropolitana de Bucaramanga por frotis de sangre y prueba de Knott modificada de 6,3% (13/207) y 0,5% (1/207) por kit de inmunocromatografía (Muñoz et al. 2020). En el suroeste de Colombia, en un estudio donde se seleccionaron 82 casos de microfilariasis identificados microscópicamente, el 81,7% (67/82) resultaron positivos por PCR y 43 individuos del grupo control fueron negativos. Sin embargo, las 82 muestras positivas por visualización correspondían a un total de 2.971 muestras, lo que nos arroja una frecuencia del 2,7% (82/2971) (Espinosa et al. 2020). En otro estudio donde se evaluó caninos de Medellín, Barranquilla y Cartagena la prevalencia de agentes hemotrópicos mediante IDEXX SNAP® 4Dx®, se evidenció en Medellín el 0% de D. immitis. Sin embargo, en Barranquilla, la prevalencia para D. immitis fue 2 % y en Cartagena, del 3% (McCown et al. 204b). Otras filarias de caninos se han identificado en aumento en ciudades como Cali, donde Acanthocheilonema reconditum fue identificado en el 61,3% de los casos (49/82) (Espinosa et al. 2022).
Distintos tipos de garrapatas se han identificado como vectores que transmiten enfermedades (VBD, por su sigla en inglés). De un total estimado de 800 especies de garrapatas a nivel mundial, los principales géneros implicados en transmitir hemoparásitos son Ixodes spp., Dermacentor spp., Amblyomma spp. y Rhipicephalus spp. (Chomel 2011). Por su parte, las pulgas (Ctenocephalides canis y C. felix) se han visto que pueden estar infectadas con Rickettsia spp., Bartonella spp. y Dirofilaria inmitis (Foongladda et al. 2011). En el caso de Dirofilaria immitis, varias especies de los géneros Culex spp., Aedes spp. y Anopheles spp. intervienen en la transmisión de este parásito, al igual que Wolbachia, que es una bacteria endosimbiótica de D. immitis, con un rol importante en el ciclo de este nemátodo (Esteban-Mendoza et al. 2020). Sin embargo, en el caso de Acanthocheilonema reconditum, otra especie de filaria que infecta a perros, la cual generapatologías que suelen ser asintomáticas o leves, su transmisión se ha reportado principalmente por Ctenocephalides felis (Palacios, et al. 2022). En Medellín, de un total de 193 garrapatas recogidas de perros urbanos, dos especies se identificaron: Rhipicephalus sanguineus (92,2%) y R. microplus (7,8%) (Arroyave et al. 2020). En dicho estudio se detectó ADN para Ehrlichia spp. y Anaplasma platys en el 30% y 8% de las garrapatas, respectivamente. En el presente estudio se diagnósticaron coinfecciones por dos o tres agentes en 17,7% (583/3.300) y 1,3% (42/3.300) de perros testeados, lo que sugiere que Rhipicephalus sanguineus podría transmitir varios patógenos simultáneamente.
CONCLUSIÓN
En este estudio se logra evidenciar la presencia de 9 agentes hemotrópicos en perros de la ciudad de Medellín mediante qPCR, y que, al igual que en otros reportes, algunos caninos positivos a algún agente hemotrópico pueden encontrarse sin alteraciones clínico-patológicas, y si bien se encuentran aparentemente sanos, estos individuos pueden desencadenar cuadros agudos o crónicos a futuro y ser fuente de infección para otros animales e incluso la población humana en presencia del vector. Por lo anterior, se hace necesario realizar otros estudios que busquen evaluar la presencia de estos agentes hemotrópicos en una población mayor que incluya pacientes sugerentes de la enfermedad y otro grupo control, y que asimismo permitan dar un acercamiento a una prevalencia de hemotrópicos en caninos de Medellín y correlacionar la presencia de uno o más agentes infecciosos con posibles manifestaciones clínicas y valores de sus respectivos hemoleucogramas.
Además, al comparar los resultados de frecuencia con otros estudios de seroprevalencia y PCR reportados, la serología suele detectar un mayor número de animales positivos de los que son identificados mediante qPCR, por lo que se enfatiza la detección molecular como herramienta diagnóstica más confiable en este tipo de patógenos transmitidos por vectores.















