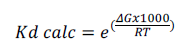INTRODUCCIÓN
El virus de la bursitis infecciosa (IBDV) es el agente causal de la enfermedad de Gumboro, una condición altamente contagiosa que afecta a las poblaciones avícolas jóvenes, lo cual genera un impacto económico negativo en la producción a nivel mundial debido a la alta tasa de morbilidad (100%) y de mortalidad de 20-30% (Sharma et al. 2000). Tanto los pollos de engorde como las gallinas ponedoras son susceptibles y son protegidas mediante vacunación. A pesar de que la mayoría de estas vacunas inducen respuestas contra el IBDV, el grado de protección contra la virulencia del IBDV es variable y puede ser subóptimo principalmente por variaciones antigénicas (Berg 2000). Debido a esto, los investigadores se enfocan en la búsqueda de nuevos métodos antivirales empleando blancos moleculares para poder combatir al avance del virus (Gayozo et al. 2022).
Uno de los blancos moleculares que se están empleando es la proteína VP1, una enzima viral encargada de la replicación del genoma viral y, por ende, vital en el ciclo replicativo del virus; esta proteína actúa como una ARN polimerasa dependiente de ARN no canónica debido a su interacción con la VP3 para su activación y completo rendimiento (Garriga et al. 2007).
En la actualidad, la búsqueda y el diseño de nuevos fármacos se realizan en una primera fase mediante el uso de herramientas informáticas, las cuales requieren la utilización de grandes recursos computacionales con un alto grado de aproximación experimental para la optimización de las investigaciones principalmente en el tiempo y los reactivos implementados para el desarrollo de nuevos compuestos con potenciales farmacológicos que pueden ser utilizados en el tratamiento de numerosas afecciones humanas y animales (Poroikov 2020).
Las plantas son fuentes naturales de compuestos bioactivos con un sinfín de beneficios tanto para el ser humano como para los demás seres vivos (Saboon et al. 2019). Los terpenoides son fitoconstituyentes que presentan una gran diversidad estructural química y tienen numerosas propiedades biológicas importantes, entre las que se mencionan las actividades antivirales y antibacterianas in vitro (Angeh et al. 2006; Nosrati y Behbahani 2015), por lo que son considerados candidatos para su estudio como posible antiviral de aplicación o uso veterinario.
El objetivo de esta investigación fue evaluar y detectar moléculas de terpenoides con potencial inhibitorio de la proteína viral 1 (VP1) del virus de la bursitis infecciosa mediante herramientas bioinformáticas y computacionales. Lo anterior para constatar qué tipos de terpenoides podrían presentar afinidades de interacción con el sitio activo de la proteína VP1 del virus de la bursitis infecciosa y también demostrar aptitudes farmacocinéticas-tóxicas óptimas para su consideración farmacológica.
MATERIALES Y MÉTODOS
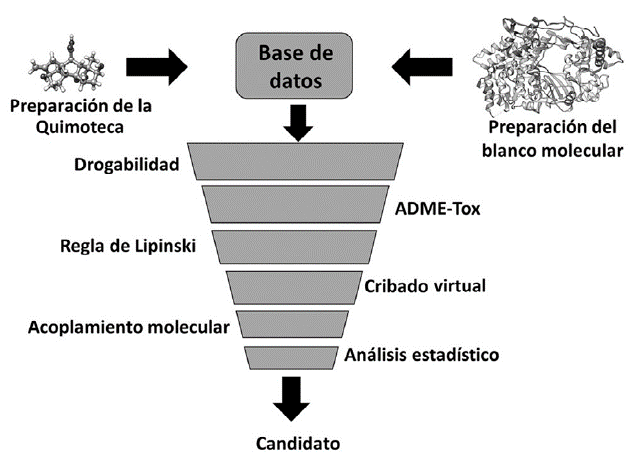
El presente estudio se realizó según el diagrama de flujo metodológico simplificado representado en la figura 1, para lo cual se emplearon ordenadores con procesadores Intel® Core™ i3-7020U 2.30GHz, RAM de 16.00 Gb y sistema operativo Windows 10.
Caracterización de sitios drogables en la región catalítica de la proteína VP1
La búsqueda de sitios con perfiles drogables presentes en la región catalítica de la VP1 se llevó a cabo empleando la estructura de la proteína viral disponible en la base de datos Protein Data Bank (PDB: 2R70, 2R72). Para la detección computacional del sitio drogable en la región catalítica se utilizó la herramienta DoGSiteScorer (Volkamer et al. 2010). La caracterización del sitio identificado se realizó mediante la estimación del puntaje de drogabilidad, de descriptores dimensionales, de grupos funcionales y composición de residuos dicha región (Volkamer et al. 2012).
Pruebas de acoplamiento molecular entre terpenoides y la proteina VP1
La estructura proteica tridimensional de la VP1 del IBDV se obtuvo de la base de datos Protein Data Bank (PDB: 2R70).
La quimioteca de las estructuras químicas de los terpenoides se realizó mediante el uso de las descripciones de Ludwiczuk et al. (2017), que se obtuvieron de la base de datos PubChem (tabla 1).
TABLA 1 Predicciones de propiedades farmacocinéticas y tóxicas (ADME-Tox) de terpenoides evaluados
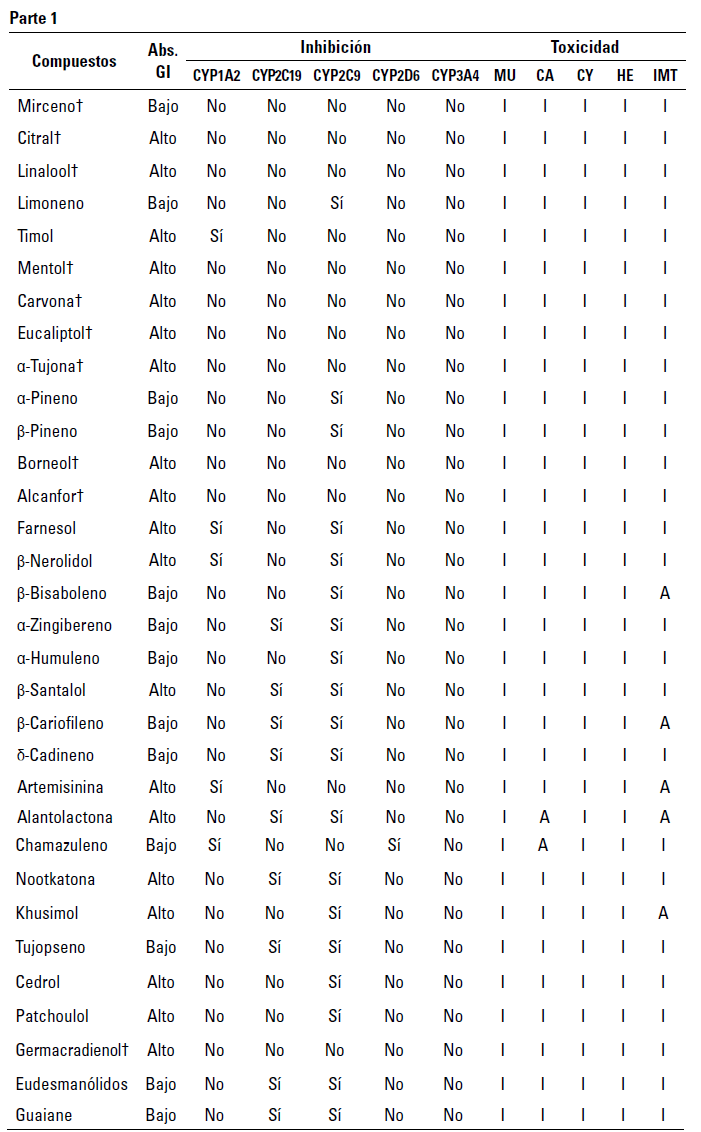
Abs. Gl: Absorción Gastrointestinal, MU: Mutagenicidad, CA: Carcinogenicidad, CY: Citotoxicidad, HE: hepatotoxicidad, IMT: Inmunotoxicidad, I: Inactivo, A: Activo, t Compuestos seleccionados para pruebas exhaustivas.
Fuente: elaboración propia.
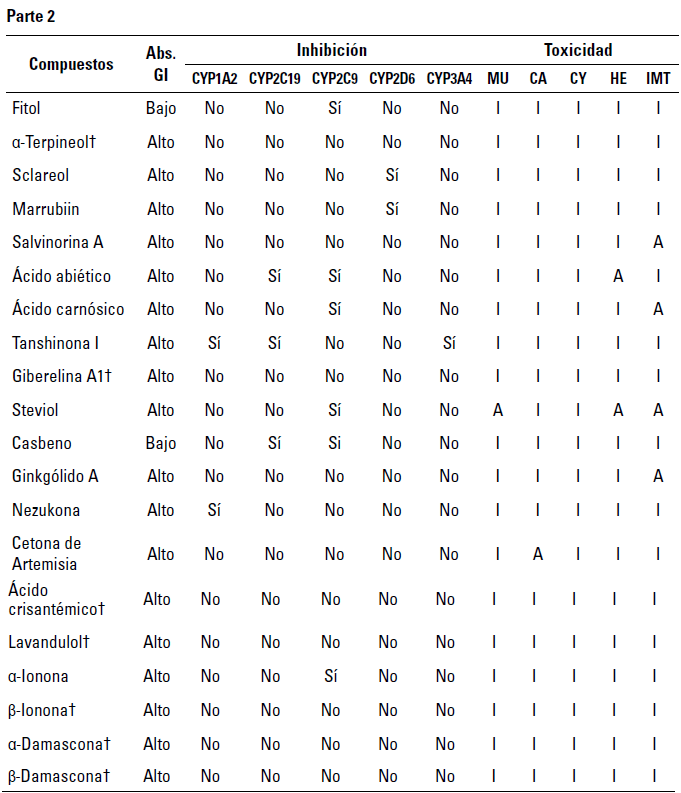
Abs. GI: Absorción Gastrointestinal, MU: Mutagenicidad, CA: Carcinogenicidad, CY: Citotoxicidad, HE: hepatotoxicidad, IMT: Inmunotoxicidad, I: Inactivo, A: Activo, t Compuestos seleccionados para pruebas exhaustivas.
Fuente: elaboración propia.
Se procedió a aplicar métodos de campo de fuerza Universal Force Field (UFF) junto con el algoritmo de optimización energética de gradientes conjugados, proporcionando cargas parciales y átomos de hidrógeno polares a pH de 7,4, para ello se utilizó el programa Avogadro 1.2 (Hanwell et al. 2012).
El cribado virtual se llevó a cabo utilizando una grilla de acoplamiento de 21x25x18 A3 en la que se incluye al sitio drogable de la región catalítica de la VP1, para ello se empleó el algoritmo genético- lamarckiano con el programa AutoDock Vina (Trott y Olson 2010). Como controles del sistema de acoplamiento se utilizaron los sustratos de la enzima, la adenosina trifosfato (rATP), la guanosina trifosfato (rGTP) y la citosina trifosfato (rCTP).
Se seleccionaron aquellos terpenoides que demostraron valores de energía libre de unión (AG) menores a los obtenidos con los controles (Gayozo et al. 2022). Estos compuestos fueron sometidos a pruebas de mayor exhaustividad en un total de diez repeticiones, a modo de minimizar los errores generados en las simulaciones (Gayozo et al. 2022).
A modo de control interno de la precisión del algoritmo utilizado (reacoplamiento/ redocking), este procedimiento se realizó llevando a cabo el ligando co-cristalizado con la proteína (PDB: 2R72) y estimando el valor de raíz de la desviación cuadrática media (RMSD) que se generó en la simulación (Gayozo et al. 2022).
La visualización tridimensional y bidimensional de los complejos, así como su análisis se realizó mediante los programas Chimera v1.16 (Pettersen et al. 2004) y PoseView (Fricker et al. 2004; Stierand et al. 2006). De los complejos con energías de unión favorables se determinó la afinidad de unión mediante la estimación de la constante de disociación K , empleando la fórmula utilizada por Choudhury y colaboradores (Choudhury et al. 2021):
Donde en la ecuación la T es la temperatura corporal promedio aviar (Gallus domesticus) de 313 K (40°C) y R es la constante de los gases ideales con valor de 1,987207 cal/mol.K.
Predicciones de aptitudes farmacológicas, propiedades farmacocinéticas y tóxicas de los terpenoides
Las propiedades ADME-Tox (absorción, distribución, metabolismo, excreción y toxicidad) de los terpenoides evaluados se estimaron y caracterizaron empleando la regla de los cinco de Lipinski (2004); los parámetros ADME y de toxicidad, mediante el uso de las herramientas bioinformáticas SwissADME (Daina et al. 2014; Daina y Zoete 2016; Daina et al. 2017) y ProTox-II (Drwal et al. 2014).
Análisis estadísticos de datos
Los valores de energía libre de unión obtenidos en las simulaciones de acoplamiento molecular se analizaron mediante el test de Kruskal-Wallis y la prueba post-hoc de Dunn (5% de nivel de significancia), para ello se empleó el programa Past 4.11 (Hammer et al. 2001). Los gráficos estadísticos se realizaron utilizando el programa Past 4.11 (Hammer et al. 2001).
RESULTADOS Y DISCUSIÓN
El análisis de las estructuras de la VP1 evidenció la presencia de un sitio con un alto puntaje de drogabilidad igual a 0,83. Este se encuentra ubicado en la región catalítica de la proteína (4) y presenta un volumen de 579,49 Å3, una superficie de 69,31 Å 2 y una profundidad de 21,53 A (figura 2).
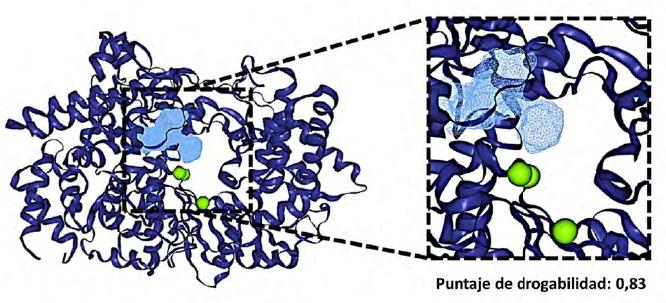
Fuente: elaboración propia.
FIGURA 2 Sitio drogable situado en la región catalítica de la VP1 (PDB: 2R72) (región resaltada en celeste).
Volkamer et al. (2010) mencionan que los puntajes de drogabilidad en una proteína o blanco molecular pueden tomar valores que van en un rango de 0 a 1, y que aquellos valores cercanos a 1 demuestran aptitudes para considerarla como blanco para la búsqueda de ligandos.
Este sitio identificado en la VP1 demuestra el 28% de residuos apolares, el 47% de residuos polares, el 19% de residuos básicos y el 6% residuos ácidos, esta región presenta una hidrofobicidad del 15%. También es importante destacar que se encuentra conformado por 22 grupos funcionales químicos capaces de actuar como donadores en puentes de hidrógeno, 54 grupos funcionales químicos aceptores en puentes de hidrógeno y 13 grupos funcionales químicos capaces de participar en la formación de interacciones hidrofóbicas.
Los residuos encontrados en el sitio drogable fueron la Tyr59, Arg175, Leu176, Met179, Lys180, Ser256, Ser257, Lys267, Leu318, Lys321, Arg335, Asn336, Ile337, Trp338, Ser339, Ala340, His345, Glu421, Ala422, Val465, Val466, Asp467, Ser468, Ser469, Cys470, Lys478, Thr479, Tyr480, Gly48, Gln482, Gly483, Ser484, Gly485, Asn486, Ala488 y Thr489, entre los que se encuentran residuos que cumplen funciones importantes en la catálisis realizada por la enzima (Garriga et al. 2007).
Con respecto a los terpenoides, se evaluaron un total de 52 compuestos mediante descriptores ADME-Tox y según la regla de los cinco de Lipinski (tabla 1, tabla 2). Entre estos, las moléculas que no presentaron actividades tóxicas y con aptitudes farmacocinéticas (absorción gastrointestinal alta sin actividades inhibidoras de las isoformas de la proteína citocromo P450) y farmacológicas (sin infracciones a la regla de Lipinski) se usaron para llevar a cabo el proceso de cribado virtual (tabla 3).
TABLA 2 Predicciones de aptitudes farmacológicas según la regla de Lipinski
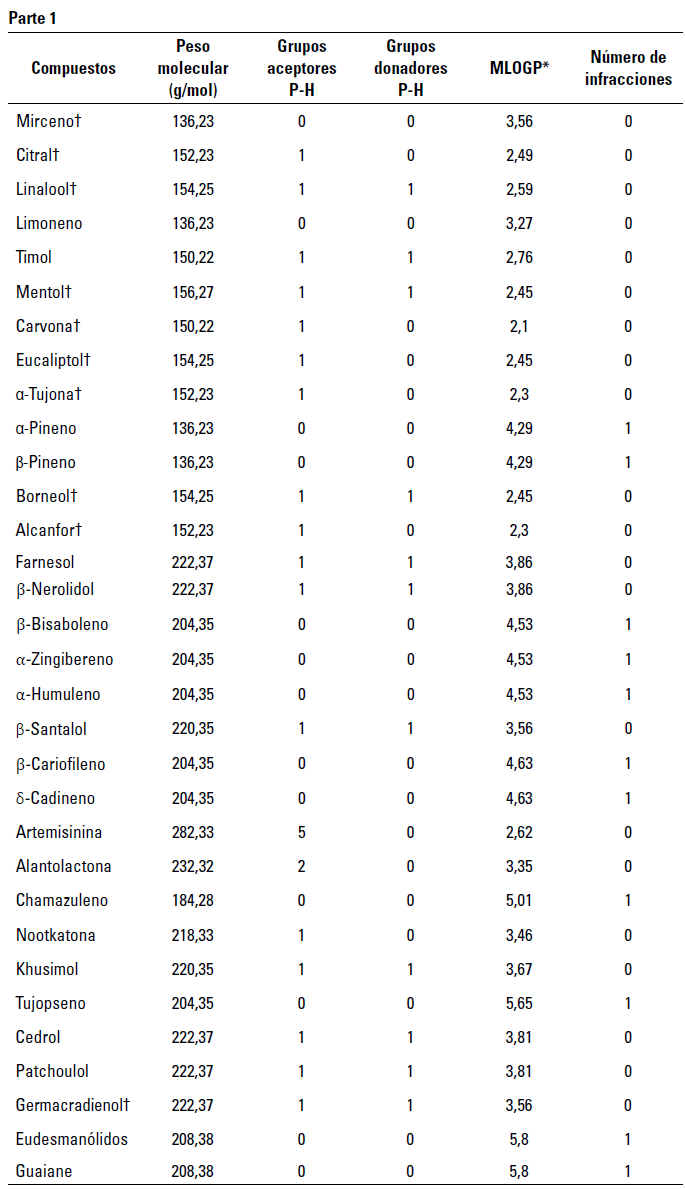
*Coeficiente de particion agua: octanol de Moriguchi, P-H: Puentes de hidrogeno, † Compuestos seleccionados para pruebas exhaustivas.
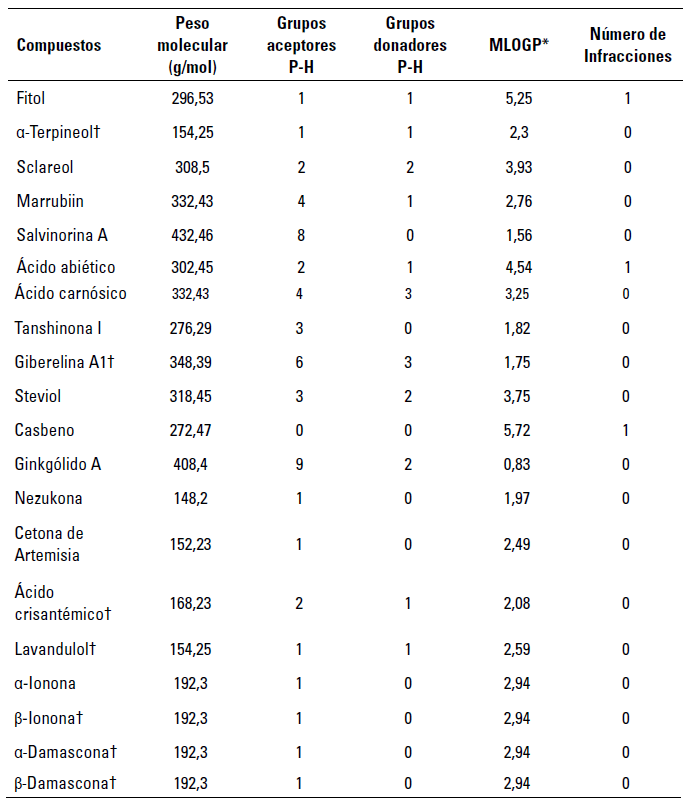
*Coeficiente de partición agua:octanol de Moriguchi, P-H: Puentes de hidrogeno, † Compuestos seleccionados para pruebas exhaustivas.
Fuente: elaboración propia.
Los resultados obtenidos en las pruebas del cribado molecular demostraron que el terpenoide con valor de energía libre de interacción semejante a los controles fue la molécula de Giberelina A1, compuesto que posteriormente se sometió a pruebas de mayor exhaustividad (tabla 3).
TABLA 3 Resultados obtenidos en las pruebas de acoplamiento molecular
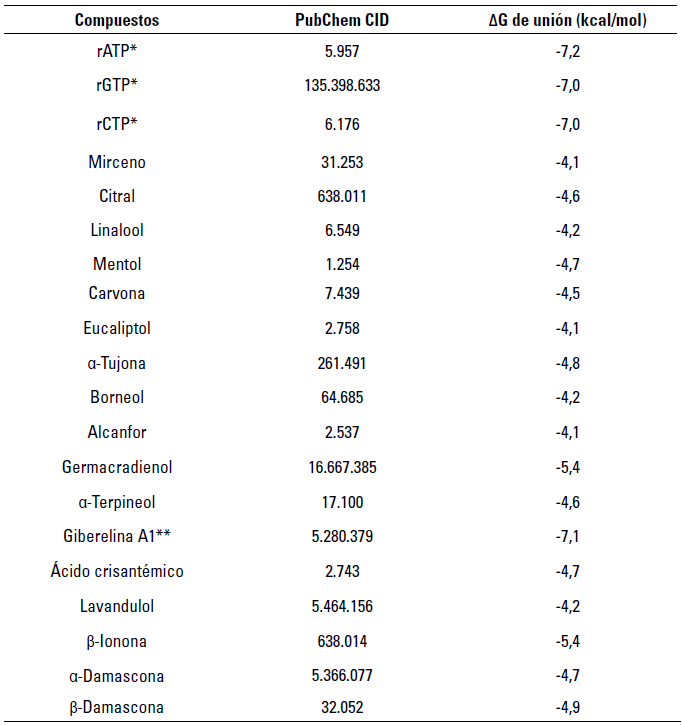
* Controles, **Compuesto con valores de energía menores o iguales a los controles.
Fuente: elaboración propia.
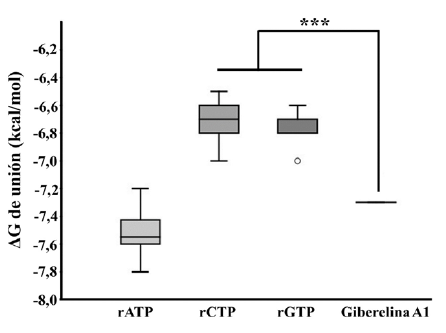
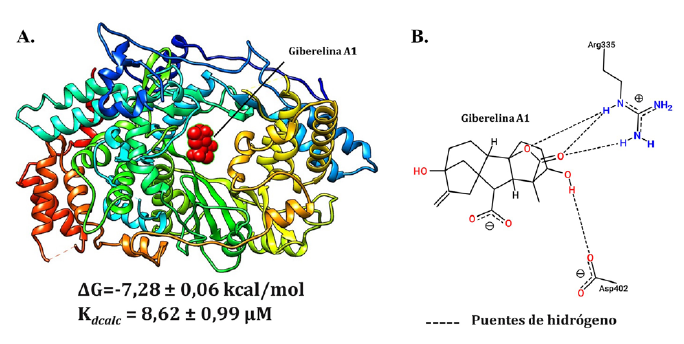
El complejo formado por la Giberelina A1 y la VP1 registró valores promedio de energía libre de unión (ΔG = -7,28±0,06 kcal/mol) significativamente favorables (p<0,05) en comparación con lo obtenido con los ribonucleótidos rCTP y rGTP, sin embargo, no se observaron diferencias significativas (p> 0,05) con el ribonucleótido rATP (figura 3). Se estimó también el valor promedio de la constante de disociación, que fue de K dcalc = 8,62±0,99 µM, demostrando de esta forma ser el terpenoide con más aptitudes para ser considerado como ligando (Choudhury et al. 2021) (figura 4).
Fuente: elaboración propia.
FIGURA 3 Valores de energía libre de interacción (AG) registrados en las pruebas de acoplamiento molecular con el sitio catalítico de la VP1. ***p < 0,05.
Fuente: elaboración propia.
FIGURA 4 Representación gráfica del acoplamiento entre la Giberelina A1 y la región catalítica de VP1. A. Modelo tridimensión del complejo Giberelina A1-VP1. B. Modelo bidimensional de las interacciones ligando-proteína del complejo Giberelina A1-VP1.
En dicho complejo (Giberelina A1-VP1), se registró la formación de varios puentes de hidrógeno entre la Giberelina A1 y los residuos Arg335 (residuo básico) y Asp402 (residuo ácido) de la VP1 (figura 4). Es importante destacar que ambos residuos cumplen funciones imprescindibles en las actividades catalíticas de la enzima durante la replicación del genoma del virus, ya que se encuentran actuando específicamente en la estabilización de los nucleótidos entrantes al sitio catalítico (Garriga et al. 2007). Además de las utilidades que poseen las moléculas de Giberelinas en el campo de la agroproducción, se ha descrito que estas tienen propiedades antiinflamatorias en organismos animales, y también se ha reportado que presentan actividades antibióticas y antiparasitarias, los cuales podrían ser beneficiosas para el control sanitario de enfermedades (Brito et al. 2006; Ghisalberti 1997; Pérez et al. 2009).
El proceso de validación de los algoritmos empleados en este estudio demostró resultados óptimos, donde el reacoplamiento del ligando co-cristalizado evidenció un valor de RMSD igual a 2 A.
La regla de Lipinski establece que las moléculas con aptitudes farmacológicas de administración oral deben poseer peso molecular no mayor a 500 g/mol, coeficiente de participación agua:octanol de Moriguchi no mayor a cinco, un número no mayor a diez grupos aceptores de puentes de hidrógeno y no mayor a cinco grupos donadores de puentes de hidrógeno (Lipinski 2004).
La Giberelina A1 no presenta infracciones a la regla de Lipinski, posee un peso molecular igual a 348,39 g/mol, presenta seis grupos funcionales que pueden actuar como aceptores en puentes de hidrógeno y solo tres grupos funcionales capaces de interactuar como donadores en los puentes de hidrógeno.
En cuanto al coeficiente de partición agua:octanol de Moriguchi igual a 1,75, todos estos parámetros estructurales se encontraban en los límites establecidos por la regla de Lipinski, sin embargo, los productos naturales generalmente rompen la regla debido a que son capaces de mantener el equilibrio entre el peso molecular, la cantidad de enlaces rotables, la hidrofobicidad del compuesto y la capacidad de actuar como donadores en puentes de hidrógeno, lo cual hace que los productos naturales presenten amplias ventajas sobre otros xenobióticos sintéticos (Ganesan 2008).
Asimismo, es importante destacar que las predicciones sugieren que la Giberelina A1 presenta un alto perfil de absorción gastrointestinal y no demuestra ser inhibidora del citocromo P450 (CYP) en ninguna de sus isoformas (CYP1A2, CYP2C19, CYP2C9, CYP2D6 y CYP3A4) (tabla 1, tabla 2).
Muchos estudios se han enfocado en la búsqueda de constituyentes vegetales con actividades antivirales que puedan ayudar a combatir el avance del IBDV, tal es el caso de los resultados reportados por Sun et al. (2013), quienes, al evaluar compuestos de la medicina natural china, evidenciaron que las moléculas de glicirricato de dipotasio y clorhidrato de ligustrazina presentan actividades antivirales contra el virus de la bursitis infecciosa, con una EC50 de 663,2±268,4 mg/mL y 92,52±21,13 mg/mL, respectivamente, e índices de selectividad mayores de 4,52 y 21,62, respectivamente.
Igualmente, Ahmad et al. (2014) reportaron potenciales actividades antivirales del extracto de raíces de Glycyrrhiza glabra, frutos de Phyllanthus emblicus, hojas de Moringa oleífera y Eugenia jambolana contra el virus de la bursitis infecciosa a las concentraciones de 12,5, 25, 50 y 100 µg/mL, respectivamente.
Así también Anyanwu et al. (2017) demostraron que moléculas de alcaloides aislados del fruto de Cucumis metuliferus presentan actividades antivirales contra el virus de la bursitis infecciosa a concentraciones de 6,125 mg/mL y 100 mg/mL, las cuales fueron seguras para el modelo biológico empleado (células fibroblásticas embrionarias de pollo).
Por otro lado, Pant et al. (2012) hallaron actividades antivirales importantes del extracto hidroalcohólico de raíces de W. somnifera contra el virus de la bursitis infecciosa, el cual evidenció un 99% de inhibición de la replicación viral a una concentración no tóxica de 25 µg/mL.
Recientemente, Gayozo et al. (2022), al desarrollar aproximaciones computacionales y bioinformáticas, han revelado que los compuestos de la especie W. somnifera con potenciales actividades inhibidoras de la VP1 fueron la somniferina, el witanólido A, el witanólido N, el witanólido R, el witanólido S y el witasomniferol C, siendo la somniferina la de mayor afinidad de interacción con la proteína viral.
Los residuos Arg335 y Asp402, que participaban activamente en la formación del complejo Giberelina A1-VP1, presentan funciones importantes en la región catalítica de la VP1, ya que están involucrados en recibir a los nucleótidos y estabilizarlos en el sitio catalítico posteriormente a ser polimerizados por la enzima, por lo que bloquear sus funciones sería fundamental (Garriga et al. 2007).
La utilización de terpenoides de baja toxicidad y de bajo riesgo como potenciales antivirales es una de las aplicaciones e investigaciones más exploradas en las últimas décadas. Estos se emplean para combatir diferentes tipos de virus que afectan a seres humanos y animales (Jumaa et al. 2021; Yang et al. 2020).
Según Amal Gaber et al. (2014), los terpenos tienen la capacidad de interrumpir la adhesión del virus a la superficie de las membranas celulares del hospedero, así como de inhibir la replicación del genoma viral.
Asimismo, Yang et al. (2015), mediante el uso de moléculas de terpenoides aisladas, han demostrado que estos son capaces de inhibir la replicación viral, impiden la síntesis de proteínas virales e inhiben la expresión de genes virales.
Otros trabajos como el de Chukwuma et al. (2017) reportaron la capacidad que presentan los terpenoides de inhibir la replicación de virus de interés veterinario, entre ellos el virus de la bursitis infecciosa, resaltando la importancia de estos compuestos naturales para combatir el avance del virus de la bursitis infecciosa causante la enfermedad del Gumboro.
CONCLUSIONES
Estos hallazgos bioinformáticos sugieren que, de entre los terpenoides evaluados, la Giberelina A1 es la que presenta mayor afinidad de interacción con la región catalítica de la VP1, demostrando aptitudes tanto farmacológicas como farmacocinéticas, así como muy bajas posibilidades de presentar algún tipo de actividad toxicológica en el organismo animal, por lo que este terpenoide puede ser considerado como compuesto candidato para estudios in vitro de inhibición de actividades enzimáticas de la VP1 e in vivo para evaluar sus propiedades antivirales con el virus de la bursitis infecciosa.