Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.33 no.1 Bogotá Jan./Mar. 2005
Reporte de Casos
Falla hepática fulminante aguda: Cuando el transplante hepático es la única solución
Vidal CA,1, González LF, 1, Ariza F, 1
1 MD, Departamento de Anestesiología, Unidad de Transplante hepático, Fundación Clínica Valle de Lili, Cali, Colombia. Correspondencia a: cavidal@uniweb.net.co, fredyariza@hotmail.com
RESUMEN
La falla hepática fulminante aguda no es una entidad frecuente en la población pediátrica pero cuando ésta se presenta, pone en serios aprietos al equipo médico. En general todos estos pacientes terminan llevándose a transplante hepático en unas condiciones generales difíciles. Sin embargo una buena estabilización perioperatoria, la pronta consecución de un donante vivo o cadavérico y los avances recientes en las técnicas quirúrgicas y en la inmunosupresión se traducen en buenos resultados. La falta de circulación colateral típica del paciente con hepatopatía crónica, la mayor incidencia de injuria pulmonar y el sangrado perioperatorio son puntos de interés para el anestesiólogo.
Palabras Claves:Trasplante hepático, hepatitis tóxica, (Fuente: DeCS, BIREME).
SUMMARY
Fulminant hepatic failure is not a frequent entity in pediatric population but remains like a serius condition that means a challenge for the medical team. Usually, liver transplantation is the only chance for this pathology, and is performed in poor general conditions. Nevertheless a good perioperatory stabilization, the timely availability of live or cadaveric donor, and recent advances in surgical techniques and inmunosupression produces good outcome. The typical lack of collateral circulation in the patients with chronic liver disease, their predisposition to lung injury and perioperiative bleeding are points of interest for the anesthesiologist.
Key words:Fulminant hepatic failure, liver transplantation, (Source: MeSH, NLM).
Caso 1
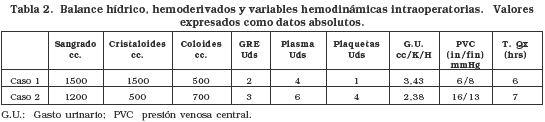
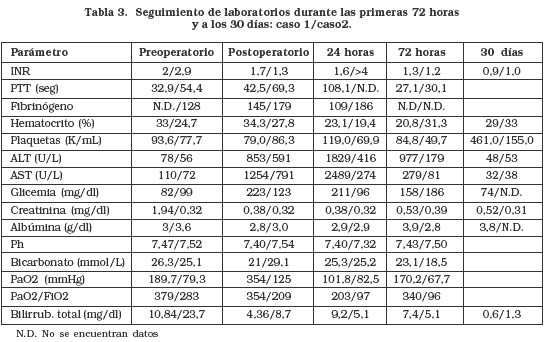
Paciente masculino de 4 años que 2 meses atrás había presentado un cuadro de hepatitis viral tipo A que posteriormente progresó a insuficiencia hepática y encefalopatía, con marcado compromiso progresivo de su estado general, sin respuesta al manejo médico. Durante la hospitalización el niño presentó sepsis nosocomial de origen neumónico que se tornó en shock séptico, coma y coagulopatía, por lo que se ingresa en la lista activa de urgencias para trasplante hepático (TH). Una vez resuelto su cuadro séptico, se consigue un donante cadavérico de ocho años procedente de Medellín, isquemia en frío de 13 horas. El paciente ingresó a cirugía intubado, con monitoreo invasivo (Linea Arterial y Catéter Venoso Central bilumen femoral). Se cambia el Catéter Venoso Central por un yugular trilumen y se inician goteos intraoperatorios (tabla 1). Luego de una fase preanhepatica de 55 minutos y anhepática de 38 minutos, posterior a la reperfusión el paciente presentó evento de bradicardia e hipotensión hasta asistolia (interpretado como sindrome de reperfusión) con rápida respuesta al masaje cardiaco transdiafragmático y bolos de 0,5 mg de atropina y 0,5 mg de adrenalina. Finalizó el procedimiento con un sangrado intraoperatorio de aprox. 1500 cc y con un gran recambio hídrico y de hemoderivados (tabla 2) sin otras complicaciones, llevándose a la UCI pediátrica donde permanece en condiciones críticas, con dependencia de soporte inotrópico. Requirió hemoderivados adicionales, para el control de su coagulopatía. Se inició inmunosupresión con micofenolato mofetil y ciclosporina al tiempo que se observó en los primeros días aumento de las transaminasas correspondiente a una disfunción primaria del injerto, con mejoría en los días siguientes (tabla 3), junto con los niveles de plaquetas, pruebas de coagulación y hemoglobina. Es retirado de ventilación mecánica al quinto día de cirugía con recuperación neurológica adecuada, buena función renal, tolerando la nutrición enteral por sonda nasoyeyunal. Presentó cuadro de mucositis severa, por lo que se inicia aciclovir endovenoso. Los antibióticos se retiraron al décimo día de tratamiento. Al 11° día postoperatorio es trasladado a la unidad de cuidados intermedios, donde permanece durante una semana, completándose el destete de oxigeno, terapia respiratoria y se inicia terapia física y rehabilitación. La ingesta por vía oral aumentó de forma progresiva y se mantuvo estable hemodinámicamente. A las dos semanas postransplante el paciente presentó aumento de transaminasas y fiebre, por lo que se realizaron estudios bacteriológicos y se inició antibioticoterapia endovenosa sin mejoría, ante lo cual se realizó biopsia hepática reportada como rechazo agudo leve a moderado. Se adicionó al manejo inmunosupresor, pulsos endovenosos de metilprednisolona con mejoría posterior de las pruebas de función hepática, continuó su evolución favorable hasta darse de alta al 21º día postransplante y 24º día de hospitalización.
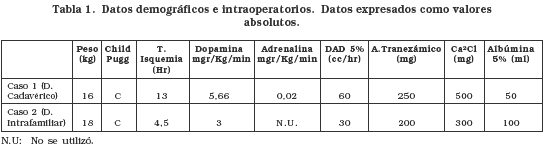
Caso 2
Paciente femenino de 4 años quien llegó con cuadro de 15 días de evolución de ictericia, coluria, acolia y fiebre no cuantificada, posterior a lo cual presentó elevación de enzimas hepáticas, anasarca, distensión abdominal y dificultad respiratoria. 5 días antes de su ingreso había presentado deterioro de su estado de conciencia con bradicardia, hipertensión arterial e hipoglicemia. Es hospitalizada en UCI donde dos días luego de su ingreso presentó mayor deterioro neurológico, prolongación importante de sus tiempos de coagulación y falla respiratoria requiriendo ventilación mecánica por lo cual se incluye en lista activa de urgencias para transplante hepático. El padre es estudiado para ser donante vivo, lográndose llevar a cirugía al quinto día de hospitalización. La extracción de los segmentos II y III del donante fue realizada sin complicaciones y sin requerir hemoderivados, siendo dado de alta a los cinco días. La paciente (receptor) ingresó a salas de cirugía intubada, con soporte inotrópico. El procedimiento se realizó sin complicaciones, con un tiempo de isquemia de 4,5 horas y recambio importante de hemoderivados (ver tabla 2). Reingresó a UCI pediátrica estable hemodinámicamente y sin mayor coagulopatía, como hallazgo positivo, hipoventilación pulmonar derecha. Al día siguiente presentó compromiso respiratorio con infiltrados algodonosos en ambos campos pulmonares, compatibles con injuria pulmonar aguda. Se decidió iniciar manejo con heparina en infusión por el riesgo de trombosis arterial del injerto. Al segundo día postoperatorio había mejoría radiológica pulmonar pero aún con soporte ventilatorio alto. El estado neurológico mejoró y se retiró la inotropía. Se extubó al sexto día postoperatorio, pero persiste agitada, con respiración irregular y polipnéica, por lo que se instauró intermitentemente ventilación no invasiva. En los días siguientes los episodios de agitación fueron manejados con fentanil endovenoso, los controles radiológicos mostraron mejoría y su relación con el medio externo mejoró así como su patrón ventilatorio. Es trasladada a la unidad de cuidados intermedios al 12º día postoperatorio donde continúa su recuperación, se reajustaron niveles de ciclosporina y su estado neurológico mejoró. Se pasó a hospitalización cuatro días después y dada su evolución clínica satisfactoria es dada de alta al 25º día postoperatorio con control por consulta externa, con inmunosupresión con ciclosportina 0,6 mg c/12h AZT 250 mg c/12 y prednisolona 2 tabletas/día.
COMENTARIOS
La historia natural de la falla hepática fulminante aguda (FHFA) está asociada a una alta mortalidad (80-100%) y es responsable del 12-14% de los pacientes pediátricos que requieren TH1,2. La causa más frecuente es la hepatitis viral, siendo la mayoría A, B y C con algunos casos por herpes virus3. Las drogas y toxinas producen FHFA con menor frecuencia, entre éstas el acetaminofén, hidrocarbonos clorinados, valproato sódico, isoniacida4 y en nuestro medio es causa no infrecuente la intoxicación por fósforo blanco (pólvora, totes, etc). Los criterios clínicos incluyen encefalopatía hepática, que ocurre dentro de las dos primeras semanas posteriores al inicio de ictericia5. Esta entidad causa disfunción orgánica múltiple con importante colapso cardiovascular, falla renal y edema cerebral. Se ha implicado una interacción endotelial-leucocitaria en la patogénesis de la disfunción orgánica, que es mediada por moléculas de adhesión intercelular y que inicia con una activación temprana de los leucocitos circulantes, seguida de activación endotelial sistémica, con gran liberación de selectinas y endotelinas6.
El primer TH en población pediátrica se realizó en julio de 1967 en Denver (USA)7 y en Colombia la Fundación Santafé de Bogotá fue pionera en este procedimiento el año de 1992. En nuestra institución se han realizado 65 TH en pacientes menores de 15 años desde julio de 1996 hasta febrero de 2005 y de éstos, siete han sido por FHFA8. La mortalidad global a un año para estos niños transplantados ha disminuido de un 61% a inicios de los años 90 a menos del 30% en la actualidad9. Dada la disminución en el número de donantes, se creó la necesidad de implementar diferentes técnicas para la obtención de órganos. En el momento contamos además de el injerto completo de donante cadavérico con otros tipos: Uno de ellos utiliza la división en dos del órgano de un mismo donante (injerto dividido «split grafts») o la utilización de segmentos del órgano (generalmente los segmentos 2 y 3) provenientes de familiares -generalmente los padres- (injerto intrafamiliar con donante vivo). En otros casos es necesaria la reducción del injerto de donante cadavérico hasta el tamaño adecuado para el peso del infante10. Aunque la práctica actual de injertos divididos se asocia a una mayor probabilidad de dificultades técnicas intraoperatorias, mayor tiempo quirúrgico y necesidad de reintervención, no se ha demostrado que influya en el éxito del procedimiento. El análisis multifactorial de un estudio reciente sugirió que en niños la edad, el sexo, o la necesidad de retransplante tampoco influenciaban significativamente la sobrevida del injerto o del paciente2.
La última década ha permitido el avance en tres grandes campos: i. la implementación de nuevas ayudas diagnósticas para determinar volumetría y anatomía del donante vivo (Tomografía Axial y Resonancia Magnética con reconstrucción tridimensional), permitiendo la elaboración de un plan quirúrgico rápido ante las diferentes variaciones anatómicas que puedan presentarse, para lograr un resultado exitoso en estas situaciones de emergencia11,12,13. ii.Técnicas de obtención de órganos o segmentos: con el perfeccionamiento de los protocolos de donante vivo e intentando disminuir al máximo los tiempos de isquemia en donantes cadavéricos al realizar la partición del órgano in vivo, se ha mejorado la tasa de supervivencia del injerto en un 10-20% sobre las técnicas in situ, al tiempo que puede aumentar las probabilidades de compartir el injerto en tre dos centros14,15. iii.Nuevos inmunosupresores: Tacrolimus, sirolimus, daclizumab, basilixumab,etc. Para una revisión completa remitimos al lector a la excelente revisión de los doctores Smallwood y Geffron16.
Cuando estos niños ingresan a la sala de cirugía, han pasado varios días de ventilación mecánica, soporte inotrópico y nutricional. A pesar de esto, muchos de ellos presentan una gran disfunción multiorgánica dentro de la cual sobresale la disfunción neurológica, asociada a edema cerebral y encefalopatía hepática, la última de éstas caracterizada por una acumulación de toxinas como amonio, agonistas del ácido g-aminobutírico (GABA) y disfunción tanto de la barrera hematoencefálica como del metabolismo cerebral. Situaciones como la hiponatremia derivada del uso de diuréticos o el síndrome de secreción inapropiada de hormona antidiurética pueden empeorar los cuadros de edema cerebral. La presión intracraneana (PIC) elevada es considerada un marcador mayor de morbimortalidad en los pacientes con FHFA1717 y puede requerir la monitorización constante de PIC, uso de diuréticos y/o barbitúricos18. La presencia de edema cerebral moderado o severo precluye la posibilidad de TH, por lo que la medición de la PIC, la ultrasonografía Doopler transcraneal19, la tomografía cerebral y la resonancia magnética serán útiles en la toma de decisiones. En ocasiones cuando hay dudas es necesario recurrir a la electroencefalografía para detectar aquellos casos de muerte cerebral que obviamente no mejorarán con el TH.
En el paciente con FHFA la falta de circulación colateral puede plantear problemas serios durante los episodios de pinza parcial o total de la vena cava durante la fase anhepática, debido a disminución significativa de los volúmenes de llenado ventricular. Por esta razón es supremamente importante para el anestesiólogo la comunicación directa con el equipo de cirujanos para entrar en esta parte con el mejor perfil hemodinámico posible (adecuadas presiones arteriales y de llenado ventricular) y tener presente la posibilidad de utilizar de manera emergente medicamentos con acción a y b -adrenérgica. En ocasiones estas medidas pueden ser insuficientes para mantener una adecuada hemodinamia, ante lo cual se plantean dos posibles soluciones. La primera ocupa lo referente a la técnica quirúrgica de preservación de la vena cava (piggyback) que tiene como objetivo evitar la pérdida total de flujo por ésta. La segunda, reservada para niños mayores de 30 kilos, consiste en la instauración del bypass veno-venoso cuyo fin es mejorar el retorno venoso derivando el flujo esplácnico hacia la vena axilar con la ayuda de una bomba centrífuga. En nuestra experiencia, durante los últimos siete años el piggyback ha reemplazado el uso del bypass veno-venoso en todos los casos de TH, incluso los realizados en pacientes adultos.
Definitivamente la consideración más importante, al igual que en todos los pacientes sometidos a TH, es el sangrado. Estos pacientes pueden ingresar con anemia y trombocitopenia marcados; esta última puede ser debida a hiperesplenismo, consumo plaquetario o dilución marcada. El objetivo perioperatorio es mantener unos recuentos plaquetarios mayores de 50 × 109× L-1, por debajo de los cuales se requiere reposición con plaquetas empaquetadas. Los niveles de fibrinógeno bajos son comunes en niños con FHFA y puede ser causa de prolongación del PT y del PTT. En presencia de sangrado importante deben cuantificarse los niveles de fibrinógeno y corregir con crioprecipitados si es necesario. En nuestra institución hemos manejado pacientes de 6 kilogramos de peso que han requerido hasta 12 unidades de eritrocitos empaquetados. Estos pacientes sufren cambios drásticos rápidos del hematocrito que obligan a la toma secuencial intraoperatoria (cada 1-2 horas o según el sangrado) para mantener unos niveles entre 25-30%.
Conociendo las posibles complicaciones que conlleva una transfusión masiva, en especial el edema pulmonar postoperatorio, el caso número dos debe hacer pensar principalmente tres situaciones: i. Una excesiva carga hídrica y de hemoderivados asociado a hipoalbuminemia, ii. Lesión pulmonar asociada a ventilador, y iii. La posibilidad de injuria pulmonar relacionada con transfusión (TRALI Transfusional related Lung Injury). Esta última ocurre dentro de las seis horas posteriores a la transfusión (1 en 2000 transfusiones de componentes celulares) y al parecer es causada por infusión de anticuerpos antileucocitarios del donante, resultando en activación de la cascada del complemento, leucostasis e injuria alveolar mediada por neutrófilos (PMN)20. Los reportes implican principalmente plaquetas, eritrocitos empaquetados, y plasma21. Existe una relación con el tiempo de almacenamiento de las unidades de plaquetas durante el cual se acumulan citokinas y lisofosfatidilcolinas, ambas activadoras de cascadas proinflamatorias22. Su curso es idéntico al SDRA y al igual que éste se considera un «fenómeno de 2 eventos», en donde el primero es una susceptibilidad del huésped y el segundo está relacionado con factores de las unidades almacenadas.
En nuestra institución contamos con un grupo de transplante pediátrico conformado por tres cirujanos vasculares, que realizan cirugía tanto para adultos como para pacientes pediátricos. Muchas instituciones manejan estos dos grupos por separado; sin embargo, el personal de apoyo conformado por las otras especialidades es grande y muy importante para que un programa de transplantes pueda funcionar. Con la reforma en nuestro país de la ley en salud que incluye a los pacientes de transplante hepático dentro del plan obligatorio de salud (POS) serán numerosos los grupos que dirigirán su mirada hacia esta clase de patologías. Se deberá establecer una verdadera política de donación de órganos en nuestro país que pueda beneficiar a más pacientes pediátricos y adultos de un transplante. Con este reporte de casos queremos hacer conocer nuestra experiencia en el manejo de estos pacientes y recalcar una vez más que en Colombia ya existe una posibilidad de vida para los niños que sufren falla hepática aguda fulminante.
BIBLIOGRAFÍA
1 Moreno González E, García GI, Loinaz SC, et al. Liver transplantation in patients with fulminant hepatic failure. Br J Surg. 1995 Jan;82(1):118-21.
2 Langham MR Jr, Tzakis AG, Gonzalez-Peralta R, et al. Graft survival in pediatric liver transplantation. J Pediatr Surg. 2001 Aug;36(8):1205-9.
3 Sokol Rj. Fulminant hepatic failure. En: Balisteri WF, Stocker JT, eds. Pediatric Hepatology. New York: Hemisphere Publishing, 1990: 315-362.
5 Bernau J, Rueff B, Benhamou JP. Fulminant and subfulminant liver failure. Definitions and causes. Semin Liver Dis 1986; 6:97-106.
6 Walsh T, Wingmore S, Lee A, Ross J. Soluble adhesion molecules and endothelin in patients with fulminant hepatic failure: evidence for endothelial activation and injury. British journal of anaesthesia, 2000; 84 (5): 659P-92P.
7 Starzl TE, Manchioro TL, Von Kaulla KN, et al. Homotransplantation of the liver in humans. Surg Gynecol Obstet 117:659-679, 1963.
8 Reporte Institucional. Base de datos Programa de Transplantes, Fundación Clínica Valle de Lili. Febrero de 2005. http://www.lilitrasplantes.org/esp/recursos/estadistica.php
9 Van Hoek B, de Boer J, Boudjema K, Williams R, Corsmit O, Terpstra OT. Auxiliary versus orthotopic liver transplantation for acute liver failure. EURALT Study Group. European Auxiliary Liver Transplant Registry. J Hepatol. 1999 Apr;30(4):699-705.
10 Vidal CA. Transplante hepático en el paciente pediátrico. En: Pinzón O, Jaramillo J, eds. Anestesiología Pediátrica. Santafé de Bogotá . Publicación de la Sociedad Colombiana e Anestesiología y Reanimación (SCARE), 2003; 638-653.
11 Goyen M, Barkhausen J, Debatin JF, et al. Right-lobe living related liver transplantation: evaluation of a comprehensive magnetic resonance imaging protocol for assessing potential donors. Liver Transpl. 2002 Mar;8(3):241-50.
12 Carr JC, Nemcek AA Jr, Abecassis M, et al. Preoperative evaluation of the entire hepatic vasculature in living liver donors with use of contrast-enhanced MR angiography and true fast imaging with steady-state precession. J Vasc Interv Radiol. 2003 Apr;14(4):441-9.
13 Hermoye L, Laamari-Azjal I, Cao Z, Annet L, et al. Liver segmentation in living liver transplant donors: comparison of semiautomatic and manual methods. Radiology. 2005 Jan;234(1):171-8. Epub 2004 Nov 24.
14 Goss JA, Yersiz H, Shackleton CR, et al. In situ splitting of the cadaveric liver for transplantation. Transplantation 64:871-877,1977.
15 Reyes J, Gerber D, Mazariegos GV, et al. Split-liver transplantation: A comparison of ex vivo and in situ techniques. J pediatr Surg 35:283-290,2000.
16 Smallwood GA, Geffron TG. Considerations in Children. Curr opin organ transplant 2001, 6:338-342.
17 Corall I, Williams R. Management of liver failure. Br J Anaesth 1986;58:234-245.
18 Ede RJ, Williams R. Hepatic encephalopathy and cerebral edema. Semin Liver Dis 1986; 6:107-118.
19 Aggarwal S, Kang Y, DeWolf A, et al. Transcranial Doppler monitoring of cerebral blood flow velocity during liver transplantation. Transplant Proc 1993;25:1799.
20 Popovsky MA, Chaplin HC Jr, Moore SB. Transfusion-related acute lung injury. Transfusion. 1993;33:444-445.
21 Popovsky MA, Moore SB. Diagnostic and pathogenetic considerations in transfusion-related acute lung injury. Transfusion. 1985;25:573-577.
22 Silliman CC, Boshkov LK, Mehdizadehkashi Z, Elzi DJ, Dickey WO, Podlosky L, Clarke G, Ambruso DR. Transfusion-related acute lung injury: epidemiology and a prospective analysis of etiologic factors». Blood 2003; 101: 454-462.
Recibido para publicación: febrero de 2005. Aceptado para publicación: 30 de marzo de 2005













