Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.33 no.2 Bogotá Apr./June 2005
Artíiculo Original
Coloides
Abner Lozano Losada
MD, FCCM*Director UCI Adultos Hospital Universitario de Neiva Clínica Medilaser. Profesor Asistente Universidad Surcolombiana. Neiva, Colombia.
Email: abnerlol@latinmail.com
RESUMEN
En esta presentación se hace un recuento histórico de la aplicación de terapias intravenosas para reanimación básica en campos de batalla y epidemias por causa infecciosa. Se analizan las propiedades reológicas y efectos vasculares, renales y hepáticos de las diferentes sustancias cristaloides, coloides, dextranos y poligelatinas. Aunque la aplicación, el tiempo, la dosis y la patología básica son controversiales el autor indica una serie de razones basadas en las recomendaciones del consenso en 1995 y diversos grados de evidencia, para inclinarse por el uso de coloides con las excepciones debidas a cada caso en particular.
Palabras clave: Cristaloides, Coloides, Expansores plasmáticos.
SUMMARY
In this article we review some topics about the historical application of liquid solutions by intravenous route in emergency conditions like basic reanimation in the battle field or in acute infectious diseases. We describe the rheological properties and dynamic effects of several substances like crystalloids, colloids, hestartash and polygelatins over the cardiovascular system, renal function and hepatic metabolism.
Although, its administration, time intervals, dosis and the pathological conditions of the patients, generate controversial betwen authors and physicians, we recomend its use based in the consensus statement about colloid volumen expanders (1995) and evidence based medicine.
Key words:Colloids, crystalloids, plasma substitutes.
INTRODUCCIÓN
Los coloides fueron investigados y desarrollados entre la segunda y tercera década del siglo pasado. La misión principal de los investigadores era encontrar y hacer útil una sustancia de reemplazo de la sangre, que pudiera utilizarse en el frente de batalla para el tratamiento de los soldados heridos en combate, debido a la gran mortalidad de estos desangrados por las heridas recibidas y la imposibilidad práctica de llegar a ellos con sangre, por la escasez de esta, grupo y factor compatible, refrigeración, etc.
Son sustancias de alto peso molecular que permanecen en el espacio intravascular produciendo una expansión de volumen más efectiva que los cristaloides isotónicos. Su mayor persistencia intravascular reduce el tiempo de reanimación y de volumen en la administración de líquidos en los pacientes traumatizados. No reponen las pérdidas de líquido intersticial que se producen en la hemorragia, por lo que suelen asociarse a cristaloides.
La reanimación con coloides puede mejorar el transporte de oxigeno, la contractilidad miocárdica y el gasto cardiaco. Sin embargo, tanto los estudios en animales como en humanos no han podido demostrar cual es el liquido ideal para la reanimación de la hipovolemia.
Los coloides pueden ser naturales (plasma y albúmina) o artificiales (dextranos, gelatinas y almidones). El coloide ideal debe estar libre de antígenos o propiedades alergénicas, ejercer una presión oncótica intravascular sostenida, libre de riesgo infeccioso, poseer una larga vida sin necesidad de almacenamiento especial y tener bajo costo. Hasta ahora no existe coloide que cumpla estas características1.
RESEÑA HISTÓRICA
La terapia intravenosa moderna es conocida desde hace aproximadamente 100 años, sin embargo desde el siglo XVII ya se inyectaban medicamentos endovenosos, pero debido a los pobres métodos científicos, los intentos originales de suministrar líquidos endovenosos y medicamentos tuvieron poco éxito. El primer registro de intento de infusión intravenosa data de 1492 cuando médicos del Papa enfermo infundieron sangre de tres jóvenes sanos al Pontífice. Después de una anastomosis veno-venosa, el Papa y los donantes murieron2.
Hasta los años 1600, los científicos no conocían como trabajaban los vasos sanguíneos y los fluidos corporales. El conocimiento de la fisiología y metabolismo de los líquidos y electrolitos comenzó en el siglo XVII cuando Sanctorius desarrolló en Padua, Italia, el primer experimento científico cuantitativo para demostrar las pérdidas insensibles de agua. En 1638, William Harvey fue el primero en describir el sistema circulatorio, luego de experimentar con ciervos muertos. Él descubrió que el corazón bombea la sangre a todo el cuerpo, actuando como una bomba que produce una circulación continua de sangre3.
En 1658 el arquitecto Londinense Christopher Wren creó un método con una pluma y una vejiga de cerdo para inyectar vino, cerveza, opio y antimonio en las venas de los perros. Seis años mas tarde J.D. Major hizo la primera inyección de compuestos impurificados en humanos, con resultados desastrosos que en la mayoría terminaron en muerte debido a las complicaciones2.
La primera aplicación terapéutica de estos principios fisiológicos deriva de tres Británicos: Stevens quien concibió la necesidad de la terapia de reemplazo de líquidos en las víctimas del cólera, O'Shaughnessy quien midió el contenido mineral de la sangre y heces de los pacientes con cólera, llevando consigo el concepto de deshidratación como diagnóstico fisiológico, además de sugerir una receta para la reposición de líquidos y Latta quien usó las recomendaciones de O'Shaughnessy para tratar exitosamente por vía endovenosa los pacientes casi moribundos. Esto representó la primera terapia médica basada en datos de experimentos cuantitativos. Debido al escaso soporte tecnológico (agujas, jeringas) pasaron alrededor de 75 años antes de que se aceptara la terapia endovenosa.
En la pandemia del cólera en 1831 en Asia y Europa luego de haberse iniciado en la India, se realizaron observaciones en la sangre de las víctimas que murieron por esta causa, y se encontró que era negra, espesa y fría y se asumió que la causa de esta alteración era la pérdida sanguínea por la émesis y el consumo de calomel (cloruro de mercurio). El Doctor William Brooke O'Shaughnessy, médico de Edimburgo estableció que una gran cantidad de agua con sus sales y álcalis se pierde de las víctimas de cólera, dedujo que la sangre debía ser restaurada a su gravedad específica natural y que en casos graves estaría indicada la inyección de agua tibia con sales normales2, 3. Después de 110 años estas conclusiones siguen siendo válidas para el tratamiento de las pérdidas severas de líquidos a causa de la diarrea.
Darrow a comienzo de la década de 1930 produjo un número de estudios sobre la fisiología de los electrolitos, primero definió los movimientos del agua entre el espacio extracelular y el intracelular, y la importancia del cloro y el sodio en esos compartimentos3. Este trabajo fue hecho con Yannet y Harrison. Este trabajo definió la deshidratación como la pérdida de agua y sal. Indirectamente también describió la deshidratación hiponatrémica. Darrow posteriormente definió el rol de la pérdida de potasio en la enfermedad diarreica, y demostró que podía ser reemplazado por vía intravenosa.
El mundo tuvo dos guerras mundiales que permitieron el desarrollo de la terapia intravenosa moderna. En la segunda y tercera década del siglo pasado se investigó sobre soluciones que pudieran reemplazar la sangre para utilizarse en el campo de batalla para tratar los soldados heridos en combate3.
Las soluciones coloides han sido utilizadas como expansores del volumen intravascular, basado en el conocimiento de la ley de Starling en los pacientes críticos y en los que son sometidos a algún tipo de procedimiento quirúrgico.
La controversia entre el uso de cristaloides y coloides aún se mantiene, ya que la administración de coloides permite usar volúmenes menores que los utilizados con los cristaloides. Sin embargo los coloides son costosos y tienen efectos adversos coagulopáticos y alérgicos que no han mostrado los cristaloides. Además algunas patologías incrementan la permeabilidad capilar y esta fuga vascular puede aumentar la sustancia coloide en el espacio intersticial llevando a la formación de edemas4.
SOLUCIÓN COLOIDE IDEAL
La solución de coloide ideal es aquella que esté libre de reacciones alérgicas e infecciosas, ejerza una presión osmótica intravascular sostenida, fácil almacenamiento, y además tenga costo reducido4. Ninguna de las soluciones que se disponen en la actualidad cumple todas estas características5. Ver (Tabla 1).

Cada una de estas características ideales en el sustituto plasmático tan discutido en los últimos años será desarrollado para su mejor compresión.
Dimensión molecular y configuración
Las moléculas que se utilizan como coloides tienen una dimensión molecular característica para cada grupo y también poseen una configuración espacial distintiva. Se debe definir que todos los coloides exceptuando a la albúmina, presentan una polidispersión de moléculas alrededor de su peso molecular. Esto significa que en los envases de las distintas soluciones se encuentra especificado un peso molecular que se debe interpretar como una media o un promedio de varios pesos moleculares. Esto representa que en una solución de coloide existen moléculas grandes y otras pequeñas, donde cada una tendrá una farmacocinética diferencial, con consecuencias distintas. Las configuraciones pueden ser desde lineales hasta globulares como la albúmina. Estas condiciones de dimensión y configuración deben garantizar el efecto coloidosmótico4.
Presión oncótica
La albúmina, globulinas y fibrinógeno son las principales proteínas del plasma. Sus concentraciones normales son de 4.5 g/dL, 2.5 g/dL y 0.3 g/dL respectivamente. Dado que la albúmina posee un bajo peso molecular (69.000 Daltons) comparado con las globulinas, 1 gramo de albúmina contiene más moléculas y por ello ejerce una mayor presión oncótica. La presión osmótica coloidal normal del plasma es de 28 mmHg y la presión parcial debido a la albúmina es de 21.8 mmHg, mientras que la de las globulinas es de solo 6 mmHg. Para una concentración dada de coloide, las soluciones con partículas pequeñas ejercen un efecto oncótico mayor y por un corto periodo de tiempo, ya que son mas rápidamente filtradas por el riñón, a diferencia de las soluciones con partículas grandes. De igual manera, para una concentración dada de coloide con un peso molecular alto, habrá relativamente menos partículas, así que el efecto oncótico es menor pero su duración es más sostenida4.
Viscosidad
Es un factor que cada día se tiene más en cuenta, y resulta ser un elemento importante cuando se trata de hemodiluciones o de manejar las condiciones reológicas de la sangre. Así la viscosidad ideal debe ser de igual magnitud que la del plasma, la cual es de 2. Los productos en uso tienen viscosidades entre 1,4 y 5,45
Antigenicidad
Si se plantea el uso masivo de estas soluciones, es lógico que deban cumplir con la premisa de no desencadenar reacciones alérgicas o inmunopatías. Cabe resaltar que los coloides utilizados diariamente, sin considerar la albúmina, el porcentaje de reacciones anafilácticas es menor al 0.2%5, 6.
Permanencia intravascular
La característica esencial de las soluciones coloides es que persistan en el espacio intravascular. La expresión correcta para esta característica sería que el sustituto plasmático utilizado dure en el espacio intravascular hasta que se pueda tratar la causa que produjo la perdida del continente o del contenido. La vida media plasmática de las soluciones empleadas en la práctica clínica está entre 3 y 24 horas5.
Eliminación
Es importante que se elimine del organismo todo el sustituto plasmático administrado después de que haya logrado el efecto terapéutico buscado. Sin embargo esto varía mucho entre los distintos productos, ya que tienen una sobrevida en sangre entre 3 horas y 6 semanas, esto significa que algunos productos se almacenan en retículo endotelial, células tubulares renales, etc.,5, 6.
Hemostasia y Coagulación
Todos los coloides producen algún grado de daño de la hemostasia. El mecanismo predominante es por hemodilución de los factores de coagulación. Sin embargo algunos coloides interfieren directamente con los factores de la coagulación y los inhiben ,.
Función Renal
Se considera ideal que no altere la función renal, ni la diuresis de los pacientes. Esto es difícil de cumplir ya que algunos coloides mejoran y otros pueden empeorar la función renal, debido al tipo de molécula, tamaño, viscosidad, etc. de cada coloide7.
Función Cardiaca
Seria ideal que el coloide no altere el rendimiento cardiaco, ni lo sobrecargue. Esto también es difícil de lograr ya que algunos coloides mejoran y otros pueden empeorar la función o sobrecargar el sistema, debido al tipo de molécula, tamaño, viscosidad, etc., de cada coloide6.
Almacenamiento
Todos los coloides pueden ser almacenados a temperatura ambiente ya que fueron creados para casos de guerra, a excepción de la albúmina4.
Varios tipos de soluciones coloides han sido desarrolladas, pero su uso requiere del conocimiento de las propiedades químicas y las características únicas de cada tipo de solución5.
SOLUCIONES COLOIDES
Hay cuatro tipos de coloides disponibles para uso clínico, y han sido desarrollados y utilizados con mas entendimiento desde la década de los setenta como expansores del espacio intravascular, basado en la compresión de la Ley de Starling4.
1. Albúmina
Es la proteína predominante del plasma y aporta cerca del 75 al 80% de la presión coloido-osmótica. Su uso como el primer coloide natural data de antes de la primera guerra mundial y se mantiene como el agente coloide estándar para comparación. La albúmina es una solución monodispersa, con un peso molecular promedio de 69.000 Daltons y pH fisiológico.
La función de la albúmina en la sangre consiste en mantener la presión oncótica normal, transportar distintas sustancias, inactivar pequeños grupos de compuestos (disulfirán, lípidos, eicosanoides, etc.), actuar como tampón plasmático, mantener la integridad microvascular y poseer acción antioxidante puesto que inhiben la formación de radicales libres de oxigeno de los polimorfonucleares8.
Es la sustancia coloidal o expansora del plasma que se usa como estándar de comparación. Puede ser isooncótica (5%) o hiperoncótica (25%). La solución al 5% proporciona un aumento del volumen intravascular similar al volumen infundido. Es sorprendente que el volumen intersticial aumente de forma sustancial después de la administración de albúmina, y su magnitud sea proporcionalmente equivalente al incremento del volumen plasmático. Algunos autores piensan que la albúmina provoca una translocación de líquido desde el espacio intracelular al intersticial en los pacientes sépticos9.
La concentración de electrolitos que posee esta en rango fisiológico, asemejándose en este sentido a las soluciones salinas isotónicas. Además, la albúmina al 5% produce una presión oncótica próxima a la del plasma. Su permanencia en el espacio vascular es de 24 horas. Aproximadamente 10% de la albúmina es destruida en el organismo diariamente, aunque se desconoce el lugar de este metabolismo se piensa que puede ser el sistema reticuloendotelial8,10.
Comercialmente en Colombia se encuentran disponibles en soluciones al 5%, 20% y al 25%. La solución al 5% tiene una presión osmótica de 19 mmHg y suministra un aumento del volumen intravascular igual al volumen infundido. La solución al 25% tiene una presión oncótica de 100 mmHg y produce un aumento de 300 a 500 cc por cada 100 cc de solución infundida. El efecto puede ser variable y se ve afectado por el déficit de volumen, presión oncótica inicial y la permeabilidad vascular. La expansión del volumen plasmático depende de la cantidad de albúmina suministrada y no de la concentración de la solución. Un gramo de albúmina atrae alrededor de 18 cc de agua1.
Por décadas se ha utilizado de forma segura por que posee muy bajo riesgo de transmisión de enfermedades, sin embargo es controvertido debido al riesgo teórico de transmitir nuevas variantes de la enfermedad de Creutzfeldt-Jakob. Al ser un derivado sanguíneo, puede causar reacciones anafilactoides en un 0.012%. Puede provocar reacciones similares a las de la transfusión sanguínea, escalofríos, fiebre, urticaria y vasodilatación. Otra complicación importante es la hipocalcemia debido a la unión con el calcio iónico, que puede terminar en depresión miocárdica1, 8, 12, 13.
Un estudio en pacientes quemados reanimados con albúmina al 25% encontró una disminución de la tasa de filtración glomerular a pesar de aumentar en 40% el volumen plasmático. Estos hallazgos sugieren que no ocurre un aumento del gasto urinario asociado con la expansión plasmática por coloides, debido a la disminución de la tasa de filtración glomerular. Aunque el mecanismo no se conoce con claridad, podría ser explicado por incremento de la presión oncótica de los vasos peritubulares causando disminución de la excreción de sodio y agua.
Las soluciones de albúmina contienen pequeñas cantidades de aluminio que deben ser tenidas en cuenta cuando se usa en prematuros y en pacientes que reciben a largo plazo Nutrición Parenteral para evitar el riesgo de toxicidad por aluminio1, 14.
La albúmina posee propiedades anticoagulantes, inhiben la agregación plaquetaria y aumentan la inhibición del factor Xa por la antitrombina III. Esta actividad anticoagulante resulta indeseable en aquellos pacientes en estado crítico por hipovolemia hemorrágica. Además, la albúmina que fuga a través de la membrana capilar alterada atrae agua hacia el espacio extravascular facilitando y potenciando la formación de edemas1.
Las revisiones sistemáticas no solo no han descubierto una menor mortalidad con el uso de coloides frente a los cristaloides sino que incluso la administración de albúmina puede aumentar la mortalidad9.
El gran inconveniente del uso de los expansores proteicos es su alto costo económico, la diferencia de costos entre coloides/cristaloides puede ser de 100:1. Pueden almacenarse a temperatura ambiente, pero no deben excederse los 30 grados centígrados1, 8.
2. Dextranos
Son polímeros ramificados de distintas longitudes que contienen alrededor de 200.000 unidades de glucosa, producidos del metabolismo bacteriano de la sacarosa. Es el primer coloide sintetizado artificialmente en 1943, cuya solución es polidispersa. Las soluciones disponibles comercialmente son Dextrano 40 y Dextrano 70 y difieren del peso molecular promedio del soluto (40.000 y 70.000 Daltons respectivamente). El Dextrano 40 se presenta como una solución al 10% en salina normal, mientras que el Dextrano 70 esta disponible en una solución al 6% en salina normal. Puede ser almacenada a temperatura ambiente entre 15 y 30 grados centígrados4.
El efecto coloido-osmótico del dextrano 40 es superior al dextrano 70, debido a que existen más partículas por unidad de peso. Ambos dextranos inicialmente producen expansión del volumen intravascular debido a la carga osmótica aumentada. La dosis recomendada es de 10 a 15 mL/k/24 horas de dextrano 40 y promueve una ganancia de volumen intravascular igual o doble al volumen de dextrano infundido, sin embargo el 50% es eliminado después de tres horas y del dextrano 70, el aclaramiento del 35% se produce en 12 horas. Un gramo de Dextrano retiene 20 a 25 mL de agua comparado con 13 mL por gramo de proteína1,15. Por este motivo (poder oncótico) el uso de los dextranos se limita a la expansión del volumen intravascular, para promover una mejoría en la microcirculación cuando las condiciones reológicas de la sangre están alteradas y finalmente por sus efectos antitrombóticos.
El dextrano 40 ocasiona disminución de la viscosidad debido a su propiedad de reducir la agregación eritrocitaria, la adhesividad agregación plaquetaria y la concentración de glóbulos rojos por hemodilución. Sin embargo el dextrano 70 favorece la agregación de los hematíes.
La característica de los dextranos en alterar la viscosidad sanguínea, es dependiente del peso molecular. Los dextranos con peso molecular alrededor de los 60.000 Daltons tienden a agregar células rojas in vitro, no obstante, por debajo de este peso, la tendencia es contraria. La principal ventaja de los dextranos sobre los otros coloides es su beneficio probado en la prevención de la trombosis venosa profunda y en la disminución de la viscosidad sanguínea. Disminuye la adhesividad de los leucocitos circulantes en los tejidos hipoperfundidos, con lo que mejora el flujo microvascular, de este modo disminuye la injuria por reperfusión y por radiación. La administración de dextranos esta asociada con coagulopatía dilucional, reducción del factor VIII complejo Von Willebrand, además de interferir en la tipificación sanguínea, especialmente con el dextrano 70. Altera también el sistema fibrinolítico, acelerando la conversión de fibrinógeno en fibrina así como su degradación por parte de la plasmina4, 16.
Las reacciones alérgicas descritas con ambos dextranos es de 1.1% y son del tipo anafilactoide con los dextranos de alto peso molecular con ramificaciones múltiples, y son reacciones alérgicas verdaderas con formación de anticuerpos. Su excreción renal puede provocar un aumento de la viscosidad urinaria con potencial desarrollo de nefropatía obstructiva. El riesgo para las reacciones anafilácticas puede ser disminuido y tratado con dextrano-hapteno monovalente, el cual se une a los anticuerpos, de esta manera la tasa de reacciones pasa de 1.1% a 0.1% 1, 4, 11, 17.
3. ALMIDÓN HIDROXIETÍLICO (AHE)
Su molécula es similar al glucógeno, lo que reduce de forma importante la posibilidad de liberación de histamina y de reacciones anafilácticas.
Es una solución polidispersa de amilopectina etoxilada, producida de la hidrólisis parcial de amilopectina insoluble, seguida de la substitución de grupos hidroxietilos en las posiciones C2, C3 y C6 de las moléculas de glucosa, a mayor número de substituciones, mayor solubilidad. La sustitución molar es el número de sustituciones por molécula de glucosa. Aunque el máximo posible es 3, la sustitución molar de los almidones hidroxietílicos utilizados en la práctica varía entre 0.5 y 0.7. El peso molecular promedio es de 450.000 Daltons con un rango entre 1.000 y 3'000.000 lo que hace que su eliminación sea muy lenta. Pueden ser almacenados a temperatura ambiente hasta 40°C. La solución al 6% genera una presión osmótica de 28 mmHg, similar a la albúmina y provoca un incremento de volumen intravascular similar a la cantidad de volumen administrado. Posee una vida media de 17 días en el 90%, teniendo el 10% restante una vida media de 42 días. La vida media de los almidones hidroxietílicos en el espacio plasmático es mayor, disminuyendo después de 24 a 36 horas por excreción renal de las moléculas pequeñas y por acción de la amilasa. Los grupos de alcohol agregados previenen la degradación enzimática, por eso los productos varían en su vida media dependiendo del número de grupos alcohol presentes. Su capacidad de expansión es similar o mayor que la dextrano 70, con menos afectación de la coagulación, sin embargo puede dificultar la interpretación del grupo sanguíneo y de anticuerpos4.
La administración de los almidones hidroxietílicos se ha asociado con reacciones alérgicas (incidencia de 0.085%) y alteraciones de la hemostasia. Aumento en el Tiempo de Protrombina, Tiempo Parcial de Tromboplastina y Tiempo de Sangría, además de disminución de niveles de factor VIII. Los almidones hidroxietílicos alteran inicialmente la coagulación por hemodilución, y luego acelerando la conversión de fibrina en fibrinógeno causando formación de trombo menos estable, reduciendo la actividad del factor VIII y alterando la agregación plaquetaria. La dosis máxima diaria recomendada para adultos es de 1.500 cc y para niños 20 mL/Kg1.
Los pentalmidones, un subgrupo de los AHE, es otra fórmula polidispersa con un menor peso molecular promedio (264.000 Daltons con rango de10.000 a 1'000.000 Daltons). Tienen una presión oncótica mayor que los AHE (40 mmHg). Esto lleva a mayor expansión del volumen intravascular, cerca de 2 veces el volumen infundido. Sin embargo la vida media es de 2.5 horas, el 60% se excreta por la orina a las 24 horas y desaparece por completo a las 96 horas. De este modo suministran mayor expansión de volumen plasmático por volumen infundido pero con eliminación más rápida que AHE y albúmina. Su administración se ha asociado con hemodilución y disminución del factor VII, complejo de Von Willebrand; incrementa la velocidad de sedimentación globular, y se usa para reforzar la separación de células blancas por centrifugación durante la leucoféresis.
Otro de los AHE, el pentrafracción, el cual ha sido separado de los componentes de peso molecular más altos y bajos. Tiene un peso molecular promedio de 110.000 Daltons con rango de 100.000 a 500.000 Daltons. La eliminación de los elementos de muy bajo peso molecular proporciona un efecto coloido-osmótico más sostenido4.
4. GELATINAS
Son derivados de la hidrólisis del colágeno bovino, son isooncóticas y ejercen un efecto osmótico inicial muy importante, pero rápidamente desaparece de la circulación por filtración glomerular. Su peso molecular es de 35.000 Daltons, lo que hace que su vida media intravascular sea de 2 a 4 horas en sujetos normales, pero en pacientes con sepsis esta acortada; a pesar de ello es destacable su buena capacidad como expansor. Se eliminan por el riñón sin causar insuficiencia renal y favorecen la diuresis osmótica. No afectan a la determinación del grupo sanguíneo, la coagulación o la adhesividad plaquetaria. La gelatina unida a urea tiene mucha mayor concentración de calcio (6.26 mmol/L) y potasio (5.1 mmol/L) que la gelatina succinato (0.4 mmol/L para ambos electrolitos), esta concentración elevada de calcio puede llevar a formación de coagulo cuando se administra simultáneamente con sangre4.
La administración simultanea de sangre y gelatina unida a urea puede provocar la formación de coágulos. Produce reacciones anafilácticas en un 0.15%. Son los expansores del plasma más económicos1.
La hidrólisis del colágeno es la vía común para la producción de los tipos de gelatina existentes. Las diferencias en el procesamiento de la molécula matriz resultan en tres diferentes compuestos:
- Poligelina
- Gelatina fluida modificada
- Oxipogelatina
A continuación se hace una descripción sobre las características de cada uno de los tipos de gelatinas existentes.
4.a. Poligelina
Es creada por un proceso de unión de varios polipéptidos derivados de la gelatina. A la proteína de gelatina se le agrega un álcali fuerte, de tal forma que se produce degradación a proteínas de peso molecular entre12.000 y 15.000 Daltons, llamadas también Gelatina Altamente Degradada. Estas cadenas peptídicas no tienen poder osmótico suficiente debido a su peso molecular tan bajo por lo que surge la necesidad de unirlas. Son procesadas con hexametil di-isocianato, con lo que se une un grupo carboxilo libre a un grupo amino libre, resultando en una unión peptídica llamada puente de urea y liberación de agua. Esta unión confiere un peso promedio de 35.000 Daltons. El tipo de unión se da entre las dos cadenas peptídicas y la distribución de pesos moleculares es polidispersa (rango de dispersión 5.000 y 50.000 Daltons) (18).
La solución se encuentra disponible al 3,5%, disuelta en agua con iones a una concentración similar al plasma, ver (Tabla 2). Presenta una osmolaridad de 300 mOsm/L, viscosidad relativa de 1,7 y pH de 7,3 + 0,3
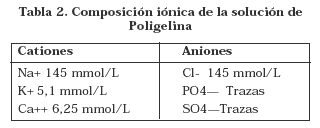
4.b. Gelatina fluida modificada
En el proceso de degradación del colágeno, se agrega un álcali no tan fuerte, produciéndose una división de la molécula en proteínas de peso molecular de aproximadamente 23.000 Daltons, a las cuales se les denomina Gelatina Degradada. Esta gelatina es procesada con Ácido Succínico Anhidro, el cual sin realizar uniones cruzadas, modifica la molécula, reemplazando un grupo NH2 básico por un grupo COOH ácido, aumentando la carga negativa. El incremento en la carga negativa resulta en disminución del enroscamiento y aumento del tamaño de la molécula.
El peso molecular que se obtiene en este proceso es de alrededor de 30.000 Daltons, con rango de 10.000 a 140.000 Daltons. La solución presenta un agregado de electrolitos similar al plasma, ver (Tabla 3). Tienen una viscosidad relativa de 1.7 y pH de 7,0. Su osmolaridad es de 240 mOsm/L18.
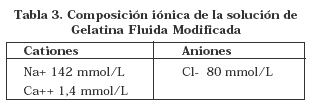
4.c. Oxipogelatina
Se forma mediante un proceso de despolimerización de la gelatina. Inicialmente se realiza un proceso de condensación con Glyoxal utilizando entre 5 y 50 mg por gramo de gelatina, posteriormente se degrada la condensación por medio de oxidación con peróxido de Hidrógeno. De este proceso se obtienen proteínas de configuración globular, y peso molecular promedio de 30.000 Daltons, con rango de 6.200 a 72.000 Daltons18.
La solución se halla disponible al 5,5%, con una viscosidad relativa de 2,1, pH de 7,4 y con agregado de electrolitos, ver (Tabla 4)
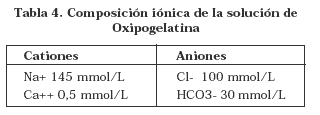
¿POR QUÉ ESCOGER COLOIDES?
La mayoría de los médicos de los países desarrollados hoy en día empiezan la reanimación de los pacientes traumatizados de acuerdo a las guías del ATLS (Advanced Trauma Life Support) del Colegio Americano de Cirujanos. Las guías actuales muestran un régimen agresivo de reanimación con líquidos que inicia con un bolo de 2 litros de cristaloides, preferiblemente Lactato de Ringer (LR). La reanimación continúa con bolos repetidos de LR, sangre y una búsqueda sistemática y reparación quirúrgica de las fuentes hemorrágicas corregibles19, 20.
Los cristaloides primariamente llenan el espacio intersticial, por eso el edema es un resultado esperado de la reanimación de acuerdo a las guías del ATLS. Para expandir el volumen plasmático se usa el axioma clásico de utilizar tres veces más el volumen de cristaloides por volumen de sangre perdida. Hoy esta relación es cuestionada, probablemente sea 7:1 o 10:1 por la disminuida presión coloido-osmótica secundaria a la disminución de la concentración sérica de las proteínas por la hemorragia, fuga capilar y reemplazo con cristaloides. En la (Tabla 5) se muestra una aproximación del total de volumen infundido y expansión plasmática.
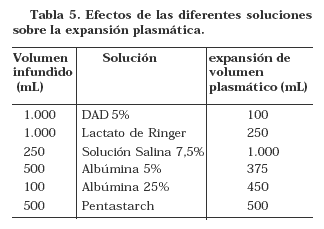
El edema tisular puede convertirse en una importante consideración, especialmente cuando los pacientes cursan con trauma craneoencefálico, donde la hipoosmolaridad dilucional puede aumentar el edema cerebral y aumentar la mortalidad. La disminución dilucional de la presión osmótica por el efecto de los cristaloides puede producir edema pulmonar y afectar el intercambio gaseoso. Esto también causa edema de los eritrocitos y afección de la microcirculación y disminución del área de intercambio de oxigeno tisular. Tal disfunción circulatoria puede participar en la disfunción orgánica múltiple que sigue a los estados de choque. Con la administración de solución salina normal se agrega la acidosis metabólica hiperclorémica21. No es una situación infrecuente en un paciente reanimado agresivamente con cristaloides.
Después de la reanimación y a pesar del edema masivo y compromiso de órgano como el edema pulmonar, es probable que no se haya completado el volumen intravascular. En tales escenarios clínicos, algunos médicos, especialmente los europeos o en las Unidades de Cuidado Intensivo consideran el uso de coloides para continuar la reanimación. Las soluciones coloides tienen algunas ventajas sobre la reanimación con cristaloides. Son más eficientes que los cristaloides en expandir el volumen plasmático y logran de manera similar las metas en la reanimación más rápido y con volúmenes mucho más pequeños (Tabla 5). Los coloides como la albúmina, aumentan la entrega tisular de oxigeno en comparación con el lactato de Ringer y mejora la microcirculación en los órganos22, 23. La expansión del volumen plasmático y la mejoría en la perfusión de los órganos por la administración de albúmina, ha sido propuesta como la explicación para el hecho que la albúmina reduce la falla renal y muerte en pacientes cirróticos con peritonitis bacteriana espontánea24. Siempre que se piensa que el alto costo del coloide es un aspecto importante, esta figura no se tiene en cuenta en los costos incurridos como resultado de la morbi-morbilidad asociada a la reanimación, y la estancia hospitalaria. Además el bajo costo de los líquidos de reanimación comparado con otras intervenciones farmacológicas, no ejercen un impacto en la escogencia de las soluciones, y los coloides frecuentemente son utilizados en los Estados Unidos por recomendación del Consenso de Consorcio de Hospitales Universitarios25, 26.
¿CUÁL COLOIDE DEBE SER ESCOGIDO?
Una vez el médico considere utilizar coloides, el paso a seguir es escoger entre las diferentes soluciones. El prototipo de coloide es la albúmina, sintetizada en el hígado y responsable del 80% de la presión oncótica del plasma. Las desventajas frecuentemente mencionadas incluyen el hecho de ser hemoderivado, el riesgo teórico de transmitir partículas desconocidas infecciosas (priones), y como los otros coloides, su alto costo. De los coloides sintéticos, las gelatinas y los dextranos, son considerados rara vez para la reanimación del paciente traumatizado, especialmente en Norteamérica. Aparte de sus propiedades expansoras plasmáticas, los dextranos tienen un poderoso efecto anticoagulante, y ha sido para la prevención de la trombosis venosa postoperatoria y el embolismo pulmonar. Las propiedades anticoagulantes de los dextranos han limitado sus indicaciones en la reanimaron de pacientes traumatizados. Sin embargo, pequeñas cantidades han sido utilizadas para prolongar el efecto de la infusión de solución salina hipertónica27. Las gelatinas son las menos disponibles en Norteamérica y su corta vida de efectividad ha disminuido el entusiasmo por este tipo de coloide en el ámbito mundial.
La opción restante es almidón hidroxietílico (AHE). Aunque en Europa hay varias formulaciones comerciales disponibles, en Norteamérica esta restringido exclusivamente a los de alto peso molecular. Diferente de los otros coloides, la farmacocinética de cada formulación de AHE es determinada por su estructura, la cual incluye no solo el peso molecular, sino también el grado de sustitución y la relación de hidroxilación C2/C6. Este grupo de coloides semisintéticos, especialmente el pentastarch, es muy atractivo. La presión coloido-osmótica del 10% del pentastarch es dos veces la presión oncótica del plasma y expande 1,5 veces el volumen infundido. Además de sus propiedades expansoras de volumen, no presenta riesgo de transmitir enfermedades infecciosas, tiene mínimos efectos adversos, su vida media es mayor y es menos costoso que la albúmina (19).
RECOMENDACIONES DE LA SOCIEDAD AMERICANA DE TÓRAX SOBRE EL USO DE COLOIDES EN EL PACIENTE CRÍTICO
En adición a restaurar el volumen intravascular, el coloide ideal debería favorablemente modular la respuesta inflamatoria, proceso que frecuentemente caracteriza a la patología crítica. Esto incluye permeabilidad vascular incrementada y formación de edema tisular, control vasomotor disfuncional con mal aporte de nutrientes celulares y cambios reológicos caracterizados por aumento de activación y adherencia de los neutrófilos.
En condiciones fisiológicas, hay un movimiento neto de albúmina del espacio intravascular al espacio intersticial, con recirculación a la vasculatura a través de los linfáticos. La tasa de paso es dependiente de la concentración de albúmina de los dos compartimentos, la permeabilidad el endotelio, y la carga eléctrica a través de la membrana capilar. La administración de albúmina puede influenciar directamente sobre la integridad vascular, uniéndose a la matriz intersticial y al subendotelio, reduciendo la permeabilidad de estas capas a moléculas grandes. Alternativamente, la albúmina puede afectar indirectamente la permeabilidad vascular uniéndose a mediadores inflamatorios como el ácido araquidónico, o quelando radicales libres (28). Las soluciones de almidón hidroxietílico (AHE) también disminuyen la activación de células endoteliales y la adhesión de neutrófilos in vitro (29), posiblemente por estabilización de la membrana celular endotelial o por formación de una barrera mecánica sobre la superficie celular endotelial. La influencia de la albúmina y los coloides sintéticos sobre la integridad microvascular se mantiene incierta.
Las soluciones coloides se utilizan con frecuencia para lograr metas hemodinámicas en las Unidades de Cuidados Intensivos, sin embargo pueden tener efectos adicionales sobre órganos individuales, independientes a la mejoría del rendimiento cardiovascular.
A continuación se revisan los efectos adicionales sobre los distintos órganos:
Cardiovascular
Modelos experimentales con la administración de coloides, han demostrado superioridad en la reanimación rápida, y en la restauración de la perfusión tisular. Como es de esperarse, las soluciones oncóticas logran de manera similar las metas en la reanimación con menos de la mitad de la infusión de cristaloides. La albúmina específicamente reduce la expresión de citoquinas inflamatorias después del choque hemorrágico30, y la administración continua de coloides reduce el daño tisular y vascular.
Pulmonar
La relación inversa entre la presión oncótica del plasma y el líquido transendotelial es importante para mantener el balance hídrico en el pulmón y en los otros órganos. De acuerdo a la Ley de Starling, las soluciones hiperoncóticas disminuyen el flujo hacia el intersticio y el flujo linfático pulmonar por aumento del gradiente de presión oncótica en el pulmón. Sin embargo los coloides pueden influenciar la integridad de la membrana capilar pulmonar, independiente de su efecto oncótico. La albúmina endógena es un importante regulador de la permeabilidad de la barrera endotelial a las macromoléculas. Esto lo realiza probablemente dependiente de concentración y por modulación de la carga molecular. La reanimación con albúmina después del choque hemorrágico, disminuye la inflamación y el edema pulmonar30.
Sistema Nervioso Central
La reanimación de la microcirculación cerebral puede no ser paralela a la de otros órganos debido a que el choque daña la autorregulación cerebral y afecta la barrera hematoencefálica con el consecuente edema cerebral que puede ser agravado con reducciones de la presión oncótica31. Además los medicamentos que mejoran la reología sanguínea tienen valor teórico ya que la viscosidad sanguínea y la agregación plaquetaria juegan un papel patogénico en la isquemia cerebral. Sin embargo la barrera hematoencefálica no cumple los Principios de la Ley de Starling sobre el intercambio de líquidos y solutos, y la osmolaridad plasmática puede ser más importante que la presión oncótica para modular el edema cerebral32.
Gastrointestinal
Modelos experimentales usados para estudiar AHE sugieren efectos más allá de los atribuibles a la presión oncótica. AHE utilizados en circulación extracorpórea reducen el edema intestinal comparado con cristaloides33. El efecto metabólico e inmunológico se mantiene incierto, la reanimación con AHE se ha asociado con aumento de la inmunosupresión y la mortalidad34, pero también se ha encontrado que disminuye la translocación bacteriana y el sobrecrecimiento intraluminal en la obstrucción intestinal experimental35.
Renal
Las ratas analbuminémicas son incapaces de transportar la furosemida a la porción ascendente del asa de Henle, impidiendo su acción. Este efecto es mediado por la alta unión de la furosemida a las proteínas, la cual en condiciones normales se conjuga con la albúmina y ejerce su efecto diurético normal36.
En diciembre de 2004 se presentaron las recomendaciones sobre el uso de coloides en el paciente crítico. El objetivo fue revisar la literatura disponible hasta el momento relacionada con coloides naturales y sintéticos, enfocándose en pacientes manejados en Unidades de Cuidados Intensivos, excluyendo los pacientes quemados y los niños. Se realizó una búsqueda sistemática en MedLine y Cochrane Library, cuyas conclusiones se exponen a continuación. La (Tabla 6) muestra los grados de evidencia por la calidad del diseño del ensayo clínico36.
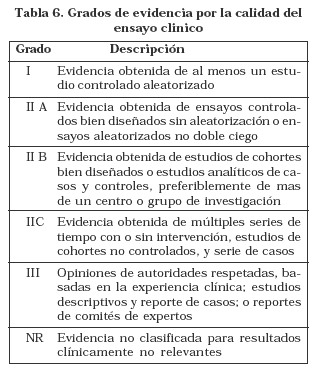
Aspectos Relevantes
1. Los coloides tienen varias propiedades no oncóticas que pueden influenciar la integridad vascular, inflamación y farmacocinética, aunque la relevancia clínica de estas propiedades no ha sido elucidada (NR).
2. Todos los coloides afectan los sistemas de la coagulación, con los dextranos se tienen los más potentes efectos antitrombóticos (IIA).
3. AHE pueden ser depositados en los tejidos reticuloendoteliales por periodos prolongados. La significancia clínica de este hecho se desconoce (I).
4. Los coloides restauran el volumen intravascular y la perfusión tisular más rápidamente que los cristaloides en todos los estados del choque, independiente de la permeabilidad vascular (IIA).
5. Hay conflicto en la evidencia que los AHE aumentan el riesgo de sangrado después de cirugía de bypass cardiopulmonar (I).
6. Aunque la presión hidrostática es más importante que la presión oncótica para la acumulación de edema pulmonar, la administración de coloides disminuye el edema tisular y puede mejorar el edema pulmonar como consecuencia de la reanimación del choque (IIA).
7. No hay evidencia del beneficio de los coloides en el tratamiento de la isquemia cerebral (I) o la hemorragia subaracnoidea (IIA). Los coloides pueden impactar adversamente sobre la supervivencia de la isquemia cerebral (I).
8. La administración de AHE puede incrementar el riesgo de falla renal aguda en pacientes con sepsis (IIA).
9. El tratamiento de la hipotensión relacionada a diálisis con coloides es superior a los cristaloides para pacientes en diálisis crónica, presumiblemente, los coloides sean similarmente superiores en el paciente agudo (IIA).
10. Los coloides son superiores a los cristaloides en el reemplazo del volumen intravascular con grandes volúmenes de paracentesis (IIA) y como terapia adjunta a los antibióticos en el tratamiento de la peritonitis bacteriana espontánea (IIA).
11. Los meta análisis del uso de coloides en cuidado crítico presentan conflictos debido a la heterogeneidad de las entradas a los ensayos y la variedad de técnicas analíticas, y un gran estudio prospectivo sugiere una influencia neutra de los coloides en los resultados clínicos.
Implicaciones terapéuticas
1. Los cristaloides deben ser administrados primero en la reanimación del choque no hemorrágico (III).
2. Las soluciones de AHE deben ser administradas con precaución en pacientes con bypass cardiopulmonar y sepsis (IIA).
3. Los coloides se deben evitar o utilizar con precaución en pacientes con trauma craneoencefálico (I).
4. La restricción hídrica es apropiada para pacientes hemodinámicamente estables con Síndrome de Dificultad Respiratoria Aguda/Injuria Pulmonar Aguda (SDRA/IPA) (IIA); la combinación de coloides y diuréticos puede ser considerada en pacientes con SDRA/IPA hipooncótica (III).
5. Los coloides son preferidos para tratar la hipotensión relacionada con diálisis y mantener la hemodinamia hasta obtener las metas de diálisis (IIA).
6. La albúmina hiperoncótica debe ser administrada cuando se extraen grandes volúmenes de líquido ascitico en la ascitis refractaria a la terapia diurética (IIA).
7. La albúmina puede ser administrada en unión con terapia antimicrobiana en pacientes con peritonitis bacteriana espontánea (IIA)
Investigaciones Futuras
1. Los ensayos clínicos son necesarios para determinar la significancia clínica de las propiedades básicas y específicas de cada coloide, tales como modulación de la permeabilidad vascular e inflamación sistémica.
2. Los resultados de cientos de estudios clínicos diseñados para discernir la mortalidad el beneficio de la reanimación con coloides en choque séptico y/o hemorrágico son necesarios, con análisis farmacoeconómicos incluidos.
3. Ensayos prospectivos son necesarios para determinar el riesgo de sangrado después de cirugía de bypass cardiopulmonar, para comparar AHE con albúmina y con cristaloides.
4. Ensayos clínicos bien diseñados son requeridos para evaluar los resultados clínicos y los efectos fisiológicos de los coloides y los cristaloides en lo relevante a la función individual de cada órgano, incluyendo el balance hídrico pulmonar en pacientes con riesgo o con SDRA/IPA establecida.
CONCLUSIONES
En 1995 fueron descritas mediante consenso, las recomendaciones para el uso de coloides y soluciones cristaloides. En el choque hemorrágico, los coloides son útiles para la reanimación, usados en combinación con los cristaloides cuando no están disponibles los hemoderivados. En estas circunstancias y teniendo en cuenta el costo, los coloides no proteicos son mejores que la albúmina, salvo cuando se desee una restricción de sodio o estén contraindicados los coloides no proteicos. En el choque distributivo no hemorrágico, los coloides no proteicos pueden emplearse cuando exista fuga capilar con edema pulmonar o periférico o tras la administración de 2 litros de cristaloides sin efecto alguno (4).
Varias soluciones coloides han sido desarrolladas y usadas en la práctica clínica a nivel mundial. Su uso requiere del conocimiento de las propiedades químicas de los coloides y las características únicas de cada solución. Los coloides son costosos y presentan reacciones alérgicas y efectos adversos coagulopáticos que no son vistos con los cristaloides. Además algunas patologías críticas, cursan con aumento de la permeabilidad vascular, lo cual limita la habilidad de los coloides para mantener el espacio vascular y ejercer una presión osmótica adicional. La fuga vascular aumenta el coloide en el espacio intersticial, llevando a la formación de edemas.
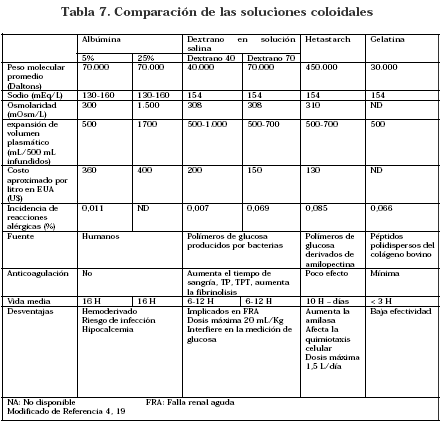
A pesar de algunas ventajas teóricas comparadas con los cristaloides, la administración de coloides no ha mostrado disminución del riesgo de injuria pulmonar aguda, o mejoría de la supervivencia. Las indicaciones precisas del uso de soluciones coloides incluyen estados hipoproteinémicos, pacientes que requieren expansión plasmática y no son capaces de tolerar grandes cantidades de volumen, procedimientos reconstructivos y ortopédicos que requieran prevención de formación de trombos y leucoféresis (4, 18). Ver (Tabla 7).
En la (Tabla 7) se comparan las características principales de las diferentes soluciones coloides.
BIBLIOGRAFÍA
1. Rodríguez P. A, MD, Coloides. Emergencias y Catástrofes 2000;1(4):211-214. [ Links ]
2. Millam D, RN, MS. The History of Intravenous Therapy. J Intraven Nurs 1996;19(1):5-14. [ Links ]
3. Kleinman RE, MD; Barness LA, MD; Finberg L, MD. History of Pediatric Nutrition and Fluid Therapy. Pediatric Research 2003;54(5):762-772. [ Links ]
4. Roberts JS, MD; Bratton SL. Colloid Volume Expanders: problems, pitfalls and possibilities. Drugs 1998;55(5):621-630. [ Links ]
5. Grocott MP, MD; Hamilton MA, MD. Resuscitation fluids. Vox Sanguinis 2002;82:1-8. [ Links ]
6. Barron ME, MD; Wilkes MM, MD; Navickis RJ, MD. A Systematic Review of the Comparative Safety of Colloids. Arch Surg 2004;139:552-563. [ Links ]
7. Boldt J, MD; Priebe HJ, MD. Intravascular Volume Replacement Theraphy wiyh Synthetic Colloids: Is there an Influence on Renal Function? Anesth Analg 2003;96:376-382. [ Links ]
8. Nicholson JP, MD; Wolmarans MR, MD; Park GR, MD. The role of albumin in critical illness. Br J Anesth 2000:85599-610. [ Links ]
9. Astiz ME, MD; Rackow EC, MD. Crystalloid-colloid controversy revisited. Crit Care Med 1999;27:34-35. [ Links ]
10. Moss GS, MD; Gould SA, MD. Plasma Expanders. Am J Surg 1988; 155:425-434. [ Links ]
11. Sutcliffe AJ, MD. Fluid Resuscitation. Current Opinion in Anaesthesiology 1996;9:178-182. [ Links ]
12. Ring J, MD; Messmer K, MD. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet 1977 Feb;I (8009):466-469. [ Links ]
13. Kovalik SG, MD; Ledgerwood AM, MD; Lucas CE, MD. The cardiac effect of altered calcium homeostasis after albumin resuscitation. J Trauma 1981 Apr;21(4):275-279. [ Links ]
14. Klein GL, MD. The aluminum content of parenteral solutions: current status. Nutr Rev 1991;49(3):74-79. [ Links ]
15. Nearman HS, MD; Herman ML, MD. Toxic effects of colloids in the intensive care unit. Crit Care Clin 1991;7(3):713-723. [ Links ]
16. Bergqvist D, MD. Dextran and haemostasis: a review. Acta Chir Scand 1982;148(8): 633-640. [ Links ]
17. Laubenthal H, MD; Messmer K, MD. Allergic reactions to dextrans. In; Baron JF, Editor. Plasma volume expansion. Paris; Arnette Blackwell, 1992. [ Links ]
18. Nolan J, MD. Fluid Replacement. British Medical Bulletin 1999;55(4):821-843. [ Links ]
19. Rizoli BS, MD. Crystalloid and Colloids in Trauma Resuscitation: A Brief Overview of the Current Debate. J Trauma. 2003;54:S82-S88. [ Links ]
20. American College of Surgeons, Committee on Trauma. In Advanced Trauma Life Support Manual. Chicago. [ Links ]
21. Orlinsky M, MD; Shoemaker W, MD; Resis ED, MD; Kerstein M, MD. Current controversies in shock resuscitation. Surg Clin North Am 2001;81:1217-1262. [ Links ]
22. Groeneveld A, MD. Albumin and artificial colloids in fluid management: where does the clinical evidence of their utility stand? Crit Care. 2000;4(suppl2:S16-S20. [ Links ]
23. Lang K, MD; Boldt J, MD; Suttner S, MD; Haisch G, MD. Colloids versus Crystalloids and the tissue oxygen tension in patients undergoing major abdominal surgery. Anesth Analg. 2001;93:405-409. [ Links ]
24. Sort P, MD; Navasa M, MD; Arroyo V, MD, et al. Effects of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Eng J Med. 1999; 341:403-409. [ Links ]
25. Vincent JL. MD. Fluid Management: The Pharmacoeconomic dimension. Crit Care. 2000;4(suppl 2):S33-S35. [ Links ]
26. Yim J, MD; Vermeulen L, MD; Erstad B, MD, et al. Albumin and nonprotein colloid solution use in US academic health centers. Arch Intern Med. 1995;155:2450-2455. [ Links ]
27. Rizoli S, MD; Rotstein O, MD; Sibbald W, MD. The immunological effects of hypertonic saline. In Vincent JL, 2002 Year Book of Intensive Care and Emergency Medicine. Berlin: Springer-Verlag; 2002:446-453. [ Links ]
28. Beck R, MD; Bertolino S, MD; Abbot SE, MD; Aaronson PI, MD; Smirnov SV, MD. Modulation of arachidonic acid release and membrane fluidity by albumin in vascular smooth muscle and endothelial cells. Circ Res 1998;83:923-931. [ Links ]
29. Collis RE, MD; Collins PW, MD; Gutteridge CN, MD; Kaul A, MD; Newland AC, MD; Williams OM, MD; Webb AR, MD. The effect of hydroxycthyl starch and other plasma volume substitutes on endothelial cell activation: an in vitro study. Intensive Care Med 1994;20:37-41. [ Links ]
30. Zhang H, MD; Voglis S, MD; Kirn CH, MD; Slutsky AS, MD. Effects of albumin and Ringer's lactate on production of lung cytokines and hydrogen peroxide after resuscitated hemorrhage and endotoxemia in rats. Crit Care Med 2003;31:1515-1522. [ Links ]
31. Drummond JC, MD; Patel PM, MD; Cole DJ, MD; Kelly PJ, MD. The effect of the reduction of colloid oncotic pressure, with and without reduction of osmolality, on post-traumatic cerebral edema. Anesthesiology 1998;88:993-1002. [ Links ]
32. Sutin KM, MD; Ruskin KJ, MD; Kaufman BS, MD. Intravenous fluid therapy in neurologic injury. Crit Care Clin 1992;8:367-408. [ Links ]
33. Cox CS Jr, MD; Brennan M, MD; Allen SJ, MD. Impact of hetaslarch on the intestinal microvascular barrier during ECLS. J Appl 2000;88:1374-1380. [ Links ]
34. Oelschlager BK, MD; Caragnano C, MD; Carpenter J, MD; Baker CC, MD. Effect of resuscitation with hydroxyethyl starch and lactated Ringers on macrophage activity with hemorrhagic shock and sepsis. Shock 1994;2:141-144. [ Links ]
35. Tiras S, MD; Yilmaz R, MD; Ersin S, MD; Kara E, MD; Ozbal O, MD; Ozdedeli E, MD; Kapkac M, MD. Hydroxyethyl starch solution: is it a new alternative way of treatment in bacterial translocation? Int Surg 1998;83:250-252. [ Links ]
36. American Thoracic Society. Evidence-based Colloid Use in the Critically Ill: American Thoracic Society Consensus Statement. Am J Resp Crit Care Med 2004;170(11):1247-1259. [ Links ]
Recibido para publicación, marzo 20, 2005, Aceptado para publicación mayo 18, 2005.













